Fortsatt utveckling av
en nationell läkemedelslista
– en del i en ny nationell infrastruktur för datadelning
Del 1
Betänkande av Utredningen om
fortsatt utveckling av registret nationell läkemedelslista
Stockholm 2025
SOU och Ds finns på regeringen.se under Rättsliga dokument.
Svara på remiss – hur och varför
Statsrådsberedningen, SB PM 2021:1.
Information för dem som ska svara på remiss finns tillgänglig på regeringen.se/remisser.
Layout: Kommittéservice, Regeringskansliet
Omslag: Elanders Sverige AB
Tryck och remisshantering: Elanders Sverige AB, Stockholm 2025
ISBN 978-91-525-1289-0 (tryck)
ISBN 978-91-525-1290-6 (pdf)
ISSN 0375-250X
Till statsrådet
Acko Ankarberg Johansson
Regeringen beslutade den 21 september 2023 att tillkalla en särskild utredare att se över möjligheterna att utveckla registret nationell läkemedelslista. Samma dag förordnades generaldirektören Sofia Wallström som särskild utredare. Uppdraget innebar att se över om fler uppgifter ska läggas till i den nationella läkemedelslistan, att regleringen blir tydligare, mer förutsägbar och flexibel samt att hälso- och sjukvården och öppenvårdsapoteken har anpassade arbets- processer. Målet är att skapa ett ändamålsenligt register och att ytterligare förbättra patientsäkerheten. Regeringen entledigade den 31 maj 2024 Sofia Wallström från uppdraget som särskild utredare. Den 20 juni förordnades stf generaldirektören och avdelnings- chefen Fredrik Andersson som särskild utredare.
Som sakkunniga förordnades den 13 november 2023 departe- mentssekreteraren Anna Gyllenstrand och rättssakkunnig Malin Cronhamn.
Som experter i utredningen förordnades samma dag analyschefen Karolina Antonov, Läkemedelsindustriföreningen, chefläkaren Thomas Brezicka, Västra Götalandsregionen, regulatoriskt ansva- rige Helena Calles, Apotek Hjärtat, överläkaren Mikael Hoffman, Nätverket för läkemedelsepidemiologi, avdelningsdirektören Suzanne Isberg, Integritetsskyddsmyndigheten, avdelningsjuristen Anton Lesse, Inspektionen för vård och omsorg, utredaren Ragda Obeid, Folkhälsomyndigheten, läkemedelsinspektören Gustav Sjöstrand, Läkemedelsverket, it-arkitekten Martin Solberg, E-hälso- myndigheten, professionsutvecklaren Björn Södergård, Sveriges Farmaceuter, specialistläkaren Helena Walfridsson, Socialstyrelsen samt den seniora analytikern Anders Viberg, Tandvårds- och läke-
medelsförmånsverket. Från den 19 februari 2024 förordnades it- direktören Markus Bylund som expert i utredningen.
Experterna Markus Bylund, Anton Lesse och Anders Viberg entledigades den 14 november 2024 och ersattes samma datum av den seniora ekonomen Pontus Johansson, Tandvårds- och läke- medelsförmånsverket, digitaliseringsstrategen Karina Tellinger, Sveriges kommuner och regioner samt t.f. avdelningschefen Anna Bennet Bark, Inspektionen för vård- och omsorg.
Som sekreterare i utredningen anställdes apotekaren Fredrik Ax från den 6 november 2023 och juristen Pernilla Lötberg från den 7 november 2023. Från den 1 februari 2025 anställdes seniorekonomen Pontus Johansson som sekreterare i utredningen.
Härmed överlämnas betänkandet Fortsatt utveckling av en natio- nell läkemedelslista – en del i en ny nationell infrastruktur för data- delning (SOU 2025:71).
Stockholm i juni 2025
Fredrik Andersson
Fredrik Ax
Pontus Johansson
Pernilla Lötberg
SOU 2025:71Innehåll
DEL 2 |
|
|
10 |
Översyn av viss lagstiftning....................................... |
629 |
10.1 |
Ändamål för personuppgiftsbehandling |
|
|
i registret nationell läkemedelslista ...................................... |
630 |
|
10.1.1 |
Gällande rätt .......................................................... |
630 |
|
10.1.2 |
Av E-hälsomyndigheten identifierade |
|
|
|
ändringsbehov........................................................ |
632 |
|
10.1.3 Ändamål som rör registrering av uppgifter.......... |
633 |
10.1.4Ändamål som rör öppenvårdsapoteken
och hälso- och sjukvården ..................................... |
635 |
10.1.5Ändamål enligt 3 kap. 5 § lagen
om nationell läkemedelslista ................................. |
636 |
10.1.6 Bestämmelser om ändamål eller |
|
om uppgiftsskyldighet? ......................................... |
639 |
10.2 Normgivningsnivå för uppgifter i registret |
|
nationell läkemedelslista ....................................................... |
641 |
10.2.1Av E-hälsomyndigheten identifierade
ändringsbehov........................................................ |
641 |
10.2.2Uppgifter som får ingå i registret bör anges
i lag och förordning ............................................... |
642 |
10.3 Uppgifter i registret nationell läkemedelslista .................... |
647 |
10.3.1 Uppgifter som får finnas i registret |
|
nationell läkemedelslista........................................ |
648 |
10.3.2Receptuppgifter och uppgifter om andra varor
enligt Läkemedelsverkets föreskrifter .................. |
649 |
10.3.3 Uppgifter vid en ordination enligt |
|
Socialstyrelsens föreskrifter .................................. |
651 |
10.3.4Identifierade behov av ytterligare uppgifter
i registret ................................................................ |
653 |
10.3.5Uppgifter som registret nationell läkemedelslista
bör få innehålla....................................................... |
657 |
10.4 Förslag till andra ändringar i registret |
|
nationell läkemedelslista ....................................................... |
675 |
10.4.1 Definitioner ........................................................... |
676 |
10.4.2Begränsningar i redovisning av uppgifter
och sökbegränsningar............................................ |
677 |
10.4.3Spärrning av uppgifter och expedierande
apotekspersonals direktåtkomst utan samtycke ... 680
10.4.4Direktåtkomst för expedierande
|
apotekspersonal med patientens samtycke.......... |
683 |
10.4.5 |
E-hälsomyndighetens uppgiftsskyldighet ........... |
685 |
10.4.6 Uppgiftsskyldighet för den som bedriver |
|
|
verksamhet inom hälso- och sjukvården |
|
|
och öppenvårdsapotek .......................................... |
687 |
10.4.7 |
Verkställighetsföreskrifter.................................... |
689 |
10.5 Fullmakter i registret nationell läkemedelslista .................. |
690 |
10.5.1 |
Rättsliga grunden samtycke.................................. |
690 |
10.5.2Vissa andra rättsliga grunder enligt
|
dataskyddsförordningen ....................................... |
692 |
10.5.3 |
Rättslig grund för ändamålet registrering |
|
|
av fullmakt ............................................................. |
694 |
10.6 Spärrar för direktåtkomst till uppgifter .............................. |
699 |
10.6.1 |
Spärr enligt lagen om nationell läkemedelslista... |
700 |
10.6.2Hur tillämpas bestämmelserna om spärrar
|
i nationella läkemedelslistan ................................. |
707 |
10.6.3 |
Spärr enligt patientdatalagen ................................ |
711 |
10.6.4Spärr enligt lagen om sammanhållen
|
vård- och omsorgsdokumentation ....................... |
718 |
10.6.5 |
Analys av möjligheten att spärra information ..... |
719 |
10.6.6 |
Hur bör regleringen av spärrar hanteras? ............ |
728 |
10.7 Förskrivares tillgång till förskrivningar i registret |
|
nationell läkemedelslista....................................................... |
734 |
10.7.1Analys av förskrivares tillgång till uppgifter
om förskrivningar i registret................................. |
735 |
10.7.2Förskrivare bör få direktåtkomst till redan
|
kända uppgifter i registret..................................... |
738 |
10.8 Vissa andra register som E-hälsomyndigheten för............. |
742 |
10.8.1 |
Legitimationsregistret FORS ............................... |
743 |
10.8.2 |
Utredningens bedömning avseende |
|
|
registret FORS ...................................................... |
748 |
10.8.3FOLK – E-hälsomyndighetens version av
folkbokföringsregistret och fullmaktsregister .... 751
SOU 2025:71Innehåll
10.9 |
Information om utbyte enligt lagen |
|
|
om läkemedelsförmåner m.m. .............................................. |
754 |
|
10.9.1 |
Gällande rätt .......................................................... |
754 |
|
10.9.2 Informationsskyldighet vid utbyte av läkemedel... |
757 |
11 |
Utökning av registret nationell läkemedelslista ........... |
761 |
11.1 |
Bör registren regleras i lag eller förordning?....................... |
762 |
|
11.1.1 |
Normgivningsmakten enligt regeringsformen .... |
762 |
|
11.1.2 En begränsning av regeringens |
|
|
|
normgivningsmakt vid betydande intrång |
|
|
|
i den personliga integriteten ................................. |
763 |
|
11.1.3 Omfattas behandlingen av personuppgifter |
|
|
|
i register som samlar aktuella patientuppgifter |
|
|
|
av det förstärkta grundlagsskyddet?..................... |
765 |
|
11.1.4 Vilken lag ska reglera de nya uppgifterna |
|
|
|
som samlas?............................................................ |
769 |
11.2 |
Registret nationell läkemedelslista....................................... |
771 |
11.2.1Uppgifter om administrerade vaccin och vissa läkemedel med långvarig effekt
i registret nationell läkemedelslista....................... |
772 |
11.2.2 Förhållandet till annan reglering |
|
och personuppgiftsansvar...................................... |
782 |
11.2.3Ändamål med personuppgiftsbehandlingen
|
och begränsning i redovisning av uppgifter ......... |
783 |
11.2.4 Uppgifter som får ingå i registret |
|
|
nationell läkemedelslista........................................ |
792 |
11.2.5 |
Sökbegränsningar .................................................. |
795 |
11.2.6 |
Bevarandetid .......................................................... |
797 |
11.2.7Den registrerades inställning
|
till personuppgiftsbehandlingen ........................... |
800 |
11.2.8 |
Spärr som patienten begär..................................... |
803 |
11.2.9 |
Spärr i förhållande till patienten själv |
|
|
eller dennes vårdnadshavare .................................. |
807 |
11.2.10 |
Direktåtkomst för apoteks- och hälso- och |
|
|
sjukvårdspersonal med patientens samtycke ....... |
812 |
11.2.11 |
Direktåtkomst för hälso- och sjukvårdspersonal |
|
|
utan patientens samtycke ...................................... |
817 |
11.2.12 |
Direktåtkomst för patienten................................. |
821 |
|
11.2.13 |
E-hälsomyndighetens skyldighet |
|
|
|
att lämna ut uppgifter ........................................... |
822 |
|
11.2.14 |
E-hälsomyndighetens informationsskyldighet ... |
823 |
|
11.2.15 |
Behörigheter och åtkomstkontroll ...................... |
824 |
|
11.2.16 |
Krav på hälso- och sjukvården |
|
|
|
att lämna uppgifter................................................ |
825 |
|
11.2.17 |
Avgifter.................................................................. |
826 |
|
11.2.18 |
Rätt att meddela föreskrifter ................................ |
832 |
12 |
Medicinteknikregistret.............................................. |
837 |
12.1 |
Uppgifter om vissa tillförda medicintekniska produkter |
|
|
i ett medicinteknikregister ................................................... |
838 |
12.2 |
Tydliggörande av lagens tillämpning................................... |
844 |
12.3 |
Förhållandet till annan reglering.......................................... |
845 |
12.4 |
Grundläggande bestämmelser om behandling |
|
|
av personuppgifter i medicinteknikregistret....................... |
846 |
|
12.4.1 |
Personuppgiftsansvarig......................................... |
847 |
12.4.2Ändamål med personuppgiftsbehandlingen
|
och begränsning i redovisning av uppgifter......... |
848 |
12.4.3 Uppgifter som får ingå i medicinteknikregistret .. |
857 |
12.4.4 |
Sökbegränsningar .................................................. |
860 |
12.4.5 |
Bevarandetid .......................................................... |
861 |
12.5Den registrerades inställning till personuppgiftsbehandlingen och spärrning
av uppgifter i medicinteknikregistret .................................. |
864 |
12.5.1 |
Den registrerades inställning |
|
|
till personuppgiftsbehandlingen........................... |
865 |
12.5.2 |
Spärr som patienten begär .................................... |
868 |
12.5.3Spärr i förhållande till patienten själv
eller dennes vårdnadshavare.................................. |
872 |
12.6 Elektronisk åtkomst ............................................................. |
877 |
12.6.1Direktåtkomst för hälso- och sjukvårdspersonal
och apotekspersonal.............................................. |
878 |
12.6.2 Direktåtkomst för patienten ................................ |
886 |
12.7 E-hälsomyndighetens skyldighet att lämna ut uppgifter ... 889
SOU 2025:71 |
Innehåll |
12.8 |
E-hälsomyndighetens informationsskyldighet ................... |
891 |
12.9 |
Behörigheter och åtkomstkontroll ...................................... |
893 |
12.10 |
Krav på hälso- och sjukvården att möjliggöra |
|
|
direktåtkomst och att lämna uppgifter ................................ |
897 |
12.11 |
Avgifter.................................................................................. |
899 |
12.12 |
Rätt att meddela föreskrifter ................................................ |
900 |
12.13 |
Ny benämning på lagen ........................................................ |
904 |
13 |
Ändringar i förordningen om nationell läkemedelslista ... |
907 |
13.1 |
Ny benämning på förordningen........................................... |
907 |
13.2 |
Utökad inledning till förordningen ..................................... |
908 |
13.3 |
Registerinnehåll..................................................................... |
909 |
|
13.3.1 Förskrivna och expedierade läkemedel och |
|
andra varor i registret nationell läkemedelslista... 909
13.3.2Administrerade vaccin och andra läkemedel med långvarig effekt i registret nationell
läkemedelslista ....................................................... |
918 |
13.3.3 Medicinteknikregistret .......................................... |
923 |
13.4 Skyldighet för vårdgivare och tillståndshavare |
|
att lämna uppgifter till registren........................................... |
927 |
13.4.1Skyldighet för vårdgivare att lämna uppgifter
vid en elektronisk förskrivning ............................. |
928 |
13.4.2Skyldighet för vårdgivare att lämna uppgifter
vid administrering av ett vaccin ............................ |
929 |
13.4.3Skyldighet för vårdgivare att lämna uppgift
vid administrering av ett läkemedel med |
|
långvarig effekt ...................................................... |
931 |
13.4.4Skyldighet för vårdgivare att lämna uppgifter
|
vid tillförande av en medicinteknisk produkt ...... |
932 |
13.4.5 Skyldighet för tillståndshavare att lämna |
|
|
uppgifter vid expediering på öppenvårdsapotek.... |
933 |
13.5 E-hälsomyndighetens skyldighet att lämna uppgifter ........ |
935 |
13.5.1 |
Regioner ................................................................. |
936 |
13.5.2 |
Förskrivare och verksamhetschef ......................... |
937 |
13.5.3 |
Socialstyrelsen ....................................................... |
938 |
13.5.4 Inspektionen för vård och omsorg ...................... |
940 |
13.5.5 |
Tandvårds- och läkemedelsförmånsverket .......... |
941 |
13.5.6 |
Läkemedelsverket.................................................. |
943 |
13.6 Bemyndiganden .................................................................... |
944 |
13.6.1 |
Verkställighetsföreskrifter.................................... |
945 |
13.6.2Föreskrifter om vilka ytterligare läkemedel
|
|
och produkter som omfattas av lagen .................. |
947 |
14 |
Offentlighet och sekretess ........................................ |
951 |
14.1 |
Offentlighet- och sekretess och tystnadsplikt ................... |
951 |
|
14.1.1 |
Vad innebär sekretess?.......................................... |
951 |
|
14.1.2 Sekretess inom hälso- och sjukvården ................. |
952 |
|
14.1.3 |
Sekretess hos E-hälsomyndigheten...................... |
952 |
|
14.1.4 Tystnadsplikt hos privata vårdgivare ................... |
954 |
|
14.1.5 Sekretess i förhållande till den enskilde ............... |
955 |
|
14.1.6 |
Sekretessbrytande bestämmelse ........................... |
956 |
15 |
En ny infrastruktur kräver utvecklade arbetsprocesser ... |
959 |
15.1 |
Dynamisk utveckling och stegvist införande |
|
|
av nuvarande register ............................................................ |
960 |
15.1.1Målsättningarna med den nationella
läkemedelslistan..................................................... |
962 |
15.2 En nationell infrastruktur för information |
|
till stöd för patientsäkerheten .............................................. |
963 |
15.2.1Utökad delning av uppgifter kan innebära
nya arbetssätt ......................................................... |
964 |
15.2.2En ny infrastruktur bestående av flera
|
komponenter ......................................................... |
966 |
15.2.3 |
Särskilt om nya uppgifter i register...................... |
984 |
15.2.4 |
Behov av information och utbildning .................. |
985 |
15.3 Andra faktorer av betydelse för gemensamma |
|
arbetsprocesser ..................................................................... |
985 |
15.3.1Vård- och apoteksverksamheter har ansvar
för sina respektive arbetsprocesser....................... |
985 |
15.3.2Ansvaret för tekniska anpassningar till stöd
för arbetsprocesser ................................................ |
989 |
15.3.3Möjligheter att minska förekomsten av recept
som inte speglar den senaste ordinationen........... |
994 |
15.3.4 Olika implementering av information |
|
om förskrivningar .................................................. |
999 |
15.3.5 Att avsluta eller makulera recept ........................ |
1002 |
15.3.6Kommunikationslösning mellan vård
|
och apotek............................................................ |
1004 |
15.3.7 |
Begreppsanvändning............................................ |
1006 |
15.3.8 Föreskrifter har stor betydelse |
|
|
för arbetsprocesserna .......................................... |
1007 |
15.3.9 |
Tillsyn................................................................... |
1013 |
15.4 Samverkan kring säkra och effektiva arbetsprocesser – |
|
för patientens skull ............................................................. |
1014 |
15.4.1Det behövs en struktur till stöd för samverkan. 1015
15.4.2 |
Uppgifter för en samverkansstruktur ................ |
1019 |
15.4.3 |
Ett urval av befintliga samverkansforum............ |
1020 |
15.4.4Nytt samverkansforum för patientcentrerade arbetsprocesser och om ansvar för vissa åtgärder
med läkemedel och medicintekniska produkter.. |
1025 |
15.4.5 Aktörer som bör delta i samverkan .................... |
1031 |
15.4.6Resultatet av samverkan behöver dokumenteras,
kommuniceras och genomföras.......................... |
1034 |
15.4.7 Nyttan uppstår först när den nya |
|
infrastrukturen kommer till användning |
............ 1036 |
16 Integritetsanalys.................................................... |
1039 |
16.1Lagen om nationell läkemedelslista i dess gällande lydelse. 1041
16.2Översynen av lagen – förslagens påverkan på den
|
registrerades personliga integritet...................................... |
1043 |
16.3 |
Utökat register nationell läkemedelslista |
|
|
och nytt medicinteknikregister .......................................... |
1046 |
16.4 |
Rättslig grund...................................................................... |
1048 |
16.5 |
Känsliga personuppgifter.................................................... |
1055 |
InnehållSOU 2025:71
16.6 |
Sekretess och tystnadsplikt................................................. |
1058 |
16.7 |
Risker för integriteten med att samla |
|
|
uppgifter i registren ............................................................. |
1060 |
|
16.7.1 |
Skyddade personuppgifter................................... |
1060 |
|
16.7.2 |
Barn och personer som inte endast tillfälligt |
|
|
|
saknar förmåga att ta ställning till samtycke ...... |
1061 |
|
16.7.3 |
Risk för personuppgiftsincidenter ...................... |
1062 |
16.8 |
Särskilda bestämmelser om behandling |
|
|
av uppgifter i registren ........................................................ |
1063 |
|
16.8.1 |
Vad registren omfattar......................................... |
1063 |
|
16.8.2 |
Personuppgiftsansvar........................................... |
1064 |
|
16.8.3 |
Ändamål med personuppgiftsbehandlingen ....... |
1064 |
|
16.8.4 |
Registerinnehåll.................................................... |
1065 |
|
16.8.5 |
Bevarandetid ......................................................... |
1068 |
|
16.8.6 |
Patientens inställning till registreringen ............. |
1069 |
|
16.8.7 |
Direktåtkomst ...................................................... |
1071 |
|
16.8.8 |
Uppgiftsskyldighet .............................................. |
1074 |
|
16.8.9 |
Informationsskyldighet till den registrerade...... |
1075 |
|
16.8.10 |
Behörigheter och åtkomstkontroll ..................... |
1075 |
16.9 |
Åtgärder till skydd för integriteten .................................... |
1076 |
|
16.9.1 |
Sökbegränsningar ................................................. |
1076 |
|
16.9.2 |
Begränsningar i redovisning av uppgifter ........... |
1077 |
|
16.9.3 |
Integritetshöjande samtycke ............................... |
1077 |
|
16.9.4 |
Spärr av uppgifter i registret |
|
|
|
på patientens begäran........................................... |
1079 |
16.10 |
Proportionalitetsbedömning............................................... |
1079 |
17 |
Utökning av registret över administrerade läkemedel . 1087 |
17.1 |
Vilken vård som omfattas av utredningens uppdrag ......... |
1088 |
|
17.1.1 |
Om förutsättningar för tandvården .................... |
1092 |
17.2 |
Behoven av tillgång till ytterligare uppgifter |
|
|
för uppföljning av läkemedelsbehandling .......................... |
1092 |
|
17.2.1 |
Behov av individuppgifter om |
|
|
|
rekvisitionsläkemedel vid införande |
|
|
|
och uppföljning av nya läkemedel ....................... |
1093 |
SOU 2025:71 |
Innehåll |
17.2.2 Andra behov av uppgifter om |
|
rekvisitionsläkemedel för statistik, |
|
uppföljning och forskning .................................. |
1097 |
17.2.3 Den framtida hälso- och sjukvården .................. |
1102 |
17.2.4 Den kommunala hälso- och sjukvården............. |
1103 |
17.3 Analys av registrering av uppgifter om vacciner ............... |
1104 |
17.3.1 Liknande syfte och ändamål |
|
med hälsodataregistren........................................ |
1105 |
17.3.2 Uppgifter i registren skiljer sig åt....................... |
1108 |
17.3.3Olika sätt att lösa insamlingen av uppgifter
|
om vacciner eller vaccinationer ........................... |
1109 |
17.3.4 |
Utredningens bedömning ................................... |
1115 |
17.4 Förutsättningar för att samla uppgifter om |
|
administrerade läkemedel från fler vårdgivare................... |
1116 |
17.4.1 |
Vilka olika uppgifter ska samlas in? ................... |
1119 |
17.4.2Förutsättningar att samla in uppgifter från
primärvård som regionerna ansvarar för ............ |
1121 |
17.4.3Förutsättningar att samla in uppgifter från
primärvård som kommunerna ansvarar för........ |
1125 |
17.4.4Förutsättningar att samla in uppgifter från
primärvård utförd av privata vårdgivare ............. |
1132 |
17.4.5 Förutsättningar att samla in uppgifter |
|
från vaccinationsverksamhet ............................... |
1133 |
17.4.6Sammanfattning av förutsättningar
att samla in uppgifter............................................ |
1134 |
17.5 En utökning av det föreslagna registret |
|
om administrerade läkemedel............................................. |
1135 |
17.6 Förslag avseende registret över administrerade läkemedel.. 1140
17.6.1Utredning om hälsodataregisters förslag till reglering av ett hälsodataregister över
administrerade läkemedel.................................... |
1140 |
17.6.2Uppgifter om en patient i registret över
|
administrerade läkemedel.................................... |
1142 |
17.6.3 |
Uppgiftsskyldighet till registret ......................... |
1143 |
17.6.4 |
Följdändring......................................................... |
1150 |
InnehållSOU 2025:71
17.7 |
Sekretess och uppgiftsskyldighet ....................................... |
1151 |
17.8 |
Integritets- och proportionalitetsanalys |
|
|
avseende förslaget om en utökning av registret |
|
|
över administrerade läkemedel ............................................ |
1152 |
17.9 |
Ikraftträdande- och övergångsbestämmelser..................... |
1157 |
18 |
Konsekvenser av utredningens förslag....................... |
1159 |
18.1 |
Utredningens förslag i korthet ........................................... |
1159 |
|
18.1.1 Konsekvenser av att inte vidta någon åtgärd ...... |
1163 |
|
18.1.2 |
Alternativa förslag................................................ |
1166 |
18.2 |
Förslagens förenlighet med EU-rätten .............................. |
1167 |
18.3 |
Konsekvenser för patientsäkerheten .................................. |
1168 |
|
18.3.1 |
Samhällsekonomiska effekter |
|
|
|
av ökad patientsäkerhet ....................................... |
1169 |
18.4 |
Konsekvenser för patienterna............................................. |
1172 |
18.5 |
Konsekvenser gemensamma för alla vårdgivare................. |
1174 |
|
18.5.1 Konsekvenser för vårdens fortsatta it-utveckling .1176 |
|
18.5.2 Konsekvenser för vårdens administration .......... |
1179 |
|
18.5.3 Ekonomiska konsekvenser för vårdgivarna........ |
1181 |
|
18.5.4 |
Övriga konsekvenser ........................................... |
1193 |
18.6 |
Finansieringsprincipen ........................................................ |
1194 |
|
18.6.1 |
Bedömningar av finansieringsprincipens |
|
|
|
tillämplighet i närliggande utredningar............... |
1195 |
|
18.6.2 |
Finansieringsprincipens tillämplighet |
|
|
|
på vår utrednings förslag ...................................... |
1197 |
18.7 |
Konsekvenser för den kommunala självstyrelsen.............. |
1199 |
18.8 |
Konsekvenser för kommuner och regioner ....................... |
1201 |
18.9 |
Konsekvenser för myndigheter .......................................... |
1204 |
|
18.9.1 |
Konsekvenser för E-hälsomyndigheten.............. |
1204 |
|
18.9.2 |
Konsekvenser för Folkhälsomyndigheten.......... |
1207 |
|
18.9.3 Konsekvenser för Inspektionen för vård |
|
|
|
och omsorg ........................................................... |
1207 |
|
18.9.4 |
Konsekvenser för Försvarsmakten ..................... |
1208 |
SOU 2025:71Innehåll
|
18.9.5 |
Konsekvenser för Kriminalvården...................... |
1208 |
|
18.9.6 |
Konsekvenser för Läkemedelsverket.................. |
1209 |
|
18.9.7 |
Konsekvenser för Socialstyrelsen ....................... |
1210 |
|
18.9.8 |
Konsekvenser för Statens institutionsstyrelse... |
1210 |
18.10 |
Konsekvenser för företagen ............................................... |
1211 |
|
18.10.1 |
Privata vårdföretag............................................... |
1211 |
|
18.10.2 |
Öppenvårdsapotek. ............................................. |
1214 |
18.11 |
Övriga konsekvenser .......................................................... |
1215 |
|
18.11.1 |
Konsekvenser för miljön..................................... |
1215 |
|
18.11.2 |
Jämställdhet mellan kvinnor och män ................ |
1216 |
|
18.11.3 |
Konsekvenser för barn ........................................ |
1217 |
|
18.11.4 |
Sysselsättning och offentlig service |
|
|
|
i olika delar av landet............................................ |
1217 |
|
18.11.5 |
Konsekvenser för brottsligheten ........................ |
1218 |
|
18.11.6 |
Konsekvenser för tillsynen ................................. |
1218 |
|
18.11.7 |
Konsekvenser för domstolarna........................... |
1219 |
18.12 |
Sammanfattning kostnader................................................. |
1219 |
18.13 |
Finansiering av utredningens förslag ................................. |
1221 |
19 |
Ikraftträdande- och övergångsbestämmelser |
|
|
samt följdändringar till utredningens förslag ............. |
1225 |
19.1 |
Patientdatalagen .................................................................. |
1225 |
19.2 |
Följdändringar med anledning av ändrad benämning ....... |
1226 |
19.3Förordningen om läkemedelsregister hos Socialstyrelsen..1227
19.4Förordningen om register över legitimerad hälso-
|
och sjukvårdspersonal och personal med bevis |
|
|
om rätt att använda yrkestiteln undersköterska................ |
1228 |
19.5 |
Förordningen med instruktion för E-hälsomyndigheten. 1229 |
19.6 |
Ikraftträdandetid och övergångsbestämmelser ................. |
1230 |
|
19.6.1 Lagen om läkemedelsförmåner m.m. |
|
|
och apoteksdatalagen........................................... |
1230 |
|
19.6.2 Lagen och förordningen om nationell |
|
|
läkemedelslista ..................................................... |
1231 |
|
19.6.3 Föreslagna följdändringar ................................... |
1236 |
Innehåll |
|
SOU 2025:71 |
20 |
Författningskommentar .......................................... |
1237 |
20.1 |
Förslaget till lag om ändring i lagen (1996:1157) |
|
|
om läkemedelskommittéer.................................................. |
1237 |
20.2 |
Förslaget till lag om ändring i lagen (2002:160) |
|
|
om läkemedelsförmåner m.m. ............................................ |
1238 |
20.3Förslaget till lag om ändring i patientdatalagen (2008:355)..1240
20.4Förslaget till lag om ändring i lagen (2009:366)
|
om handel med läkemedel ................................................... |
1241 |
20.5 |
Förslaget till lag om ändring i apoteksdatalagen |
|
|
(2009:367) ............................................................................ |
1242 |
20.6 |
Förslaget till lag om ändring i offentlighets- |
|
|
och sekretesslagen (2009:400) ............................................ |
1244 |
20.7 |
Förslaget till lag om ändring i lagen (2018:1212) |
|
|
om nationell läkemedelslista ............................................... |
1245 |
Bilagor |
|
|
Bilaga 1 |
Kommittédirektiv 2023:133........................................ |
1287 |
Bilaga 2 |
Kommittédirektiv 2024:124........................................ |
1301 |
Sammanfattning
Bakgrunden till utredningens uppdrag är ett sedan länge konstate- rat behov av att förbättra överblicken över patienters läkemedels- användning och öka patientsäkerheten. Riksdagen pekade år 2017 på behovet av en heltäckande nationell sammanställning av ordine- rade läkemedel för varje patient, något som dagens register natio- nell läkemedelslista inte fullt ut uppfyller, vare sig i omfattning eller teknisk utformning. Sedan lagen om nationell läkemedelslista trädde i kraft har registret införts för att samla uppgifter om patienters för- skrivna och uthämtade läkemedel. Alla vårdgivare och öppenvårds- apotek ska vara anslutna senast den 1 december 2025.
Uppdraget
Utredningen har haft i uppdrag att se över möjligheterna att utveckla registret nationell läkemedelslista genom att fler uppgifter läggs till, att regleringen blir tydligare, mer förutsägbar och flexibel samt att hälso- och sjukvården och öppenvårdsapoteken har anpassade arbets- processer. Syftet är att skapa ett ändamålsenligt register och att ytter- ligare förbättra patientsäkerheten. Utredningen har särskilt analyse- rat och tagit ställning till om och hur uppgifter om ordination och administrering av sådana läkemedel som patienter får vid behand- ling inom hälso- och sjukvården, inklusive vacciner, kan läggas till i den nationell läkemedelslistan. Utredningen har också analyserat och tagit ställning till om, och i så fall vilka, uppgifter om medicin- tekniska produkter kan läggas till i en nationell läkemedelslista. Ut- redningen har vidare kartlagt de arbetsprocesser som används inom hälso- och sjukvården respektive öppenvårdsapoteken vid ordina- tion och förskrivning respektive vid expediering av läkemedel och föreslagit hur de kan anpassas till registret nationell läkemedelslista.
31
Sammanfattning |
SOU 2025:71 |
I uppdraget har också ingått att se över lagen (2018:1212) om nationell läkemedelslista i vissa avseenden. Utredningen har därför analyserat vilka uppgifter som får registreras, för vilka ändamål de får behandlas och om nuvarande normgivningsnivå för olika bestäm- melser är lämplig. Vidare har utredningen kartlagt hur de spärrar som finns i registret nationell läkemedelslista hanteras i dag och, om det är möjligt, hur spärrarna kan samordnas eller ensas med de spärrar som finns i patientdatalagen (2008:355), analyserat och före- slagit hur förskrivares elektroniska tillgång till egna förskrivningar kan förtydligas, analyserat och tagit ställning till om öppenvårds- apotekens skyldighet att informera förskrivaren om genomförda utbyten enligt lagen (2002:160) om läkemedelsförmåner m.m. kan tas bort samt analyserat och tagit ställning till hur de övriga register som E-hälsomyndigheten för över hälso- och sjukvårdspersonal respektive folkbokföringen bör regleras. I uppdraget har ingått att lämna nödvändiga författningsförslag.
Genom ett tilläggsdirektiv fick utredningen i uppdrag att kart- lägga behoven av att ha uppgifter om rekvisitionsläkemedel från annan vård än slutenvård och specialiserade öppenvård i ett hälso- dataregister och att analysera vårdgivarnas förutsättningar att lämna uppgifter till ett sådant register.
Uppdrag inom ett föränderligt område
Utredningens uppdrag rör ett område där det för närvarande pågår ett intensivt förändrings- och utvecklingsarbete, såväl nationellt som internationellt. Ett flertal utredningar pågår, hade nyligen lämnat eller lämnade under vår utredningstid sina betänkanden, som på olika sätt rör frågor om elektronisk datadelning och interoperabilitet, såväl sektorsövergripande som specifikt för hälso- och sjukvårds- området. På EU-nivå slutförhandlades och beslutades under utred- ningstiden förordningen (EU) 2025/327 om det europeiska hälso- dataområdet. EU-förordningen påverkar direkt hur elektroniska hälsodata med personuppgifter ska kunna delas både nationellt och inom EU. Uppgifter bl.a. om patienters behandlingar med vaccin, medicintekniska produkter och implantat är uppgiftskategorier som specifikt omfattas av såväl EU-förordningen som vårt uppdrag. Även
SOU 2025:71 |
Sammanfattning |
uppgifter om vissa andra läkemedelsbehandlingar omfattas av EU- förordningen.
Utredningen har med anledning av det förändrings- och utveck- lingsarbete som pågår funnit att det är nödvändigt att, vid våra över- väganden om uppgifter i ökad utsträckning bör samlas i register eller om uppgifterna bör delas på annat sätt, sätta våra förslag i relation till vad som pågår på området i övrigt. Utvecklingen går t.ex. alltmer bort från att samla uppgifter i register och alltmer mot federerade lösningar, där uppgifter så långt möjligt enbart lagras hos den som först dokumenterat uppgiften. Utredningen har, vad gäller de delar av uppdraget som hänför sig till den nationella läkemedelslistan, koncentrerat förslagen till primäranvändning av data, dvs. använd- ning av hälsodata för tillhandhållande av hälso- och sjukvård till en patient. Hälso- och sjukvårdspersonal är beroende av en mängd upp- gifter för att kunna besluta om patientens vård och adekvat behand- ling. Utredningens uppdrag begränsas till uppgifter om ordination och administrering av sådana läkemedel som patienter får vid be- handling inom hälso- och sjukvården, inklusive vaccin, och medi- cintekniska produkter. Även denna begränsning av utredningens uppdrag nödvändiggör att förslag om hanteringen av dessa data behöver passa in i vad som i övrigt händer och föreslås på området. Det är enligt utredningen olämpligt att bygga upp särskilda system för datadelning av begränsade uppgiftskategorier utan att också klara ut hur detta passar in i en helhet. Utredningen har avgränsat förslagen till att avse gällande nationell rätt utan att föreslå anpass- ningar av denna till den nya EU-förordningen om det europeiska hälsodataområdet. Ett arbete med en sådan anpassning av nationell lagstiftning i sin helhet har pågått parallellt med vår utredning, men är inte färdigt. Anpassningen av lagen om nationell läkemedelslista till EU-förordningen görs därför lämpligast inom ramen för det arbe- tet, så att anpassningen av de lagar som berörs blir enhetlig.
Genom valet av lösningar lägger utredningen en grund för en nationell infrastruktur för datadelning på läkemedels- och medicin- teknikområdet där uppgifter som omfattas av utredningens upp- drag utgör några få av många pusselbitar i den nya nationella infra- strukturen. Utredningen gör inte anspråk på att förslagen ska täcka vare sig patientens, vårdens eller öppenvårdsapotekens samlade behov av vårdinformation men de utgör en viktig del i detta arbete. För- slagen är utformade så att de ska vara förenliga med, eller möjliga
Sammanfattning |
SOU 2025:71 |
att anpassa till, andra initiativ och utredningars förslag på området, liksom till det europeiska hälsodataområdet.
Utgångspunkten för utredningens arbete är patientperspektivet och att skapa ett mer ändamålsenligt tillgängliggörande av uppgifter. Genom en samlad nationell översikt av patientens behandlingar med läkemedel och vissa medicintekniska produkter förbättras patient- säkerheten. När behörig vårdpersonal och patienten själv får tillgång till mer komplett information bör risken för felbehandling, som
i dag kan uppstå på grund av fragmenterad eller inaktuell informa- tion, minska. Utredningen har arbetat utifrån premissen att patient- journalen även fortsättningsvis är det primära verktyget för infor- mationsinhämtning i vården och att en nationell sammanställning av uppgifter om patientens läkemedelsbehandling och behandling med, inledningsvis, vissa medicintekniska produkter kan utgöra ett viktigt komplement när journalinformation är spridd eller svåråt- komlig. Den övergripande visionen har varit att bygga upp en natio- nell infrastruktur för information om patienters läkemedelsbehand- ling och vissa medicintekniska behandlingar som kan användas av såväl patienten själv som berörd hälso- och sjukvårdspersonal.
Bedömningar och förslag, grunduppdraget
Utredningen har primärt utgått från patientperspektivet och patient- nyttan i sina överväganden. För förståelsen för hur en patient ordi- neras eller förskrivs ett läkemedel och, när så är aktuellt, därefter kan hämta ut rätt läkemedel från öppenvårdsapotek beskrivs dessa processer inledningsvis i betänkandet. Även processen för när en patient ordineras en medicinteknisk produkt redovisas. Utredningen beskriver också hur uppgifter enligt gällande regelverk ska dokumen- teras i samband med detta och hur uppgifter får delas och tillgäng- liggöras.
För att fånga vilka behov av uppgifter som finns har utredningen genomfört enkäter riktade till patienter, hälso- och sjukvårdpersonal och apotekspersonal. Utredningen har även genomfört ett möte med patientorganisationer för att inhämta deras synpunkter.
Utredningens bedömningar och förslag syftar sammantaget till att utvidga tillgängliggörandet av uppgifter om en patients behand- lingar med läkemedel och användning av medicintekniska produkter
SOU 2025:71 |
Sammanfattning |
och att även i övrigt skapa förutsättningar för en mer heltäckande, nationell infrastruktur för sådan information. Centralt i utredningens resonemang är balansen mellan att dela mer information för ökad patientsäkerhet och att samtidigt skydda patientens integritet. Lös- ningen som föreslås är bl.a. därför delvis federerad (decentraliserad) och delvis centraliserad genom register. Utredningen bedömer att huvuddelen av de uppgifter som tillgängliggörs kan delas via befint- liga journal- och systemlösningar (federerade tekniska lösningar), men att vissa uppgifter behöver samlas i centrala register för att säker- ställa att de alltid finns tillgängliga vid vårdbehov över längre tid.
En ny nationell infrastruktur
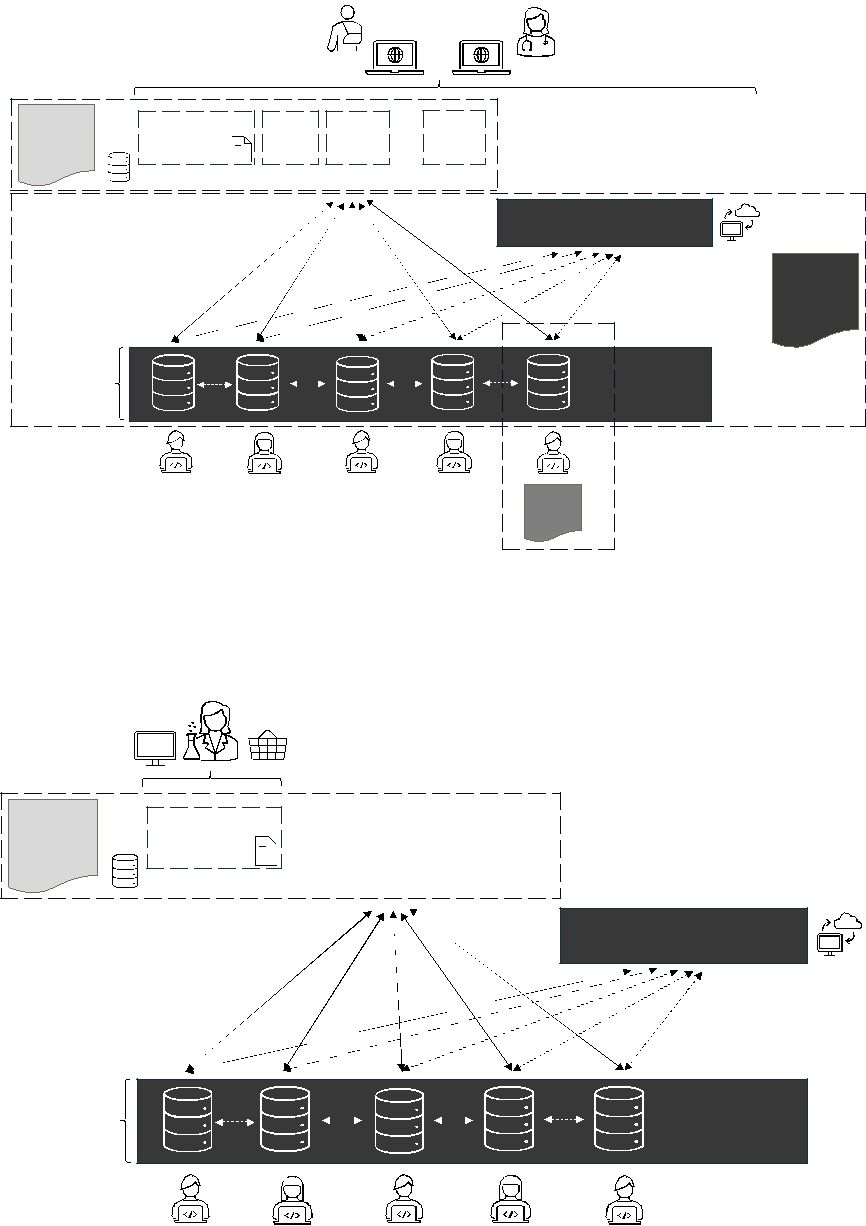
Utredningen föreslår begreppet en nationell infrastruktur för informa- tion om en patients läkemedelsbehandling och behandling med eller användning av vissa medicintekniska produkter, i stället för att enbart tala om en nationell läkemedelslista eller ett register. Med detta menas en sammanhållen lösning där information kan hämtas från flera källor (olika journalsystem och register) och göras tillgänglig för behöriga användare på ett samlat och enhetligt sätt. En sådan infrastruktur bör vara statligt förvaltad för att säkra nationell styrning och likvärdig tillgång till data för patienter och vårdgivare oavsett driftsform. En fördel med detta är att all relevant data inte lagras på en enda plats, utan det viktiga är att data kan tillgängliggöras för den som behöver den, när den behövs. Utredningen anser därför att visionen av en nationell läkemedelslista ska vidareutvecklas till ett system av kom- ponenter: delvis genom utbyte av information direkt mellan vårdens it-system (interoperabilitet/federation) och delvis genom utökade nationella register där så krävs. Figur 1 nedan illustrerar den före- slagna infrastrukturlösningen ur patientens och vårdpersonalens per- spektiv, medan figur 2 visar motsvarande infrastruktur ur apoteks- personalens perspektiv (då apoteken föreslås ha en mer begränsad åtkomst).
Sammanfattning |
SOU 2025:71 |
Figur 1 Schematisk illustration över den föreslagna nationella infrastrukturen för information om en patients läkemedelsbehandling och användning av vissa medicintekniska produkter (perspektiv: patient och hälso- och sjukvårdspersonal)
Nationell infrastruktur för information om en patients behandling med läkemedel eller medicintekniska produkter
Lagen om |
Förskrivningar och |
|
Vissa lm |
|
|
nationell |
Vacciner |
|
|
expedierade |
med lång |
|
Vissa MTP |
läkemedels |
|
|
läkemedel |
|
|
|
verkan |
|
|
-lista |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Registret nationell läkemedelslista |
MTP-registret |
|
|
|
|
|
|
|
|
Administrerade eller överlämnade
läkemedel
Lagen om
sammanhållen
vård- och omsorgs- dokumentation
Ordinationer i |
|
vårdgivares |
|
system |
(n…) |
Patient-
datalagen
Figur 2 Schematisk illustration över en nationell infrastruktur för information om en patients behandling med läkemedel eller medicintekniska produkter (perspektiv:apotekspersonal)
Lagen om |
Förskrivningar och |
|
|
nationell |
|
|
expedierade |
|
|
läkemedels |
|
|
läkemedel |
|
|
|
|
|
|
|
|
-lista |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Registret nationell läkemedelslista |
MTP-registret |
|
|
|
|
|
|
Administrerade eller överlämnade
läkemedel
Ordinationer i |
|
vårdgivares |
|
system |
(n…) |
SOU 2025:71 |
Sammanfattning |
För att ge en heltäckande bild och skapa förutsättningar för att öka patientsäkerheten behöver infrastrukturen omfatta uppgifter om ordi- nation, administrering, förskrivning och expediering av läkemedel samt uppgifter om vissa medicintekniska produkter. En sådan natio- nell sammanställning av ordinerade och förskrivna produkter är ett viktigt komplement till den enskilda patientjournalen för upprätt- hållande av patientsäkerheten. En patientjournal visar endast de ordi- nationer som gjorts inom den enskilda vårdgivarens system, och ibland inte ens all sådan information. Informationsdelningen mellan vårdgivare är begränsad. Registret nationell läkemedelslista i sin nu- varande form möjliggör visserligen en sammanhållen bild av förskrivna och uthämtade läkemedel, men den omfattar inte läkemedel som administreras i vården eller information om medicintekniska pro- dukter som patienten tillförts. Den information som delas via Inera AB:s tjänster är inte heller komplett då varken alla vårdgivare eller vårdinformationssystem är anslutna. Därför kvarstår behovet av en mer komplett sammanställning. Utredningen konstaterar att situa- tioner ofta uppstår där vårdpersonal saknar tillgång till viktig läke- medelsinformation eller information om t.ex. patientens implantat i sina vårdinformationssystem – exempelvis om en patient har fått läkemedel administrerade i en annan region eller hos en vårdgivare med ett annat vårdinformationssystem. Genom att bygga ut infra- strukturen kan dessa luckor täppas till.
Myndigheten för vårdanalys bör få i uppdrag att utvärdera och följa upp införandet av den nya infrastrukturen för hälso- och sjuk- vården. I ett första skede bör myndigheten följa upp det nuvarande införandet av den nationella läkemedelslistan som ska vara genom- fört till december 2025. I ett senare skede bör myndigheten följa upp implementeringen av den av utredningen föreslagna vidare utveck- lingen av infrastrukturen.
Federerad lösning
Utredningen bedömer att en federerad lösning är lämplig för hanter- ing av merparten av de hälsodata som omfattas av utredningens upp- drag eftersom en sådan lösning minimerar integritetsrisker genom att undvika onödig central lagring av patientuppgifter. Därigenom säkerställs också att aktuella uppgifter kan delas och man undviker
Sammanfattning |
SOU 2025:71 |
risken att en uppgift inte uppdateras på samtliga ställen där upp- giften lagras när uppgiften t.ex. lagras både i en journal och i ett register. Att utredningen stannar vid en bedömning och inte lägger fram ett eget konkret förslag i denna del beror på att de lagänd- ringar som krävs redan presenterats av en tidigare statlig utredning (SOU 2024:33).1 Där föreslås det bli obligatoriskt för vårdgivare att elektroniskt dela viss patientinformation genom just federerade lösningar. Vår utredning bygger därmed vidare på detta förslag och begränsar sig därför till att föreslå att interoperabilitetsspecifika- tioner utvecklas för att möjliggöra teknisk och semantisk interopera- bilitet och kompatibilitet med de federerade lösningar som föresla- gits i SOU 2024:33.
Ordinationer och i hälso- och sjukvården administrerade läkemedel
En huvudfråga för utredningen har varit om uppgifter om läkemedel som administreras till patienten i vården ska samlas i registret natio- nell läkemedelslista. Utredningens bedömning är att all information om en patients läkemedelsbehandling bör ingå i den nationella sam- manställningen, men att tekniska lösningar för lagring och tillgäng- liggörande kan variera. Utredningen föreslår därför att:
–Uppgifter om vad behörig hälso- och sjukvårdspersonal ordine- rat liksom, som huvudregel, uppgifter om läkemedel som admini- strerats eller överlämnats till patienten i hälso- och sjukvården ska göras tillgängliga nationellt. I första hand ska detta ske fede- rerat via interoperabilitetslösningar, dvs. att olika journalsystem kan utbyta dessa data genom den nationella infrastrukturen. Rele- vanta specifikationer för teknisk och semantisk interoperabilitet behöver därför tas fram. Utredningen föreslår att E-hälsomyn- digheten får i uppdrag att, tillsammans med Socialstyrelsen, ut- veckla de standarder och tekniska specifikationer som krävs för ett sådant informationsutbyte avseende ordinationer och admini- streringar. I arbetet ska myndigheterna dra nytta av pågående arbeten nationellt och inom EU för digital hälsodatainfrastruk- tur, och involvera Sveriges kommuner och regioner, SKR, samt
1SOU 2024:33 Delad hälsodata – dubbel nytta, Regler för ökad interoperabilitet i hälso- och sjukvården.
SOU 2025:71 |
Sammanfattning |
privata vårdgivare i framtagandet. En interoperabel, modulär arki- tektur anses ge ökad flexibilitet och minska riskerna jämfört med monolitiska system.
–Uppgifter om vissa i hälso- och sjukvården administrerade läke- medel med långvarig effekt bör samlas i ett nationellt register. Vissa läkemedel som ges av vårdpersonal har effekt som kan sträcka sig över lång tid, ibland livslångt (t.ex. genterapi och vissa biologiska läkemedel). För dessa kan en federerad lösning där uppgifterna delas direkt från patientjournalen vara otillräck- lig, då patienten kan behöva vård lång tid efter att läkemedlet administrerats eller på annan ort eller hos en annan vårdgivare. Det kan innebära att elektronisk åtkomst till uppgifter i ursprungs- journalen inte alltid är möjlig. Uppgifter om i hälso- och sjukvården administrerade läkemedel med långvarig effekt och som är av sär- skild betydelse att ha kännedom om i patientens fortsatta vård bör därför enligt utredningen samlas i registret nationell läke- medelslista. Uppgifter om andra läkemedel, med mer kortvarig effekt, som administreras i vården bör enligt utredningen delas via journalsystemen på samma sätt som uppgifter om ordinatio- ner. Detta innebär att registret nationell läkemedelslista utvidgas men ändå inte kommer innehålla alla uppgifter om i vården admini- strerade läkemedel, endast den kritiska delmängd som kan vara svår eller omöjlig att få tillgång till elektroniskt på annat sätt. Utredningen föreslår att Socialstyrelsen ska föreskriva om vilka i hälso- och sjukvården administrerade läkemedel som ska om- fattas av registret och vilka förutsättningar som ska gälla för det. Socialstyrelsen ska i det arbetet samråda med Läkemedelsverket.
Vaccin
En särskild fråga för utredningen har varit hur information om admi- nistrerade vacciner ska hanteras. Vacciner är läkemedel, ofta med långvarig effekt, som ges i förebyggande syfte och som hanteras sepa- rat t.ex. i samband med dokumentation i patientjournalen. Admini- strerade vaccin som ingår i nationella vaccinationsprogram och vaccin mot covid-19 registreras i dag i det Nationella vaccinationsregistret som förs av Folkhälsomyndigheten. Det registret är endast tillgängligt för sekundäranvändning, dvs. det är inte möjligt att använda för pati-
Sammanfattning |
SOU 2025:71 |
entens fortsatta vård och behandling och är inte tillgängligt för patien- ten själv (primäranvändning). Enligt utredningen vore det värdefullt för både patienten och hälso- och sjukvårdspersonalen om även en patients kompletta vaccinationsuppgifter var åtkomliga via den natio- nella infrastrukturen.
Utredningen gör därför bedömningen att uppgifter om genom- förda vaccinationer bör vara en del av den nationella infrastruktu- ren tillgänglig för vårdpersonal och patient. Utredningen föreslår att även uppgifter om i hälso- och sjukvården administrerade vaccin ska ingå i registret nationell läkemedelslista. För att möjliggöra detta behöver begreppet vaccin definieras i lagen, så att det avgrän- sas till traditionella vacciner, dvs. mot sjukdomar orsakade av ett smittämne. Utredningen föreslår en definition av vaccin i lagen som följer den EU-rättsliga definitionen av begreppet. Genom att samla vaccinationsuppgifter i registret nationell läkemedelslista blir de elektroniskt åtkomliga för behörig hälso- och sjukvårdspersonal (med patientens samtycke, se nedan) och för patienten själv, vilket kan underlätta kliniska bedömningar (t.ex. vid kontroll av vilka vaccin en patient redan fått) och ge patienten bättre överblick.
Medicintekniska produkter
Utredningen har också analyserat om uppgifter om medicintekniska produkter bör tillgängliggöras genom ett nationellt register. Utred- ningen gör här en liknande avvägning som för läkemedel och vaccin. Utredningens bedömning är att uppgifter om användning av medicin- tekniska produkter som är viktiga att ha kännedom i patientens vård i regel ska delas via de ordinarie systemen (federerat), men att för vissa medicintekniska produkter med avsedd långvarig användning behövs ett nationellt register.
Det finns ett mycket stort antal olika medicintekniska produkter (hundratusentals på svenska marknaden) och utredningen bedömer att endast en avgränsad grupp är relevanta i detta sammanhang. Fokus bör initialt ligga på implantat och invasiva produkter med avsedd långvarig användning – sådana produkter som kvarstannar i patien- tens kropp eller vars användning påverkar framtida vård (t.ex. pace- makers, proteser, insulinkanyler med kontinuerlig infusion, osv.). Därigenom ges vårdpersonal alltid tillgång till information om pati-
SOU 2025:71 |
Sammanfattning |
enten har t.ex. en viss pacemaker, även om patienten behandlas av någon annan än den ursprungliga vårdgivaren eller lång tid efter att den medicintekniska produkten tillfördes patienten. Detta bedöms öka patientsäkerheten vid exempelvis akuta situationer, vid olika radiologiska undersökningar eller vid säkerhetskontroller i samband med resa, där kunskap om en patients implantat är kritisk. Patien- terna själva efterfrågar också bättre överblick över sina implantat; en av utredningen genomförd enkät visar att både patienter med och utan implantat värdesätter möjligheten att ha sådan informa- tion lätt tillgänglig.
Utredningen föreslår att det bör inrättas ett särskilt medicintek- nikregister inom ramen för den nationella infrastrukturen. Registret ska föras av E-hälsomyndigheten och innehålla uppgifter om medi- cintekniska produkter med avsedd långvarig användning som till- förts en patient i samband med hälso- och sjukvård och som det är av särskild betydelse att ha kännedom om i patientens fortsatta vård. Registret bör regleras genom samma lag och förordning som regi- stret nationell läkemedelslista. Utredningen föreslår att Socialstyrelsen ska få föreskriva om vilka medicintekniska produkter som ska om- fattas av registret och vilka förutsättningar som ska gälla för det. Socialstyrelsen ska samråda med Läkemedelsverket i det arbetet.
Utredningen föreslår att lagen och förordningen om nationell läkemedelslista ges nya benämningar som återspeglar det bredare innehållet; lagen, respektive förordningen, om nationella register över vissa läkemedel och andra produkter i medicinsk användning. Det innebär en utökning av lagstiftningen om den nationella läke- medelslistan som därefter även omfattar vissa medicintekniska pro- dukter.
Skyldighet för vårdgivare att lämna uppgifter till register
För att registren ska kunna föras enligt utredningens förslag behö- ver vårdgivare åläggas en skyldighet att lämna uppgifter till registren när läkemedel som omfattas av lagen, inklusive vaccin, administreras en patient och när en medicinteknisk produkt som omfattas av lagen tillförs en patient eller åtgärder vidtas med en tidigare tillförd sådan medicinteknisk produkt som påverkar redan registrerade uppgifter. Utredningen föreslår därför en sådan skyldighet. Skyldigheten för
Sammanfattning |
SOU 2025:71 |
vårdgivare att rapportera uppgifter till nationella register ställer krav på interoperabilitet varför en gemensam informationsmodell och gemensamma nationella specifikationer på området behöver tas fram. När sådana specifikationer finns på plats och är implementerade bör även en fullständig automatisering av inrapportering till nationella register vara möjlig. Utredningens förslag att administrering av läke- medel, inklusive vaccin, i vissa fall ska lämnas till fler register bör därför inte medföra ökad administration.
Åtkomst och integritet
Vem som ska få ta del av de utökade uppgifterna och hur åtkomsten ska regleras har varit en viktig del av utredningens analys. Här görs skillnad mellan patienten själv, hälso- och sjukvårdspersonal och apotekspersonal. Enligt nuvarande bestämmelser är det patienten och vårdpersonal med vårdrelation till patienten som med samtycke medges direktåtkomst till uppgifterna i registret nationell läkemedels- lista, medan apotekspersonal har direktåtkomst för att expediera förskrivningar samt, med patientens samtycke, för att underlätta en patients läkemedelsanvändning. Utredningen föreslår inga utvid- gningar av personkretsen som har direktåtkomst – de kategorier som i dag har tillgång ska ha det även fortsättningsvis, men inga nya till- kommer. Däremot behöver det klargöras vilka uppgifter respektive kategori ska få ges åtkomst till.
Utredningen gör bedömningen att apotekspersonal inte bör få direktåtkomst till de nya kategorierna uppgifter (dvs. om ordinationer och i hälso- och sjukvården administrerade läkemedel, vacciner och medicintekniska produkter som omfattas av det nya medicinteknik- registret). Skälen är att apotekens uppdrag till stor del rör förskrivna läkemedel och andra varor och att det i dagsläget saknas både författ- ningsstöd och uttryckt behov av att apoteken hanterar t.ex. informa- tion om patientens implantat eller administrerade vaccin. Apoteks- personal kommer alltså även framöver att kunna se uppgifter om förskrivningar (recept, livsmedelsanvisningar och hjälpmedelskort) och tidigare expedierade läkemedel och andra varor. För hälso- och sjukvårdspersonal däremot innebär förslagen att de – som huvudregel under förutsättning av patientens samtycke – får en mer heltäckande bild, inklusive de nya uppgifterna, via infrastrukturen. Patienten själv
SOU 2025:71 |
Sammanfattning |
kommer också att genom E-hälsomyndighetens portal (via 1177.se, Läkemedelskollen eller liknande) kunna se sina uppgifter om ordina- tioner, i hälso- och sjukvården administrerade läkemedel och vissa medicintekniska produkter utöver som i dag sina förskrivna och ut- hämtade läkemedel och andra varor. Detta stärker patientens insyn och kontroll över sin egen behandling, vilket är positivt för delaktig- het och kan medföra mer framgångsrik behandling.
Patientens möjlighet att spärra uppgifter i registren för hälso- och sjukvårdpersonal har analyserats för att se om möjligheten att spärra uppgifter som ges i olika lagar kan ensas eller samordnas. Möj- ligheten för patienten att kunna spärra känsliga uppgifter i register är viktig ur integritetssynpunkt. Å andra sidan är det viktigt att den som ordinerar eller administrerar behandlingar har tillgång till rele- vant information för att kunna bedriva säker vård. Utredningen be- dömer att nuvarande samtyckes- och spärrmekanismer för närvarande bör bibehållas, men att patientens förståelse för omfattningen och konsekvenserna av hur spärrar sätts behöver öka.
Lagens reglering av bl.a. spärrar och krav på patientens samtycke för direktåtkomst är områden som kan förväntas påverkas av den an- passning av nationell rätt till EU-förordningen om det europeiska hälsodataområdet som utreds särskilt för närvarande.
Genom att centralt i register enbart samla de mest nödvändiga uppgifterna minimeras omfattningen av känsliga personuppgifter i register. Utredningen föreslår också att detaljregler om vilka upp- gifter registren får innehålla flyttas från lag till förordning. På så vis kan regeringen snabbare justera vilka uppgifter som får ingå, utan att tumma på integritetsskyddet, eftersom ramen sätts i lag och endast nödvändiga uppgifter för i lagen angivna ändamål får samlas. De upp- gifter som enligt utredningen bör få samlas och tillgängliggöras är nödvändiga för att ändamål som fastslås i lag ska kunna uppfyllas samt för att E-hälsomyndigheten och hälso- och sjukvårdspersonal ska kunna utföra sina åligganden. Den personuppgiftsbehandling som möjliggörs genom utredningens förslag utgör enligt utredningen en proportionerlig inskränkning av det skydd för den personliga integ- riteten som finns i regeringsformen, den europeiska konventionen om skydd för de mänskliga rättigheterna och de grundläggande frihe- terna samt Europeiska unionens stadga om de grundläggande rättig- heterna. Utredningen bedömer att förslagen också är förenliga med kravet på proportionalitet i EU:s dataskyddsförordning.
Sammanfattning |
SOU 2025:71 |
Offentlighet- och sekretess
Som angetts ovan föreslår utredningen att E-hälsomyndigheten utöver registret nationell läkemedelslista även ska föra ett medicin- teknikregister. Även medicinteknikregistret regleras i lagen om nationell läkemedelslista och regleringen följer strukturen för hur registret nationell läkemedelslista regleras. Det föranleder att vissa tillägg i offentlighets- och sekretesslagen (2009:400) är nödvändiga för att motsvarande sekretess ska gälla för uppgifter i medicinteknik- registret som i registret nationell läkemedelslista. Den sekretess- brytande bestämmelsen för E-hälsomyndigheten vid utlämnande av uppgifter från registren i enlighet med vad som följer av lagen om nationell läkemedelslista behöver också ändras med anledning av att medicinteknikregistret tillkommer. Utredningen föreslår därför sådana ändringar.
Författningsförslag
Utredningen lämnar förslag till ändringar i lagen (2018:1212) och förordningen (2021:67) om nationell läkemedelslista. Bland annat föreslås:
–Utvidgat tillämpningsområde; lagens rubrik och inledning ändras för att lagen tydligt i tillämpliga delar ska omfatta även vaccin och vissa administrerade läkemedel med långvarig effekt, och vissa medicintekniska produkter, i två register. Lagen utökas med särskilda kapitel om medicinteknikregistret.
–Definitioner; en definition av vaccin och av vad som avses med uttrycket ordinationsorsak införs i lagen.
–Ändrad normhierarki; i lagen anges övergripande vilka typer av uppgifter registren får innehålla, medan detaljuppgifter specifi- ceras i förordningen. Den övergripande uppräkningen sätter en ram för vilka uppgifter som registren får innehålla. I förordningen preciseras vilka konkreta uppgifter som får ingå. Detta ger flexi- bilitet att i framtiden lägga till eller justera uppgifter inom den i lagen angivna ramen utan att behöva ändra i lagen varje gång. Även E-hälsomyndighetens uppgiftsskyldighet detaljregleras enligt utredningens förslag till största delen i förordning. Till vem uppgiftsskyldighet föreligger kvarstår dock i lag.
SOU 2025:71 |
Sammanfattning |
–Bevarandetider; personuppgifter som hänför sig till vaccin, läke- medel med långvarig effekt och medicintekniska produkter med avsedd långvarig användning behöver få finnas i registren längre tid än de fem år som lagens gällande lydelse medger. Utredningen föreslår därför att sådana uppgifter ska få bevaras så länge de är nödvändiga för de ändamål som anges i lagen, dock som längst fem år efter patientens död.
–Direktåtkomst utan samtycke för förskrivare till egna förskriv- ningar i registret nationell läkemedelslista och till medicintek- nikregistret för korrigeringar; utredningen har analyserat behovet av att förtydliga förskrivares rätt till direktåtkomst till sina tidi- gare registrerade förskrivningar i registret nationell läkemedels- lista för att kunna korrigera fel och göra justeringar. Enligt gällande rätt krävs patientens samtycke för att förskrivaren ska kunna se uppgifter i registret, vilket kan förhindra nödvändiga korriger- ingar. Utredningen föreslår en ändring som tydliggör att en förskrivare får ha direktåtkomst till sina egna förskrivningar i registret utan patientens samtycke och utan hinder av spärr när syftet är att korrigera eller justera uppgifter. Sådan åtkomst ska under vissa förutsättningar även vara tillåten för en annan för- skrivare för att möjliggöra t.ex. att en annan förskrivare vid samma vårdcentral kan göra nödvändiga justeringar. Även uppgifter i medicinteknikregistret ska få uppdateras, korrigeras och rättas utan patientens samtycke och utan hinder av att uppgifter är spärrade. Sådana justeringar stärker patientsäkerheten och effek- tiviteten, och åtgärden anses proportionerlig eftersom det gäller uppgifter om patienten som förskrivaren redan har kännedom om.
–Verkställighetsföreskrifter; E-hälsomyndigheten bör få bemyn- digande att föreskriva om verkställighet av lagen och förord- ningen om nationell läkemedelslista.
Utredningen föreslår även en ändring av öppenvårdsapotekens rap- porteringsskyldighet som regleras i lagen (2002:160) om läkemedels- förmåner m.m. Enligt den lagen har öppenvårdsapoteken en skyl- dighet att informera förskrivaren när ett annat likvärdigt läkemedel har lämnats ut till patienten än det förskrivna. Eftersom information om expedierade läkemedel finns i registret nationell läkemedelslista, föreslår utredningen att detta krav tas bort.
Sammanfattning |
SOU 2025:71 |
Utredningen har också gjort en förnyad analys av den rättsliga grunden för registrering av fullmakter och funnit att denna bör ut- göras av utförande av en uppgift av allmänt intresse och inte grundas på samtycke. Denna bedömning föranleder enligt utredningens för- slag en mindre ändring i lagen.
Utredningen föreslår inga författningsändringar hänförligt till E-hälsomyndighetens register FORS och FOLK. E-hälsomyndig- heten bör få uppdrag att analysera och utreda hur myndigheten be- höver använda uppgifter ur Socialstyrelsens register över legitimerad hälso- och sjukvårdspersonal och personal med bevis om rätt att använda yrkestiteln undersköterska och om dessa behov föranleder några författningsändringar.
Sammanfattningsvis innebär utredningens förslag att registret nationell läkemedelslista tillsammans med medicinteknikregistret utvecklas och att grunden läggs för vidare delning av information genom federerade lösningar. Förslaget innebär att patienten och hälso- och sjukvården kommer att få tillgång till mer komplett in- formation om patientens läkemedelsbehandlingar och om vissa till- förda medicintekniska produkter samt även till uppgifter om ordina- tioner. Apoteken har fortsatt tillgång till de uppgifter de har i dag och behöver för expediering av förskrivna läkemedel och andra varor och för underlättande av patientens läkemedelsbehandling. De lag- ändringar som föreslås skapar ramen för denna utvidgning, samtidigt som integritetsskyddande åtgärder (såsom samtycke, spärr, begräns- ning av åtkomst och bevarandetider) behålls och förtydligas där nöd- vändigt.
Arbetsprocesser
Den infrastruktur som utredningen beskriver skapar förutsättningar och möjligheter att dela information mellan olika aktörer i syfte att förbättra patientsäkerheten. För att informationen ska skapa värde för dem som får åtkomst till uppgifterna måste den presenteras på ett relevant, begripligt och lättillgängligt sätt som också stödjer en fortsatt utveckling av de gemensamma arbetsprocesserna. Detta är ett gemensamt ansvar såtillvida att ingen aktör ensam kan svara för detta. Infrastrukturen behöver ta sin utgångspunkt i patientens och hälso- och sjukvårdens behov. En mycket viktig del är därför att in-
SOU 2025:71 |
Sammanfattning |
volvera samtliga berörda aktörer i arbetet med att omsätta utred- ningens förslag i praktiken, både nationellt i utvecklingen av infra- struktur såväl som lokalt i arbetet med processer.
Utredningen gör bedömningen att för att realisera nyttan med utökad uppgiftsdelning och uppnå en patientsäker läkemedels- och medicinteknikprocess behöver det inrättas en samverkansstruktur vid sidan av den som i dag finns vid E-hälsomyndigheten till stöd för samverkan mellan berörda aktörer. Ett samverkansforum för pati- entcentrerade arbetsprocesser samt för frågor om ansvar vid ordina- tion, förskrivning och expediering av läkemedel och medicintekniska produkter, bör inrättas vid Läkemedelsverket. Forumet bör samla berörda aktörer och med patienten i centrum gemensamt utveckla läkemedels- och medicinteknikprocesserna ur ett helhetsperspektiv som sträcker sig bortom teknikfrågor. Målsättningen bör vara att fortlöpande arbeta med att förbättra patientsäkerheten i processerna utifrån omvärldsutvecklingen. Utgångspunkten är att de åtgärder som gemensamt identifieras i första hand ska kunna lösas genom de ingående aktörernas olika ansvar och att endast sådana frågor som kräver ytterligare mandat hänskjuts till regeringen.
Deltagare i detta forum bör vara representanter för patienter, professioner, vårdgivare samt öppenvårdsapotek. De statliga myn- digheter som bör ingå är E-hälsomyndigheten, Folkhälsomyndig- heten, Inspektionen för vård och omsorg, Läkemedelsverket och Socialstyrelsen. Andra myndigheter bör kunna adjungeras vid behov. Vid behov bör även representanter för systemleverantörer bjudas in till forumet.
Det bör åligga Läkemedelsverket att årligen upprätta en rapport som beskriver den genomförda samverkan och vilka åtgärder man gemensamt kommit överens om behöver genomföras. Av rapporten bör också framgå vilka åtgärder man bedömt varit nödvändiga men som aktörerna inte själva kunnat genomföra.
Behov och förutsättningar för fler uppgifter om administrerade läkemedel i hälsodataregister
Genom förslagen i betänkandet Ett nytt regelverk för hälsodataregister (SOU 2024:57) möjliggörs insamling av uppgifter om användningen av rekvisitionsläkemedel (dvs. i huvudsak läkemedel som admini-
Sammanfattning |
SOU 2025:71 |
streras i hälso- och sjukvården) inom både slutenvården och den specialiserade öppenvården till ett nytt hälsodataregister, registret över administrerade läkemedel, hos Socialstyrelsen. Vår utredning har genom tilläggsdirektiv fått i uppdrag att kartlägga behovet av att samla in uppgifter om rekvisitionsläkemedel även från annan vård än slutenvård och specialiserad öppenvård, samt att analysera vårdgivarnas förutsättningar att lämna sådana uppgifter till ett regi- ster och föreslå regler för personuppgiftsbehandling.
Utredningen konstaterar att det finns ett behov av att samla in uppgifter om administrerade rekvisitionsläkemedel även från öppen- vård som inte är specialiserad, inklusive kommunal hälso- och sjuk- vård. Sådan information är viktig för i huvudsak samma ändamål som konstaterades av Utredningen om hälsodataregister t.ex. för statistik, uppföljning, forskning och patientsäkerhet. Det krävs också för att skapa en heltäckande nationell läkemedelsstatistik. Socialstyrelsen, som ansvarar för den officiella statistiken inom hälso- och sjukvård, behöver dessa uppgifter, oberoende av vårdform, för sina uppdrag. Även regionerna har behov av individbaserad information för exempelvis kunskapsstyrning, verksamhetsutveckling, kostnadsprog- noser och beredskap. Ett särskilt viktigt användningsområde är vid introduktion av nya läkemedel, där både regioner, myndigheter och läkemedelsföretag behöver tillgång till heltäckande och aktuella data för att kunna följa upp användning, effekter och kostnader på individ-
nivå. Sådan information är viktig för att kunna fatta välgrundade beslut om införande och uppföljning av nya behandlingar i hälso- och sjukvården.
Behovet omfattar även uppgifter om administrerade vaccin. Efter- som många vaccin ges utanför nationella vaccinationsprogram och utanför slutenvården och den specialiserade öppenvården, finns ett särskilt behov av att även dessa uppgifter samlas in och kan följas upp på ett systematiskt sätt.
När det gäller regionernas förutsättningar att lämna de nu aktuella uppgifterna till ett hälsodataregister konstaterar utredningen att flera av de vårdinformationssystem, som skulle beröras av krav på en ökad insamling av uppgifter om läkemedel som administreras i öppenvård som inte är specialiserad, redan påverkas av de förslag som Utred- ningen om hälsodataregister lämnat i sitt betänkande. Genom den interoperabilitetsspecifikation som föreslås i detta betänkande skapas dessutom en teknisk grund för att strukturerat kunna överföra upp-
SOU 2025:71 |
Sammanfattning |
gifter om administrerade läkemedel till det nationella registret. Efter- som regionerna i regel använder eller kommer att använda samma huvudsakliga vårdinformationssystem i primärvården som i den spe- cialiserade öppenvården bedömer utredningen att några ytterligare systemanpassningar inte kommer att krävas i dessa system för att även möjliggöra insamling av uppgifter om administrerade läkemedel från annan vård än den specialiserade öppenvården och slutenvården.
Det finns många vårdgivare som bedriver både privat och offent- lig vård som inte är sluten vård eller specialiserad öppenvård. Dessa vårdgivare använder ofta traditionella vårdinformationssystem där dokumentation av läkemedelsbehandlingar sker strukturerat. Antalet olika vårdinformationssystem som används av dessa aktörer är begrän- sat och vissa av systemen träffas redan av de förslag som lämnats av Utredningen om hälsodataregister. Endast ett fåtal system bedöms därför behöva anpassas, och anpassningen bedöms mindre omfattande, för att möjliggöra ytterligare insamling av uppgifter om administre- rade läkemedel. De system som inte redan omfattas av förslagen från Utredningen om hälsodataregister kommer enligt utredningens be- dömning att påverkas av kommande krav på interoperabilitet enligt EU-förordningen om det europeiska hälsodataområdet.
Den hälso- och sjukvård som bedrivs av kommuner omfattas inte av de förslag som lämnats av Utredningen om hälsodataregister. Kom- munerna använder också i huvudsak andra typer av vårdinformations- system än övriga vårdgivare, anpassade för dokumentation av vård- och omsorgsåtgärder och utan möjlighet till strukturerad information om läkemedelsbehandling. Utredningen bedömer därför att kommu- nerna i dagsläget har begränsade möjligheter att lämna uppgifter om andra administrerade läkemedel än vaccin till ett nationellt hälsodata- register hos Socialstyrelsen. Det krävs betydligt större anpassningar i grunddokumentationen och räcker inte med anpassning till natio- nella interoperabilitetslösningar. När det gäller administrerade vacci- ner är förutsättningarna däremot bättre. I många kommuner finns redan etablerade systemstöd för strukturerad dokumentation i de fall där krav på inrapportering till det nationella vaccinationsregi- stret föreligger. Det finns även goda förutsättningar att rapportera uppgifter om vaccinationer inom elevhälsan.
Det av Utredningen om hälsodataregister föreslagna registret över administrerade läkemedel, som ska föras av Socialstyrelsen, bör enligt vår utrednings bedömning utökas med uppgifter om läkemedel som
Sammanfattning |
SOU 2025:71 |
administrerats i annan vård än specialiserad öppenvård och slutenvård. Uppgifter om administrerade vaccin bör inte undantas.
Avseende vårdgivare som utför kommunal hälso- och sjukvård bedömer utredningen att dessa enbart bör lämna uppgifter om administrerade vaccin till registret över administrerade läkemedel. När det gäller övriga rekvisitionsläkemedel bedömer utredningen att det i nuläget saknas förutsättningar att kräva att vårdgivare som utför kommunal hälso- och sjukvård ska rapportera administrering av dessa, och att de därför inte bör omfattas av den rapporterings- skyldighet som föreslås i övrigt.
För tandvård enligt tandvårdslagen (1985:125) bedömer utred- ningen att det behöver utredas vidare vilka behov som finns av att samla in uppgifter om rekvisitionsläkemedel. Dessa vårdgivare bör därför tills vidare undantas från skyldigheten att lämna uppgifter till registret.
Socialstyrelsen bör få i uppdrag att ytterligare utreda vilka behov som finns av att samla in uppgifter om samtliga rekvisitionsläkemedel från den kommunala hälso- och sjukvården och tandvården samt ana- lysera och fortsatt följa hur förutsättningarna att lämna uppgifter till registret över administrerade läkemedel förändras över tid.
Konsekvenser av utredningens förslag
Utredningens bedömningar och förslag syftar till att förbättra pati- entsäkerheten genom ökad tillgång till information om ordinerade, förskrivna och i hälso- och sjukvården administrerade läkemedel samt vissa medicintekniska produkter.
För patienter innebär förslagen förbättrad tillgång till egna be- handlingsuppgifter, inklusive vaccinationsstatus och information om långvariga behandlingar och medicintekniska produkter. Detta ger ökad kontroll över den egna vården och bidrar till större trygghet. För vårdgivare medför förslagen framför allt behov av tekniska anpassningar av deras informationssystem för att möjliggöra effek- tiv och säker datadelning. En federerad lösning, där uppgifter delas direkt mellan vårdgivarnas egna system, bedöms minska administra-
tionen och förbättra arbetsprocesserna.
Sammantaget möjliggör förslagen en förbättrad överblick över patientens behandling både för patienterna själva och för hälso- och
SOU 2025:71 |
Sammanfattning |
sjukvårdpersonal, vilket bedöms minska risken för vårdskador och därmed leda till betydande samhällsekonomiska vinster. Förbättrad informationsdelning är ett viktigt steg mot en säkrare och mer kost- nadseffektiv vård, även om exakta besparingar är svåra att uppskatta.
Kostnaderna för att genomföra utredningens förslag är svåra att bedöma och beror på vårdgivarnas tekniska mognad och hur många vårdinformationssystem som behöver anpassas. Kostnaderna för implementering kan minskas genom gemensamma standarder och interoperabilitetslösningar som följer av krav i EU-förordningen om det europeiska hälsodataområdet.
Alla vårdgivare som blir skyldiga att lämna uppgifter till något av de föreslagna registren kommer påverkas, eftersom de behöver säkerställa att deras system kan kommunicera med den nationella infrastrukturen. Implementeringskostnaderna för regioner och kom- muner är osäker och beror dessutom på hur vårdgivare kan samverka och dela på kostnaden för anpassningen av ett och samma system.
Privata vårdgivare och företag som utvecklar vårdinformationssystem kommer också att påverkas, men eftersom marknaden är begränsad med få leverantörer förväntas kostnaderna kunna spridas över flera aktörer.
Sammantaget beräknas utredningens förslag medföra en engångs- kostnad på cirka 430 miljoner kronor, fördelad över en treårsperiod. E-hälsomyndigheten är den myndighet som bedöms ha de största kostnaderna, 300 miljoner kronor för utvecklingen av nya system och framtagande av interoperabilitetsspecifikaioner. Socialstyrelsens kostnader för deltagande i arbetet med interoperbilitetsspecifikatio- ner samt framtagande av föreskrifter beräknas till cirka 4 miljoner kronor. Läkemedelsverkets ansvar för att leda ett nationellt sam- verkansforum bedöms medföra löpande kostnader om 3 miljoner kronor per år.
Utredningens förslag innebär nya skyldigheter för kommuner och regioner att lämna och ta del av uppgifter i nationella register. Finansieringsprincipen bör i dessa fall vara tillämplig. De kostnader utredningen utgår från gällande systemanpassningen baseras på ut- redningen Delad hälsodata – dubbel nytta (SOU 2024:33). Baserat på detta underlag uppskattar utredningen regionernas kostnader för anpassning av sina vårdinformationssystem totalt till cirka 20 miljoner kronor. Osäkerheten i kostnadsbedömningen är betydande. Erfaren- heter från införandet av den nationella läkemedelslistan enligt nu-
Sammanfattning |
SOU 2025:71 |
varande lagstiftning, exempelvis i Region Stockholm, visar att de kostnaderna kan vara avsevärt högre. Dessa kostnader har dock omfattat fler komponenter än den typ av systemanpassningar som föreslås omfattas av finansieringsprincipen.
Kostnaderna för kommunerna beräknas uppgå till cirka 87 miljo- ner kronor, vilket motsvarar cirka 300 tusen kronor per kommun, men även dessa kostnadsuppskattningar är osäkra. För kommunerna saknas nästan helt underlag, vilket gör bedömningen ännu mer osäker.
Trots dessa osäkerheter bedömer utredningen att det är avgö- rande att investeringarna genomförs, då den långsiktiga samhälls- ekonomiska vinsten i form av minskade vårdskador och ökad pati- entsäkerhet är betydande och kan uppgå till miljardbelopp årligen. För att minska osäkerheten och kostnaderna betonas vikten av att regioner och kommuner i största möjliga mån samarbetar kring tek- niska lösningar och att staten tar ett samlat ansvar för finansieringen av den strategiska satsningen.
Vad avser utredningens tilläggsuppdrag möjliggör förslagen att insamlingen av uppgifter till Socialstyrelsens hälsodataregister över administrerade läkemedel blir mer heltäckande. För att åstadkomma detta behöver vårdgivarna anpassa sina system för att även kunna lämna uppgifter om rekvisitionsläkemedel i sådan vård som inte är sluten vård eller specialiserad öppenvård till registret över admini- strerade läkemedel. För detta bedöms inga extra kostnader uppstå för regioner, kommuner eller myndigheter utöver de kostnader som följer av förslagen som lämnas i Ett nytt regelverk för hälsodataregister, SOU 2024:57. Privata vårdgivares anpassning av sina system och de övriga system som inte redan omfattas av förslagen från Utredningen om hälsodataregister kommer, enligt utredningens bedömning, ändå att påverkas av kommande krav på interoperabilitet enligt EU-förord- ningen om det europeiska hälsodataområdet.
1 Författningsförslag
1.1Förslag till lag om ändring i lagen (1996:1157) om läkemedelskommittéer
Härigenom föreskrivs att 4 § lagen (1996:1157) om läkemedels- kommittéer ska ha följande lydelse.
Nuvarande lydelse |
Föreslagen lydelse |
4 §1 |
E-hälsomyndigheten ska till en |
E-hälsomyndigheten ska till en |
läkemedelskommitté lämna upp- |
läkemedelskommitté lämna upp- |
gift om läkemedelsförskrivningar |
gift om läkemedelsförskrivningar |
av personal vid vårdinrättning |
av personal vid vårdinrättning |
inom kommitténs verksamhets- |
inom kommitténs verksamhets- |
område och som registrerats en- |
område och som registrerats en- |
ligt lagen (2018:1212) om natio- |
ligt lagen (2018:1212) om natio- |
nell läkemedelslista. |
nella register över vissa läkemedel |
|
och andra produkter i medicinsk |
|
användning. |
Om kommittén finner att det förekommer brister i läkemedels- användningen inom verksamhetsområdet ska kommittén göra de på- pekanden som behövs och vid behov erbjuda hälso- och sjukvårds- personalen utbildning för att avhjälpa bristerna.
___________
Denna lag träder i kraft den 26 mars 2029.
1Senaste lydelse 2018:1213.
53
Författningsförslag |
SOU 2025:71 |
1.2Förslag till lag om ändring i lagen (2002:160) om läkemedelsförmåner m.m.
Härigenom föreskrivs att 21–21 b §§ lagen (2002:160) om läkemedels- förmåner m.m. ska ha följande lydelse.
Nuvarande lydelse |
Föreslagen lydelse |
21 §1
Ett öppenvårdsapotek ska byta ut ett läkemedel som har förskri- vits inom läkemedelsförmånerna mot det tillgängliga läkemedel inom förmånerna som det är utbytbart mot och som har lägst fastställt för- säljningspris.
Ett öppenvårdsapotek ska byta ut ett läkemedel som har förskri- vits inom läkemedelsförmånerna mot något av de läkemedel inom för- månerna som är tillgängliga och har ett lägre fastställt försäljnings- pris, när det inom förmånerna finns utbytbarhet enbart mellan
1.ett läkemedel och ett eller flera av dess parallellimporterade läke- medel, eller
2.ett läkemedels parallellimporterade läkemedel.
Ett läkemedel får inte bytas ut om
1.förskrivaren på medicinska grunder har motsatt sig ett utbyte,
2.den expedierande farmaceuten på öppenvårdsapoteket har mot- satt sig utbyte av läkemedlet med hänsyn till att det finns anledning att anta att ett utbyte skulle innebära betydande olägenhet för pati- enten, eller
3.patienten betalar mellanskillnaden mellan det försäljningspris som fastställts för det förskrivna läkemedlet och lägsta försäljningspris för det utbytbara läkemedel som finns tillgängligt.
Om något annat utbytbart läkemedel inom förmånerna finns till- gängligt, kan utbyte ske mot detta läkemedel, under förutsättning att patienten betalar hela kostnaden för det läkemedlet.
Ett öppenvårdsapotek ska upp- |
Ett öppenvårdsapotek ska upp- |
lysa patienten om att utbyte kom- |
lysa patienten om att utbyte kom- |
mer i fråga och om patientens |
mer i fråga och om patientens |
rätt att mot betalning få det för- |
rätt att mot betalning få det för- |
skrivna läkemedlet eller något |
skrivna läkemedlet eller något |
annat utbytbart läkemedel inom |
|
1Senaste lydelse 2018:1237.
SOU 2025:71Författningsförslag
förmånerna. När utbyte sker ska |
annat utbytbart läkemedel inom |
öppenvårdsapoteket |
skriftligen |
förmånerna. |
underrätta förskrivaren. |
|
|
21 a §2
Ett öppenvårdsapotek ska byta ut ett läkemedel som har förskri- vits utanför förmånerna men i övrigt enligt 4 och 6 §§, mot
1.det tillgängliga läkemedel inom förmånerna utan förmånsbe- gränsning som det är utbytbart mot och som har lägst fastställt för- säljningspris, eller
2.något av de tillgängliga läkemedlen inom förmånerna utan för- månsbegränsning, när det inom förmånerna finns utbytbarhet enbart mellan ett läkemedel och ett eller flera av dess parallellimporterade läkemedel, eller mellan ett läkemedels parallellimporterade läkemedel.
Ett läkemedel får inte bytas ut om
1.förskrivaren på medicinska grunder har motsatt sig ett utbyte,
2.den expedierande farmaceuten på öppenvårdsapoteket har mot- satt sig utbyte av läkemedlet med hänsyn till att det finns anledning att anta att ett utbyte skulle innebära betydande olägenhet för pati- enten, eller
3.patienten betalar hela kostnaden för det förskrivna läkemedlet. Om något annat utbytbart läkemedel inom förmånerna finns till-
gängligt, kan utbyte ske mot detta läkemedel, under förutsättning att patienten betalar hela kostnaden för det läkemedlet.
Ett öppenvårdsapotek ska upp- |
Ett öppenvårdsapotek ska upp- |
lysa patienten om att utbyte kom- |
lysa patienten om att utbyte kom- |
mer i fråga och om patientens |
mer i fråga och om patientens |
rätt att mot betalning få det för- |
rätt att mot betalning få det för- |
skrivna läkemedlet |
eller något |
skrivna läkemedlet eller något |
annat utbytbart läkemedel inom |
annat utbytbart läkemedel inom |
förmånerna. När utbyte sker ska |
förmånerna. |
öppenvårdsapoteket |
skriftligen |
|
underrätta förskrivaren.
2Senaste lydelse 2018:1237.
Författningsförslag |
SOU 2025:71 |
21 b §3
Ett öppenvårdsapotek ska byta ut ett läkemedel som har förskri- vits enligt 7 kap. 1 § smittskyddslagen (2004:168) mot det läkemedel som utbyte skulle ha skett mot vid ett utbyte enligt
1.21 § första och andra styckena om det förskrivna läkemedlet har fastställda priser enligt 7 §, eller
2.21 a § första stycket om det förskrivna läkemedlet inte har fast- ställda priser enligt 7 §.
Ett läkemedel får inte bytas ut om
1.förskrivaren på medicinska grunder har motsatt sig ett utbyte,
eller
2.den expedierande farmaceuten på öppenvårdsapoteket har mot- satt sig utbyte av läkemedlet med hänsyn till att det finns anledning att anta att ett utbyte skulle innebära betydande olägenhet för pati- enten eller i annat fall dröjsmål med behandlingen.
Ett öppenvårdsapotek ska upp- |
Ett öppenvårdsapotek ska upp- |
lysa patienten om att utbyte kom- |
lysa patienten om att utbyte kom- |
mer i fråga. När utbyte sker ska |
mer i fråga. |
öppenvårdsapoteket |
skriftligen |
|
underrätta förskrivaren.
__________
Denna lag träder i kraft den 1 januari 2026.
3Senaste lydelse 2018:1237.
SOU 2025:71 |
Författningsförslag |
1.3Förslag till lag om ändring i patientdatalagen (2008:355)
Härigenom föreskrivs att 4 kap. 6 § patientdatalagen (2008:355) ska ha följande lydelse.
Nuvarande lydelseFöreslagen lydelse
4 kap.
6 §1
I 6 kap. 3 § lagen (2018:1212) |
I 6 kap. 3 § lagen (2018:1212) |
om nationell läkemedelslista finns |
om nationella register över vissa |
bestämmelser om att E-hälso- |
läkemedel och andra produkter i |
myndigheten ska lämna ut vissa |
medicinsk användning finns be- |
uppgifter till regionerna om för- |
stämmelser om att E-hälsomyn- |
skrivning av läkemedel och andra |
digheten ska lämna ut vissa uppgif- |
varor och att uppgifter om pati- |
ter till regionerna och att uppgifter |
entens identitet ska vara krypte- |
om patientens identitet ska vara |
rade vid utlämnandet. |
krypterade vid utlämnandet. |
Uppgifter som avses i första stycket får inte behandlas i syfte att röja en patients identitet utan att patienten samtycker till det.
Uppgifter om en patients identitet som har dokumenterats inom hälso- och sjukvården och som regionerna ska sambearbeta med så- dana uppgifter som avses i första stycket, ska vara krypterade så att patientens identitet skyddas vid behandlingen.
Denna lag träder i kraft den 26 mars 2029.
1Senaste lydelse 2019:991.
Författningsförslag |
SOU 2025:71 |
1.4Förslag till lag om ändring i lagen (2009:366) om handel med läkemedel
Härigenom föreskrivs att 2 kap. 6 § lagen (2009:366) om handel med läkemedel ska ha följande lydelse.
Nuvarande lydelse |
Föreslagen lydelse |
2 kap.
6 §1
Den som har tillstånd enligt 1 § att bedriva detaljhandel med läke- medel till konsument ska
1.ha lokalen bemannad med en eller flera farmaceuter under öppet- hållandet,
2.bedriva verksamheten i lokaler som är lämpliga för sitt ändamål och säkerställa att de delar av lokalerna där information och rådgiv- ning om läkemedel, utbyte av läkemedel, läkemedelsanvändning och egenvård lämnas är utformade så att konsumentens integritet skyddas,
3.tillhandahålla samtliga förordnade läkemedel, och samtliga för- ordnade varor som omfattas av lagen (2002:160) om läkemedels- förmåner m.m. så snart det kan ske,
4.ha en läkemedelsansvarig för apoteket som ska ha det infly- tande över verksamheten som krävs för att han eller hon ska kunna fullgöra sina uppgifter,
5. vid expediering av en för- |
5. vid expediering av en för- |
skrivning lämna de uppgifter som |
skrivning lämna de uppgifter som |
anges i 3 kap. 8 § lagen (2018:1212) |
anges i 3 kap. 8 § lagen (2018:1212) |
om nationell läkemedelslista till |
om nationella register över vissa |
E-hälsomyndigheten, |
läkemedel och andra produkter i |
|
medicinsk användning till E-hälso- |
|
myndigheten, |
6.ha ett elektroniskt system som gör det möjligt att få direkt- åtkomst till uppgifter hos E-hälsomyndigheten,
7.till E-hälsomyndigheten lämna de uppgifter som är nödvändiga för att myndigheten ska kunna föra statistik över detaljhandeln,
8.utöva särskild kontroll (egenkontroll) över detaljhandeln och hanteringen i övrigt och se till att det finns ett för verksamheten lämp- ligt egenkontrollprogram,
1Senaste lydelse 2021:1126.
SOU 2025:71 |
Författningsförslag |
9.på begäran utfärda intyg enligt 3 a § lagen (1992:860) om kon- troll av narkotika,
10.på begäran erbjuda konsumenter delbetalning av läkemedel och varor som omfattas av lagen om läkemedelsförmåner m.m.,
11.tillhandahålla individuell och producentoberoende informa- tion och rådgivning om läkemedel, utbyte av läkemedel, läkemedels- användning och egenvård till konsumenter samt se till att informa- tionen och rådgivningen endast lämnas av personal med tillräcklig kompetens för uppgiften,
12.ha ett för Läkemedelsverket registrerat varumärke för öppen- vårdsapotek väl synligt på apoteket,
13.i de fall tillståndshavaren inte direkt kan tillhandahålla ett läke- medel eller en vara som avses i 3, informera konsumenten om på vilket eller vilka öppenvårdsapotek läkemedlet eller varan finns för försälj- ning,
14.uppfylla de krav avseende säkerhetsdetaljer som följer av kom- missionens delegerade förordning (EU) 2016/161, och
15.vid expediering av en förskrivning av läkemedel för behand- ling av djur lämna uppgifter till E-hälsomyndigheten.
___________
Denna lag träder i kraft den 26 mars 2029.
Författningsförslag |
SOU 2025:71 |
1.5Förslag till lag om ändring i apoteksdatalagen (2009:367)
Härigenom föreskrivs att 8 och 10 §§ apoteksdatalagen (2009:367) ska ha följande lydelse.
Nuvarande lydelse |
Föreslagen lydelse |
8 §1
Personuppgifter får behandlas om det är nödvändigt för
1.expediering av förordnade läkemedel, och sådana förordnade varor som omfattas av lagen (2002:160) om läkemedelsförmåner m.m. samt för åtgärder i anslutning till expedieringen,
2.redovisning av uppgifter till E-hälsomyndigheten enligt 2 kap. 6 § 5, 7 eller 15 lagen (2009:366) om handel med läkemedel,
3.hantering av reklamationer och indragningar,
4.administrering av delbetalning av läkemedel och varor som om- fattas av lagen om läkemedelsförmåner m.m.,
5.administrering av fullmakter att hämta ut läkemedel,
6.redovisning av uppgifter till Inspektionen för vård och omsorg och Läkemedelsverket för deras tillsyn,
7.rapportering till förskrivare
om utbyte av läkemedel enligt 21 § |
|
|
femte stycket, 21 a § fjärde stycket |
|
|
och 21 b § tredje stycket lagen om |
|
|
läkemedelsförmåner m.m., |
|
|
8. hälsorelaterad kundservice, |
7. hälsorelaterad kundservice, |
9. att kunna lämna ut recept |
8. att kunna lämna ut recept |
eller blankett till konsumenten, |
eller blankett till konsumenten, |
10. systematisk och fortlöp- |
9. systematisk |
och fortlöp- |
ande utveckling och säkerställ- |
ande utveckling och säkerställ- |
ande av öppenvårdsapotekens kva- |
ande av öppenvårdsapotekens kva- |
litet, samt |
litet, samt |
|
11. administration, planering, |
10. administration, planering, |
uppföljning och utvärdering av |
uppföljning och |
utvärdering av |
öppenvårdsapotekens verksamhet |
öppenvårdsapotekens verksamhet |
samt framställning av statistik. |
samt framställning av statistik. |
1Senaste lydelse 2021:1127.
SOU 2025:71 |
Författningsförslag |
Sådan personuppgiftsbehand- ling som avses i första stycket 5 och 8 får inte omfatta någon annan än den som har lämnat sitt samtycke till behandlingen.
För ändamål som avses i första stycket 10 och 11 får inga upp- gifter redovisas som kan hänfö- ras till en enskild person.
Sådan personuppgiftsbehand- ling som avses i första stycket 5 och 7 får inte omfatta någon annan än den som har lämnat sitt samtycke till behandlingen.
För ändamål som avses i första stycket 9 och 10 får inga upp- gifter redovisas som kan hänfö- ras till en enskild person.
10 §
Identitet får användas som sökbegrepp endast i fråga om
1. konsument, för de ändamål |
1. konsument, för de ändamål |
som anges i 8 § första stycket 1, |
som anges i 8 § första stycket 1, |
3–5, 8 och 9, och |
3–5, 7 och 8, och |
2. den som är behörig att för- |
2. den som är behörig att för- |
ordna läkemedel, för de ändamål |
ordna läkemedel, för de ändamål |
som anges i 8 § första stycket 6 |
som anges i 8 § första stycket 6. |
och 7.
Förskrivningsorsak får inte användas som sökbegrepp.
Denna lag träder i kraft den 1 januari 2026.
Sekretessen enligt 1–5 §§ gäller i förhållande till den vård- eller behandlingsbehövande själv för uppgift om hans eller hennes hälsotillstånd, om det med hän- syn till ändamålet med vården eller behandlingen är av synner- lig vikt att uppgiften inte lämnas till honom eller henne. Detsamma gäller i fråga om sekretess enligt 17 a § om uppgiften om hälso- tillståndet avser ordinationsorsak i den nationella läkemedelslistan eller i medicinteknikregistret enligt lagen (2018:1212) om nationella register över vissa läkemedel och andra produkter i medicinsk an- vändning.
Författningsförslag |
SOU 2025:71 |
1.6Förslag till lag om ändring i offentlighets- och sekretesslagen (2009:400)
Härigenom föreskrivs att 25 kap. 6 och 17 c §§ offentlighets- och sek- retesslagen (2009:400) ska ha följande lydelse.
Nuvarande lydelse |
Föreslagen lydelse |
25kap. 6 §1
Sekretessen enligt 1–5 §§ gäller i förhållande till den vård- eller behandlingsbehövande själv för uppgift om hans eller hennes hälsotillstånd, om det med hän- syn till ändamålet med vården eller behandlingen är av synner- lig vikt att uppgiften inte lämnas till honom eller henne. Detsamma gäller i fråga om sekretess enligt 17 a § om uppgiften om hälso- tillståndet avser ordinationsorsak i den nationella läkemedelslistan enligt lagen (2018:1212) om natio- nell läkemedelslista.
17 c §2
Sekretessen enligt 17 a och 17 b §§ hindrar inte att
1. uppgift i den nationella läke- |
1. uppgift i den nationella läke- |
medelslistan lämnas enligt lagen |
medelslistan eller i medicintek- |
(2018:1212) om nationell läke- |
nikregistret lämnas enligt lagen |
medelslista till hälso- och sjuk- |
(2018:1212) om nationella regis- |
vårdspersonal som har behörig- |
ter över vissa läkemedel och andra |
het att förskriva läkemedel eller |
produkter i medicinsk användning |
1Senaste lydelse 2018:1216.
2Senaste lydelse 2021:1128.
SOU 2025:71Författningsförslag
andra varor, en sjuksköterska utan |
till hälso- och sjukvårdspersonal |
behörighet att förskriva läkemedel |
som har behörighet att förskriva |
eller andra varor, en dietist, en |
läkemedel eller andra varor, en |
farmaceut i hälso- och sjukvården |
sjuksköterska utan behörighet att |
eller till expedierande personal på |
förskriva läkemedel eller andra |
öppenvårdsapotek, |
varor, en dietist, en farmaceut i |
|
hälso- och sjukvården eller till |
|
expedierande personal på öppen- |
|
vårdsapotek, |
2.uppgift lämnas enligt lagen (2016:526) om behandling av per- sonuppgifter i ärenden om licens för läkemedel till öppenvårds- apotek eller den som är behörig att förordna läkemedel, eller
3.uppgift om förordnande och expediering av läkemedel för be- handling av djur lämnas till expedierande personal på öppenvårds- apotek.
Denna lag träder i kraft den 26 mars 2029.
E-hälsomyndigheten ska med automatiserad behandling föra ett register (nationell läkemedelslista) över vissa uppgifter om
1. förskrivna och på öppen- vårdsapotek expedierade förskrivna läkemedel och andra varor för män- niskor,
Författningsförslag |
SOU 2025:71 |
1.7Förslag till lag om ändring i lagen (2018:1212) om nationell läkemedelslista
Härigenom föreskrivs i fråga om lagen (2018:1212) om nationell läke- medelslista
dels att 6 kap. 4–8 §§ ska upphöra att gälla,
dels att rubrikerna närmast före 6 kap. 4, 5, 6, 7 och 8 §§ ska utgå, dels att rubriken till lagen (2018:1212) om nationell läkemedels-
lista ska ha följande lydelse,
dels att 1 kap. 1 §, 3 kap. 2–6 och 8–10 §§, 4 kap. 1 och 3 §§, 5 kap. 1–3 och 6 §§, 6 kap. 2 och 3 §§, 7 kap. 1 och 3 §§, 8 kap. 1 och 2 §§, 9 kap. 1 § och 10 kap. 1 och 3 §§ samt rubrikerna till 1, 4 och 5 kap. och rubriken närmast före 6 kap. 3 § ska ha följande lydelse,
dels att det ska införas tre nya kapitel, 3 a, 4 a och 5 a kap. av föl- jande lydelse,
dels att det ska införas tio nya paragrafer, 1 kap. 1 a, 1 b och 3 §§, 5 kap. 3 a och 3 b §§, 9 kap. 3 § samt 10 kap. 2 a och 4–6 §§ av föl- jande lydelse.
Nuvarande lydelse |
Föreslagen lydelse |
Lag om nationell |
Lag om nationella register |
läkemedelslista |
över vissa läkemedel och |
|
andra produkter i medicinsk |
|
användning |
1 kap. Inledande bestämmelser |
1 kap. Inledande bestämmelser |
|
och definitioner |
1 §
E-hälsomyndigheten ska med automatiserad behandling föra ett register över vissa uppgifter om förskrivna och expedierade läke- medel och andra varor för män- niskor (nationell läkemedelslista).
SOU 2025:71 |
Författningsförslag |
2. i hälso- och sjukvården admi- nistrerade vaccin, samt
3. i hälso- och sjukvården admi- nistrerade läkemedel med långvarig effekt som det är av särskild bety- delse att ha kännedom om i pati- entens fortsatta vård.
1 a §
E-hälsomyndigheten ska med automatiserad behandling föra ett register (medicinteknikregister) över vissa uppgifter om medicintekniska produkter med avsedd långvarig användning som tillförts en pati- ent i samband med hälso- och sjuk- vård och som det är av särskild betydelse att ha kännedom om i patientens fortsatta vård.
1 b §
Om inte annat anges avser be- stämmelserna i denna lag både regi- stret nationell läkemedelslista och medicinteknikregistret.
3 §
I lagen används följande uttryck med nedan angiven betydelse:
ordinationsorsak: samlingsbe- grepp för behandlingsorsak och änd- ringsorsak som anges vid en ordi- nation,
vaccin: läkemedel som är av- sedda att framkalla ett immunsvar för förebyggande, inklusive post- exponeringsprofylax, och för be- handling av sjukdomar som orsa- kas av ett smittämne.
Författningsförslag |
SOU 2025:71 |
3kap. 2 §
Personuppgifterna får behand- |
Personuppgifterna får behand- |
las om det är nödvändigt för ända- |
las om det är nödvändigt för ända- |
mål som rör registrering av upp- |
mål som rör registrering i natio- |
gifter: |
nella läkemedelslistan av uppgifter: |
1. om förskrivna läkemedel och |
1. om läkemedel |
och |
andra |
andra varor som ska expedieras på |
varor enligt 1 kap. 1 § 1, |
|
öppenvårdsapotek, |
|
|
|
|
2. om vaccin och andra läke- |
|
medel enligt 1 kap. 1 § 2 och 3, |
2. för tillämpning av bestäm- |
3. för tillämpning av bestäm- |
melserna om läkemedelsförmå- |
melserna om läkemedelsförmå- |
ner vid köp av läkemedel m.m., |
ner vid köp av läkemedel m.m., |
eller |
|
|
|
3. om en fullmakt. |
4. om en fullmakt, eller |
|
|
5. andra uppgifter enligt 8 §. |
3 § |
|
|
Personuppgifterna får behand- |
Personuppgifterna i nationella |
las om det är nödvändigt för ända- |
läkemedelslistan som hör till läke- |
mål som rör öppenvårdsapotek: |
medel och andra varor enligt 1 kap. |
|
1 § 1 får behandlas om det är nöd- |
|
vändigt för ändamål som rör |
|
öppenvårdsapotek: |
|
|
1. expediering av läkemedel och |
1. åstadkommande av en säker |
andra varor som förskrivits, eller |
expediering av läkemedel och andra |
|
varor som förskrivits, eller |
|
2. underlättande av en patients läkemedelsanvändning. |
|
4 § |
|
|
Personuppgifterna får behand- |
Personuppgifterna |
i |
natio- |
las om det är nödvändigt för ända- |
nella läkemedelslistan får behand- |
mål som rör hälso- och sjukvården: |
las om det är nödvändigt för ända- |
|
mål som rör hälso- och sjukvården: |
1.åstadkommande av en säker ordination av läkemedel och andra varor för en patient,
2.beredande av vård eller behandling av en patient, eller
3.komplettering av en patientjournal.
Personuppgifterna i nationella läkemedelslistan som hör till läke- medel och andra varor enligt 1 kap. 1 § 1 får behandlas om det är nöd- vändigt för övriga ändamål:
SOU 2025:71 |
Författningsförslag |
5 §1
Personuppgifterna får behand- las om det är nödvändigt för övriga ändamål:
1.debitering till regionerna,
2.ekonomisk uppföljning och framställning av statistik hos E-hälso- myndigheten,
3.registrering och redovisning till regionerna av uppgifter för eko- nomisk och medicinsk uppföljning samt för framställning av stati- stik,
4.registrering och redovisning till förskrivare, verksamhetschefer enligt hälso- och sjukvårdslagen (2017:30), verksamhetschefer enligt tandvårdslagen (1985:125) och läkemedelskommittéer enligt lagen (1996:1157) om läkemedelskommittéer av uppgifter för medicinsk uppföljning, utvärdering och kvalitetssäkring i hälso- och sjukvården,
5.registrering och redovisning till Socialstyrelsen av uppgifter för epidemiologiska undersökningar, forskning, framställning av statistik, uppföljning, utvärdering och kvalitetssäkring inom hälso- och sjuk- vårdsområdet,
6.registrering och redovisning till Inspektionen för vård och om- sorg av uppgifter om en läkares eller tandläkares förskrivning av nar- kotiskt läkemedel eller annat särskilt läkemedel, för inspektionens tillsyn över hälso- och sjukvårdspersonal enligt patientsäkerhets- lagen (2010:659),
7.registrering och redovisning av uppgifter för Tandvårds- och läke- medelsförmånsverkets tillsyn över utbyte av läkemedel enligt 21–21 c §§ lagen (2002:160) om läkemedelsförmåner m.m. och för prövning och tillsyn enligt samma lag av läkemedel som får säljas enligt 4 kap. 10 § och 5 kap. 1 § andra stycket läkemedelslagen (2015:315), eller
8.registrering och redovisning av uppgifter för Läkemedelsverkets tillsyn över tillhandahållandeskyldigheten enligt 2 kap. 6 § 3 lagen (2009:366) om handel med läkemedel samt för Läkemedelsverkets tillsyn över uppgiftslämnande vid expediering av en förskrivning en- ligt 2 kap. 6 § 5 lagen om handel med läkemedel.
1Senaste lydelse 2019:992.
Författningsförslag |
SOU 2025:71 |
6 §
För ändamål som anges i 5 § 1 |
För ändamål som anges i 5 § 1 |
får uppgifter om en person inte |
får uppgifter om en person inte |
omfatta annat än datum för expe- |
omfatta annat än datum för expe- |
diering, kostnad, kostnadsredu- |
diering, kostnad, kostnadsredu- |
cering enligt lagen (2002:160) om |
cering enligt lagen (2002:160) om |
läkemedelsförmåner m.m., kost- |
läkemedelsförmåner m.m., kost- |
nadsfrihet enligt smittskyddslagen |
nadsfrihet enligt smittskyddslagen |
(2004:168) och patientens per- |
(2004:168) och patientens person- |
sonnummer eller samordnings- |
nummer eller annan identitets- |
nummer. |
beteckning. |
För ändamål som anges i 5 § 2, |
För ändamål som anges i 5 § 2, |
4 och 7 får inga uppgifter om en |
4 och 7 får inga uppgifter om en |
person redovisas. Ändamålet enligt |
person redovisas. Ändamålet enligt |
5 § 3 får inte, med undantag för |
5 § 3 får inte, med undantag för |
utlämnande av uppgifter enligt |
utlämnande av uppgifter till regio- |
6 kap. 3 §, omfatta några åtgär- |
ner enligt 6 kap. 3 §, omfatta några |
der som innebär att uppgifter om |
åtgärder som innebär att upp- |
en patient redovisas. Dock får upp- |
gifter om en patient redovisas. |
gifter om en förskrivare ingå i |
Dock får uppgifter om en för- |
redovisning enligt 5 § 4 till samma |
skrivare ingå i redovisning enligt |
förskrivare och till verksamhets- |
5 § 4 till samma förskrivare och |
chefen vid den enhet där förskri- |
till verksamhetschefen vid den |
varen tjänstgör samt i redovis- |
enhet där förskrivaren tjänstgör |
ning enligt 5 § 6 till Inspektionen |
samt i redovisning enligt 5 § 6 till |
för vård och omsorg. |
Inspektionen för vård och omsorg. |
Ordinationsorsak får redovi- |
Behandlingsorsak får redovi- |
sas endast för de ändamål som |
sas endast för de ändamål som |
anges i 3 § 1, 4 § och 5 § 3–5. |
anges i 3 § 1, 4 § och 5 § 3–5. |
8 §
I den utsträckning det behövs för ändamålen enligt 2–5 §§ får den nationella läkemedelslistan innehålla följande uppgifter:
1.förskriven vara, mängd och dosering, aktiv substans, läkemedels- form, styrka, administreringssätt, läkemedelsbehandlingens längd, be- handlingsändamål och datum för förskrivning,
SOU 2025:71 |
Författningsförslag |
2. patientens namn, person- nummer eller samordningsnum- mer, folkbokföringsort och post- numret i patientens bostadsadress,
3. förskrivarens namn, yrke, spe- cialitet, arbetsplats, arbetsplatskod och förskrivarkod,
4.ordinationsorsak,
5.senaste datum för när läke- medelsbehandlingen ska följas upp eller avslutas,
6.expedierad vara, mängd och dosering, datum för expediering, expedierande apotek, expedierande farmaceut och uppgift om att far- maceuten har motsatt sig utbyte av ett förskrivet läkemedel och skälen för det,
7.kostnad, kostnadsreducering enligt lagen (2002:160) om läke- medelsförmåner m.m. och kost- nadsfrihet enligt smittskyddslagen (2004:168),
1.patientens namn och per- sonnummer eller annan identi- tetsbeteckning, samt för läkemedel och andra varor enligt 1 kap. 1 § 1 även uppgift om patientens kön, folkbokföringsort och postnumret
ipatientens bostadsadress,
2.ordinationsorsak,
3.det förskrivna och expedie- rade läkemedlet eller varan och andra uppgifter hänförliga till för- skrivningen och expedieringen,
4.administrerat vaccin eller läkemedel med långvarig effekt och andra uppgifter hänförliga till utförd och framtida administrering,
5.ordinationen, utöver uppgift om ordinationsorsak,
6.kostnad och kostnadsreducer- ing för läkemedel och andra varor enligt 1 kap. 1 § 1,
7.samtycke, spärrade uppgifter och om fullmakt, samt
Författningsförslag |
SOU 2025:71 |
8.andra uppgifter som krävs i samband med en förskrivning eller en expediering,
9.uppgift om samtycke och om spärrade uppgifter, och
10.uppgift om fullmakt.
8.andra nödvändiga uppgifter av administrativ karaktär för att registerändamålen ska kunna till- godoses.
9 §
Patientens identitet får använ- |
Patientens identitet får använ- |
das som sökbegrepp endast för |
das som sökbegrepp endast för |
de ändamål som anges i 2–4 §§. |
de ändamål som anges i 2–4 §§. |
Ombudets identitet får användas |
Ombudets identitet får användas |
som sökbegrepp endast för de |
som sökbegrepp endast för de |
ändamål som anges i 2 § 3 och |
ändamål som anges i 2 § 4 och |
3 §. Förskrivarens identitet får |
3 §. Förskrivarens identitet får |
användas som sökbegrepp endast |
användas som sökbegrepp endast |
för de ändamål som anges i 5 § 4 |
för de ändamål som anges i 5 § 4 |
och 6. |
och 6. |
Ordinationsorsak får inte an- |
Behandlingsorsak får inte an- |
vändas som sökbegrepp. |
vändas som sökbegrepp. |
10 §
Personuppgifter ska tas bort ur den nationella läkemedelslistan senast fem år efter det att den förskrivning som uppgifterna hör till registrerades.
Personuppgifter som inte kan hänföras till en förskrivning ska tas bort senast fem år efter det att upp- gifterna registrerades.
Personuppgifter som hänför sig till administrerade vaccin och läke- medel enligt 1 kap. 1 § 2 och 3 ska tas bort när de inte längre är nöd- vändiga för ändamålen i 2 och 4 §§ samt 7 § andra stycket, dock senast fem år efter patientens död
SOU 2025:71 |
Författningsförslag |
Uppgifter om samtycke och spärrning ska tas bort när de inte längre är nödvändiga för ända- målen i 2–5 §§ och 7 § andra stycket.
Andra personuppgifter än så- dana som avses i första och andra stycket ska tas bort senast fem år efter det att uppgifterna registre- rades. Uppgifter om samtycke och spärrning ska tas bort när de inte längre är nödvändiga för ända- målen i 2–5 §§ och 7 § andra stycket.
3 a kap. Grundläggande bestämmelser om behandling av personuppgifter
i medicinteknikregistret
Personuppgiftsansvar
1 §
E-hälsomyndigheten är person- uppgiftsansvarig för den behandling av personuppgifter som myndighe- ten utför i medicinteknikregistret.
Ändamål med personuppgiftsbehandlingen
2 §
Personuppgifterna får behand- las om det är nödvändigt för ända- mål som rör registrering i medicin- teknikregistret av uppgifter:
1.om medicintekniska produkter enligt 1 kap. 1 a §,
2.om en fullmakt, eller
3.andra uppgifter enligt 5 §.
Författningsförslag |
SOU 2025:71 |
3 §
Personuppgifterna i medicin- teknikregistret får behandlas om det är nödvändigt för ändamål som rör hälso- och sjukvården:
1.åstadkommande av en säker ordination av läkemedel och andra varor för en patient,
2.beredande av vård eller be- handling av en patient, eller
3.komplettering av en patient- journal.
Personuppgiftsbehandling för andra ändamål
4 §
Personuppgifter som behandlas enligt 2 och 3 §§ får behandlas även för andra ändamål, under förut- sättning att uppgifterna inte be- handlas på ett sätt som är ofören- ligt med det ändamål för vilket uppgifterna samlades in.
Behandling av personuppgifter som inte är tillåten enligt lagen ska ändå få utföras, om den registre- rade har lämnat ett uttryckligt sam- tycke till behandlingen.
Registerinnehåll
5 §
I den utsträckning det behövs för ändamålen enligt 2 och 3 §§ får medicinteknikregistret innehålla uppgifter om:
SOU 2025:71 |
Författningsförslag |
1.patientens namn och person- nummer eller annan identitets- beteckning,
2.ordinationsorsak,
3.den tillförda medicintekniska produkten och andra uppgifter hän- förliga till att produkten tillfördes patienten,
4.samtycke, spärrade uppgifter och om fullmakt, samt
5.andra nödvändiga uppgifter av administrativ karaktär för att registerändamålen ska kunna till- godoses.
Sökbegränsningar
6 §
Patientens identitet får använ- das som sökbegrepp endast för de ändamål som anges i 2 och 3 §§. Ombudets identitet får användas som sökbegrepp endast för det ända- mål som anges i 2 § 2.
Ordinationsorsak får inte an- vändas som sökbegrepp.
Bevarandetid
7 §
Personuppgifter som hör till en tillförd medicinteknisk produkt samt uppgifter om samtycke och spärr- ning i medicinteknikregistret ska tas bort ur registret när de inte längre är nödvändiga för ända- målen i 2 och 3 §§ och 4 § andra stycket. Personuppgifter som hör till en tillförd medicinteknisk produkt
Behandling av personuppgifter i nationella läkemedelslistan som är tillåten enligt denna lag får ut- föras även om den registrerade inte har lämnat sitt samtycke till behandlingen.
Patientens samtycke krävs för behandling av uppgifter om en patient som får dosdispenserade läkemedel för ändamålet i 3 kap. 2 § 1. Patientens samtycke krävs även i de fall som avses i 5 §, 3 kap. 7 § andra stycket, 5 kap. 1 § andra stycket, 5 kap. 2 § och 5 kap. 3 § första stycket.
Författningsförslag |
SOU 2025:71 |
|
ska tas bort senast fem år efter pati- |
|
entens död. |
|
Andra personuppgifter än sådana |
|
som avses i första stycket ska tas |
|
bort senast fem år efter det att upp- |
|
gifterna registrerades. |
4 kap. Den registrerades |
4 kap. Den registrerades |
inställning till |
inställning till |
personuppgiftsbehandlingen |
personuppgiftsbehandlingen |
och spärrning av uppgifter |
och spärrning av uppgifter |
|
i den nationella läkemedelslistan |
1 §
Behandling av personuppgifter som är tillåten enligt denna lag får utföras även om den registre- rade inte har lämnat sitt samtycke till behandlingen.
Den registrerades samtycke krävs för behandling av uppgifter om fullmakter för ändamålet i 3 kap. 2 § 3. Patientens samtycke krävs för behandling av uppgifter om en patient som får dosdispen- serade läkemedel för ändamålet i 3 kap. 2 § 1. Patientens samtycke krävs även i de fall som avses i 5 §, 3 kap. 7 § andra stycket, 5 kap. 1 § andra stycket, 5 kap. 2 § och 5 kap. 3 § första stycket.
3 §
Efter begäran av en patient |
Efter begäran av en patient |
ska E-hälsomyndigheten spärra |
ska E-hälsomyndigheten spärra |
uppgifterna i den nationella läke- |
uppgifterna i den nationella läke- |
medelslistan för direktåtkomst så- |
medelslistan för direktåtkomst så- |
vitt gäller ändamålen i 3 kap. 3 § 2 |
vitt gäller ändamålen i 3 kap. 3 § 2 |
och 4 § samt uppgift om ordina- och 4 § samt uppgift om behand- tionsorsak även såvitt gäller ända- lingsorsak även såvitt gäller ända-
målet i 3 kap. 3 § 1.målet i 3 kap. 3 § 1.
Ett barns vårdnadshavare har inte rätt att få uppgifter om barnet spärrade.
En spärr enligt första stycket För uppgifter som hör till läke- hindrar inte sådan behandling av medel och andra varor enligt 1 kap. personuppgifter som avses i 5 kap. 1 § 1 hindrar inte en spärr enligt 3 § andra och tredje styckena, 4 första stycket sådan behandling av
och 5 §§.personuppgifter som avses i 5 kap. 3 § andra och tredje styck- ena, 3 a, 4 och 5 §§. För uppgifter som hör till administrerade vaccin eller läkemedel med långvarig effekt enligt 1 kap. 1 § 2 och 3 hindrar inte en spärr enligt första stycket sådan behandling av personupp- gifter som aves i 5 kap. 3 § andra stycket, 3 b och 5 §§.
4 a kap. Den registrerades inställning till personuppgiftsbehandlingen och spärrning av uppgifter
i medicinteknikregistret
1 §
Behandling av personuppgifter i medicinteknikregistret som är tillåten enligt denna lag får utföras även om den registrerade inte har lämnat sitt samtycke till behand- lingen.
Patientens samtycke krävs för behandling av uppgifter i de fall som avses i 5 §, 3 a kap. 4 § andra stycket och 5 a kap. 1 § första stycket.
75
Författningsförslag
SOU 2025:71
Författningsförslag |
SOU 2025:71 |
2 §
För en patient som inte endast tillfälligt saknar förmåga att ta ställ- ning till om uppgifter ska få behand- las för ändamål som annars skulle kräva patientens samtycke får upp- gifter i medicinteknikregistret be- handlas, om
1.patientens inställning till en sådan behandling så långt som möj- ligt har klarlagts, och
2.det inte finns anledning att anta att patienten skulle ha motsatt sig personuppgiftsbehandlingen.
Spärrning av uppgifter
3 §
Efter begäran av en patient ska E-hälsomyndigheten spärra uppgif- terna i medicinteknikregistret för direktåtkomst såvitt gäller ända- målen i 3 a kap. 3 §.
Ett barns vårdnadshavare har inte rätt att få uppgifter om barnet spärrade.
En spärr enligt första stycket hindrar inte sådan behandling av personuppgifter som avses i 5 a kap. 1 § andra stycket, 2 och 3 §§.
4 §
E-hälsomyndigheten ska spärra uppgift om ordinationsorsak i medi- cinteknikregistret för direktåtkomst av patienten om uppgiften enligt 25 kap. 6 § offentlighets- och sekre- tesslagen (2009:400) inte får lämnas ut. E-hälsomyndigheten ska spärra
SOU 2025:71 |
Författningsförslag |
uppgift om en underårig i medi- cinteknikregistret för direktåtkomst av vårdnadshavaren om uppgiften enligt 12 kap. 3 § offentlighets- och sekretesslagen inte får lämnas ut.
Hälso- och sjukvårdspersonal som har behörighet att förskriva läkemedel och som efter en pröv- ning enligt 25 kap. 6 § offentlig- hets- och sekretesslagen eller 6 kap. 12 § andra stycket patientsäker- hetslagen (2010:659) finner att upp- gift om ordinationsorsak i medi- cinteknikregistret inte får lämnas ut till en patient, ska hos E-hälso- myndigheten begära att få upp- giften spärrad i medicinteknikregist- ret för direktåtkomst av patienten.
Hälso- och sjukvårdspersonal som har behörighet att förskriva läkemedel och som efter en pröv- ning enligt 12 kap. 3 § offentlig- hets- och sekretesslagen eller 6 kap. 12 § patientsäkerhetslagen finner att en uppgift om en underårig i medicinteknikregistret inte får läm- nas ut till dennes vårdnadshavare, ska hos E-hälsomyndigheten begära att få uppgiften spärrad i medi- cinteknikregistret för direktåtkomst av vårdnadshavaren.
Hävning av spärr
5 §
En spärr enligt 3 § första stycket ska hävas av E-hälsomyndigheten endast om patienten samtycker till det.
Författningsförslag |
SOU 2025:71 |
|
6 § |
|
|
Hälso- |
och sjukvårdspersonal |
|
som har behörighet att förskriva |
|
läkemedel och som efter en ny pröv- |
|
ning finner att en uppgift som be- |
|
gärts spärrad enligt 4 § andra eller |
|
tredje stycket kan lämnas ut till |
|
patienten respektive vårdnadshava- |
|
ren, ska hos E-hälsomyndigheten |
|
begära att spärren hävs. E-hälso- |
|
myndigheten ska häva en spärr om |
|
den uppgift som spärrats enligt 4 § |
|
kan lämnas ut till patienten re- |
|
spektive vårdnadshavaren. |
5 kap. Om elektronisk åtkomst |
5 kap. Om elektronisk åtkomst |
|
till uppgifter i den nationella |
|
läkemedelslistan |
1 § |
|
Direktåtkomst till andra upp- |
För uppgifter som hör till läke- |
gifter i den nationella läkemedels- |
medel eller andra varor enligt 1 kap. |
listan än ordinationsorsak får, även |
1 § 1 i den nationella läkemedels- |
utan patientens samtycke, ges till |
listan får direktåtkomst till andra |
expedierande personal på öppen- |
uppgifter än uppgift om behand- |
vårdsapotek för det ändamål som |
lingsorsak, |
även utan patientens |
anges i 3 kap. 3 § 1. |
samtycke, |
ges till expedierande |
|
personal på öppenvårdsapotek för |
|
det ändamål som anges i 3 kap. |
|
3 § 1. |
|
Direktåtkomst till uppgift om |
Direktåtkomst till uppgift om |
ordinationsorsak får endast med |
behandlingsorsak, som hör till läke- |
patientens samtycke ges till expe- |
medel eller andra varor enligt 1 kap. |
dierande personal på öppenvårds- |
1 § 1, får endast med patientens |
apotek för det ändamål som an- |
samtycke ges till expedierande per- |
ges i 3 kap. 3 § 1. |
sonal på öppenvårdsapotek för det |
|
ändamål som anges i 3 kap. 3 § 1. |
3. dietist och farmaceut i hälso- och sjukvården till uppgifter om läkemedel och andra varor enligt 1 kap. 1 § 1 och 3, för de ändamål som anges i 3 kap. 4 § 2 och 3.
Direktåtkomst enligt första stycket avser även uppgiften om att det finns spärrade uppgifter.
Direktåtkomst enligt första Direktåtkomst enligt första stycket får utan patientens sam- stycket får utan patientens sam- tycke ges till uppgifter om en pati- tycke ges till uppgifter hänförliga till läkemedel och andra varor en-
79
1. hälso- och sjukvårdspersonal som har behörighet att förskriva läkemedel eller andra varor, för de ändamål som anges i 3 kap. 4 §,
2. sjuksköterska utan behö- righet att förskriva läkemedel eller andra varor, för de ändamål som anges i 3 kap. 4 § 2 och 3, och
SOU 2025:71 |
Författningsförslag |
Direktåtkomst enligt första och andra styckena får i fråga om uppgifter om förskrivningar endast avse förskrivningar som registre- rats i den nationella läkemedelslistan inom de senaste 24 månaderna.
2 §
Direktåtkomst till andra uppgif- |
För uppgifter som hör till läke- |
ter i den nationella läkemedels- |
medel eller andra varor enligt 1 kap. |
listan än ordinationsorsak får med |
1 § 1 i den nationella läkemedels- |
patientens samtycke ges till expe- |
listan får direktåtkomst till andra |
dierande personal på öppenvårds- |
uppgifter än behandlingsorsak, med |
apotek för det ändamål som anges |
patientens samtycke, ges till ex- |
i 3 kap. 3 § 2. |
pedierande personal på öppen- |
|
vårdsapotek för det ändamål som |
|
anges i 3 kap. 3 § 2. |
3 §
Direktåtkomst till uppgifter i den nationella läkemedelslistan får med patientens samtycke ges till
1. hälso- och sjukvårdspersonal som har behörighet att förskriva läkemedel eller andra varor, för de ändamål som anges i 3 kap. 4 §, och
2. sjuksköterska utan behö- righet att förskriva läkemedel eller andra varor, dietist och farmaceut i hälso- och sjukvården, för de ända- mål som anges i 3 kap. 4 § 2 och 3.
Författningsförslag |
SOU 2025:71 |
ent som får dosdispenserade läke- medel.
ligt 1 kap. 1 § 1 om en patient som får dosdispenserade läkemedel.
3 a §
För uppgifter hänförliga till för- skrivningar i den nationella läke- medelslistan får direktåtkomst, utan patientens samtycke, ges till hälso- och sjukvårdspersonal som har be- hörighet att förskriva läkemedel eller andra varor, för det ändamål som anges i 3 kap. 4 § 1. Direkt- åtkomsten avser även uppgifter som har spärrats.
Direktåtkomst enligt första stycket får endast avse förskriv- ningar som förskrivaren själv ut- färdat eller annars har kännedom om genom att förskrivaren har tagit del av dokumenterade uppgifter i enlighet med 4 kap. 1 § patient- datalagen (2008:355) i samband med att denne deltar i vården av patienten. Direktåtkomsten får en- bart avse uppgifter om förskriv- ningar som registrerats i den natio- nella läkemedelslistan inom de senaste 24 månaderna.
3 b §
För uppgifter hänförliga till adm- inistrerade vaccin eller läkemedel med långvarig effekt i nationella läkemedelslistan får direktåt- komst, utan patientens samtycke, ges till hälso- och sjukvårdsperso- nal med behörighet att förskriva läkemedel eller andra varor när direktåtkomsten är nödvändig för
SOU 2025:71 |
Författningsförslag |
att genomföra en korrigering eller rättelse av en tidigare registrerad uppgift. Direktåtkomsten avser även spärrade uppgifter.
6 §
Patienten får ha direktåtkomst till uppgifter om sig själv. Direkt- åtkomst får även ges till en annan fysisk person som patienten utsett genom en fullmakt som finns registrerad i den nationella läkemedels- listan.
En fullmakt som registreras enligt första stycket ska kunna begränsas till att enbart avse uppgifter hän- förliga till viss eller vissa av punk- terna i 1 kap. 1 §.
5 a kap. Om elektronisk åtkomst till uppgifter
i medicinteknikregistret
1 §
Direktåtkomst till uppgifter i medicinteknikregistret får med pati- entens samtycke ges till
1.hälso- och sjukvårdspersonal som har behörighet att förskriva läkemedel eller andra varor, för de ändamål som anges i 3 a kap. 3 §, och
2.sjuksköterska utan behörig- het att förskriva läkemedel eller andra varor, dietist och farmaceut
ihälso- och sjukvården, för de ända- mål som anges i 3 a kap. 3 § 2 och 3.
Direktåtkomst enligt första stycket avser även uppgiften om att det finns spärrade uppgifter.
Författningsförslag |
SOU 2025:71 |
2 §
För uppgifter hänförliga till en tillförd medicinteknisk produkt en- ligt 1 kap. 1 a § får direktåtkomst, utan patientens samtycke, ges till hälso- och sjukvårdspersonal med behörighet att förskriva läkemedel eller andra varor för registrering av uppgifter i enlighet med 9 kap. 3 § andra stycket. Direktåtkomsten avser även uppgifter som spärrats.
Direktåtkomst enligt första stycket får även ges när direktåtkom- sten är nödvändig för att vidta rätt- else eller korrigering av en tidigare registrerad uppgift.
3 §
Om det är nödvändigt för att en patient ska kunna få den vård eller behandling som han eller hon oundgängligen behöver och patien- ten inte kan lämna sitt samtycke, får hälso- och sjukvårdspersonal som har behörighet att förskriva läkemedel och sjuksköterska utan sådan behörighet ges direktåtkomst till uppgifter i medicintekniksregi- stret för de ändamål som anges i 3 a kap. 3 §. Direktåtkomsten avser även uppgifter som har spärrats.
4 §
Patienten får ha direktåtkomst till uppgifter om sig själv. Direkt- åtkomst får även ges till en annan fysisk person som patienten utsett genom en fullmakt som finns regi- strerad i medicinteknikregistret.
E-hälsomyndigheten ska till hälso- och sjukvårdspersonal som har behörighet att förskriva läke- medel eller andra varor, sjukskö- terska utan sådan behörighet samt till dietist och farmaceut i hälso- och sjukvården lämna ut de upp- gifter som omfattas av direkt- åtkomst enligt 5 kap. 3–5 §§ och 5 a kap. 1–3 §§.
SOU 2025:71 |
Författningsförslag |
6kap. 2 §
E-hälsomyndigheten ska till hälso- och sjukvårdspersonal som har behörighet att förskriva läke- medel eller andra varor, sjukskö- terska utan sådan behörighet samt till dietist och farmaceut i hälso- och sjukvården lämna ut de upp- gifter som omfattas av direkt- åtkomst enligt 5 kap. 3–5 §§.
Regioner |
|
|
E-hälsomyndighetens |
|
|
|
uppgiftsskyldighet i övrigt |
|
|
3 §2 |
E-hälsomyndigheten ska till |
E-hälsomyndigheten ska för de |
den region som enligt 22 § lagen |
ändamål som anges i 3 kap. 5 § 1 |
(2002:160) om läkemedelsförmåner |
och 3–8 lämna ut nödvändiga upp- |
m.m. ska ersätta kostnaderna för |
gifter till regioner, förskrivare, verk- |
läkemedelsförmåner, för de ända- |
samhetschefer, Socialstyrelsen, In- |
mål som anges i 3 kap. 5 § 1 och 3, |
spektionen för vård och omsorg, |
lämna ut uppgifter om expedie- |
Tandvårds- och läkemedelsförmåns- |
ringar av förskrivna läkemedel och |
verket och Läkemedelsverket. |
andra varor som omfattas av den |
|
lagen. |
|
|
|
E-hälsomyndigheten ska, för |
|
samma ändamål som anges i första |
|
stycket, till den region som enligt |
|
7 kap. |
4 § |
smittskyddslagen |
|
(2004:168) ska ersätta kostnader för läkemedel lämna ut uppgifter om expedieringar av förskrivna läke- medel som är kostnadsfria enligt den lagen.
2Senaste lydelse 2019:990.
Författningsförslag |
SOU 2025:71 |
För ändamål som anges i 3 kap. 5 § 3 ska uppgifter om patientens identitet vara krypterade på ett sådant sätt att dennes identitet skyddas. I 4 kap. 6 § andra stycket patientdatalagen (2008:355) finns bestäm- melser om att detta skydd för patientens identitet ska bestå hos regionerna.
7 kap.
1 §
E-hälsomyndigheten ska informera Inspektionen för vård och omsorg om det som kommit fram vid en kontroll av det elektroniska system för direktåtkomst till uppgifter hos myndigheten som den som bedriver verksamhet inom hälso- och sjukvården ska ha enligt
9 kap. 1 §. |
|
Myndigheten ska även infor- |
Myndigheten ska även infor- |
mera Inspektionen för vård och |
mera Inspektionen för vård och |
omsorg om den som bedriver verk- |
omsorg om den som bedriver verk- |
samhet inom hälso- och sjukvår- |
samhet inom hälso- och sjukvår- |
den inte lämnar de uppgifter till |
den inte lämnar de uppgifter till |
myndigheten som föreskrivs i |
myndigheten som föreskrivs i |
9 kap. 1 §. |
9 kap. 1 och 3 §§. |
3 §
Utöver det som framgår av artiklarna 13 och 14 i EU:s dataskydds- förordning ska den som är personuppgiftsansvarig enligt denna lag lämna information till den registrerade om
1.vilka uppgifter registret får innehålla,
2.tystnadsplikts- och säkerhetsbestämmelser,
3.rätten enligt artikel 82 i EU:s dataskyddsförordning och 7 kap. 1 § lagen (2018:218) med kompletterande bestämmelser till EU:s data- skyddsförordning till skadestånd vid behandling av personuppgifter
istrid med denna lag,
4.sökbegränsningar,
5.utlämnande av uppgifter på medium för automatiserad behand-
ling,
6.direktåtkomst, samtycke och spärrning,
7.behandling av uppgifter om patienter som får dosdispenserade läkemedel, och
E-hälsomyndigheten ska be- stämma villkor för tilldelning av behörighet till den som arbetar hos myndigheten för åtkomst till den nationella läkemedelslistan och till medicinteknikregistret. Be- hörigheten ska begränsas till det som behövs för att den som arbe- tar hos E-hälsomyndigheten ska kunna fullgöra sina arbetsupp- gifter där.
E-hälsomyndigheten ska se till att åtkomst till uppgifter i den nationella läkemedelslistan och i medicinteknikregistret dokumente- ras så att åtkomsten kan kontrolle- ras. Myndigheten ska systematiskt och återkommande kontrollera om någon obehörigen tar del av uppgifter i registren.
SOU 2025:71Författningsförslag
8. att registreringen inte är fri- |
8. att registreringen inte är fri- |
villig med de undantag som fram- |
villig med det undantag som fram- |
går av 4 kap. 1 §. |
går av 4 kap. 1 §. |
8kap. 1 §
E-hälsomyndigheten ska be- stämma villkor för tilldelning av behörighet till den som arbetar hos myndigheten för åtkomst till den nationella läkemedelslistan. Behörigheten ska begränsas till det som behövs för att den som arbe- tar hos E-hälsomyndigheten ska kunna fullgöra sina arbetsupp- gifter där.
E-hälsomyndigheten ska se till att åtkomst till uppgifter i den nationella läkemedelslistan doku- menteras så att åtkomsten kan kontrolleras. Myndigheten ska systematiskt och återkommande kontrollera om någon obehöri- gen tar del av uppgifter i registret.
2 §
Direktåtkomst till uppgifter i |
Direktåtkomst till uppgifter i |
den nationella läkemedelslistan får |
den nationella läkemedelslistan och |
ges först sedan E-hälsomyndig- |
i medicinteknikregistret får ges |
heten försäkrat sig om att be- |
först sedan E-hälsomyndigheten |
hörighets- och säkerhetsfrågorna |
försäkrat sig om att behörighets- |
är lösta på ett sätt som är till- |
och säkerhetsfrågorna är lösta på |
fredsställande ur integritetssyn- |
ett sätt som är tillfredsställande ur |
punkt och att behörigheten hos |
integritetssynpunkt och att behö- |
den som ska få direktåtkomst är |
righeten hos den som ska få direkt- |
begränsad till att endast gälla så- |
åtkomst är begränsad till att endast |
Författningsförslag |
SOU 2025:71 |
dana uppgifter som denne har rätt att få ut enligt denna lag.
gälla sådana uppgifter som denne har rätt att få ut enligt denna lag.
9kap. 1 §
Den som bedriver verksamhet inom hälso- och sjukvården som inne- fattar ordination och förskrivning av läkemedel eller andra varor ska
1. ha ett elektroniskt system |
1. ha ett elektroniskt system |
som gör det möjligt att få direkt- |
som gör det möjligt att få direkt- |
åtkomst till uppgifter i den natio- |
åtkomst till uppgifter i den natio- |
nella läkemedelslistan, och |
nella läkemedelslistan och i medi- |
|
cinteknikregistret, och |
2. vid en elektronisk förskriv- |
2. vid en elektronisk förskriv- |
ning lämna de uppgifter till den |
ning och vid administrering av |
nationella läkemedelslistan som |
sådant vaccin eller läkemedel med |
anges i 3 kap. 8 §. |
långvarig effekt som avses i 1 kap. |
|
1 § 2 och 3 lämna de uppgifter till |
|
den nationella läkemedelslistan |
|
som anges i 3 kap. 8 §. |
|
3 § |
|
Den som bedriver verksamhet |
|
inom hälso- och sjukvården som |
|
innefattar tillförande till patienter |
|
av medicintekniska produkter som |
|
avses i 1 kap. 1 a § ska vid sådant |
|
tillförande lämna de uppgifter till |
|
medicinteknikregistret som anges i |
|
3 a kap. 5 §. |
|
Den som bedriver verksamhet |
|
inom hälso- och sjukvården och som |
|
vidtar en åtgärd med en produkt |
|
som registrerats i enlighet med första |
|
stycket ska lämna uppgifter till medi- |
|
cinteknikregistret om detta när åt- |
|
gärden |
|
1. påverkar redan registrerade |
|
uppgifter om produkten i registret, |
|
eller |
Regeringen eller den myndig- het som regeringen bestämmer kan med stöd av 8 kap. 7 § regerings- formen meddela närmare före- skrifter om verkställigheten av denna lag och om hur ordinations- orsak enligt 3 kap. 8 § och 3 a kap. 5 § ska registreras och redovisas.
87
E-hälsomyndigheten får ta ut avgifter av den som har tillstånd att bedriva öppenvårdsapotek för att täcka kostnaderna för att föra den nationella läkemedelslistan i den del registret avser uppgifter enligt 1 kap. 1 § 1.
2 a §
Regeringen eller den myndig- het regeringen bestämmer får med- dela föreskrifter om vilka läke- medel som omfattas av 1 kap. 1 § 3 och vilka medicintekniska produk- ter som omfattas av 1 kap. 1 a § samt om de förutsättningar som ska gälla för detta.
SOU 2025:71 |
Författningsförslag |
2.innebär att de registrerade uppgifterna inte längre är nödvän- diga för ändamålen i 3 a kap. 2–3 §§ och 4 § andra stycket.
10kap. 1 §
E-hälsomyndigheten får ta ut avgifter av den som har tillstånd att bedriva öppenvårdsapotek för att täcka kostnaderna för att föra den nationella läkemedelslistan.
3 §
Regeringen eller den myndig- het som regeringen bestämmer kan med stöd av 8 kap. 7 § regerings- formen meddela närmare före- skrifter om hur ordinationsorsak enligt 3 kap. 8 § ska registreras och redovisas.
Författningsförslag |
SOU 2025:71 |
4 §
Regeringen får meddela före- skrifter om uppgifter som registren får innehålla enligt 3 kap. 8 § 3–8 och 3 a kap. 5 § 3–5.
5 §
Regeringen får meddela före- skrifter om E-hälsomyndighetens uppgiftsskyldighet enligt 6 kap. 3 §.
6 §
Regeringen får meddela före- skrifter om vilka uppgifter i 3 kap. 8 § och 3 a kap. 5 § som omfattas av kravet på den som bedriver hälso- och sjukvårdsverksamhet att lämna uppgifter enligt 9 kap. 1 § 2 och 3 §.
Regeringen får också meddela föreskrifter om vilka uppgifter i 3 kap. 8 § som omfattas av kravet på den som har tillstånd att be- driva öppenvårdsapotek enligt 2 kap. 1 § lagen (2009:366) om handel med läkemedel att lämna uppgifter enligt 2 kap. 6 § 5 den lagen.
1.Denna lag träder i kraft den 26 mars 2029.
2.Uppgifter om fullmakter som insamlats med den registrerades samtycke ska efter ikraftträdandet fortsätta behandlas med samtycke.
3.Uppgifter om vaccin, långtidsverkande läkemedel och medicin- tekniska produkter enligt 1 kap. 1 § 2 och 3 samt 1 a §, som admi- nistrerats eller tillförts patienten innan vaccinet, läkemedlet eller pro- dukten omfattades av lagen, får registreras med patientens samtycke.
SOU 2025:71 |
Författningsförslag |
1.8Förslag till förordning om ändring i förordningen (2005:363) om läkemedelsregister hos Socialstyrelsen
Härigenom föreskrivs att 4 § förordningen (2005:363) om läkemedels- register hos Socialstyrelsen ska ha följande lydelse.
Nuvarande lydelse |
Föreslagen lydelse |
4 §1
I läkemedelsregistret får endast följande uppgifter registreras:
1.datum för expediering, vara, mängd, dosering, kostnad och kost- nadsreducering enligt lagen (2002:160) om läkemedelsförmåner m.m.,
2.ordinationsorsak,
3. patientens personnummer |
3. patientens personnummer |
eller samordningsnummer samt |
eller annan identitetsbeteckning |
folkbokföringsort, och |
samt folkbokföringsort, och |
4.förskrivarens yrke, specialitet och arbetsplatskod. Ordinationsorsak ska anges med en kod.
Denna förordning träder i kraft den 26 mars 2029.
1Senaste lydelse 2021:68.
Författningsförslag |
SOU 2025:71 |
1.9Förslag till förordning om ändring i förordningen (2006:196) om register över legitimerad hälso- och sjukvårdspersonal och personal med bevis om rätt att använda yrkestiteln undersköterska
Härigenom föreskrivs att 5 § förordningen (2006:196) om register över legitimerad hälso- och sjukvårdspersonal och personal med bevis om rätt att använda yrkestiteln undersköterska ska ha följande lydelse.
Nuvarande lydelse |
Föreslagen lydelse |
5 §1
Personuppgifterna i registret får, utöver det som anges i 4 §, be- handlas endast för att
1.utöva tillsyn över hälso- och sjukvården och dess personal samt verksamhet enligt socialtjänstlagen (2001:453) och lagen (1993:387) om stöd och service till vissa funktionshindrade,
2. lämna uppgifter till den |
2. lämna uppgifter till |
den |
nationella läkemedelslistan enligt |
nationella läkemedelslistan |
och |
lagen (2018:1212) om nationell |
medicinteknikregistret enligt lagen |
läkemedelslista, |
(2018:1212) om nationella regis- |
|
ter över vissa läkemedel och andra |
|
produkter i medicinsk använd- |
|
ning, |
|
3.lämna uppgifter till myndigheter och enskilda i enlighet med det som föreskrivs i annan författning eller avtal,
4. i samband med E-hälsomyn- |
4. i samband med E-hälsomyn- |
dighetens behandling av person- |
dighetens behandling av person- |
uppgifter enligt lagen om nationell |
uppgifter enligt lagen om natio- |
läkemedelslista lämna uppgifter till |
nella register över vissa läkemedel |
den myndigheten för kontroll av |
och andra produkter i medicinsk |
identitet och behörighet i fråga |
användning lämna uppgifter till |
om förskrivare, legitimerade sjuk- |
den myndigheten för kontroll av |
sköterskor utan behörighet att för- |
identitet och behörighet i fråga |
skriva läkemedel, apotekare, recep- |
om förskrivare, legitimerade sjuk- |
tarier och dietister, |
sköterskor utan behörighet att för- |
|
skriva läkemedel, apotekare, recep- |
|
tarier och dietister, |
1Senaste lydelse 2024:283.
SOU 2025:71 |
Författningsförslag |
5.lämna uppgifter till E-hälsomyndigheten för kontroll av för- skrivares identitet och behörighet vid expediering på öppenvårds- apotek av läkemedel och andra varor som förskrivits,
6.kontrollera legitimerad hälso- och sjukvårdspersonals identitet och behörighet i samband med tjänstetillsättning och under anställ- ning eller uppdrag,
7.kontrollera legitimerad hälso- och sjukvårdspersonals identitet och behörighet att utfärda intyg,
8.kontrollera identiteten och behörigheten för personal med bevis om rätt att använda yrkestiteln undersköterska i samband med tjänste- tillsättning och under anställning eller uppdrag, och
9.framställa statistik om hälso- och sjukvård enligt lagen (2001:99) om den officiella statistiken.
Denna förordning träder i kraft den 26 mars 2029.
Myndigheten ska särskilt
1. ansvara för det register som anges i lagen (2018:1212) om nationell läkemedelslista,
Författningsförslag |
SOU 2025:71 |
1.10Förslag till förordning om ändring
i förordningen (2013:1031) med instruktion för E-hälsomyndigheten
Härigenom föreskrivs att 2 och 16 §§ förordningen (2013:1031) med instruktion för E-hälsomyndigheten ska ha följande lydelse.
Nuvarande lydelse |
Föreslagen lydelse |
2 §1
1. ansvara för de register som anges i lagen (2018:1212) om nationella register över vissa läke- medel och andra produkter i medi- cinsk användning,
2.utfärda intyg som visar att den som ansöker om tillstånd att bedriva detaljhandel med läkemedel till konsument uppfyller de för- utsättningar för tillståndet som föreskrivs i 2 kap. 6 § 5–7 lagen (2009:366) om handel med läkemedel,
3.vid behov genomföra kontroller av det elektroniska system för direktåtkomst till uppgifter hos myndigheten
a) som en tillståndshavare ska ha enligt 2 kap. 6 § 6 lagen om handel med läkemedel, eller
b) som avses i 9 kap. 1 § 1 lagen |
b) som avses i 9 kap. 1 § 1 lagen |
om nationell läkemedelslista, |
om nationella register över vissa |
|
läkemedel och andra produkter i |
|
medicinsk användning, |
4.förmedla ersättning från regionerna till öppenvårdsapoteken enligt vad som sägs i förordningen (2002:687) om läkemedelsförmåner m.m. och i smittskyddsförordningen (2004:255),
5.kvalitetssäkra, förvalta, framställa och tillhandahålla nationell läkemedelsstatistik,
6.tillhandahålla ett system för analys av läkemedelsstatistik,
7.ansvara för det register som anges i förordningen (2021:1129) om register över förordnade läkemedel för behandling av djur,
1Senaste lydelse 2021:1131.
Grunderna för hur myndig- heten har beräknat storleken på avgifterna enligt 10 kap. 1 § lagen (2018:1212) om nationella register över vissa läkemedel och andra produkter i medicinsk användning ska redovisas särskilt i årsredo- visningen.
SOU 2025:71 |
Författningsförslag |
8.ansvara för ett nationellt produkt- och artikelregister över läke- medel samt förbrukningsartiklar och livsmedel som ingår i läkemedels- förmånerna,
9.tillhandahålla ett system för insamling av läkemedelsinformation,
10.ansvara för ett nationellt register över sortiments- och leve- ransinformation avseende dosdispenserade läkemedel,
11.tillhandahålla ett elektroniskt expertstöd till öppenvårdsapote- ken i syfte att öka säkerheten vid expediering av läkemedelsrecept,
12.tillhandahålla ett system för förmedling av ansökningar om tillstånd till försäljning av läkemedel enligt 4 kap. 10 § läkemedels- lagen (2015:315),
13.ansvara för att fastställa vilka e-hälsospecifikationer som ska vara nationella och gemensamma och tillgängliggöra information om dessa samt samordna och stödja berörda aktörers arbete med att ta fram och använda sådana specifikationer, och
14.samråda med Myndigheten för digital förvaltning när e-hälso- specifikationer fastställs enligt 13.
16 §2
Grunderna för hur myndig- heten har beräknat storleken på avgifterna enligt 10 kap. 1 § lagen (2018:1212) om nationell läke- medelslista ska redovisas särskilt i årsredovisningen.
Denna förordning träder i kraft den 26 mars 2029.
2Senaste lydelse 2021:70.
Författningsförslag |
SOU 2025:71 |
1.11Förslag till förordning om ändring i förordningen (2021:67) om nationell läkemedelslista
Härigenom föreskrivs i fråga om förordningen (2021:67) om natio- nell läkemedelslista
dels att nuvarande 1 § ska betecknas 1 kap. 1 §, nuvarande 2 § ska betecknas 5 kap. 1 § och nuvarande 3 § ska betecknas 5 kap. 3 §,
dels att rubriken till förordningen samt 1 kap. 1 § ska ha följande lydelse,
dels att det ska införas fem nya kapitel, kap. 1–5, av följande lydelse.
Nuvarande lydelse |
Föreslagen lydelse |
Förordning om nationell |
Förordning om nationella |
läkemedelslista |
register över vissa läkemedel |
|
och andra produkter i medicinsk |
|
användning |
|
1 kap. Inledande bestämmelser |
1 § |
|
I denna förordning finns kom- |
|
pletterande föreskrifter om sådan |
|
behandling av personuppgifter som |
|
omfattas av lagen (2018:1212) om |
|
nationella register över vissa läke- |
|
medel och andra produkter i medi- |
|
cinsk användning. |
Denna förordning är medde- |
Förordningen är meddelad med |
lad med stöd av |
stöd av |
|
1. 10 kap. 4 § lagen om natio- |
|
nella register över vissa läkemedel |
|
och andra produkter i medicinsk an- |
vändning i fråga om 2 kap. 1–3 §§, 2. 10 kap. 6 § lagen om natio- nella register över vissa läkemedel och andra produkter i medicinsk an- vändning i fråga om 3 kap. 1–5§§,
SOU 2025:71 |
Författningsförslag |
10 kap. 2 § lagen (2018:1212) om nationell läkemedelslista i fråga om 2 § och med stöd av 8 kap. 7 § regeringsformen i fråga om 3 §.
3.10 kap. 5 § lagen om natio- nella register över vissa läkemedel och andra produkter i medicinsk an- vändning i fråga om 4 kap. 1–6 §§,
4.10 kap. 2 § lagen om natio- nella register över vissa läkemedel och andra produkter i medicinsk användning i fråga om 5 kap. 1 §,
5.10 kap. 2 a § lagen om natio- nella register över vissa läkemedel och andra produkter i medicinsk användning i fråga om 5 kap. 2 §, samt
6.8 kap. 7 § regeringsformen i fråga om 5 kap. 3 och 4 §§.
2 §
De uttryck som används i lagen (2018:1212) om nationella regis- ter över vissa läkemedel och andra produkter i medicinsk användning har samma betydelse i denna för- ordning.
2 kap. Registerinnehåll
Registret nationell läkemedelslista
1 §
Hänförligt till läkemedel och andra varor enligt 1 kap. 1 § 1 i lagen (2018:1212) om nationella register över vissa läkemedel och andra produkter i medicinsk an- vändning får den nationella läke- medelslistan innehålla följande upp- gifter med stöd av 3 kap. 8 § 3, 5 och
6 samma lag:
Författningsförslag |
SOU 2025:71 |
1.andra uppgifter som framgår av en förskrivning än uppgifter om patienten,
2.aktiv substans för det för- skrivna läkemedlet,
3.senaste datum för när en läke- medelsbehandling ska följas upp eller avslutas,
4.förskrivarens specialitet, arbetsplats och arbetsplatskod,
5.expedierad vara, mängd och dosering, datum för expediering, expedierande apotek, expedierande farmaceut, uppgift om att expedie- rande farmaceut har motsatt sig ut- byte av ett förskrivet läkemedel och skälen för det, samt
6.uppgift om kostnad, kostnads- reducering enligt lagen (2002:160) om läkemedelsförmåner m.m. och kostnadsfrihet enligt smittskydds- lagen (2004:168).
2 §
Hänförligt till administrerade vaccin och läkemedel med lång- varig effekt enligt 1 kap. 1 § 2 och 3 i lagen (2018:1212) om natio- nella register över vissa läkemedel och andra produkter i medicinsk användning får den nationella läke- medelslistan innehålla följande upp- gifter med stöd av 3 kap. 8 § 4 och
5 samma lag:
1.administrerat vaccin eller läkemedel med långvarig effekt, sats- nummer, mängd och dosering, läke- medelsform, styrka och admini- streringssätt,
SOU 2025:71 |
Författningsförslag |
2.för vaccin, i förekommande fall även uppgift om vilken dos som getts i ordningen av totalt antal doser och datum för kommande på- fyllnadsdos,
3.aktiv substans för admini- strerat vaccin eller läkemedel med långvarig effekt,
4.namn, yrke, specialitet, för- skrivarkod och arbetsplatskod för den person som ordinerat vaccinet eller läkemedlet med långvarig effekt,
5.ansvarig vårdgivare och vård- inrättning eller motsvarande där åt- gärden utfördes, samt
6.datum för utförd åtgärd.
Medicinteknikregistret
3 §
Medicinteknikregistret får med stöd av 3 a kap. 5 § 3 lagen (2018:1212) om nationella regi- ster över vissa läkemedel och andra produkter i medicinsk användning innehålla uppgifter om:
1.den tillförda medicintekniska produkten och dess unika produk- tidentifierare,
2.namn, yrke, specialitet, för- skrivarkod och arbetsplatskod för den person som ordinerat åtgärden,
3.ansvarig vårdgivare och vård- inrättning eller motsvarande där åt- gärden utfördes, samt
4.datum för utförd åtgärd.
Författningsförslag |
SOU 2025:71 |
3 kap. Skyldighet för vårdgivare och tillståndshavare att lämna uppgifter till E-hälsomyndigheten
Elektronisk förskrivning
1 §
Vid elektronisk förskrivning ska den som bedriver verksamhet inom hälso- och sjukvården till natio- nella läkemedelslistan lämna föl- jande uppgifter:
1.patientens namn och person- nummer eller annan identitetsbe- teckning,
2.ordinationsorsak, samt
3.uppgifter enligt 2 kap. 1 § 1–3.
Administrerat vaccin
2 §
I samband med administrering till en patient av ett vaccin som omfattas av 1 kap. 1 § 2 lagen (2018:1212) om nationella register över vissa läkemedel och andra produkter i medicinsk användning ska den som bedriver verksamhet inom hälso- och sjukvården till nationella läkemedelslistan lämna följande uppgifter:
1.patientens namn och person- nummer eller annan identitetsbe- teckning,
2.ordinationsorsak, samt
3.uppgifter enligt 2 kap. 2 § 1–2 och 4–6.
SOU 2025:71 |
Författningsförslag |
Administrerat läkemedel med långvarig effekt
3 §
I samband med administrering till en patient av ett läkemedel som omfattas av 1 kap. 1 § 3 lagen (2018:1212) om nationella regis- ter över vissa läkemedel och andra produkter i medicinsk användning ska den som bedriver verksamhet inom hälso- och sjukvården till nationella läkemedelslistan lämna följande uppgifter:
1.patientens namn och person- nummer eller annan identitets- beteckning,
2.ordinationsorsak, samt
3.uppgifter enligt 2 kap. 2 § 1 och 4–6.
Tillförd medicinteknisk produkt
4 §
I samband med tillförande till en patient av en produkt som omfattas av 1 kap. 1 a § lagen (2018:1212) om nationella regis- ter över vissa läkemedel och andra produkter i medicinsk användning ska den som bedriver verksamhet inom hälso- och sjukvården till medicinteknikregistret lämna föl- jande uppgifter:
1.patientens namn och person- nummer eller annan identitetsbe- teckning,
2.ordinationsorsak i förekom- mande fall, samt
3.uppgifter enligt 2 kap. 3 §.
Författningsförslag |
SOU 2025:71 |
Expediering på öppenvårdsapotek
5 §
Vid expediering av en förskriv- ning ska den som har tillstånd att bedriva detaljhandel med läke- medel till konsument enligt 2 kap. 1 § lagen (2009:366) om handel med läkemedel, till nationella läke- medelslistan lämna följande upp- gifter:
1.patientens namn och person- nummer eller annan identitetsbe- teckning,
2.i förekommande fall upp- gifter enligt 2 kap. 1 § 1 och 2, samt
3.uppgifter enligt 2 kap. 1 § 5 och 6.
4kap. E-hälsomyndighetens skyldighet att lämna ut uppgifter
Regioner
1 §
E-hälsomyndigheten ska till den region som enligt 22 § lagen (2002:160) om läkemedelsförmå- ner m.m. ska ersätta kostnaderna för läkemedelsförmåner, för de ändamål som anges i 3 kap. 5 § 1 och 3 lagen (2018:1212) om natio- nella register över vissa läkemedel och andra produkter i medicinsk användning, lämna ut uppgifter om expedieringar av förskrivna läke- medel och andra varor som om-
SOU 2025:71 |
Författningsförslag |
fattas av lagen om läkemedelsför- måner m.m.
E-hälsomyndigheten ska, för samma ändamål som anges i första stycket, till den region som enligt
7 kap. 4 § smittskyddslagen (2004:168) ska ersätta kostnader för läkemedel lämna ut uppgifter om expedieringar av förskrivna läke- medel som är kostnadsfria enligt den lagen.
Förskrivare och verksamhetschef
2 §
E-hälsomyndigheten ska till den förskrivare som gjort en förskriv- ning och till verksamhetschefen vid den enhet där förskrivaren tjänst- gör lämna ut uppgifter som avses i 3 kap. 5 § 4 lagen (2018:1212) om nationella register över vissa läke- medel och andra produkter i medi- cinsk användning.
Socialstyrelsen
3 §
E-hälsomyndigheten ska till Socialstyrelsen, för de ändamål som anges i 3 kap. 5 § 5 lagen (2018:1212) om nationella regi- ster över vissa läkemedel och andra produkter i medicinsk användning, lämna ut uppgifter om
1.datum för förskrivning och expediering, förskriven och expe- dierad vara, mängd och dosering, kostnad och kostnadsreducering en-
Författningsförslag |
SOU 2025:71 |
ligt lagen (2002:160) om läke- medelsförmåner m.m.,
2.ordinationsorsak,
3.patientens personnummer eller annan identitetsbeteckning och folk- bokföringsort, samt
4.förskrivarens yrke, specialitet och arbetsplatskod.
Inspektionen för vård- och omsorg
4 §
E-hälsomyndigheten ska till In- spektionen för vård och omsorg, för de ändamål som anges i 3 kap. 5 § 6 lagen (2018:1212) om nationella register över vissa läkemedel och andra produkter i medicinsk an- vändning, lämna ut uppgifter om en läkares eller tandläkares förskriv- ning av narkotiskt läkemedel eller annat särskilt läkemedel.
Tandvårds- och läkemedelsförmånsverket
5 §
E-hälsomyndigheten ska till Tandvårds- och läkemedelsför- månsverket, för det ändamål som anges i 3 kap. 5 § 7 lagen (2018:1212) om nationella regi- ster över vissa läkemedel och andra produkter i medicinsk användning lämna ut uppgifter om:
1.datum för expediering, expe- dierad vara och mängd,
SOU 2025:71 |
Författningsförslag |
2.kostnad och kostnadsreduce-
ring,
3.uppgifter om att farmaceuten har motsatt sig utbyte och skälen för det enligt lagen (2002:160) om läkemedelsförmåner m.m., och
4.övriga uppgifter som avser en förskrivning eller en expediering.
E-hälsomyndigheten ska redo- visa uppgifterna per öppenvårds- apotek.
Läkemedelsverket
6 §
E-hälsomyndigheten ska till Läkemedelsverket, för de ända- mål som anges i 3 kap. 5 § 8 lagen (2018:1212) om nationella regis- ter över vissa läkemedel och andra produkter i medicinsk använd- ning lämna ut uppgifter om:
1.patientens namn, person- nummer eller annan identitetsbe- teckning, folkbokföringsort och post- numret i patientens bostadsadress, samt
2.uppgifter som anges i 2 kap. 1 § 1, 2 och 4–6.
E-hälsomyndigheten ska redo- visa uppgifterna per öppenvårds- apotek.
5 kap. Bemyndiganden
2 §
Socialstyrelsen får, efter sam- råd med Läkemedelsverket, med- dela föreskrifter om vilka läke-
Författningsförslag |
SOU 2025:71 |
medel som ska omfattas av 1 kap. 1 § 3 lagen (2018:1212) om natio- nella register över vissa läkemedel och andra produkter i medicinsk användning och om vilka medi- cintekniska produkter som ska om- fattas av 1 kap. 1 a § samma lag, samt om de förutsättningar som ska gälla för detta.
4 §
E-hälsomyndigheten får meddela föreskrifter om verkställigheten av lagen (2018:1212) om nationella register över vissa läkemedel och andra produkter i medicinsk an- vändning och denna förordning.
____________
Denna förordning träder i kraft den 26 mars 2029.
Av 6 kap. 3 § lagen (2018:1212) om nationella register över läke- medel och andra varor i medicinsk användning följer att E-hälsomyn- digheten ska lämna de uppgifter som avses i 3 § till Socialstyrelsen.
SOU 2025:71 |
Författningsförslag |
1.12Förslag till förordning om ändring i hälsodataregisterförordningen (2025:000)
Härigenom föreskrivs i fråga hälsodataregisterförordningen (2025:000) dels att 5 kap. 4 § samt 8 kap. 3 och 4 §§ ska ha följande lydelse, dels att det ska införas en ny paragraf, 8 kap. 4 a §, av följande
lydelse.
Nuvarande lydelse |
Föreslagen lydelse |
5kap. 4 §
Av 6 kap. 5 § lagen (2018:1212) om nationell läkemedelslista följer att E-hälsomyndigheten ska lämna de uppgifter som avses i 3 § till Socialstyrelsen.
8 kap.
3 §
I registret över administrerade |
I registret över administrerade |
läkemedel får det finnas uppgift |
läkemedel får det finnas uppgift |
om en patient som tillhandahållits |
om en patient som tillhandahållits |
ett läkemedel inom sluten vård |
ett läkemedel inom hälso- och sjuk- |
eller öppen specialiserad vård. |
vård som inte utgör tandvård enligt |
|
tandvårdslagen (2985:125). |
I registret får också finnas uppgift av medicinsk betydelse som rör
1.ordinationsorsak,
2.det administrerade läkemedlet,
3.administrerad dos och dosenhet, samt
4.när och hur läkemedlet har administrerats.
I registret får också finnas uppgift av administrativ karaktär som rör vårdgivaren eller ordineringen och administreringen av läkemedlet.
4 §
En vårdgivare som administre- |
En vårdgivare som administre- |
rar läkemedel inom sluten vård |
rar läkemedel ska till registret över |
eller öppen specialiserad vård ska |
|
Författningsförslag |
SOU 2025:71 |
till registret över administrerade läkemedel lämna de uppgifter som avses i 3 §.
_______________
administrerade läkemedel lämna de uppgifter som avses i 3 §.
Skyldigheten enligt första stycket gäller inte den vårdgivare som utför
1.hälso- och sjukvård som en kommun är skyldig att erbjuda enligt 12 kap. 1 och 2 §§ hälso- och sjuk- vårdslagen (2017:30) eller som har överlåtits till kommunen enligt 14 kap. 1 § i samma lag, eller
2.tandvård enligt tandvårds- lagen (1985:125).
4 a §
En vårdgivare som administre- rar vaccin vid utförande av hälso- och sjukvård som en kommun är skyldig att erbjuda enligt 12 kap. 1 och 2 §§ hälso- och sjukvårds- lagen (2017:30) eller som har över- låtits till kommunen enligt 14 kap. 1 § i samma lag, ska lämna de upp- gifter som avses i 3 § till registret över administrerade läkemedel.
Om vaccinet ordinerats av hälso- och sjukvårdspersonal hos en annan vårdgivare kan uppgifterna, efter skriftlig överenskommelse därom, i stället lämnas av den vårdgivare där ordinationen gjordes.
Denna förordning träder i kraft den 26 mars 2029 i fråga om 8 kap. 4 a § och i övrigt den 1 december 2026.
2Utredningens uppdrag och arbete
Regeringen beslutade i september 2023 att tillsätta en utredning som ska se över möjligheten att utveckla registret nationell läke- medelslista samt lämna nödvändiga författningsförslag. Utredaren ska bl.a. analysera och ta ställning till om och hur uppgifter om ordi- nation och administrering av sådana läkemedel som patienter får vid behandling inom hälso- och sjukvården, inklusive vacciner, kan läggas till i nationell läkemedelslista, analysera och ta ställning till om upp- gifter om medicintekniska produkter kan läggas till i nationell läke- medelslista och i så fall vilka produkter, analysera och ta ställning till om andra delar av regleringen av nationell läkemedelslista bör justeras samt kartlägga de arbetsprocesser som används inom hälso- och sjuk- vården respektive öppenvårdsapoteken vid ordination och förskriv- ning respektive vid expediering av läkemedel och föreslå hur de kan anpassas till registret nationell läkemedelslista. Uppdraget skulle redovisas senast den 14 februari 2025 (se bilaga 1).
Utredningens sekretariat påbörjade arbetet i november 2023 och regeringen utsåg utredningens expertgrupp samma månad. Utred- ningen fick i december 2024 tilläggsdirektiv där uppdraget utvidgades (se bilaga 2). Utredningen ska därmed även kartlägga behoven av att ha uppgifter om rekvisitionsläkemedel från annan vård än sluten- vården och den specialiserade öppenvården i ett hälsodataregister, analysera vårdgivarnas förutsättningar att lämna uppgifter till ett hälsodataregister och lämna nödvändiga författningsförslag. Sam- tidigt förlängdes utredningstiden till den 15 augusti 2025.
107
Utredningens uppdrag och arbete |
SOU 2025:71 |
2.1Föränderliga omvärldsfaktorer
Utredningens arbete har pågått parallellt med utveckling och in- förande av den nationella läkemedelslistan utifrån nu gällande lag- stiftning. När utredningen påbörjades pågick en diskussion om en säkerhetslösning för att vårdgivare ska kunna ansluta till, och där- med lämna och ta del av uppgifter i registret. Diskussionen kunde stundtals uppfattas som att projektet riskerade att försenas ytter- ligare. Frågan löstes genom pragmatisk samverkan mellan aktörerna. Samtidigt har frågan om huruvida nya och moderna journalsystem anpassade till den nationella läkemedelslistan ska hinna föras in i vården till december 2025 under hela utredningstiden varit aktuell. Efter en hemställan till Socialdepartementet från Sveriges kommuner och regioner under hösten 2024 har en promemoria som föreslår att återigen skjuta delar av införandet på framtiden remitterats. Debatten om huruvida den nationella läkemedelslistan kommer ge de vinster som från början avsågs har fortsatt i bl.a. fackpressen.
Under utredningens arbete har fler och fler system efterhand godkänts för, och anslutits till, den nationella läkemedelslistan i enlighet med den av E-hälsomyndigheten framtagna stegvisa pro- cessen. Däremot har alla de som anslutit ännu inte gjort detta med full funktionalitet. Dessa utmaningar och ständiga förändringar i införandet har stundtals på olika sätt även påverkat vår utrednings arbete. Olika aktörers behov av att belysa problem i den nu pågående implementeringen har tenderat att tränga ut diskussioner om utred- ningens framåtsyftande uppdrag. Samtidigt har det varit en nödvän- dig del i utredningens arbete, dels utifrån betydelsen av att förstå omvärlden och de olika behov och utmaningar som föreligger, dels utifrån utredningens uppdrag att se över hälso- och sjukvårdens och öppenvårdsapotekens arbetsprocesser genom införandet av den nationella läkemedelslistan. Det sistnämnda uppdraget är beroende både av den nationella läkemedelslistan som den är beslutad i dag, och de nya förslag som utredningen lämnar.
Flera parallella utredningar om hälsodata
Utredningen kan konstatera att det parallellt med vår utredning genomförts flera andra utredningar på hälsodataområdet, både av- seende primäranvändning och sekundäranvändning av data. De flesta
SOU 2025:71 |
Utredningens uppdrag och arbete |
av de frågeställningar som utretts går i varandra. Vissa av utredning- arna har under vår utredningstid hunnit lämna sina betänkanden. Utredningen har under arbetet haft dialog med dessa utredningar och efterhand som betänkanden överlämnats justerat och anpassat våra texter. Genom ett öppet klimat inom utredningsväsendet, mellan kommittéerna, har dock de grundläggande idéerna hela tiden kunnat byggas upp parallellt i ett försök att gemensamt bidra till och beskriva en helhet. Utredningen beskriver de närliggande utredningarna när- mare i kapitel 4.
EU-förordningen om det euroepiska hälsodataområdet
Även EU-förordningen om det europeiska hälsodataområdet är av betydelse för utredningens arbete och förslag. Utredningen har inte i sina direktiv ett uttalat uppdrag att se över lagen (2018:1212) om nationell läkemedelslista för att anpassa den till EU-förordningen. När utredningen påbörjade sitt arbete pågick fortfarande förhand- lingar och den slutgiltiga förordningen beslutades först den 21 januari 2025. Det faktum att en för utredningen så central EU-förordning som denna beslutades sent under utredningens arbete, nära inpå det tänkta överlämnandet i februari 2025, och vars innehåll inte var till- gängligt för utredningen har påverkat förutsättningarna för utred- ningens arbete. Utredningsarbetet påverkas i denna del även av att den utredning (S 2024:A) som har i uppdrag att anpassa svensk rätt till EU-förordningen i tiden har arbetat parallellt med vår utredning och ska redovisa sitt arbete efter vår utredning. Se avsnitt 2.4 om vilka avgränsningar utredningen gjort avseende detta. Utredningen har dock så långt möjligt tagit förslagen till den nya EU-förordningen i beaktande i de framåtsyftande diskussioner som förs i betänkandet.
Ett omfattande betänkande
Utredningens arbete har resulterat i ett omfattande betänkande. Detta har flera orsaker. Utredningen har haft i uppdrag att genom- föra vissa justeringar av nuvarande lag. Tillsammans med uppdraget att se över hälso- och sjukvårdens arbetsprocesser efter införandet har detta gjort att utredningen behövt beskriva och analysera läke- medelsprocessen i sin helhet. Alltså inte enbart de delar som om-
Utredningens uppdrag och arbete |
SOU 2025:71 |
fattas av en vidareutveckling av den nationella läkemedelslistan. Vidare har utredningen i den fortsatta utvecklingen av den natio- nella läkemedelslistan undersökt och beskrivit patientens, hälso- och sjukvårdens och öppenvårdsapotekens behov av ytterligare upp- gifter. Samtidigt konstaterar utredningen att vissa av dessa uppgifter kan vara nödvändiga att dela även utifrån krav i EU-förordningen om det europeiska hälsodataområdet. Beroende på vilken ingång man har till frågeställningen kan man därför se dessa behovsanalyser som överflödiga. Utredningens direktiv tar dock sitt avstamp i hälso- och sjukvårdens behov.
Eftersom EU-förordningen inte var vare sig färdigförhandlad eller beslutad när utredningen ursprungliga direktiv beslutades, och ingen justering i denna del gjorts i tilläggsdirektivet, har utredningen försökt förhålla sig till både perspektivet att göra en beskrivning av behoven och en analys i förhållande till EU-förordningen. Detta arbete har också varit viktigt för den gemensamma förståelsen och acceptansen i utredningens expertgrupp. Avslutningsvis ska nämnas att de förslag om en vidare utveckling av registret medfört att en omfattande analys behövt genomföras av den nuvarande lagen där samtliga bestämmelsers tillämplighet på de föreslagna nya informa- tionsmängderna i register behövt övervägas.
Utredningens bedömning är att de texter som inkluderats i be- tänkandet är av olika betydelse för olika aktörer i den fortsatta ut- vecklingen av en nationell infrastruktur för datadelning i samband med läkemedelsbehandlingar. En närmare beskrivning av betänkan- dets struktur och läsanvisning återfinns i avsnitt 2.5.
2.2Utredningens arbetssätt
Utredningen har haft en brett sammansatt expertgrupp med represen- tanter från Regionerna Gävleborg och Västra Götaland, branschorga- nisationerna Sveriges Apoteksförening, Läkemedelsindustriföreningen, fackförbundet Sveriges Farmaceuter, professionsorganisationen Svenska Läkaresällskapet. Region Gävleborg ersattes senare med Sveriges Kommuner och Regioner. Sakkunniga från Regeringskans- liet har ingått i expertgruppen och de statliga myndigheterna har re- presenterats genom E-hälsomyndigheten, Folkhälsomyndigheten, Inspektionen för vård och omsorg, Integritetsskyddsmyndigheten,
SOU 2025:71 |
Utredningens uppdrag och arbete |
Läkemedelsverket, Socialstyrelsen samt Tandvårds- och läkemedels- förmånsverket. I gruppen ingår flera läkare, apotekare och jurister. Utredningen har genomfört sex expertgruppsmöten under utred- ningstiden. Expertgruppsmötena har fokuserat på att diskutera prin- cipiella frågor och lösningsförslag i syfte att få en gemensam förstå- else för utmaningar och acceptans kring lösningar medan konkreta synpunkter på texter inhämtats skriftligt.
Utredningen har genomfört en mängd dialoger. Utredningen har haft bilaterala möten och kontakter med flera av de statliga myn- digheter som deltagit i expertgruppen, särskilt E-hälsomyndigheten, Folkhälsomyndigheten och Socialstyrelsen. Utredningen har även träffat E-hälsomyndighetens styrelse. Utöver myndigheter i expert- gruppen har utredningen fört dialog med Försvarsmakten, Kriminal- vården och Statens institutionsstyrelse.
Utredningen har även fört dialog med representanter för kom- muner och regioner. Utredningen har träffat representanter för nationella samverkansgruppen för strukturerad vårdinformation (numera samverkansgruppen för hälsodata), SUSSA-samverkan, representanter för Sveriges Kommuner och Regioners kansliorga- nisation, SKR:s nätverk för medicinskt ansvariga sjuksköterskor samt nätverket Sveriges läkemedelskommittéer (LOK).
Utredningen har fört dialog med relevanta branschorganisationer såsom Läkemedelsindustriföreningens styrelse, Swedish Medtech, Sveriges Apoteksförening och Vårdföretagarna.
Utredningen har träffat representanter systemleverantörerna Cambio, CGI och CGM CompuGroup Medical, den senare flera gånger eftersom de har flera system på marknaden. Utredningen har även träffat Inera. I vissa leverantörsdialoger har även represen- tanter för regionerna deltagit.
Utredningen har också haft enskilda dialoger med flera av exper- terna i utredningen samt med externa experter som docenten i in- fektionssjukdomar med särskild vaccinexpertis Helena Hervius Askling vid Karolinska institutet.
Utredningen har via Funktionsrätt Sverige bjudit in och haft dia- log med flera patientorganisationer. Under arbetets gång har utred- ningen samrått med flera andra statliga utredningar, bl.a. Utredningen om infrastruktur för hälsodata som nationellt intresse (S 2022:10), Vaccinationsprogramsutredningen (S 2022:13), Utredningen om hälsodataregister (S 2023:02) samt Utredningen om stärkt medi-
Utredningens uppdrag och arbete |
SOU 2025:71 |
cinsk kompetens i kommunal hälso- och sjukvård (S 2023:07). Utredningen har dessutom haft dialog med Samordnaren för en nationell digital infrastruktur i hälso- och sjukvården (S 2023:14) samt Utredaren med uppdrag att möjliggöra en nationell digital infrastruktur för hälsodata (S 2024:A).
Utredningen har deltagit i rundabordssamtal kring den natio- nella läkemedelslistan arrangerade av Läkarförbundet i februari 2024 och har deltagit i programmet kring den nationella läkemedels- listan vid e-hälsomässan Vitalis.
Regeringen utsåg i juni 2024 en ny särskild utredare. Utgångs- punkt för det fortsatta arbetet har varit att bibehålla utredningens arbetssätt.
Utredningen har även haft dialog med allmänläkaren Johannes Saers, apotekschefen Farm Dr Per Öhrngren, professor Tommy Westerlund och forskaren Fil Dr Tora Hammar under utredningens arbete.
2.3Användningen av vissa termer och begrepp
Inom hälso- och sjukvårdsområdet används begrepp som kan ha olika betydelse beroende på sammanhang. Utredningen vill därför här klargöra hur vissa begrepp används i betänkandet.
När utredningen skriver vårdgivare avses i första hand utförare av hälso- och sjukvård enligt hälso- och sjukvårdslagen. När utred- ningen avser ett öppenvårdsapotek används i stället begreppet öppen- vårdsapotek eller bara apotek.
Utredningen omfattar både hälso- och sjukvård och tandvård. Fackspråkligt räknas tandvård som hälso- och sjukvård, men juri- diskt regleras det inte i hälso- och sjukvårdslagen (2017:30) utan i tandvårdslagen (1985:125). När utredningen skriver hälso- och sjukvård i löpande text avses därför även tandvård om inget annat framkommer.
När utredningen använder begreppet hälso- och sjukvårdsper- sonal omfattas personal som är verksam hos vårdgivare enligt vad som anges ovan, dvs. även tandvårdspersonal. För personal på öppen- vårdsapotek har utredningen valt att använda begreppet apoteks- personal eller expedierande personal på öppenvårdsapotek. Med apotekspersonal avses den personal på öppenvårdsapotek som
SOU 2025:71 |
Utredningens uppdrag och arbete |
utgör hälso- och sjukvårdspersonal enligt patientsäkerhetslagen (2010:659) genom att de expedierar läkemedel eller lämnar råd och upplysningar. Begreppet expedierande personal på öppenvårdsapotek används t.ex. i lagen (2009:366) om nationell läkemedelslista.
Utredningen försöker undvika begreppet rekvisitionsläkemedel då det avspeglar ett beställningssätt snarare än en viss typ av läke- medel eller situation. Utredningen använder i stället begreppet läke- medel som administreras eller överlämnas till patienten i hälso- och sjukvården. Begreppet rekvisitionsläkemedel förekommer dock i betänkandet eftersom det tidigare använts i flera rapporter och be- tänkanden och därmed inte helt går att undvika. Begreppet används även i tilläggsdirektivet till utredningen.
Begreppet egenvård uppfattas ibland som problematiskt efter- som det används med två olika betydelser. WHO definierar egen- vård som individers, närståendes och civilsamhällets förmåga att främja och vidmakthålla hälsa, förebygga sjukdom och hantera sjukdom och funktionsnedsättningar med eller utan stöd av hälso- och sjukvårds- personal. I lagen (2022:1250) om egenvård avses en hälso- och sjuk- vårdsåtgärd som behandlande hälso- och sjukvårdspersonal har bedömt att en patient kan utföra själv eller med hjälp av någon annan. Egen- vård är också ett begrepp som används på öppenvårdsapotek i sam- band med rådgivning och försäljning av receptfria läkemedel.1 Vad begreppet avser måste därför alltid utläsas av den kontext där det begreppet används.
Utredningen har valt att använda begreppet vårdinformations- system i stället för journalsystem eftersom de flesta vårdgivare i dag använder it-stöd som innehåller många olika typer av funktionalitet, inte bara sådan som stödjer förandet av patientjournal. Exempel på en sådan stödtjänst är tidsbokning.
I vissa sammanhang använder utredningen begreppet konsumtion i förhållande till information. Utredningen syftar då på tjänstekon- sumtion där konsumenter eller företag använder tjänster för att upp- fylla specifika behov eller uppnå önskade resultat. Det innebär en handling och att aktivt engagera och använda de tjänster som erbjuds av tjänsteleverantörer.
1Se 2 kap. 6 § 11 lagen (2009:366) om handel med läkemedel.
Utredningens uppdrag och arbete |
SOU 2025:71 |
2.4Avgränsningar
Som angetts ovan har samtidigt som arbetet med vårt uppdrag fortgått EU-förordningen om det europeiska hälsodataområdet förhandlats och slutligen trätt i kraft den 26 mars 2025.2 EU-för- ordningen reglerar bl.a. delning och tillgång till elektroniska hälso- data för primäranvändning varför den har direkt påverkan på det område som också lagen (2018:1212) om nationell läkemedelslista reglerar. Utredningen har i sina direktiv inte något uttalat uppdrag att se över och anpassa lagen om nationell läkemedelslista utifrån den nya EU-förordningen. Regeringskansliet har utsett en särskild utredare att biträda Socialdepartementet med att möjliggöra en natio- nell digital infrastruktur för hälsodata, S 2024:A, som den 3 juli 2024 även fick i uppdrag att bl.a. lämna nödvändiga och lämpliga författningsändringar för att anpassa svensk rätt till EU-förord- ningen om det europeiska hälsodataområdet (S2024/01340).3 Upp- draget omfattar att föreslå nödvändiga anpassningar av bl.a. lagen om nationell läkemedelslista, patientdatalagen (2008:355) och lagen (2022:913) om sammanhållen vård- och omsorgsdokumentation.
De ställningstaganden som kommer att göras inom ramen för Uppdrag att möjliggöra en nationell digital infrastruktur för hälso- data, S 2024:A med dess tilläggsuppdrag, kommer därigenom att påverka även den lagstiftning som vår utredning ska se över och vidareutveckla. Lagen om nationell läkemedelslista utgör bara en del av den lagstiftning som behöver anpassas till EU-förordningen om det europeiska hälsodataområdet. Det är enligt utredningens bedömning därför inte ändamålsenligt att i våra förslag göra sådana anpassningar. Dels skulle det innebära att vi föregår den totalöver- syn av behov av anpassning av nationell rätt till EU-förordningen som S 2024:A utför, dels riskerar utredningarna att komma till skilda slutsatser om hur anpassningen bör göras i de delar där uppdragen överlappar varandra utifrån hur utredningarnas olika uppdrag är for- mulerade. Vi har därför avgränsat vår utrednings översyn i detta av- seende och utgår i våra förslag från gällande nationell rätt som den är utformad innan EU-förordningen börjar tillämpas. De anpass- ningar av lagen som utredningen S 2024:A finner är nödvändiga kom-
2Förordningen (EU) 2025/327 om det europeiska hälsodataområdet.
3Uppdrag att möjliggöra en nationell digital infrastruktur för hälsodata, S 2024:A.
SOU 2025:71 |
Utredningens uppdrag och arbete |
mer därför i tillämpliga delar att få betydelse även för förslag som lämnas i detta betänkande.
Under utredningens arbete har det också framkommit flera olika behov och förslag från framförallt statliga myndigheter angående sekundäranvändning av uppgifter som endera redan finns i den natio- nella läkemedelslistan eller bland de uppgifter som utredningen före- slår ska läggas till. Sådana behov beskrivs t.ex. i avsnitt 4.3.4–4.3.6 samt 9.4.4.
Utredningen har, utifrån det första direktivet, fokuserat på att analysera och lämna förslag om att tillgängliggöra uppgifter för patientens vård, dvs. för primäranvändning. Utredningen är med- veten om betydelsen av att kunna få tillgång till hälsodata för olika sekundäranvändningsändamål men har bl.a. av tidsskäl inte kunnat analysera dessa frågor på djupet. Utredningen har dock tagit med beskrivningarna av behoven för att de ska kunna ligga till grund för eventuella framtida uppdrag. Innan den nationella läkemedelslistan eller de nya uppgifter utredningen föreslår ska samlas i register till- gängliggörs för sekundäranvändning behöver det också analyseras om uppgifterna ska hämtas ur dessa register eller om de finns, eller kan göras tillgängliga, via andra register som har sekundäranvänd- ning som ändamål och att behoven därmed kan lösas på ett mindre ingripande sätt.
Det finns redan i dag vissa ändamål för sekundäranvändning av uppgifter i den nationella läkemedelslistan. Dessa finns av historiska skäl och överfördes från dåvarande receptregistret och läkemedels- förteckningen när lagen skapades.4 Utredningen har inte haft i upp- drag att se över dessa bestämmelser och inte heller funnit andra skäl att göra det. I och med det tilläggsuppdrag som utredningen fått ut- vidgas frågeställningarna till att även omfatta viss sekundäranvänd- ning av hälsodata. Utredningen knyter i dessa delar an till vad som i övrigt framkommit när så är möjligt.
Utredningens uppdrag är begränsat till att se över hur man kan samla och dela uppgifter inom hälso- och sjukvården varför t.ex. de möjligheter att, med stöd av lagen om sammanhållen vård- och omsorgsdokumentation, att även dela omsorgsdokumentation inte kommer att beaktas i betänkandet.
4Se prop. 2017/18:223 Nationell läkemedelslista, s. 225 f.
Utredningens uppdrag och arbete |
SOU 2025:71 |
2.5Betänkandets struktur
Betänkandet inleds med en beskrivning av gällande rätt (kap. 3). Därefter följer ett bakgrundskapitel som beskriver nuläget för den nationella läkemedelslistan, de utmaningar som identifierats och andra utredningar som slutförts eller fortfarande pågår och som har betydelse för utredningens arbete (kap. 4). Kapitel 5 beskriver pro- cesserna kring när ett läkemedel eller en medicinteknisk produkt behövs i samband med patientens vård. Kapitel 6 beskriver de behov av uppgifter kring behandling med läkemedel och medicintekniska produkter som patienter, hälso- och sjukvårdspersonal samt apoteks- personal kan ha. Därefter följer ett kapitel som beskriver hur upp- gifter om behandling med läkemedel eller medicintekniska produkter kan tillgängliggöras genom register eller federerade lösningar (kap. 7). I kapitel 8 redogör sedan utredningen för en nationell infrastruktur för information om en patients behandling med läkemedel eller medicintekniska produkter och hur vi menar att uppgifter bör delas och med vem. I kapitel 9 redogör utredningen särskilt för behoven av uppgifter kopplade till vaccinationer.
Utredningens uppdrag att se över och föreslå ändringar i nuva- rande bestämmelser i lagen (2018:1212) om nationell läkemedels- lista och lagen (2002:160) om läkemedelsförmåner m.m. samt sär- skilt analysera spärrhantering redovisas i kapitel 10. I kapitel 11, 12 och 13 redogör utredningen för sina förslag att samla ytterligare uppgifter i register. Hur utredningens förslag påverkar offentlighets- och sekretesslagstiftningen redovisas i kapitel 14.Utifrån de utma- ningar, behov, nuvarande arbetsprocesser samt nya förslag som redovisats i betänkandet beskriver utredningen i kapitel 15 de behov av gemensamt arbete som behövs för att utveckla arbetsprocesserna framöver. I kapitel 16 redovisas utredningens integritetsanalys. Kapi- tel 17 avhandlar de frågeställningar som utredningen fått i tilläggs- direktivet och knyter när så är lämpligt an till övriga kapitel. I kapi- tel 18 redovisas utredningens samlade konsekvensanalys.
3 Gällande rätt
I detta kapitel redogör utredningen översiktligt för rättsakter och lagstiftning som är relevanta för vad som avhandlas i betänkandet. Lagen (2018:1212) om nationell läkemedelslista redovisas mer ut- förligt i avsnitt 3.5.
3.1Skyddet för enskildas personliga integritet
I avsnittet ges en överblick över ett urval av rättsgrundsatser, konven- tioner, EU-rättsakter, grundlag och andra författningar som reglerar skydd för enskildas personliga integritet och personuppgifter. Sär- skilt i redovisningen av nationell lagstiftning är den begränsad till i huvudsak lagar som har särskild betydelse för hälso- och sjukvårds- området.
3.1.1FN:s förklaring om de mänskliga rättigheterna
Förenta nationerna antog 1948 den allmänna förklaringen om de män- skliga rättigheterna. Den allmänna förklaringen består av 30 artiklar som gemensamt uttrycker de grundläggande och universella fri- och rättigheterna. Förklaringen är inte formellt bindande för medlems- länderna, men ses som ett uttryck för sedvanerättsliga regler. Skyddet för den personliga integriteten behandlas i artikel 12 som anger att ingen får utsättas för godtyckligt ingripande i fråga om privatliv, familj, hem eller korrespondens och inte heller för angrepp på sin heder eller sitt anseende, samt att var och en har rätt till lagens skydd mot sådana ingripanden och angrepp. I förklaringens artikel 29.2 anges att en person endast får underkastas sådana inskränkningar som har fastställts i lag och enbart i syfte att trygga tillbörlig hänsyn till och respekt för andras rättigheter och friheter samt för att till-
117
Gällande rätt |
SOU 2025:71 |
godose ett demokratiskt samhälles berättigade krav på moral, all- män ordning och allmän välfärd.
3.1.2Europakonventionen
Den europeiska konventionen om skydd för de mänskliga rättighet- erna och de grundläggande friheterna (Europakonventionen) skyddar rätten till privat- och familjeliv. Konventionen är sedan den 1 januari 1995 inkorporerad i svensk rätt och gäller som lag. Av artikel 8 i Europakonventionen framgår att var och en har rätt till respekt för sitt privat- och familjeliv, sitt hem och sin korrespondens. Med detta avses bland annat skyddet av personuppgifter. Enligt artikeln får en offentlig myndighet inte inskränka åtnjutande av denna rättighet annat än med stöd av lag och om det i ett demokratiskt samhälle är nödvändigt med hänsyn till statens säkerhet, den allmänna säkerheten, landets ekonomiska välstånd eller till förebyggande av oordning eller brott eller till skydd för hälsa eller moral eller för andra personers fri- och rättigheter. Enligt 2 kap. 19 § regeringsformen får lag eller annan föreskrift inte meddelas i strid med Sveriges åtaganden på grund av konventionen.
3.1.3Dataskyddskonventionen
Europarådets ministerkommitté antog 1980 en konvention (nr 108) till skydd för enskilda vid automatisk databehandling av person- uppgifter (dataskyddskonventionen). Sverige anslöt sig till data- skyddskonventionen före EU-medlemskapet. Övriga EU-medlems- länder är anslutna. Konventionens syfte är att säkerställa respekten för grundläggande fri- och rättigheter, särskilt den enskildes rätt till personlig integritet i samband med automatiserad behandling av per- sonuppgifter. Dess innehåll kan ses som en precisering av skyddet för den personliga integriteten som följer av artikel 8 i Europakon- ventionen. Konventionen tillämpas på behandling av personuppgifter i automatiserade personregister och automatiserad personuppgifts- behandling i allmän och enskild verksamhet, men inte för enskilds rent privata verksamhet. Europarådets utrikesministermöte antog i maj 2018 ändringsprotokoll 108 som syftar till att modernisera och uppdatera konventionens integritetsskydd.
SOU 2025:71 |
Gällande rätt |
Dataskyddskonventionen innehåller principer för dataskydd som de konventionsanslutna länderna måste iaktta i sin nationella lag- stiftning.
3.1.4EU-stadgan om de grundläggande fri- och rättigheterna
Den Europeiska unionens stadga om de grundläggande rättigheterna (nedan stadgan) tillkännagavs år 2000 och blev rättsligt bindande år 2009. Stadgan är tillämplig på alla åtgärder som EU-institutionerna vidtar och medlemsstaterna ska följa stadgan när de tillämpar unions- rätten. Enligt artikel 7 har var och en rätt till respekt för sitt privat- liv och familjeliv, sin bostad och sina kommunikationer. Enligt arti- kel 8 har var och en rätt till skydd av de personuppgifter som rör honom eller henne. Dessa uppgifter ska behandlas lagenligt för be- stämda ändamål och på grundval av den berörda personens samtycke eller någon annan legitim och lagenlig grund. Var och en har rätt att få tillgång till insamlade uppgifter som rör honom eller henne och att få rättelse av dem.
3.1.5EU:s dataskyddsförordning
Den 27 april 2016 antogs EU:s dataskyddsförordning1. Ett av syf- tena med dataskyddsförordningen är att skydda enskildas grund- läggande rättigheter och friheter, särskilt deras rätt till skydd av per- sonuppgifter. Det huvudsakliga syftet med dataskyddsförordningen är att ytterligare harmonisera och effektivisera skyddet för person- uppgifter för att förbättra den inre marknadens funktion och öka en- skildas kontroll över sina personuppgifter. Dataskyddsförordningen är direkt tillämplig i alla medlemsländer och ersatte från och med den 25 maj 2018 Europaparlamentets och rådets direktiv 95/46/EG av den 24 oktober 1995 om skydd för enskilda personer med avseende på behandling av personuppgifter och om det fria flödet av sådana uppgifter (dataskyddsdirektivet). Även om dataskyddsförordningen är direkt tillämplig både möjliggör och förutsätter förordningen kom- pletterande nationella bestämmelser av olika slag. Dataskyddsförord-
1Europaparlamentets och rådets förordning (EU) 2016/679 av den 27 april 2016 om skydd för fysiska personer med avseende på behandling av personuppgifter och om det fria flödet av sådana uppgifter och om upphävande av direktiv 95/46/EG (allmän dataskyddsförordning).
Gällande rätt |
SOU 2025:71 |
ningen baseras till stor del på dataskyddsdirektivets struktur och innehåll men det har även tillkommit några nyheter såsom en ut- ökad informationsskyldighet, administrativa sanktionsavgifter och inrättandet av Europeiska dataskyddsstyrelsen.
Dataskyddsförordningen är tillämplig på all helt eller delvis auto- matiserad behandling av personuppgifter och på manuell behandling av personuppgifter, om uppgifterna ingår i eller kommer att ingå i ett register. Vissa behandlingar av personuppgifter är uttryckligen undantagna från tillämpningsområdet. Dataskyddsförordningen ska inte tillämpas på behandlingar som utförs av en fysisk person och som är av rent privat natur. Detsamma gäller behandlingar som sker inom verksamhet som inte omfattas av EU-rätten, behandling som sker inom EU:s gemensamma utrikes- och säkerhetspolitik och be- handling som sker inom brottsbekämpande verksamhet, artikel 2.
För att dataskyddsförordningen ska vara tillämplig krävs att de personuppgiftsansvariga är etablerade inom EES, att de behandlar personuppgifter i samband med att de erbjuder varor och tjänster till personer i det området eller behandlar personuppgifter i samband med övervakning av människors beteende inom EES, artikel 3.
Enligt artikel 4.7 är en personuppgiftsansansvarig en fysisk eller juridisk person, offentlig myndighet, institution eller annat organ som ensamt eller tillsammans med andra bestämmer ändamålen och med- len för behandlingen av personuppgifter. Om ändamålen och med- len för behandlingen bestäms av unionsrätten eller medlemsstaternas nationella rätt kan den personuppgiftsansvarige eller de särskilda kriterierna för hur denne ska utses föreskrivas i unionsrätten eller i medlemsstaternas nationella rätt.
Av artikel 5 följer ett antal grundläggande principer som gäller vid all behandling av personuppgifter. Dessa principer utgör ett ramverk för hur personuppgifter får behandlas. För det första ska uppgifterna behandlas på ett lagligt, korrekt och öppet sätt i förhål- lande till den enskilde. Uppgifterna ska vidare samlas in för särskilda, uttryckligt angivna och berättigade ändamål och inte senare behandlas på ett sätt som är oförenligt med dessa ändamål. Uppgifterna ska också vara adekvata, relevanta och inte för omfattande i förhållande till de ändamål för vilka de behandlas. Uppgifterna ska dessutom vara riktiga och om nödvändigt uppdaterade. Alla rimliga åtgärder måste vidtas för att säkerställa att personuppgifter som är felaktiga i förhål- lande till de ändamål för vilka de behandlas raderas eller rättas utan
SOU 2025:71 |
Gällande rätt |
dröjsmål. Personuppgifter får inte förvaras i en form som möjliggör identifiering av den registrerade under en längre tid än vad som är nödvändigt för de ändamål för vilka uppgifterna behandlas. Slutligen ska uppgifterna behandlas på ett sätt som säkerställer lämplig säkerhet för personuppgifterna, inbegripet skydd mot obehörig eller otillåten behandling och mot förlust, förstöring eller skada genom olyckshän- delse, med användning av lämpliga tekniska eller organisatoriska åt- gärder.
Av artikel 5.2 följer att det är den personuppgiftsansvarige som ansvarar för och ska kunna visa att de grundläggande principerna efterlevs (ansvarsskyldighet). Som ett led i den personuppgifts- ansvariges ansvarsskyldighet ska denna bland annat genomföra en konsekvensbedömning avseende dataskydd, artikel 35. Det är en skyldighet för den personuppgiftsansvarige att göra en konsekvens- bedömning före en behandling av personuppgifter som sannolikt leder till en hög risk för fysiska personers rättigheter och friheter. Konsekvensbedömning avseende dataskydd är ett verktyg för att säkerställa att den personuppgiftsansvarige följer dataskyddsför- ordningen.
För att det ska vara tillåtet att behandla personuppgifter krävs det att behandlingen stödjer sig på någon av de rättsliga grunderna i artikel 6 i dataskyddsförordningen. Bestämmelsen är uttömmande och om inte någon av de uppräknade rättsliga grunderna är tillämpliga är det inte tillåtet att behandla personuppgifter. Ett sådant villkor är att den enskilde har lämnat sitt samtycke till att personuppgif- terna behandlas, artikel 6.1 a. Behandling kan också ske om den är nödvändig för att fullgöra ett avtal, artikel 6.1 b eller nödvändig för att fullgöra en rättslig förpliktelse, artikel 6.1 c, för att skydda intres- sen som är av grundläggande betydelse för en fysiskperson, arti- kel 6.1 d, för att utföra en uppgift av allmänt intresse eller som ett led i myndighetsutövning, artikel 6.1 e. Personuppgifter kan slut- ligen behandlas med stöd av en intresseavvägning, artikel 6.1 f.
Av artikel 6.3 dataskyddsförordningen följer att grunden för den personuppgiftsbehandling som är nödvändig för att den personupp- giftsansvarige ska kunna uppfylla en rättslig förpliktelse (artikel 6.1 c) eller en uppgift för allmänt intresse eller som ett led i myndighets- utövning (artikel 6.1 e) måste fastställas i nationell rätt eller EU-rätt. Det innebär att det inte är möjligt att endast stödja sig på den gene- rella regleringen i dataskyddsförordningen vid sådan behandling.
Gällande rätt |
SOU 2025:71 |
Vidare framgår av artikel 6.3 andra stycket att syftet med behand- lingen, då denna grundar sig på en rättslig förpliktelse, ska fastställas i den rättsliga grunden och i fråga om behandling vara nödvändigt för att utföra en uppgift av allmänt intresse eller som ett led i den personuppgiftsansvariges myndighetsutövning (artikel 6.1 e).
Det finns också möjlighet att i nationell rätt mer detaljerat reglera olika krav på sådan behandling av personuppgifter som är nödvändig för att den personuppgiftsansvarige ska kunna uppfylla en rättslig skyldighet eller utföra en arbetsuppgift av allmänt intresse eller som ett led i myndighetsutövning, artikel 6.2. I artikel 6.3 anges dessutom att den rättsliga grunden kan innehålla särskilda bestämmelser för att anpassa tillämpningen av dataskyddsförordningen, bl.a. de all- männa villkor som ska gälla för den personuppgiftsansvariges be- handling, vilken typ av uppgifter som ska behandlas, vilka registrerade som berörs, de enheter till vilka personuppgifterna får lämnas ut och för vilka ändamål, ändamålsbegränsningar, lagringstid samt typer av behandling och förfaranden för behandling, inbegripet åtgärder för att tillförsäkra en laglig och rättvis behandling. Den författning eller det beslut som utgör den rättsliga grunden för behandling av per- sonuppgifter enligt förordningen måste uppfylla ett mål av allmänt intresse och vara proportionell mot det legitima mål som eftersträvas.
Behandling av känsliga personuppgifter, i dataskyddsförordningen benämnda särskilda kategorier av person- uppgifter, är som huvudregel förbjuden, se artikel 9.1. Huvudregeln kompletteras med ett antal undantag i artikel 9.2 som anger när be- handling av känsliga personuppgifter är tillåten. Ett av undantagen är om den registrerade uttryckligen har samtyckt till behandlingen, arti- kel 9.2 a. Ett annat undantag avser behandling av känsliga personupp- gifter som är nödvändig för skäl som hör samman med förebyggande hälso- och sjukvård, yrkesmedicin och social omsorg, på grundval av EU-rätten eller medlemsländernas nationella rätt, under förutsättning att uppgifterna behandlas av eller under ansvar av en yrkesutövare som omfattas av tystnadsplikt, artikel 9.2 h och 9.3.
Dataskyddsförordningen innehåller även ett antal rättigheter för de enskilda vars personuppgifter behandlas (de registrerade). Den registrerade har bland annat rätt att göra invändningar mot person- uppgiftsbehandling avseende honom eller henne som utförs på vissa rättsliga grunder, artikel 21.1. Dessa rättigheter kan begränsas under vissa förutsättningar, artikel 23.1.
SOU 2025:71 |
Gällande rätt |
3.1.6EU-förordningen om det europeiska hälsodataområdet
Under utredningens gång har en EU-förordning om det europeiska hälsodataområdet beslutats.2 Förordningen trädde i kraft den 26 mars 2025. Genom EU-förordningen inrättas det europeiska hälsodata- området genom fastställande av gemensamma regler, standarder och infrastrukturer och en styrningsram i syfte att underlätta tillgången till elektroniska hälsodata för primäranvändning av elektroniska hälso- data och sekundäranvändning av dessa data.3 EU-förordningen syf- tar till att förbättra enskilda personers tillgång till och kontroll över sina personliga e-hälsodata och samtidigt göra det möjligt att åter- använda vissa data för allmänintresset, politiskt stöd och vetenskap- liga forskningsändamål. Syftet med det europeiska hälsodataområdet är att underlätta tillgång till och utbyte av hälsodata över gränserna, både för att stödja tillhandahållande av hälso- och sjukvård, s.k. pri- märanvändning av data, och ligga till grund för forskning och besluts- fattande på hälsoområdet, dvs. återanvändning av data, även kallad sekundäranvändning av data.
EU-förordningen specificerar och kompletterar fysiska personers rättigheter som fastställs i EU:s dataskyddsförordning när det gäller primäranvändning och sekundäranvändning av deras elektroniska hälsodata med personuppgifter. Där fastställs också gemensamma regler för elektroniska hälsodokumentationssystem när det gäller två obligatoriska harmoniserade programvarukomponenter, den europeiska programvarukomponenten för interoperabilitet och den europeiska programvarukomponenten för loggning när det gäller primäranvändning av elektroniska hälsodata. Vidare fastställs gemen- samma regler och mekanismer för primäranvändning och sekundär- användning av elektroniska hälsodata och inrättas en gränsöverskri- dande infrastruktur som möjliggör primäranvändning av elektroniska hälsodata med personuppgifter i hela unionen. Det inrättas också en gränsöverskridande infrastruktur för sekundäranvändning av elek- troniska hälsodata samt fastställs styrnings- och samordningsmeka- nismer på unionsnivå och nationell nivå.4
2Europaparlamentets och rådets förordning (EU) 2025/327 om det europeiska hälsodata- området och om ändring av direktiv 2011/24/EU och förordning (EU) 2024/2847.
3Artikel 1.1 förordningen (EU) 2025/327 om det europeiska hälsodataområdet.
4Artikel 1.2 förordningen (EU) 2025/327 om det europeiska hälsodataområdet.
Gällande rätt |
SOU 2025:71 |
Nedan redovisas de för utredningen mest relevanta artiklarna avseende primäranvändning i EU-förordningen om det europeiska hälsodataområdet, nedan EU-förordningen.
I artikel 14.1 fastslås ett antal prioriterade kategorier av elektro- niska hälsodata med personuppgifter för primäranvändning. Dessa uppgifter ska delas med patienten och vårdgivare i enlighet med vad som anges i förordningen.5 Sådana prioriterade hälsodata utgörs av bl.a. patientöversikter som ska innehålla information om vaccina- tioner, medicintekniska produkter och implantat, aktuella och rele- vanta tidigare läkemedel m.m.6
Av artikel 3.1 följer att fysiska personer ska ha rätt att få tillgång till åtminstone elektroniska hälsodata med personuppgifter som avser dem och som tillhör de prioriterade kategorier som avses i artikel 14 och behandlas för tillhandahållande av hälso- och sjukvård genom de tjänster för tillgång till elektroniska hälsodata som avses i förord- ningens artikel 4. Tillgång ska ges, i enlighet med vad som är tekniskt genomförbart, omedelbart efter det att dessa personliga elektroniska hälsodata har registrerats i ett elektroniskt hälsodokumentations- system, kostnadsfritt och i en lättläst, konsoliderad och tillgänglig form.
Enligt artikel 3.2 ska fysiska personer, eller dennes företrädare enligt artikel 4.2, ha rätt att kostnadsfritt ladda ned en elektronisk kopia av åtminstone sina elektroniska hälsodata med personuppgifter i de prioriterade kategorier som avses i artikel 14 avseende dessa fys- iska personer, genom de tjänster för tillgång till elektroniska hälso- data som avses i artikel 4, i det europeiska formatet för utbyte av elektronisk hälsodokumentation.
Enligt artikel 3.3. får medlemsstaterna, i enlighet med artikel 23 i EU:s dataskyddsförordning, begränsa tillämpningsområdet för de rättigheter som föreskrivs i artikel 3.1 och 3.2 EU-förordningen, särskilt när dessa begränsningar är nödvändiga för att skydda fys- iska personer, baserat på patientsäkerhetsöverväganden och etiska överväganden, genom att fördröja tillgång till deras elektroniska hälsodata med personuppgifter under en begränsad tidsperiod till dess att hälso- och sjukvårdspersonal har möjlighet att på ett korrekt sätt kommunicera till och förklara för de berörda personerna infor- mation som kan ha betydande inverkan på deras hälsa.
5Se bl.a. artikel 4 och 12 förordningen (EU) 2025/327 om det europeiska hälsodataområdet.
6Artikel 14.1 och bilaga I till förordningen (EU) 2025/327 om det europeiska hälsodataområdet.
SOU 2025:71 |
Gällande rätt |
I artikel 4.2 EU-förordningen anges att medlemsstaterna ska säker- ställa att det inom ramen för tjänsterna för tillgång till elektroniska hälsodata inrättas en eller flera fullmaktstjänster och som gör det möjligt
a)för fysiska personer att ge andra fysiska personer som de själva väljer tillstånd att få tillgång till deras elektroniska hälsodata med personuppgifter, eller delar av dem, för deras räkning under en begränsad eller obegränsad period och vid behov, endast för ett särskilt ändamål, samt att förvalta dessa tillstånd, och
b)för rättsliga företrädare för fysiska personer att få tillgång till elektroniska hälsodata med personuppgifter för de fysiska per- soner vars angelägenheter de har hand om, i enlighet med natio- nell rätt.
Medlemsstaterna ska fastställa regler för de tillstånd som avses i a) och för åtgärder som vidtas av förmyndare och andra rättsliga före- trädare.
Enligt artikel 4.1 ska medlemsstaterna säkerställa att en eller flera tjänster för tillgång till elektroniska hälsodata inrättas på nationell, regional eller lokal nivå och därigenom göra det möjligt för fysiska personer att få tillgång till sina elektroniska hälsodata med person- uppgifter och utöva sina rättigheter enligt artiklarna 3 och 5–10.
Sådana tjänster för tillgång till elektroniska hälsodata ska vara kost- nadsfria för de fysiska personerna och deras företrädare som avses i artikel 4.2.
Enligt artikel 5 ska fysiska personer, eller deras företrädare, ha rätt att föra in information i dessa fysiska personers elektroniska hälsodokumentation genom tjänster för tillgång till elektroniska hälsodata eller applikationer kopplade till dessa tjänster. Det ska tydligt framgå att informationen har förts in av den fysiska personen eller av dennes företrädare. Fysiska personer eller deras företrädare ska inte ha möjlighet att direkt ändra elektroniska hälsodata och till- hörande information som förts in av hälso- och sjukvårdspersonal.
Enligt artikel 6 ska fysiska personer enkelt kunna begära rättelse online i enlighet med artikel 16 i EU:s dataskyddsförordning. Med- lemsstaterna får också göra det möjligt för fysiska personer att online utöva andra rättigheter enligt kapitel III i EU:s dataskyddsförord- ning via tjänster för tillgång till elektroniska hälsodata.
Gällande rätt |
SOU 2025:71 |
I artikel 7.1 EU-förordningen anges att fysiska personer ska ha rätt att ge en annan vårdgivare som de själva väljer tillgång till alla eller delar av sina elektroniska hälsodata med personuppgifter, eller att begära att en vårdgivare överför dessa data till denna andra vårdgivare, omedelbart och kostnadsfritt och utan att detta hindras av vård- givaren eller tillverkarna av de system som den vårdgivaren använder.
Enligt artikel 8 ska fysiska personer ha rätt att begränsa tillgången för hälso- och sjukvårdspersonal och vårdgivare till alla eller delar av sina elektroniska hälsodata med personuppgifter enligt artikel 3 EU-förordningen. När de utövar den rätten ska fysiska personer göras medvetna om att en begränsning av tillgången kan påverka tillhandahållandet av hälso- och sjukvård till dem. Det faktum att en fysisk person har begränsat tillgången ska inte vara synligt för vårdgivare. Medlemsstaterna ska fastställa regler och särskilda skydds- åtgärder för sådana begränsningsmekanismer.
Av artikel 9 framgår bl.a. att fysiska personer ska ha rätt att få information, inbegripet genom automatiska meddelanden, om all tillgång som ges till deras elektroniska hälsodata med personupp- gifter genom tjänsten för tillgång för hälso- och sjukvårdspersonal i samband med hälso- och sjukvård. Informationen ska tillhandahållas kostnadsfritt och utan dröjsmål genom tjänster för tillgång till elek- troniska hälsodata och vara tillgänglig åtminstone tre år efter varje datum för åtkomst till dessa data. Medlemsstaterna får av vissa i artikeln angivna skäl införa begränsningar i detta.
Enligt artikel 10 får medlemsstater införa en möjlighet för en fy- sisk person att för primäranvändning motsätta sig tillgång till sina elektroniska hälsodata med personuppgifter som registrerats i ett elektroniskt hälsodokumentationssystem via de tjänster för tillgång till elektroniska hälsodata som regleras i EU-förordningen, dvs. en möjlighet till s.k. opt-out.
Vad gäller hälso- och sjukvårdens tillgång till patientens elektro- niska hälsodata med personuppgifter för primäranvändning anges i artikel 11 att hälso- och sjukvårdspersonal, när de behandlar data i elektroniskt format, ska ha tillgång till relevanta och nödvändiga elektroniska hälsodata med personuppgifter för fysiska personer som står under deras behandling, genom de tjänster för tillgång för hälso- och sjukvårdspersonal som avses i artikel 12, oavsett försäkringsmed- lemsstat och behandlande medlemsstat. Tillgången till uppgifter ska
SOU 2025:71 |
Gällande rätt |
åtminstone inbegripa de prioriterade kategorier av elektroniska hälso- data med personuppgifter som avses i artikel 14.
Av artikel 12 följer att vid tillhandahållande av hälso- och sjukvård ska medlemsstaterna säkerställa att hälso- och sjukvårdspersonal kostnadsfritt kan få tillgång till de prioriterade kategorier av elek- troniska hälsodata med personuppgifter som avses i artikel 14, inklu- sive för gränsöverskridande hälso- och sjukvård, genom tjänster för tillgång för hälso- och sjukvårdspersonal. Tjänsterna ska bara vara tillgängliga för hälso- och sjukvårdspersonal som innehar medel för elektronisk identifiering enligt vad som närmare anges i EU-förord- ningen. Elektroniska hälsodata med personuppgifter ska presenteras på ett användarvänligt sätt i den elektroniska hälsodokumentationen så att hälso- och sjukvårdspersonal enkelt kan använda dem.
Det anges vidare i artikel 11 att i enlighet med de principer som anges i artikel 5 i EU:s dataskyddsförordning7 ska medlemsstaterna fastställa regler för de kategorier av elektroniska hälsodata med per- sonuppgifter som ska vara tillgängliga för olika kategorier av hälso- och sjukvårdspersonal eller olika hälso- eller sjukvårdsuppdrag. Sådana regler ska ta hänsyn till möjligheten för patienten att införa spärrar. Det anges att genom undantag från artikel 8 första stycket EU-för- ordningen (om spärrar på patientens begäran) får vårdgivaren eller hälso- och sjukvårdpersonalen beviljas åtkomst till de elektroniska hälsodata som är föremål för begränsning, om det är nödvändigt för att skydda den registrerades grundläggande intressen. Sådana fall ska loggas i ett tydligt och begripligt format och ska vara lättillgängliga för den registrerade. Medlemsstaterna får föreskriva ytterligare skyddsåtgärder.
Enligt artikel 13 ska medlemsstaterna, när elektroniska hälsodata behandlas för tillhandahållande av hälso- och sjukvård, säkerställa att vårdgivare registrerar relevanta elektroniska hälsodata med per- sonuppgifter som helt eller delvis omfattas av åtminstone de prio- riterade kategorier av elektroniska hälsodata som avses i artikel 14 i elektroniskt format i ett elektroniskt hälsodokumentationssystem. När vårdgivare behandlar data i elektroniskt format ska de säker- ställa att elektroniska hälsodata med personuppgifter för de fysiska personer som står under deras behandling uppdateras med informa-
7I artikel 5 EU:s dataskyddsförordning anges principer för behandling av personuppgifter, bl.a. principerna om laglighet, korrekthet och öppenhet, uppgiftsminimering, riktighet och integritet och konfidentialitet.
Gällande rätt |
SOU 2025:71 |
tion om hälso- och sjukvården. När sådana hälsodata registreras eller uppdateras ska elektronisk hälsodokumentation identifiera den hälso- och sjukvårdspersonal och den vårdgivare som utförde en sådan registrering eller uppdatering, samt den tidpunkt då regi- streringen eller uppdateringen skedde. Medlemsstaterna får kräva att andra aspekter av dataregistreringen ska registreras.
Enligt artikel 25 ska elektroniska hälsodokumentationssystem innehålla en europeisk programvarukomponent för interoperabilitet för elektroniska hälsodokumentationssystem och en europeisk pro- gramvarukomponent för loggning för elektroniska hälsodokumen- tationssystem.
I artikel 30 anges ett antal skyldigheter för tillverkare av elektro- niska hälsodokumentationssystem. Tillverkare ska bl.a. utarbeta EU-försäkran om överensstämmelse, artikel 30.1.e. Av artikel 39.5 EU-förordningen framgår att genom upprättande av EU-försäkran om överensstämmelse ska tillverkaren ta ansvar för att de harmoni- serade programvarukomponenterna för det elektroniska hälsodoku- mentationssystemet uppfyller de krav som fastställs i förordningen när det släpps ut på marknaden eller tas i bruk. Enligt artikel 49 ska kommissionen upprätta och upprätthålla en offentligt tillgänglig EU- databas bl.a. med uppgifter om elektroniska hälsodokumentations- system för vilka en EU-försäkran om överensstämmelse har utfärdats enligt artikel 39 (EU-databas för registrering av elektroniska hälso- dokumentationssystem och hälsoapplikationer). Det uppställs även krav på importörer och distributörer av sådana system (se bl.a. arti- kel 32–34). Enligt artikel 34 ska under i artikeln angivna förutsätt- ningar även vissa krav gälla för den som använder ett elektroniskt hälsodokumentationssystem.
Senast den 26 mars 2027 ska kommissionen genom genomförande- akter fastställa de tekniska specifikationerna för de prioriterade kate- gorier av elektroniska hälsodata med personuppgifter som avses i artikel 14.1 och ange det europeiska format för utbyte av elektronisk hälsodokumentation som ska användas. Ett sådant format ska vara allmänt använt och maskinläsbart och tillåta överföring av elektroniska hälsodata med personuppgifter mellan olika programvaruapplikationer, anordningar och vårdgivare.8 Senast samma datum ska kommissionen genom genomförandeakter fastställa datakvalitetskrav, inbegripet med avseende på semantik, enhetlighet, konsekvens, korrekthet och
8Artikel 15.1 förordningen (EU) 2025/327 om det europeiska hälsodataområdet.
SOU 2025:71 |
Gällande rätt |
fullständighet, för registrering av elektroniska hälsodata med person- uppgifter i ett elektroniskt hälsodokumentationssystem, beroende på vad som är relevant.9
Varje medlemsstat ska utse en nationell kontaktpunkt för digital hälsa som en organisatorisk och teknisk ingång för tillhandahållande av tjänster kopplade till gränsöverskridande utbyte av elektroniska hälsodata med personuppgifter i samband med primäranvändning. Varje nationell kontaktpunkt för digital hälsa ska vara ansluten till alla andra nationella kontaktpunkter för digital hälsa i andra medlems- stater och till den centrala interoperabilitetsplattformen för digital hälsa i den gränsöverskridande infrastrukturen MinHälsa@EU.10
Förordningens krav ska börja tillämpas på de första prioriterade kategorierna av elektroniska hälsodata med personuppgifter för pri- märanvändning den 26 mars 2029.
3.1.7Regeringsformen
Regeringsformen, nedan RF, beskriver hur landet ska styras och skyddet för alla medborgares fri- och rättigheter. Av 1 kap. 2 § första stycket RF framgår att den offentliga makten ska utövas med respekt för alla människors lika värde och för den enskilda människans fri- het och värdighet.
I 2 kap. RF anges de grundläggande fri- och rättigheterna. Enligt 2 kap. 6 § andra stycket är var och en gentemot det allmänna skyddad mot betydande intrång i den personliga integriteten, om det sker utan samtycke och innebär övervakning eller kartläggning av den enskildes personliga förhållanden. Enligt 2 kap. 20 § 2 får denna fri- och rät- tighet begränsas genom lag i vissa fall. Av 2 kap. 21 § följer att sådana begränsningar endast får göras för att tillgodose ändamål som är god- tagbara i ett demokratiskt samhälle. Begränsningen får aldrig gå ut- över vad som är nödvändigt med hänsyn till det ändamål som har föranlett den och inte heller sträcka sig så långt att den utgör ett hot mot den fria åsiktsbildningen såsom en av folkstyrelsens grundvalar. Begränsningen får inte göras enbart på grund av politisk, religiös, kulturell eller annan sådan åskådning.
9Artikel 13.4 förordningen (EU) 2025/327 om det europeiska hälsodataområdet.
10Artikel 23 förordningen (EU) 2025/327 om det europeiska hälsodataområdet.
Gällande rätt |
SOU 2025:71 |
Av prop. 2009/10:80 framgår bland annat följande avseende de överväganden som gjordes vid utformningen av 2 kap. 6 § RF. I lik- het med Integritetsskyddskommittén anser regeringen att den nya grundlagsbestämmelsen inte bör utformas som en absolut rättighet i den meningen att den ska kunna inskränkas endast genom ändring i grundlag. I stället bör det utvidgade integritetsskyddet, på samma sätt som rättighetsskyddet enligt 2 kap. 6 § RF i dess nuvarande lyd- else, kunna inskränkas i enlighet med bestämmelserna i 2 kap. 12 § RF. Det innebär – med några få undantag – att inskränkningar i integ- ritetsskyddet bara kan ske i lag. Det ställs också krav på att begräns- ningarna ska vara nödvändiga för att tillgodose ett ändamål som är godtagbart i ett demokratiskt samhälle. Begränsningarna får inte gå utöver vad som är nödvändigt med hänsyn till de ändamål som för- anlett begränsningarna och inte heller sträcka sig så långt att de utgör ett hot mot den fria åsiktsbildningen. Som kommittén påpekar är en följd av denna reglering bland annat att lagstiftaren tvingas att tyd- ligt redovisa vilka avvägningar som gjorts vid proportionalitetsbedöm- ningen. Detta kan förväntas öka förutsättningarna för att avvägning- arna i fråga om integritetsintrånget blir mer ingående belysta och att de presenteras på ett sådant sätt att kvaliteten i lagstiftningen höjs ytterligare.11
Vidare anges i nämnd proposition att vid behandlingen av upp- gifter som rör den enskilde får ett integritetsintrång normalt anses större om behandlingen sker utan den enskildes samtycke än om det sker efter dennes medgivande.12 Det framgår också att vid bedöm- ningen av hur ingripande intrånget i den personliga integriteten kan anses vara i samband med insamling, lagring och bearbetning eller utlämnande av uppgifter om enskildas personliga förhållanden, är det enligt regeringens mening naturligt att stor vikt läggs vid upp- gifternas karaktär. Ju känsligare uppgifterna är, desto mer ingripande måste det allmännas hantering av uppgifterna normalt anses vara. Även hantering av ett litet fåtal uppgifter kan med andra ord innebära ett betydande intrång i den personliga integriteten om uppgifterna är av mycket känslig karaktär. Vid bedömningen av intrångets karak- tär är det också naturligt att stor vikt läggs vid ändamålet med behand- lingen. En hantering som syftar till att utreda brott kan således normalt anses vara mer känslig än t.ex. en hantering som uteslutande sker för
11Prop. 2009/10:80 En reformerad grundlag, s. 176 f.
12A.a., s. 178.
SOU 2025:71 |
Gällande rätt |
att ge en myndighet underlag för förbättringar av kvaliteten i hand- läggningen. Därutöver kan givetvis mängden uppgifter vara en be- tydelsefull faktor i sammanhanget. Det kan anmärkas att konstitu- tionsutskottet i flera lagstiftningsärenden som rört myndigheters personuppgiftsbehandling framhållit att målsättningen bör vara att myndighetsregister med ett stort antal registrerade och ett särskilt känsligt innehåll ska regleras särskilt i lag (se t.ex. bet. 1990/91:KU11 s. 11, 1997/98:KU18 s. 43). Regeringen har vid åtskilliga tillfällen instämt i denna bedömning (se t.ex. 1997/98:44 s. 41 och 1999/2000:39 s. 78). Regeringen har också uttalat att behovet av lagstiftning är sär- skilt stort om uppgifterna sprids externt i inte obetydlig omfattning (prop. 1990/91:60 s. 58).13
3.1.8Lagen med kompletterande bestämmelser till EU:s dataskyddsförordning
Lagen (2018:218) med kompletterande bestämmelser till EU:s data- skyddsförordning (dataskyddslagen) innehåller kompletterande natio- nella bestämmelser till EU:s dataskyddsförordning och förtydligar under vilka förutsättningar personuppgifter får behandlas med stöd av dataskyddsförordningen. Enligt 1 kap. 6 § är lagen subsidiär i för- hållande till annan lag eller förordning, vilket möjliggör avvikande bestämmelser i så kallade registerförfattningar.
Av 3 kap. 1 § följer att med känsliga personuppgifter avses sådana uppgifter som avses i 9 kap. 1 § dataskyddförordningen, dvs. sådana uppgifter som där benämns särskilda kategorier av personuppgifter. Enligt 3 kap. 5 § får känsliga personuppgifter behandlas med stöd av artikel 9.2 h i EU:s dataskyddsförordning, om behandlingen är nöd- vändig för förebyggande hälso- och sjukvård och yrkesmedicin, be- dömningen av en arbetstagares arbetskapacitet, medicinska diagnoser, tillhandahållande av hälso- och sjukvård eller behandling, social om- sorg, eller förvaltning av hälso- och sjukvårdstjänster, social omsorg samt deras system. Behandlingen får ske under förutsättning att kravet på tystnadsplikt i artikel 9.3 i EU:s dataskyddsförordning är uppfyllt.
I lagen anges också att personnummer och samordningsnummer får behandlas utan samtycke endast när det är klart motiverat med hänsyn till ändamålet med behandlingen, vikten av en säker identi-
13A.a., s. 183.
Gällande rätt |
SOU 2025:71 |
fiering eller något annat beaktansvärt skäl samt att regeringen får meddela ytterligare föreskrifter om i vilka fall behandling av per- sonnummer och samordningsnummer är tillåten, 3 kap. 10–11 §§.
Överträdelser av dataskyddsförordningens eller lagens bestäm- melser kan leda till sanktionsavgifter eller skadestånd, se 6 och
7 kap. i lagen.
3.1.9Patientdatalagen
Patientdatalagen (2008:355) tillämpas vid vårdgivares behandling av personuppgifter inom hälso- och sjukvården, oavsett om vården be- drivs i offentlig eller privat regi.
Lagen innehåller bestämmelser som kompletterar EU:s data- skyddsförordning, vid sådan behandling av personuppgifter inom hälso- och sjukvården som är helt eller delvis automatiserad eller där uppgifterna ingår i eller är avsedda att ingå i en strukturerad sam- ling av personuppgifter som är tillgängliga för sökning eller sam- manställning enligt särskilda kriterier. Vid behandling av person- uppgifter gäller lagen (2018:218) med kompletterande bestämmelser till EU:s dataskyddsförordning och föreskrifter som har meddelats i anslutning till den lagen, om inte annat följer av patientdatalagen eller föreskrifter som har meddelats i anslutning till lagen.
Enligt 1 kap. 2 § patientdatalagen ska informationshantering inom hälso- och sjukvården vara organiserad så att den tillgodoser patient- säkerhet och god kvalitet samt främjar kostnadseffektivitet. Person- uppgifter ska utformas och i övrigt behandlas så att patienters och övriga registrerades integritet respekteras. Dokumenterade person- uppgifter ska hanteras och förvaras så att obehöriga inte får tillgång till dem.
Enligt 2 kap. 6 § är en vårdgivare personuppgiftsansvarig för den behandling av personuppgifter som vårdgivaren utför. I en region och en kommun är varje myndighet som bedriver hälso- och sjukvård personuppgiftsansvarig för den behandling av personuppgifter som myndigheten utför. Personuppgiftsansvaret omfattar även sådan behandling av personuppgifter som vårdgivaren, eller den myndighet i en region eller en kommun som är personuppgiftsansvarig, utför när vårdgivaren eller myndigheten genom direktåtkomst i ett enskilt
SOU 2025:71 |
Gällande rätt |
fall bereder sig tillgång till personuppgifter om en patient hos en annan vårdgivare eller annan myndighet i samma region eller kommun.
I 3 kap. regleras skyldigheten att föra patientjournal. Sådan jour- nal ska föras vid vård av patienter, 3 kap. 1 §. Syftet med patientjour- nalen är i första hand att bidra till en god och säker vård av patienten men den är även en informationskälla för patienten, för uppföljning och utveckling av verksamheten, tillsyn och rättsliga krav, uppgifts- skyldighet enligt lag samt för forskning, 3 kap. 2 §. Av 3 kap. framgår bland annat även vem som ska föra journal, vilka uppgifter journalen ska innehålla och vem som ansvarar för uppgifterna i den.
I lagen anges även för vilka ändamål personuppgifter får behandlas och vilka personuppgifter som får behandlas, patientens möjlighet att spärra uppgifter, inre sekretess, elektronisk åtkomst m.m.
3.1.10Lag om sammanhållen vård- och omsorgsdokumentation
Lagen (2022:913) om sammanhållen vård- och omsorgsdokumen- tation, nedan kallad SVOD, innehåller bestämmelser om under vilka förutsättningar och till vem som vårdgivare och omsorgsgivare kan ge åtkomst till personuppgifter om patienter och omsorgstagare. Lagen har bland annat ersatt de bestämmelser om sammanhållen journalföring som tidigare fanns i 6 kap. patientdatalagen (2008:355).
Lagen innehåller bestämmelser som kompletterar EU:s data- skyddsförordning, patientdatalagen, lagen (2001:454) om behand- ling av personuppgifter inom socialtjänsten och föreskrifter som har meddelats i anslutning till dessa lagar. Vid behandling av person- uppgifter enligt lagen gäller lagen (2018:218) med kompletterande bestämmelser till EU:s dataskyddsförordning och föreskrifter som har meddelats i anslutning till den lagen, om inte annat följer av SVOD eller föreskrifter som har meddelats i anslutning till lagen. Bestämmelserna i SVOD får tillämpas på vårdgivares behandling av personuppgifter enligt patientdatalagen och också på omsorgs- givares behandling av omsorgsmottagares personuppgifter enligt vad som närmare anges i lagen.
Enligt 2 kap. 1 § SVOD får en vårdgivare, under de förutsättningar som anges i lagen, ges tillgång, genom direktåtkomst eller annat elek- troniskt utlämnande, till personuppgifter som behandlas av andra vårdgivare eller av omsorgsgivare. Även en omsorgsgivare kan få
Gällande rätt |
SOU 2025:71 |
åtkomst till personuppgifter som behandlas av andra vårdgivare eller av omsorgsgivare enligt vad som närmare anges i SVOD. Utifrån vad som är relevant för nu föreliggande utredning får tillgång avse bl.a. personuppgifter som behandlas för de ändamål som anges i
2 kap. 4 § 1 och 2 patientdatalagen. Det vill säga för ändamålet att fullgöra de skyldigheter att föra patientjournal som följer av 3 kap. patientdatalagen och upprätta annan dokumentation som behövs i och för vården av patienter samt för ändamålet administration som rör patienter och som syftar till att ge vård i enskilda fall eller som annars föranleds av vård i enskilda fall. Patienten eller omsorgstagaren ska informeras om vad sammanhållen vård och omsorgsdokumen- tation innebär, möjligheten att motsätta sig tillgängliggörandet av informationen samt få information om spärrar och upprätthållande av sådana, se 2 kap. 2 § SVOD.
Lagen anger uttömmande i vilka fall och under vilka förutsätt- ningar en vårdgivare eller omsorgsgivare får behandla en annan vårdgivares eller omsorgsgivares uppgifter om en patient eller om- sorgsmottagare. Denna begränsning gäller även om patienten eller omsorgsmottagaren ger sitt uttryckliga samtycke till något annat, 3 kap. 7 §.
En vårdgivare eller en omsorgsgivare är personuppgiftsansvarig för behandling av personuppgifter enligt lagen. I en region eller i en kommun är varje myndighet som bedriver hälso- och sjukvård per- sonuppgiftsansvarig för den behandling av personuppgifter som myn- digheten utför. Personuppgiftsansvaret omfattar även sådan behand- ling av personuppgifter som utförs när någon genom direktåtkomst eller annat elektroniskt utlämnande i ett enskilt fall bereder sig till- gång till personuppgifter hos en annan vårdgivare eller omsorgsgivare, 4 kap. 1 §.
Patientdatalagens bestämmelser om behörighetstilldelning, elek- tronisk åtkomst och om att en vårdgivare på en patients begäran ska lämna information om den direktåtkomst och elektroniska åtkomst till uppgifter om patienten som förekommit, ska tillämpas i dessa av- seenden även när åtgärderna utförs med stöd av SVOD. Detta fram- går av 4 kap. 3–5 §§ SVOD. Motsvarande skyldigheter för omsorgs- givare i dessa avseenden fastslås också i dessa lagrum.
SOU 2025:71 |
Gällande rätt |
3.1.11Apoteksdatalagen
Apoteksdatalagen (2009:367) reglerar öppenvårdsapotekens behand- ling av personuppgifter vid detaljhandel med läkemedel m.m. som är helt eller delvis automatiserad, eller där uppgifterna ingår i eller är avsedda att ingå i en strukturerad samling av personuppgifter, som är tillgängliga för sökning eller sammanställning enligt särskilda kri- terier. Även apoteksdatalagen kompletterar EU:s dataskyddsförord- ning och vid behandling av personuppgifter ska lagen (2018:218) med kompletterande bestämmelser till EU:s dataskyddsförordning och föreskrifter som har meddelats i anslutning till den lagen, om inte annat följer av apoteksdatalagen eller föreskrifter som har med- delats i anslutning till lagen, 5 §.
Vad gäller den enskildes inställning till personuppgiftsbehand- lingen anges i 6 § att behandling av personuppgifter som är tillåten enligt lagen får utföras även om den enskilde motsätter sig behand- lingen. Vidare får behandling av personuppgifter som inte är tillåten enligt lagen ändå utföras, om den enskilde har lämnat ett uttryckligt samtycke till behandlingen.
Det är tillståndshavaren som är personuppgiftsansvarig för den personuppgiftsbehandling som utförs på ett öppenvårdsapotek, 7 §. I lagen anges för vilka ändamål som personuppgiftsbehandling är tillåten, 8–9 §§.
3.2Lagar som reglerar hälso- och sjukvårdsverksamhet och apoteksverksamhet
I detta avsnitt redogörs kortfattat för ytterligare författningar som gäller vid bedrivande av hälso- och sjukvårdsverksamhet och vid be- drivande av verksamhet på öppenvårdsapotek.
3.2.1Hälso- och sjukvårdslagen
Hälso- och sjukvårdslagen (2017:30) innehåller bestämmelser om hur hälso- och sjukvårdsverksamhet ska organiseras och bedrivas. Lagen gäller för samtliga vårdgivare samt regioner och kommuner som huvudmän. Det som sägs i lagen om regioner gäller också kom- muner som inte ingår i en region. Med hälso- och sjukvård avses i
Gällande rätt |
SOU 2025:71 |
lagen åtgärder för att medicinskt förebygga, utreda och behandla sjukdomar och skador, sjuktransporter, och omhändertagande av av- lidna. Lagen omfattar inte tandvård enligt tandvårdslagen (1985:125). Med vårdgivare avses i lagen statlig myndighet, region, kommun, annan juridisk person eller enskild näringsidkare som bedriver hälso- och sjukvårdsverksamhet.14
I hälso- och sjukvårdslagen fastslås att målet med hälso- och sjuk- vården är en god hälsa och en vård på lika villkor för hela befolk- ningen. Vården ska ges med respekt för alla människors lika värde och för den enskilda människans värdighet. Den som har det största behovet av hälso- och sjukvård ska ges företräde till vården.15 Det anges vidare att hälso- och sjukvårdsverksamhet ska bedrivas så att kraven på en god vård uppfylls. Det innebär att vården särskilt ska vara av god kvalitet med en god hygienisk standard och att vården ska tillgodose patientens behov av trygghet, kontinuitet och säkerhet, bygga på respekt för patientens självbestämmande och integritet, främja goda kontakter mellan patienten och hälso- och sjukvårds- personalen och vara lätt tillgänglig. Där det bedrivs hälso- och sjuk- vårdsverksamhet ska det finnas den personal, de lokaler, de sjukvårds- produkter och den övriga utrustning som behövs för att god vård ska kunna ges.16
Lagen innehåller också bestämmelser om regioners och kommu- ners ansvar som huvudmän för hälso- och sjukvård. Med huvudman avses i lagen den region eller den kommun som enligt lagen ansvarar för att erbjuda hälso- och sjukvård. Inom en huvudmans geografiska område kan en eller flera vårdgivare bedriva verksamhet. Med vård- givare avses i lagen statlig myndighet, region, kommun, annan juri- disk person eller enskild näringsidkare som bedriver hälso- och sjukvårdsverksamhet.17
3.2.2Tandvårdslagen
I tandvårdslagen (1985:125) anges att med tandvård avses åtgärder för att förebygga, utreda och behandla sjukdomar och skador i mun- hålan. Målet för tandvården är en god tandhälsa och en tandvård på
142 kap. 1 och 3 §§ hälso- och sjukvårdslagen (2017:30).
153 kap. 1 § hälso- och sjukvårdslagen (2017:30).
165 kap. 1–2 §§ hälso- och sjukvårdslagen (2017:30).
172 kap. 2–3 §§ hälso- och sjukvårdslagen (2017:30).
SOU 2025:71 |
Gällande rätt |
lika villkor för hela befolkningen. Tandvården ska bedrivas så att den uppfyller kravet på en god tandvård. Det innebär att den ska vara av god kvalitet med en god hygienisk standard och lägga sär- skild vikt vid förebyggande åtgärder. Den ska också tillgodose pati- entens behov av trygghet i vården och behandlingen, vara lätt till- gänglig, bygga på respekt för patientens självbestämmande och integritet och främja goda kontakter mellan patienten och tand- vårdspersonalen.18
Lagen fastslår att där det bedrivs tandvårdsverksamhet ska det finnas den personal, de lokaler och den utrustning som behövs för att god vård skall kunna ges.19 I lagen preciseras också bland annat regionernas ansvarar att bedriva tandvård.
3.2.3Patientsäkerhetslagen
Patientsäkerhetslagen (2010:659) syftar till att främja hög patient- säkerhet inom hälso- och sjukvård och därmed jämförlig verksam- het. I lagen finns bland annat bestämmelser vårdgivares skyldighet att bedriva ett systematiskt patientsäkerhetsarbete, behörighets- frågor, skyldigheter för hälso- och sjukvårdspersonal m.fl., Inspek- tionen för vård och omsorgs tillsyn och om Hälso- och sjukvårdens ansvarsnämnd.20
Begreppet hälso- och sjukvård har en vidare betydelse i patient- säkerhetslagen än vad det har i hälso- och sjukvårdslagen. I patient- säkerhetslagen avses med begreppet verksamhet som omfattas av hälso- och sjukvårdslagen (2017:30), tandvårdslagen (1985:125), lagen (2001:499) om omskärelse av pojkar, lagen (2018:744) om försäkringsmedicinska utredningar, lagen (2019:1297) om koordi- neringsinsatser för sjukskrivna patienter, lagen (2021:363) om este- tiska kirurgiska ingrepp och estetiska injektionsbehandlingar samt verksamhet inom detaljhandel med läkemedel enligt lagen (2009:366) om handel med läkemedel.21 Således omfattas även bland annat öppenvårdsapotekens verksamhet med detaljhandel av läkemedel av patientsäkerhetslagens tillämpningsområde.
181–3 §§ tandvårdslagen (1985:125).
194 a § tandvårdslagen (1985:125).
201 kap. 1 § patientsäkerhetslagen (2010:659).
211 kap. 2 § patientsäkerhetslagen (2010:659).
Gällande rätt |
SOU 2025:71 |
Med vårdgivare avses i patientsäkerhetslagen statlig myndighet, region och kommun i fråga om sådan hälso- och sjukvård som myn- digheten, regionen eller kommunen har ansvar för samt annan juri- disk person eller enskild näringsidkare som bedriver hälso- och sjukvård.22 Vårdgivaren ska planera, leda och kontrollera verksam- heten på ett sätt som leder till att kravet på god vård i hälso- och sjukvårdslagen (2017:30) respektive tandvårdslagen (1985:125) upprätthålls. Vårdgivaren ska också vidta de åtgärder som behövs för att förebygga att patienter drabbas av vårdskador. För åtgärder som inte kan vidtas omedelbart ska en tidsplan upprättas.23
Begreppet hälso- och sjukvårdspersonal i patientsäkerhetslagen omfattar bland annat den som har legitimation för ett yrke inom hälso- och sjukvården, personal som är verksam vid sjukhus och andra vårdinrättningar och som medverkar i hälso- och sjukvård av patienter, den som i annat fall vid hälso- och sjukvård av patienter biträder en legitimerad yrkesutövare och apotekspersonal som till- verkar eller expedierar läkemedel eller lämnar råd och upplysningar.24 Enligt patientsäkerhetslagen ska hälso- och sjukvårdspersonalen utföra sitt arbete i överensstämmelse med vetenskap och beprövad erfarenhet. En patient ska ges sakkunnig och omsorgsfull hälso- och sjukvård som uppfyller dessa krav. Vården ska så långt som möjligt utformas och genomföras i samråd med patienten och patienten ska visas omtanke och respekt. Den som tillhör hälso- och sjukvårds- personalen bär själv ansvaret för hur han eller hon fullgör sina arbets- uppgifter. Det sistnämnda innebär ingen inskränkning i vårdgivarens ansvar enligt lagen eller annan författning.25 Hälso- och sjukvårds- personalen är bland annat också skyldig att bidra till att hög patient- säkerhet upprätthålls.26
Apotekspersonal åläggs i lagen en anmälningsskyldighet om en legitimerad yrkesutövares förskrivning av narkotiska läkemedel, andra särskilda läkemedel, alkoholhaltiga läkemedel eller teknisk sprit skäligen kan befaras stå i strid med vetenskap och beprövad erfaren- het. Apotekspersonal som expedierar läkemedel ska anmäla detta till Inspektionen för vård och omsorg.27
221 kap. 3 § patientsäkerhetslagen (2010:659).
233 kap. 1–2 §§ patientsäkerhetslagen (2010:659).
241 kap. 4 § patientsäkerhetslagen (2010:659).
256 kap. 1–2 §§ patientsäkerhetslagen (2010:659).
266 kap. 4 § första stycket patientsäkerhetslagen (2010:659).
276 kap. 11 § patientsäkerhetslagen (2010:659).
SOU 2025:71 |
Gällande rätt |
I patientsäkerhetslagen regleras även tystnadsplikt som den som tillhör eller har tillhört hälso- och sjukvårdspersonalen inom den enskilda hälso- och sjukvården omfattas av. Tystnadsplikten innebär att dessa personer inte obehörigen får röja vad de i sin verksamhet har fått veta om en enskilds hälsotillstånd eller andra personliga för- hållanden. Tystnadsplikt som gäller för en uppgift om en patients hälsotillstånd gäller även i förhållande till patienten själv, om det med hänsyn till ändamålet med hälso- och sjukvården är av synner- lig vikt att uppgiften inte lämnas till patienten.28 Den som tillhör eller har tillhört hälso- och sjukvårdspersonalen inom den enskilda hälso- och sjukvården får inte heller obehörigen röja en uppgift från en enskild om någon annan persons hälsotillstånd eller andra personliga förhållanden, om det kan antas att det finns en risk för att den som har lämnat uppgiften eller någon närstående till uppgifts- lämnaren utsätts för våld eller annat allvarligt men om uppgiften röjs.29 Som obehörigt röjande anses inte att någon fullgör sådan uppgiftsskyldighet som följer av lag eller förordning. För det all- männas verksamhet gäller i stället offentlighets- och sekretesslagen (2009:400).
3.2.4Offentlighets- och sekretesslagen
I 1 kap. 1 § offentlighets- och sekretesslagen (2009:400), nedan OSL, anges att lagen innehåller bestämmelser om myndigheters och vissa andra organs handläggning vid registrering, utlämnande och övrig hantering av allmänna handlingar. Lagen innehåller vidare bestäm- melser om tystnadsplikt i det allmännas verksamhet och om förbud att lämna ut allmänna handlingar. Dessa bestämmelser avser förbud att röja uppgift, vare sig detta sker muntligen, genom utlämnande av allmän handling eller på något annat sätt. Bestämmelserna innebär begränsningar i yttrandefriheten enligt regeringsformen, begränsningar i den rätt att ta del av allmänna handlingar som följer av tryckfrihets- förordningen samt, i vissa särskilt angivna fall, även begränsningar i den rätt att meddela och offentliggöra uppgifter som följer av tryck- frihetsförordningen och yttrandefrihetsgrundlagen.
286 kap. 12 § patientsäkerhetslagen (2010:659).
296 kap. 13 § patientsäkerhetslagen (2010:659).
Gällande rätt |
SOU 2025:71 |
Förbud att röja eller utnyttja en uppgift enligt OSL eller enligt lag eller förordning som OSL hänvisar till gäller för myndigheter.30 Ett sådant förbud gäller också för en person som fått kännedom om uppgiften genom att för det allmännas räkning delta i en myndighets verksamhet på grund av anställning eller uppdrag hos myndigheten, på grund av tjänsteplikt, eller på annan liknande grund. Riksdagen och beslutande kommunala församlingar ska vid tillämpningen av OSL jämställas med myndigheter. Det som föreskrivs i tryckfrihets- förordningen om rätt att ta del av allmänna handlingar hos myndig- heter ska i tillämpliga delar gälla också handlingar hos aktiebolag, handelsbolag, ekonomiska föreningar och stiftelser där kommuner eller regioner utövar ett rättsligt bestämmande inflytande. Sådana bolag, föreningar och stiftelser ska vid tillämpningen av OSL jäm- ställas med myndigheter.
25 kap. OSL reglerar bland annat sekretess till skydd för enskild i verksamhet som avser hälso- och sjukvård. Exempelvis anges i 25 kap. 1 § första stycket att sekretess gäller inom hälso- och sjukvården för uppgift om en enskilds hälsotillstånd eller andra personliga för- hållanden, om det inte står klart att uppgiften kan röjas utan att den enskilde eller någon närstående till denne lider men. I 25 kap. 2 § regleras den sekretess som gäller när uppgifter delas med stöd av lagen (2022:913) om sammanhållen vård- och omsorgsdokumenta- tion. Sekretess som gäller vid E-hälsomyndigheten anges i 25 kap. 17 a–17 b §§. När sekretessen enligt dessa paragrafer får brytas anges i 25 kap. 17 c §.
Enligt 25 kap. 18 § OSL inskränks den så kallade meddelarfriheten vad gäller bland annat uppgifter om enskilds hälsotillstånd eller andra personliga förhållanden som omfattas av sekretess enligt 25 kap.
17 a § OSL. En sådan inskränkning gäller också bland annat för tyst- nadsplikten enligt 6 kap. 12 § patientsäkerhetslagen som åligger den som tillhör eller har tillhört hälso- och sjukvårdspersonalen inom den enskilda hälso- och sjukvården. Detta följer av 44 kap. 3 § 1 OSL.
Se vidare om offentlighets- och sekretesslagen i kap. 14.
302 kap. 1 § offentlighets- och sekretesslagen (2009:400).
SOU 2025:71 |
Gällande rätt |
3.2.5Patientlagen
Patientlagen (2014:821) syftar till att inom hälso- och sjukvårds- verksamhet stärka och tydliggöra patientens ställning samt till att främja patientens integritet, självbestämmande och delaktighet.31 Med hälso- och sjukvård avses i patientlagen dels åtgärder för att medicinskt förebygga, utreda och behandla sjukdomar och skador, dels sjuktransporter. Målet med hälso- och sjukvården är en god hälsa och en vård på lika villkor för hela befolkningen. Vården ska ges med respekt för alla människors lika värde och för den enskilda människans värdighet. Den som har det största behovet av hälso- och sjukvård ska ges företräde till vården. Patienten ska få sakkun- nig och omsorgsfull hälso- och sjukvård som är av god kvalitet och som står i överensstämmelse med vetenskap och beprövad erfarenhet.32
I lagen fastslås bland annat att patientens självbestämmande och integritet ska respekteras. Hälso- och sjukvård inte får ges utan pati- entens samtycke om inte annat följer av patientlagen eller någon annan lag. Innan samtycke inhämtas ska patienten få information enligt vad som särskilt anges i lagen. Patienten kan, om inte annat särskilt följer av lag, lämna sitt samtycke skriftligen, muntligen eller genom att på annat sätt visa att han eller hon samtycker till den aktuella åt- gärden. Patienten får när som helst ta tillbaka sitt samtycke. Om en patient avstår från viss vård eller behandling, ska han eller hon få infor- mation om vilka konsekvenser detta kan medföra.33
3.2.6Läkemedelslagen
Syftet med läkemedelslagen (2015:315) är främst att skydda männi- skors och djurs liv, hälsa och välbefinnande samt att värna om folk- hälsan och skydda miljön utan att detta i högre grad än vad som är nödvändigt hindrar utvecklingen av läkemedel eller handeln med läke- medel i Sverige och inom Europeiska ekonomiska samarbetsområdet (EES).34 Lagen innehåller bland annat bestämmelser om krav på läke- medel, registrering och tillstånd till försäljning av läkemedel, krav för försäljning av läkemedel, klinisk läkemedelsprövning, tillverkning,
311 kap. 1 § patientlagen (2014:821).
321 kap. 5–7 §§ patientlagen (2014:821).
334 kap. 1–2 §§ patientlagen (2014:821).
341 kap. 1 § läkemedelslagen (2015:315).
Gällande rätt |
SOU 2025:71 |
import och annan införsel av läkemedel, marknadsföring samt om förordnande och utlämnande av läkemedel och teknisk sprit.
Enligt lagen ska den som förordnar eller lämnar ut läkemedel särskilt iaktta kraven på sakkunnig och omsorgsfull vård samt på upplysning till och samråd med patienten eller företrädare för denne. Sådan information om ett läkemedel som har särskild betydelse för att förebygga skada eller för att främja en ändamålsenlig användning ska lämnas skriftligen när läkemedlet tillhandahålls en användare.35
3.2.7Lagen om handel med läkemedel
I lagen (2009:366) om handel med läkemedel anges att handel med läkemedel ska bedrivas på ett sådant sätt att läkemedlen inte skadar människor, egendom eller miljö samt så att läkemedlens kvalitet inte försämras.36 Där anges också att i öppenvårdsapotekens grunduppdrag ingår att verka för en god och säker läkemedelsanvändning genom att säkerställa att konsumenten så snart det kan ske får tillgång till förordnade läkemedel och varor, ge sakkunnig och individuellt an- passad information och rådgivning och genom att genomföra och upplysa om utbyte av läkemedel.37
För att få bedriva detaljhandel med läkemedel till konsument
krävs som huvudregel tillstånd från Läkemedelsverket.38 Förutsätt- ningarna för att någon ska få bedriva detaljhandel med läkemedel till konsument framgår av lagens andra kapitel. Där anges bland annat att den som har tillstånd att bedriva öppenvårdsapotek vid expediering av en förskrivning ska lämna de uppgifter som anges i lagen (2018:1212) om nationell läkemedelslista till E-hälsomyndig- heten. Tillståndshavaren ska också ha ett elektroniskt system som gör det möjligt att få direktåtkomst till uppgifter hos E-hälsomyn- digheten.39
3513 kap. 1 § läkemedelslagen (2015:315).
361 kap. 2 § lagen (2009:366) om handel med läkemedel.
372 kap. 3 a § första stycket lagen (2009:366) om handel med läkemedel.
382 kap. 1 § lagen (2009:366) om handel med läkemedel.
392 kap. 6 § 5 och 6 lagen (2009:366) om handel med läkemedel.
SOU 2025:71 |
Gällande rätt |
3.2.8Lagen om läkemedelsförmåner m.m.
Lagen (2002:160) om läkemedelsförmåner m.m. finns bestämmel- ser om läkemedelsförmåner, prisreglering av läkemedel och andra varor, utbyte av läkemedel och därmed sammanhängande frågor.
Där regleras bland annat vem som har rätt till läkemedelsförmåner och vad förmånen innehåller. Tandvårds- och läkemedelsförmåns- verket beslutar vilka läkemedel och varor som ska ingå i förmånen. De varor som kan ingå i förmånen är Läkemedelsförmånerna ska enligt 18 § lagen om läkemedelsförmåner m.m. omfatta varor för vilka det med stöd av 18 kap. 2 § läkemedelslagen (2015:315) har föreskrivits att läkemedelslagen helt eller delvis ska gälla och som förskrivs enbart i födelsekontrollerande syfte av läkare eller barn- morskor, förbrukningsartiklar som en förmånsberättigad behöver vid stomi och som förskrivs av läkare eller någon annan som Social- styrelsen förklarat har behörighet till sådan förskrivning, och förbruk- ningsartiklar som en förmånsberättigad på grund av sjukdom behöver för att tillföra kroppen ett läkemedel eller för egenkontroll av medi- cinering och som förskrivs av läkare, tandläkare eller någon annan som Socialstyrelsen förklarat har behörighet till sådan förskrivning. Lagen innehåller även bestämmelser om utbyte av läkemedel.40
I korthet innebär dessa bestämmelser att läkemedel som förskrivs, i samband med expediering på öppenvårdsapotek, ska bytas ut mot ett läkemedel som det förskrivna läkemedlet är utbytbart mot och som har lägst fastställt försäljningspris. Läkemedelsverket beslutar om vilka läkemedel som är utbytbara.41 Förskrivaren kan motsätta sig utbyte på medicinska grunder och expedierande farmaceut på öppenvårdsapoteket kan motsätta sig utbyte med hänsyn till att det finns anledning att anta att ett utbyte skulle innebära betydande olägenhet för patienten. Även patienten själv kan motsätta sig att utbyte sker men får då betala en mellanskillnad eller hela läkemed- lets kostnad.
4021–21 d §§ lagen (2002:160) om läkemedelsförmåner m.m.
414 kap. 22 § läkemedelslagen (2015:315).
Gällande rätt |
SOU 2025:71 |
3.2.9Lagen om register över nationella vaccinationsprogram m.m.
Lagen (2012:453) om register över nationella vaccinationsprogram
m.m.tillämpas vid behandling av personuppgifter i Folkhälsomyndig- hetens verksamhet när det gäller nationella vaccinationsprogram och vaccinationer mot sjukdomen covid-19 (vaccinationsregistret). Behandling av personuppgifter får utföras även om den enskilde motsätter sig behandlingen. Folkhälsomyndigheten är personuppgifts- ansvarig för den behandling som myndigheten utför enligt lagen.42 I lagen regleras bland annat även vilka personuppgifter som får be- handlas och tillåtna ändamål för personuppgiftsbehandlingen.43
3.3EU:s förordningar om medicintekniska produkter och lagen med kompletterande bestämmelser till dessa förordningar
Till skillnad från vad som gäller för läkemedel krävs inget förhands- godkännande från någon myndighet för att få släppa en medicin- teknisk produkt på marknaden. Produkterna ska som huvudregel dock vara CE-märkta och kontrolleras genom marknadskontroll. Några specialfall av medicintekniska produkter hanteras inte via CE-märkning, men ska ändå uppfylla stora delar av regelverken. Det gäller till exempel för specialanpassade och egentillverkade medi- cintekniska produkter.
Det finns en omfattande reglering avseende medicintekniska pro- dukter, huvudsakligen i två EU-förordningar.44 Lagen (2021:600) med kompletterande bestämmelser till EU:s förordningar om medi- cintekniska produkter innehåller kompletterande bestämmelser till dessa samt regleras där även frågor som inte omfattas av EU-förord- ningarna. Genom lagen upphävdes lagen (1993:584) om medicin- tekniska produkter. Den upphävda lagen ska dock under en tid
421, 4 och 5 §§ lagen (2012:453) om register över nationella vaccinationsprogram m.m.
436–7 §§ lagen (2012:453) om register över nationella vaccinationsprogram m.m.
44Europaparlamentets och rådets förordning (EU) 2017/745 av den 5 april 2017 om medicin- tekniska produkter, om ändring av direktiv 2001/83/EG, förordning (EG) nr 178/2002 och förordning (EG) nr 1223/2009 och om upphävande av rådets direktiv 90/385/EEG och 93/42/EEG samt Europaparlamentets och rådets förordning (EU) 2017/746 av den 5 april 2017 om medicintekniska produkter för in vitro-diagnostik och om upphävande av direktiv 98/79/EG och kommissionens beslut 2010/227/EU.
SOU 2025:71 |
Gällande rätt |
fortsätta att gälla för vissa medicintekniska produkter vilket framgår av lagens övergångsbestämmelser.
3.4Föreskrifter som reglerar hälso- och sjukvårdsverksamhet och apoteksverksamhet
Socialstyrelsen och Läkemedelsverket har beslutat ett antal föreskrif- ter som reglerar hälso- och sjukvårdsverksamhet ur olika aspekter och Läkemedelsverket föreskriver även om verksamhet som bedrivs på öppenvårdsapotek. Nedan redogörs kortfattat för innehållet i de för utredningen mest centrala föreskrifterna.
3.4.1Socialstyrelsens föreskrifter och allmänna råd
om journalföring och behandling av personuppgifter i hälso- och sjukvården
Bestämmelser om vad som gäller då vårdgivare behandlar patienters personuppgifter inom hälso- och sjukvården finns också i Social- styrelsens föreskrifter och allmänna råd (HSLF-FS 2016:40) om journalföring och behandling av personuppgifter i hälso- och sjuk- vården. Vårdgivare som omfattas av föreskrifterna är statlig myndig- het, region och kommun i fråga om sådan hälso- och sjukvård som myndigheten, regionen eller kommunen har ansvar för samt annan juridisk person eller enskild näringsidkare som bedriver hälso- och sjukvård, se 2 kap. HSLF-FS 2016:40.
Föreskrifterna reglerar bland annat vad vårdgivarens lednings- system ska säkerställa, att det ska finnas en informationssäkerhets- policy och att riskanalyser ska göras fortlöpande, 3 kap.
Föreskrifterna innehåller i 4 kap. bestämmelser om tilldelning och begränsning av behörighet för åtkomst till patientuppgifter och att detta ska föregås av en behovs- och riskanalys. Vidare regleras i
4 kap. vad som gäller för åtkomst till uppgifter om patienter på andra vårdenheter eller i andra vårdprocesser och om patienten har spärrat uppgifter samt om så kallad nödöppning av spärrade uppgifter. Det anges också att vårdgivaren ansvarar för att kunna kontrollera åtkomst till uppgifter samt åläggs vårdgivaren att systematiskt och återkom- mande genomföra stickprovskontroller av loggar över åtkomst. Så- dana loggar ska sparas i minst fem år.
Gällande rätt |
SOU 2025:71 |
Föreskrifterna innehåller också bestämmelser om hur en journal ska struktureras och vad den ska innehålla. Bland annat ska en pati- ents journal innehålla uppgifter om ordinationer och ordinations- orsak, överkänslighet för läkemedel eller vissa ämnen och om sam- tycken och återkallade samtycken. Den ska även innehålla uppgift om de medicintekniska produkter som har förskrivits till, utlämnats till eller tillförts en patient på ett sådant sätt att de kan spåras. Vilka uppgifter journalens ska innehålla anges i 5 kap. 5 § HSLF-FS 2016:40.
I föreskrifternas 6 kap. 1 § finns ytterligare bestämmelser om åtgärder för att skydda personuppgifter mot obehörig åtkomst. Det ska ske genom att hälso- och sjukvårdspersonalen ansvarar dels för att personliga lösenord och hjälpmedel för autentisering inte kan bli tillgängliga för någon annan, dels för att datorer och andra en- heter som möjliggör åtkomst till patientuppgifter inte lämnas utan att uppgifterna är skyddade för obehörig åtkomst.
3.4.2Socialstyrelsens föreskrifter och allmänna råd om ordination och hantering av läkemedel
i hälso- och sjukvården
Hur läkemedel ska ordineras och hanteras i hälso- och sjukvården finns reglerat i Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordination och hantering av läkemedel i hälso- och sjukvården. Föreskrifterna ska tillämpas i verksamhet som omfattas av hälso- och sjukvårdslagen (2017:30) och med undan- tag för 11 kap. ska de även tillämpas i verksamhet som omfattas av tandvårdslagen (1985:125) (i 11 kap. regleras läkemedelsgenom- gångar).
Föreskrifterna anger att vårdgivare ska fastställa rutiner för ordi- nation och hantering av läkemedel i verksamheten, 4 kap. 2 §. Endast hälso- och sjukvårdspersonal som är behörig att förordna eller för- skriva läkemedel enligt föreskrifter som anges i 5 kap. 2–5 §§ är be- hörig att ordinera läkemedel, 5 kap. 1 §.
Den som ordinerar ett läkemedel ska säkerställa att ordinationen är lämplig med utgångspunkt i patientens behov. Det innebär att den som ordinerar särskilt ska göra en lämplighetsbedömning där hänsyn tas till patientens hälsotillstånd, ålder, kön, läkemedelsanvänd- ning, pågående behandling och utredning, överkänslighet mot läke- medel, och eventuell graviditet eller amning. Vid bedömningen ska
SOU 2025:71 |
Gällande rätt |
även läkemedlets kontraindikationer och andra viktiga faktorer för läkemedelsbehandlingen beaktas. Motsvarande bedömning ska göras vid insättning eller utsättning av ett läkemedel och även vid ändring eller förlängning av en pågående läkemedelsbehandling, 6 kap. 2 §.
Läkemedelsordinationer ska dokumenteras i patientjournalen på ett strukturerat sätt och i ett enhetligt format. De uppgifter om en läkemedelsordination som ska dokumenteras är läkemedelsnamn eller aktiv substans, läkemedelsform, läkemedlets styrka, dosering, administreringssätt, administreringstillfällen, läkemedelsbehand- lingens längd, ordinationsorsak, när och hur läkemedelsbehandlingen ska följas upp eller avslutas och i förekommande fall även anledningen till att läkemedlet inte får bytas ut mot ett likvärdigt läkemedel. Även övriga uppgifter som behövs för en säker hantering av läkemedlet ska anges. Uppgiften om dosering ska anges i ett strukturerat format. Om doseringen anges som en vidbehovsordination, ska även uppgif- ten om maxdos per dygn dokumenteras, 6 kap. 9 och 10 §§. Socialsty- relsen anger i allmänna råd att dokumentation av läkemedelsordina- tioner bör göras elektroniskt. Dokumenterade läkemedelsordinationer ska hållas samlade i patientjournalen, 6 kap. 12 §.
I föreskrifternas 7 kap. regleras vem som har behörighet att iord- ningställa, administrera och överlämna läkemedel och i 8 kap. finns närmare bestämmelser om iordningställande och administrering eller överlämnande av läkemedel.
3.4.3Socialstyrelsens föreskrifter om användning av medicintekniska produkter inom hälso- och sjukvården
Socialstyrelsens föreskrifter (HSLF-FS 2021:52) om användning av medicintekniska produkter inom hälso- och sjukvården innehåller bestämmelser om ledningssystem, kompetens och arbetsuppgifter, behörighet att förskriva vissa förbrukningsartiklar, negativa händelser och tillbud med medicintekniska produkter och kompletterande be- stämmelser till EU:s förordning om medicintekniska produkter. Föreskrifterna ska tillämpas i verksamheter som omfattas av hälso- och sjukvårdslagen (2017:30) och tandvårdslagen (1985:125). Enligt föreskrifterna ska varje vårdgivare bland annat fastställa rutiner för förskrivning, utlämnande och tillförande av en medicinteknisk pro- dukt till en patient, 2 kap. 3 §.
Gällande rätt |
SOU 2025:71 |
3.4.4Läkemedelsverkets föreskrifter om förordnande och utlämnande av läkemedel och teknisk sprit
Vad som gäller vid förordnande och utlämnande av bland annat läke- medel finns reglerat i Läkemedelsverkets föreskrifter (HSLF-FS 2021:75) om förordnande och utlämnande av läkemedel och teknisk sprit. I föreskrifternas 2 kap. anges vem som har behörighet att för- ordna läkemedel. Med förordna läkemedel avses att förskriva läke- medel på recept och rekvirera (beställa) läkemedel till hälso- och sjukvården. Föreskrifterna ska dock inte tillämpas vid förordnande eller utlämnande av läkemedel och teknisk sprit som ska användas på sjukhus, 1 kap. 1 § sista stycket.
Föreskrifterna reglerar bland annat vad som gäller vid utläm- nande av så kallad jourdos av läkemedel från hälso- och sjukvården till en patient, 3 kap. 1 och 2 §§. Läkemedel som patienten ska ta genom egen försorg efter att ett vårdbesök är avslutat ska i normal- fallet förskrivas på recept och patienten får hämta ut läkemedlet från ett öppenvårdsapotek för att sedan använda det. När det exempel- vis är angeläget att en läkemedelsbehandling sätts igång omedelbart eller att en pågående läkemedelsbehandling inte avbryts och öppen- vårdsapoteken för tillfället är stängda, kan hälso- och sjukvårdsperso- nalen skicka med patienten läkemedel hem i en sådan mängd att patienten kan påbörja och upprätthålla sin behandling tills läkemed- let går att få ut från ett öppenvårdsapotek. I sådana fall är bestäm- melserna om jourdos tillämpliga.
I HSLF-FS 2021:75 regleras även att en förskrivning som huvud- regel ska göras elektroniskt, 4 kap. 1 §. Vilka uppgifter en förskriv- ning ska innehålla för att vara giltig framgår av 4 kap. 8 §. Vid för- skrivning till människa ska följande receptuppgifter alltid anges. Patientens namn och personnummer eller i vissa fall samordnings- nummer eller födelsedatum, om patienten är en förmånsberättigad person enligt lagen (2002:160) om läkemedelsförmåner m.m., läke- medelsnamn, läkemedelsform och styrka samt mängd eller behand- lingstid, dosering, användning och behandlingsändamål, hur många gånger ett recept får expedieras, förskrivarens namn, förskrivarkod och yrke samt adress och telefon till förskrivarens arbetsplats och datum då förskrivningen görs.
Vissa receptuppgifter ska anges i förekommande fall. Dessa är om läkemedlet inte får bytas ut, om förutsättningarna för förmån
SOU 2025:71 |
Gällande rätt |
enligt lagen om läkemedelsförmåner m.m. är uppfyllda eller inte när läkemedel med förmånsbegränsning förskrivs, om läkemedlet ska lämnas ut kostnadsfritt till patienten enligt smittskyddslagen (2004:168), om förskriven dosering av läkemedlet är högre än rekommenderad dos för aktuellt ändamål ska detta markeras med ordet ”obs”, om en startförpackning ska lämnas ut, expedierings- intervall och hur långt intervallet i så fall ska vara, om det första ut- taget måste göras före ett visst datum, receptets giltighetstid om giltighetstiden ska vara kortare än ett år, särskilda upplysningar av vikt för expedierande öppenvårdsapotek samt förskrivarens arbets- platskod om receptet ska kunna expedieras inom läkemedelsför- månerna.
Föreskrifterna innehåller bland annat även bestämmelser om vad som gäller vid rekvirering av läkemedel från öppenvårdsapotek, 6 kap., och vad som ska iakttas på öppenvårdsapoteket vid expediering, 8 kap.
3.5Lagen (2018:1212) om nationell läkemedelslista
Enligt lagen (2018:1212) om nationell läkemedelslista ska E-hälso- myndigheten föra ett register över vissa uppgifter om förskrivna och expedierade läkemedel och andra varor för människor.45 Regi- stret omfattar inte läkemedel eller andra varor som förskrivs för att användas på djur.
Med förskrivna läkemedel avses att läkemedel har förskrivits på recept för en enskild patient för uthämtande av läkemedlet på ett öppenvårdsapotek.
Med andra varor avses teknisk sprit enligt 2 kap. 1 § läkemedels- lagen (2015:315), förbrukningsartiklar enligt 18 § lagen (2002:160) om läkemedelsförmåner m.m., livsmedel för särskilda näringsända- mål enligt 20 § lagen om läkemedelsförmåner m.m. samt sådana varor som upptas i Läkemedelsverkets föreskrifter (LVFS 2011:15) om tillämpning av läkemedelslagen (2015:315) på vissa varor. Varor som omfattas av LVFS 2011:15 är t.ex. medel avsedda att efter absorp- tion åstadkomma antikonceptionell verkan, medel som kan användas för att avbryta havandeskap och samtliga injektionsmedel.46
451 kap. 1 § lagen (2018:1212) om nationell läkemedelslista.
46Prop. 2017/18:223 Nationell läkemedelslista, s. 223.
Gällande rätt |
SOU 2025:71 |
De förbrukningsartiklar som omfattas av 18 § lagen om läkemedels- förmåner är varor för vilka det med stöd av 18 kap. 2 § läkemedels- lagen (2015:315) har föreskrivits att läkemedelslagen helt eller delvis ska gälla och som förskrivs enbart i födelsekontrollerande syfte av läkare eller barnmorskor, förbrukningsartiklar som en förmåns- berättigad behöver vid stomi och som förskrivs av läkare eller någon annan som Socialstyrelsen förklarat har behörighet till sådan förskriv- ning och förbrukningsartiklar som en förmånsberättigad på grund av sjukdom behöver för att tillföra kroppen ett läkemedel eller för egenkontroll av medicinering och som förskrivs av läkare, tandläkare eller någon annan som Socialstyrelsen förklarat har behörighet till sådan förskrivning.
Den som är under 16 år kan ha rätt till reducering av sina kost- nader för inköp av vissa livsmedel för särskilda näringsändamål som förskrivits av läkare. I Läkemedelsverkets föreskrifter (LVFS 1997:13) om förskrivning av vissa livsmedel anges vilka livsmedel som om- fattas av detta och övriga förutsättningar för sådan förskrivning.
Med begreppet expediering avses färdigställande och utlämnande från öppenvårdsapotek av läkemedel och andra varor som förskri- vits. I Läkemedelsverkets föreskrifter (HSLF-FS 2021:75) om för- ordnande och utlämnande av läkemedel och teknisk sprit finns be- stämmelser om vad som gäller för en behörig förskrivare när ett recept ska utfärdas. I föreskrifterna finns även bestämmelser för öppenvårds- apotekens hantering fram till att det förskrivna läkemedlet lämnas ut till rätt person.
Vid förskrivning av teknisk sprit och sådana varor som omfattas av LVFS 2011:15 sker förskrivning på samma sätt som för läkemedel
ienlighet med bestämmelserna i HSLF-FS 2021:75. Teknisk sprit förskrivs dock i regel inte.
Vid förskrivning av livsmedel och hjälpmedel görs detta på en livsmedelsanvisning respektive ett hjälpmedelskort, detta framgår av 7 och 8 §§ förordningen (2002:687) om läkemedelsförmåner.
SOU 2025:71 |
Gällande rätt |
3.5.1Registerlagstiftning
Lagen om nationell läkemedelslista reglerar vilka personuppgifter som får behandlas i registret och för vilka ändamål det får göras. Lagen kompletterar EU:s dataskyddsförordning47. Vid behandling av personuppgifter gäller lagen (2018:218) med kompletterande bestämmelser till EU:s dataskyddsförordning och föreskrifter som har meddelats i anslutning till den lagen, om inte annat följer av lagen om nationell läkemedelslista eller föreskrifter som har med- delats i anslutning till lagen. Lagen om nationell läkemedelslista medger behandling av känsliga personuppgifter. I lagen finns därför också en upplysning om att det i EU:s dataskyddsförordning finns bestämmelser om krav på tystnadsplikt vid behandling av känsliga personuppgifter.48
3.5.2Personuppgiftsansvar
E-hälsomyndigheten är personuppgiftsansvarig för den behandling av personuppgifter som myndigheten utför i den nationella läke- medelslistan.49 När apotekspersonal genom direktåtkomst tar del av uppgifter som finns hos E-hälsomyndigheten i nationella läkemedels- listan regleras den personuppgiftsbehandlingen i apoteksdatalagen (2009:367) och det är öppenvårdsapotekets tillståndshavare som är personuppgiftsansvarig för behandlingen. På motsvarande sätt re- glerar patientdatalagen (2008:355) när personal inom hälso- och sjukvården genom direktåtkomst behandlar personuppgifter i den nationella läkemedelslistan. För sådan personuppgiftsbehandling är vårdgivaren personuppgiftsansvarig. Några bestämmelser om person- uppgiftsansvar vid apotekens eller hälso- och sjukvårdens personupp- giftsbehandling återfinns därför inte i lagen om nationell läkeme- delslista.50
47Europaparlamentets och rådets förordning (EU) 2016/679 av den 27 april 2016 om skydd för fysiska personer med avseende på behandling av personuppgifter och om det fria flödet av sådana uppgifter och om upphävande av direktiv 95/46/EG (allmän dataskyddsförordning).
482 kap. 1 § och 2 § lagen (2018:1212) om nationell läkemedelslista.
493 kap. 1 § lagen (2018:1212) om nationell läkemedelslista.
50Prop. 2017/18:223 Nationell läkemedelslista, s. 82.
Gällande rätt |
SOU 2025:71 |
3.5.3Ändamål med personuppgiftsbehandling
Lagen om nationell läkemedelslista anger för vilka ändamål som personuppgifter får behandlas i registret. Inledningsvis anges att uppgifter får behandlas för ändamål som rör registrering av upp- gifter. Det avser registrering av uppgifter om förskrivna läkemedel och andra varor som ska expedieras på öppenvårdsapotek, uppgifter för tillämpning av bestämmelserna om läkemedelsförmåner vid köp av läkemedel m.m. och uppgifter om en fullmakt.51
Begreppet registrering omfattar både att uppgifter får föras in i registret och att de får finnas i registret under den tillåtna bevarande- tiden.52 Begreppet förskrivning utgör ett samlingsbegrepp för recept utfärdade på pappersblankett, dosrecept, livsmedelsanvisning, hjälp- medelskort och elektroniska recept.
Ändamålet registrering av uppgifter för tillämpning av bestäm- melser om läkemedelsförmåner är avsett att möjliggöra registrering av uppgifter för tillämpning av bestämmelserna om läkemedelsförmå- ner samt debitering till landstingen. Det innebär att en patients in- köpssummor vid uthämtning av läkemedel från öppenvårdsapotek kan registreras och löpande sammanräknas, vilket underlättar för patienten att utnyttja högkostnadsskyddet.53
Avsikten med ändamålet registrering av uppgifter om en fullmakt var enligt lagens förarbeten att möjliggöra registrering av fullmakter i ett nationellt register för att underlätta för såväl patienter som öppenvårdsapotek. Patienten behöver bara ge in fullmakten en gång och den blir därefter tillgänglig på alla öppenvårdsapotek. Öppen- vårdsapoteken behöver inte bygga upp egna fullmaktsregister. Det aktuella ändamålet avser att omfatta fullmakter som behövs för åt- gärder såsom beställning eller uthämtning av receptförskrivna läke- medel för någon annans räkning och fullmakter som ger en fysisk person rätt till direktåtkomst till den nationella läkemedelslistan avseende någon annan persons uppgifter i registret. Enligt lagens förarbeten ska det krävas att en fullmakt om direktåtkomst regi- streras i registret för att kunna utnyttjas, för andra fullmakter utgör ändamålet en möjlighet att även registrera dessa, men det utgör inget krav.54
51Se 3 kap. 2 § lagen (2018:1212) om nationell läkemedelslista.
52Prop. 2017/18:223 Nationell läkemedelslista, s. 223.
53Prop. 2017/18:223 Nationell läkemedelslista, s. 90.
54Prop. 2017/18:223 Nationell läkemedelslista, s. 90 f.
SOU 2025:71 |
Gällande rätt |
I lagen anges även ändamål som uttryckligen rör öppenvårds- apotek. Personuppgifter ska få behandlas i nationella läkemedels- listan om det är nödvändigt för öppenvårdsapotekens expediering av läkemedel och andra varor som förskrivits och för underlättande av en patients läkemedelsanvändning.55
Med expediering avses i lagen färdigställande och utlämnande av läkemedel och andra varor som förskrivits och ändamålet omfattar den behandling av personuppgifter som är nödvändig för en expedie- ring. Expedierande apotekspersonal har med stöd av detta ändamål, och utan krav på patientens samtycke, möjlighet att göra nödvändiga kontroller i enlighet med de författningar som styr verksamheten.56 Det kan t.ex. vara att kontrollera att förskrivningen är korrekt utfär- dad, om förskrivaren är behörig eller att efter kontroll i registret av patientens övriga aktuella förskrivningar kunna göra en bedömning av om läkemedlet, styrkan och dosen som förskrivits är rimlig för patienten. Det möjliggör också att expedierande personal kan upp- täcka eventuella risker för interaktioner mellan olika förskrivna läke- medel.
Ändamålet underlättande av patientens läkemedelsbehandling avser situationer när apotekspersonal, i andra sammanhang än i an- slutning till en expediering, behöver bistå en patient med råd eller svar på frågor avseende tidigare läkemedelsexpedieringar.57
För ändamål som rör hälso- och sjukvården får personuppgifter i nationella läkemedelslistan behandlas om det är nödvändigt för att åstadkomma en säker ordination av läkemedel och andra varor för en patient, beredande av vård eller behandling av en patient eller för komplettering av en patientjournal.58
En förutsättning för att fatta patientsäkra beslut om en patients behandling med läkemedel eller andra varor är att hälso- och sjuk- vårdspersonalen har tillgång till så många uppgifter som möjligt om patientens pågående och tidigare läkemedelsbehandlingar.
Ändamålet ”åstadkommande av en säker ordination av läkemedel och andra varor för en patient” avser att möjliggöra åtkomst till nöd- vändiga uppgifter i registret för berörd personal inom hälso- och sjukvården i samband med att läkemedel eller andra varor ska ordi-
553 kap. 3 § lagen (2018:1212) om nationell läkemedelslista.
56Se t.ex. 8 kap. 11 § Läkemedelsverkets föreskrifter (HSLF-FS 2021:75) om förordnande och utlämnande av läkemedel och teknisk sprit.
57Prop. 2017/18:223 Nationell läkemedelslista, s. 92 f. och 224.
583 kap. 4 § lagen (2018:1212) om nationell läkemedelslista.
Gällande rätt |
SOU 2025:71 |
neras. En ordination är enligt Socialstyrelsens termbank ett beslut av behörig hälso- och sjukvårdspersonal som är avsett att påverka en patients hälsotillstånd genom en hälso- och sjukvårdsåtgärd. Att begreppet ordination används är för att ändamålet ska täcka inte bara situationen att en ordinatör avser att utfärda ett nytt recept för en patient utan även exempelvis fall där läkemedel ska tillhanda- hållas och administreras av vårdpersonal och fall där det är aktuellt att rekommendera ett receptfritt läkemedel.
Ändamålet beredande av vård eller behandling av en patient gör det möjligt för behörig personal i hälso- och sjukvården att skaffa sig ett bättre underlag inför beslut om även andra vårdinsatser än läkemedelsbehandling. T.ex. ställer Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordination och hantering av läkemedel i hälso- och sjukvården krav på läkemedelsgenomgångar i vissa fall. För att kunna genomföra dessa är bl.a. uppgifterna i natio- nella läkemedelslistan nödvändiga.
Ändamålet komplettering av en patientjournal möjliggör att pati- entjournaler kan kompletteras med uppgifter från registret i de fall uppgifterna i registret har bidragit till ett ställningstagande om att vidta, eller inte vidta, en hälso- och sjukvårdsåtgärd. För att fullt ut kunna utnyttja detta ändamål krävs vissa tekniska förutsättningar, både i registret och i vårdens system.59
Utöver de ovan redovisade ändamålen finns ytterligare ändamål angivna i lagen som medger att nödvändig personuppgiftsbehandling får genomföras.60 Sammanfattningsvis är det för debitering till regio- nerna, ekonomisk uppföljning och framställning av statistik hos E-hälsomyndigheten samt för registrering och redovisning av upp- gifter för olika i lagen angivna syften till regioner, förskrivare, verk- samhetschefer, läkemedelskommittéer, Socialstyrelsen, Inspektionen för vård och omsorg, Tandvårds- och läkemedelsförmånsverket och Läkemedelsverket.
59Prop. 2017/18:223 Nationell läkemedelslista, s. 94 f. och 225.
603 kap. 5 § (2018:1212) lagen om nationell läkemedelslista.
SOU 2025:71 |
Gällande rätt |
3.5.4Andra ändamål och samtycke
Personuppgifter som behandlas med stöd av de uttryckliga ändamål som anges i lagen får behandlas även för andra ändamål under förut- sättning att uppgifterna inte behandlas på ett sätt som är oförenligt med det ändamål för vilket uppgifterna samlades in.61 Eftersom det är svårt att uttryckligen och uttömmande ange alla nödvändiga och tillåtna ändamål i en lag infördes detta ändamål i lagen. Ändamålet möjliggör t.ex. att E-hälsomyndigheten felsöker, validerar och kom- pletterar uppgifter i den nationella läkemedelslistan genom tekniska kopplingar mellan den nationella läkemedelslistan och vissa stöd- register som myndigheten förvaltar. Detta under förutsättning att personuppgiftsbehandlingen bidrar till att annan personuppgifts- behandling som är nödvändigt för de särskilda och uttryckliga ända- mål som är angivna i lagen kan ske på ett mer korrekt och patient- säkert sätt.62
Personuppgiftsbehandlingar som inte är tillåtna enligt lagen om nationell läkemedelslista får ändå utföras om den enskilde har lämnat ett uttryckligt samtycke till behandlingen.63 För behandling av käns- liga personuppgifter med stöd av samtycke krävs enligt EU:s data- skyddsförordning att den registrerade uttryckligen har lämnat sitt samtycke till behandlingen av dessa personuppgifter för ett eller flera specifika ändamål. Detta gäller dock inte då unionsrätten eller medlemsstaternas nationella rätt föreskriver att förbudet mot behand- ling av känsliga uppgifter inte kan upphävas av den registrerade.64
I lagens förarbeten anges som exempel på ändamål som kan om- fattas av lagens bestämmelse behandling av personuppgifter för mindre avgörande ändamål för patienten som t.ex. aviserings- och påminnelsetjänster, eller behandling av uppgifter om förskrivare.65
613 kap. 7 § första stycket lagen (2018:1212) om nationell läkemedelslista.
62Prop. 2017/18:223 Nationell läkemedelslista, s. 85 f.
633 kap. 7 § andra stycket lagen (2018:1212) om nationell läkemedelslista.
64Artikel 9.2 a Europaparlamentets och rådets förordning (EU) 2016/679 av den 27 april 2016 om skydd för fysiska personer med avseende på behandling av personuppgifter och om det fria flödet av sådana uppgifter och om upphävande av direktiv 95/46/EG.
65Prop. 2017/18:223 Nationell läkemedelslista, s. 228.
Gällande rätt |
SOU 2025:71 |
3.5.5Vissa begränsningar vid redovisning av uppgifter
Enligt lagens förarbeten ska behandling av personuppgifter i den nationella läkemedelslistan, utifrån ett integritetshänseende, ske endast i den mån det är nödvändigt för att respektive ändamål ska kunna tillgodoses.66 Som en integritetshöjande åtgärd infördes där- för i lagen begränsningar för vilka personuppgifter som får redo- visas för vissa av lagens ändamål. Vilka uppgifter om en person som får redovisas begränsas på olika sätt för flera ändamål. Det fastslås också att uppgift om ordinationsorsak endast får ingå i redovisning för ändamålen expediering av läkemedel och andra varor som för- skrivits, åstadkommande av en säker ordination av läkemedel och andra varor för en patient, beredande av vård eller behandling av en patient, komplettering av en patientjournal samt registrering och redovisning till regioner, förskrivare, verksamhetschefer och läke- medelskommittéer samt till Socialstyrelsen.67
3.5.6Vad registret får innehålla
Enligt lagen om nationell läkemedelslista får registret innehålla följande uppgifter:
1.förskriven vara, mängd och dosering, aktiv substans, läkemedels- form, styrka, administreringssätt, läkemedelsbehandlingens längd, behandlingsändamål och datum för förskrivning,
2.patientens namn, personnummer eller samordningsnummer, folkbokföringsort och postnumret i patientens bostadsadress,
3.förskrivarens namn, yrke, specialitet, arbetsplats, arbetsplatskod och förskrivarkod,
4.ordinationsorsak,
5.senaste datum för när läkemedelsbehandlingen ska följas upp eller avslutas,
66Prop. 2017/18:223 Nationell läkemedelslista, s. 101.
673 kap. 6 § lagen (2018:1212) om nationell läkemedelslista.
SOU 2025:71 |
Gällande rätt |
6.expedierad vara, mängd och dosering, datum för expediering, expedierande apotek, expedierande farmaceut och uppgift om att farmaceuten har motsatt sig utbyte av ett förskrivet läke- medel och skälen för det,
7.kostnad, kostnadsreducering enligt lagen (2002:160) om läke- medelsförmåner m.m. och kostnadsfrihet enligt smittskydds- lagen (2004:168),
8.andra uppgifter som krävs i samband med en förskrivning eller en expediering,
9.uppgift om samtycke och om spärrade uppgifter, och
10.uppgift om fullmakt.
För samtliga uppgifter gäller att de får ingå i registret i den utsträck- ning det behövs för de ändamål som anges i lagen.68
Uppgifterna enligt punkten 1 hänför sig till förskrivningen eller ordinationen av läkemedlet eller varan. Vid utfärdande av ett recept ska ett läkemedels handelsnamn anges69 men vid en ordination kan i stället namnet på den relevanta aktiva substansen (eller substanserna) dokumenteras70.
ISocialstyrelsens föreskrifter definieras begreppet ordinations- orsak (punkten 4 ovan) som den indikation som en ordinatör anger som skäl till en viss ordination.71 Ordinationsorsak är inte detsamma som uppgift om behandlingsändamål, som omfattas av punkten 1.
I lagens förarbeten anges att begreppet ordinationsorsak avser att omfatta såväl skälet till att en läkemedelsbehandling påbörjas (insättningsorsak) som skälet till att en läkemedelsordination ändras (ändringsorsak) eller avslutas. För hälso- och sjukvårdspersonal som är behörig att förskriva läkemedel är det av stor vikt att veta varför ett läkemedel har satts in, satts ut eller ändrats av en tidigare behand- lande ordinatör. Många läkemedel kan användas för ett flertal god- kända indikationer. Informationen är viktig att känna till inte bara inför en eventuell ny läkemedelsordination utan även vid rutinmässiga
683 kap. 8 § lagen (2018:1212) om nationell läkemedelslista.
694 kap. 8 § Läkemedelsverkets föreskrifter (HSLF-FS 2021:75) om förordnande och utläm- nande av läkemedel och teknisk sprit.
706 kap. 10 § Socialstyrelsens föreskrifter och allmänna råd (2017:37) om ordination och hantering av läkemedel i hälso- och sjukvården.
713 kap. 1 § Socialstyrelsens föreskrifter och allmänna råd (2017:37) om ordination och hantering av läkemedel i hälso- och sjukvården.
Gällande rätt |
SOU 2025:71 |
bedömningar av patientens hälsotillstånd och pågående behandlingar eller i samband med enkla eller fördjupade läkemedelsgenomgångar. Det anges vidare i förarbetena att även för expedierande personal på ett öppenvårdsapotek kan uppgiften om ordinationsorsak bidra till att läkemedel kan expedieras på ett mer patientsäkert sätt. I den farmakologiska kontroll som görs på öppenvårdsapotek ingår bl.a. att kontrollera läkemedlets dosering. Personalen är också skyldig att ge individuellt anpassad information och så långt det är möjligt förvissa sig om att patienten kan använda läkemedlet på rätt sätt. När farmaceuten bedömer om doseringen är rimlig behövs ofta infor- mation om vilket eller vilka sjukdomstillstånd som motiverar in- sättningen av läkemedlet. I de flesta fall räcker det med information om behandlingsändamål, men ibland behövs fler upplysningar. Reger- ingen anger också i förarbetena att för att uppgiften ordinationsorsak ska få registreras i nationella läkemedelslistan ska dokumentationen ske med hjälp av den nationella källan för ordinationsorsak som Social- styrelsen utvecklat. Uppgiften måste kunna hämtas till vårdens läke- medelsmoduler och föras över till E-hälsomyndigheten. Ett krav på att senaste datum för när läkemedelsbehandlingen ska följas upp eller avslutas (punkten 5 ovan) ska anges vid ordination av läkemedel följer av Socialstyrelsens föreskrifter.72
Med ”andra uppgifter som krävs i samband med en förskrivning eller en expediering”, punkten 8 ovan, avses uppgifter som behövs för att en förskrivning ska vara giltig enligt Läkemedelsverkets före- skrifter73 men som inte uttryckligen nämns i lagen om nationell läke- medelslista. Det är t.ex. information som måste registreras för att recept för flera uttag ska få sparas elektroniskt och uppgiften att en förskrivare motsätter sig utbyte av det förskrivna läkemedlet. Enligt förarbetena omfattar detta även parametrar av teknisk karaktär som behöver få lagras. Sådana parametrar som omnämns är en identitets- beteckning som kopplar ihop förskrivningar som registreras i den nationella läkemedelslistan med den aktuella läkemedelsordination som ligger till grund för förskrivningen liksom en parameter som entydigt beskriver vilket läkemedel som har förskrivits eller expedie- rats. Även krav på spårbarhet som följer av förordningen (EU) 2016/161 om säkerhetsdetaljer som anges på förpackningar för
726 kap. 10 § Socialstyrelsens föreskrifter och allmänna råd (2017:37) om ordination och hantering av läkemedel i hälso- och sjukvården.
734 kap. Läkemedelsverkets föreskrifter (HSLF-FS 2021:75) om förordnande och utläm- nande av läkemedel och teknisk sprit.
SOU 2025:71 |
Gällande rätt |
humanläkemedel74 innebär att uppgifter som inte är personuppgifter behöver få lagras i registret. Uppgifter om att ett läkemedel ska dos- dispenseras är ytterligare en uppgift som omfattas av denna punkt.75 Uppgifter om fullmakt, punkten 10 ovan, omfattar både full- makter om att ge någon annan fysisk person direktåtkomst till regi- stret och fullmakter som ger en annan person rätt att hämta ut läke-
medel på öppenvårdsapotek.
3.5.7Sökbegränsningar
På vilket sätt personuppgifter kan sammanställas är en viktig fråga ur integritetsskyddssynpunkt och elektronisk lagring av informa- tion möjliggör i det närmaste obegränsade sökmöjligheter. Som en integritetshöjande åtgärd har vissa sökbegränsningar därför införts i lagen om nationell läkemedelslista.76 Begränsningarna anges i 3 kap.
9 § lagen om nationell läkemedelslista.
Ordinationsorsak får inte användas som sökbegrepp. Patientens identitet får endast användas som sökbegrepp för de ändamål som anges i 3 kap. 2–4 §§ lagen om nationell läkemedelslista. Det är ända- målen som medger personuppgiftsbehandling för
1.registrering av uppgifter om förskrivna läkemedel och andra varor som ska expedieras på öppenvårdsapotek, uppgifter för tillämpning av bestämmelserna om läkemedelsförmåner vid köp av läkemedel m.m., samt uppgifter om en fullmakt,
2.expediering av läkemedel och andra varor som förskrivits eller underlättande av en patients läkemedelsanvändning vid öppen- vårdsapotek och
3.åstadkommande av en säker ordination av läkemedel och andra varor för en patient, beredande av vård eller behandling av en patient eller komplettering av en patientjournal i hälso- och sjukvården.
74Kommissionens delegerade förordning (EU) 2016/161 av den 2 oktober 2015 om kom- plettering av Europaparlamentets och rådets direktiv 2001/83/EG genom fastställande av närmare bestämmelser om de säkerhetsdetaljer som anges på förpackningar för human- läkemedel.
75Prop. 2017/18:223 Nationell läkemedelslista, s. 115 f.
76A.a., s. 117.
Gällande rätt |
SOU 2025:71 |
Ett ombuds identitet får användas som sökbegrepp endast för ända- målet registrering av uppgifter om en fullmakt och för öppenvårds- apotekens ändamål; expediering av läkemedel och andra varor som förskrivits och underlättande av en patients läkemedelsanvändning vid öppenvårdsapotek.77
Förskrivarens identitet får endast användas som sökbegrepp för ändamålen registrering och redovisning till förskrivare, vissa verk- samhetschefer och läkemedelskommittéer av uppgifter för medicinsk uppföljning, utvärdering och kvalitetssäkring i hälso- och sjukvår- den78 samt för ändamålet registrering och redovisning till Inspektio- nen för vård och omsorg av uppgifter om en läkares eller tandläkares förskrivning av narkotiskt läkemedel eller annat särskilt läkemedel, för inspektionens tillsyn över hälso- och sjukvårdspersonal enligt patientsäkerhetslagen (2010:659)79.
3.5.8Bevarandetid
Huvudregeln enligt artikel 5.1 e i EU:s dataskyddsförordning är att personuppgifter inte får lagras i en form som möjliggör identifier- ing av den registrerade under längre tid än vad som är nödvändigt för de ändamål för vilka personuppgifterna behandlas. Utgångspunk- ten får anses vara ett uttryck för resultatet av avvägningen mellan integritetsskyddsintresset och det informationsbehov som uppgif- terna ska tillgodose. Artikel 6.2 och 6.3 i EU:s dataskyddsförordning tillåter nationella bestämmelser om lagringstid när behandlingen grundar sig på en rättslig förpliktelse eller en arbetsuppgift av allmänt intresse eller som ett led i myndighetsutövning enligt artikel 6.1 c eller e i EU:s dataskyddsförordning.
Regeringen gjorde följande bedömning i frågan om lämplig beva- randetid för uppgifter i den nationella läkemedelslistan.80 Ändamålen med den personuppgiftsbehandling som regleras genom nu före- slagen lag framgår av förslagets 3 kap. 2–5 §§. Ändamålen för den nationella läkemedelslistan avser huvudsakligen hantering som är nödvändig för att en patient ska kunna få en säker ordination och expediering av ett förskrivet läkemedel samt redovisning av upp-
77Se 3 kap. 2 § 3 och 3 § lagen (2018:1212) om nationell läkemedelslista.
78Se 3 kap. 5 § 4 lagen (2018:1212) om nationell läkemedelslista.
79Se 3 kap. 5 § 6 lagen (2018:1212) om nationell läkemedelslista.
80Prop. 2017/18:223 Nationell läkemedelslista, s. 121.
SOU 2025:71 |
Gällande rätt |
gifter till olika myndigheter som behöver uppgifterna i sin tillsyn eller övriga verksamhet. Vid bedömning av vilken bevarandetid som är lämplig bör syftet med dessa ändamål vara vägledande. För att en patient ska kunna få en säker ordination och expediering av ett för- skrivet läkemedel behöver den nationella läkemedelslistan kunna förmedla uppgifter om en patients aktuella läkemedelssituation men också en viss läkemedelshistorik. Uppgifterna behövs för att bl.a. kunna identifiera biverkningar, förhindra ordination och expediering av läkemedel som tidigare orsakat biverkningar, begränsa onödig antibiotikaanvändning och bevaka den kumulativa dosen av ett läke- medel. Med hänsyn till att den nationella läkemedelslistan kommer att innehålla en nationell samling av känsliga personuppgifter är det av särskild vikt att bevarandetiden inte sträcker sig längre än vad som är nödvändigt för att tillgodose de aktuella ändamålen. Reger- ingen bedömer att en tid om fem år är välavvägd för att ändamålen med personuppgiftsbehandlingen i den nationella läkemedelslistan ska kunna uppnås. Bevarandetiden ska räknas från det att en giltig förskrivning registrerades i den nationella läkemedelslistan. Samtliga de uppgifter om ordinationer, förskrivningar och expedieringar som hör till en förskrivning ska följa förskrivningens bevarandetid. Reger- ingens konstaterar att detta får till följd att vissa uppgifter i registret, t.ex. ändringar som görs i en befintlig förskrivning, eller del- och helexpedieringar, dvs. uppgifter som hör till en förskrivning men som registrerats i registret i ett senare skede, kommer att bevaras under en kortare tid än fem år. När fem år har gått från det att en giltig förskrivning registrerats i registret ska samtliga uppgifter till- hörande förskrivningen tas bort.
Personuppgifter som inte kan hänföras till en förskrivning ska tas bort senast fem år efter det att uppgifterna registrerades. Upp- gifter om samtycke och spärrning ska tas bort när de inte längre är nödvändiga för de ändamål i lagen som är relevanta för deras regi- strering.81
813 kap. 10 § lagen (2018:1212) om nationell läkemedelslista.
Gällande rätt |
SOU 2025:71 |
3.5.9Den registrerades inställning till personuppgiftsbehandling
Behandling av personuppgifter som är tillåten enligt lagen om natio- nell läkemedelslista får utföras även om den registrerade inte har lämnat sitt samtycke till behandlingen., utom i de fall där det särskilt anges att samtycke kräv.82 I lagens förarbeten anges att den rättsliga grunden för behandling av personuppgifter i den nationella läke- medelslistan, med undantag för registrering av fullmakter och under- lättande av en patients läkemedelsbehandling, är att behandlingen är nödvändig för att fullgöra den rättsliga förpliktelse som E-hälsomyn- digheten har i fråga om att föra och ansvara för register som öppen- vårdsapotek och vårdgivare behöver ha tillgång till för en patientsäker och kostnadseffektiv läkemedelshantering, och att särskilt ansvara för de register som anges i myndighetens instruktion. Dataskydds- förordningen ger inte den registrerade rätt att invända mot behand- ling som sker med stöd av grunden rättslig förpliktelse.83
Regleringen innebär bland annat att all registrering av uppgifter i den nationella läkemedelslistan, med undantag av uppgifter om full- makter och om förskrivna läkemedel och andra varor till en patient med dosdispenserade läkemedel, får ske utan patientens samtycke.
Ordet registrering innefattar både att uppgifter får föras in i registret och att de får finnas i registret under den tillåtna bevarandetiden. Rätten för en enskild att få uppgifter raderade gäller inte när behand- lingen är nödvändig för att bl.a. uppfylla en rättslig förpliktelse som kräver behandling enligt nationell rätt eller utföra en uppgift av allmänt intresse, eller om behandlingen är nödvändig för skäl som rör ett viktigt allmänt intresse på folkhälsoområdet enligt artikel 9.2 h i dataskyddsförordningen.84
Enligt lagens förarbeten är den rättsliga grunden för E-hälsomyn- digheten att få behandla personuppgifter för ändamålet registrering av uppgifter om en fullmakt är samtycke.85 Både den som ger full- makten och ombudet får registreras i registret och båda dessa behöver därför också ge sitt samtycke för att fullmakten ska få registreras.
För vissa i lagen angivna ändamål krävs den enskildes samtycke som en integritetshöjande åtgärd utan att samtycket utgör den rätts-
824 kap. 1 § första stycket lagen (2018:1212) om nationell läkemedelslista.
83Prop. 2017/18:223 Nationell läkemedelslista, s. 124.
84Se också prop. 2017/18:223 Nationell läkemedelslista, s. 125.
85A.a., s. 125.
SOU 2025:71 |
Gällande rätt |
liga grunden för behandlingen. När ett samtycke utgör rättslig grund för personuppgiftsbehandling måste samtycket vara frivilligt, speci- fikt, informerat och utgöra en otvetydig viljeyttring, genom vilken den registrerade, antingen genom ett uttalande eller genom en otve- tydig bekräftande handling, godtar den aktuella behandlingen av per- sonuppgifter som rör honom eller henne, se artikel 4.11 i EU:s data- skyddsförordning. Den registrerade kan när som helst återkalla ett lämnat samtycke enligt artikel 7.3 i EU:s dataskyddsförordning. Det anges i lagens förarbeten att införandet av den integritetshöjande åtgärden samtycke är tillåten, då det får ses som preciseringar enligt artikel 6.2 och 6.3 i EU:s dataskyddsförordning.86
För registrering av uppgifter om en patient som får dosdispense- rade läkemedel krävs patientens samtycke. En patient som har svårt att hantera och dosera sina läkemedel kan erbjudas tjänsten dosdispen- sering av läkemedel. Förenklat innebär dosdispensering att läkemedel tas ut ur tillverkarens originalförpackning och packas om i påsar eller dosetter utifrån den dosering som patienten ordinerats. En patient som får dosdispenserade läkemedel kan även få vissa läkemedel för- skrivna i helförpackningar. Tjänsten medför att alla förskrivningar som rör en patient som får sina läkemedel dosdispenserade, även sådana som avser helförpackning av läkemedel, måste finnas sam- lade i elektronisk form och vara åtkomliga för utpekad hälso- och sjukvårdspersonal.87
I lagens förarbeten anges att det bör införas en integritetshöjande åtgärd i form av att patienten måste ha lämnat sitt samtycke för att uppgifter om en patient som får dosdispenserade läkemedel ska få registreras i den nationella läkemedelslistan. Detta innebär att patien- ten samtycker till att uppgifter om förskrivna läkemedel och andra varor registreras under den tid som patienten får dosdispenserade läkemedel. De enskilda registreringarna och hälso- och sjukvårdsper- sonalens direktåtkomst kan för dessa patienter därefter ske utan ytter- ligare samtycke. Samtycket bör enligt förarbetena rimligen lämnas i dialog med berörd hälso- och sjukvårdspersonal. Eftersom patientens samtycke är en förutsättning för att uppgifterna ska få registreras i den nationella läkemedelslistan måste emellertid E-hälsomyndig-
86A.a., s. 127.
87A.a., s. 127 f.
Gällande rätt |
SOU 2025:71 |
heten informeras om att ett sådant samtycke finns. Detta bör kunna åstadkommas genom en teknisk lösning.88
Vidare krävs patientens samtycke för vissa ytterligare åtgärder. Detta gäller för
–hävande av spärr,
–behandling av uppgifter som annars inte är tillåten,
–direktåtkomst för expedierande personal på öppenvårdsapotek till uppgift om ordinationsorsak i samband med expediering av läkemedel och andra varor som förskrivits,
–direktåtkomst för expedierande personal på öppenvårdsapotek till andra uppgifter än ordinationsorsak för underlättande av en patients läkemedelsanvändning,
–direktåtkomst till uppgifter för hälso- och sjukvårdspersonal som har behörighet att förskriva läkemedel eller andra varor för ändamålen åstadkommande av en säker ordination av läkemedel och andra varor för en patient, beredande av vård eller behandling av en patient eller komplettering av en patientjournal, och
–direktåtkomst till uppgifter för en sjuksköterska utan behörighet att förskriva läkemedel eller andra varor, dietist och farmaceut i hälso- och sjukvården för ändamålen beredande av vård eller be- handling av en patient och komplettering av en patientjournal.89
När det gäller kravet på samtycke för direktåtkomst till uppgifter i registret för personal på öppenvårdsapotek och i hälso- och sjuk- vården gjordes följande överväganden i lagens förarbeten.90 Samtycket utgör i dessa fall en integritetshöjande åtgärd. Direktåtkomst till uppgifter i den nationella läkemedelslistan får enligt regeringens bedömning anses omfatta både behandling som innebär att E-hälso- myndigheten tillgängliggör uppgifter för utlämnande genom direkt- åtkomst och behandling som innebär att personal på öppenvårds- apotek respektive inom hälso- och sjukvården får uppgifter utlämnade genom direktåtkomst. I de fall patientens samtycke är en förutsättning för att uppgifterna ska få lämnas ut genom direktåtkomst är det den personuppgiftsansvarige som ska se till att patienten har lämnat sitt
88A.a., s. 128 f.
894 kap. 1 § lagen (2018:1212) om nationell läkemedelslista.
90Prop. 2017/18:223 Nationell läkemedelslista, s. 129 f.
SOU 2025:71 |
Gällande rätt |
samtycke till behandlingen. Personal på öppenvårdsapotek respektive inom hälso- och sjukvården som får uppgifter utlämnande genom direktåtkomst ska, i de fall direktåtkomsten kräver patientens sam- tycke, ha fått patientens samtycke innan de bereder sig direktåtkomst till uppgifter i den nationella läkemedelslistan. E-hälsomyndigheten som lämnar ut uppgifter genom direktåtkomst ska, i de fall direkt- åtkomsten kräver patientens samtycke, ha fått patientens samtycke innan uppgifter i den nationella läkemedelslistan får lämnas ut. Pati- entens samtycke bör i sådana fall enligt regeringen genom en tek- nisk lösning kunna förmedlas från öppenvårdsapotek respektive hälso- och sjukvården till E-hälsomyndigheten.
För en patient som inte endast tillfälligt saknar förmåga att ta ställning till om uppgifter ska få behandlas för ändamål som annars skulle kräva patientens samtycke får uppgifter i den nationella läke- medelslistan behandlas, om patientens inställning till en sådan behand- ling så långt som möjligt har klarlagts, och det inte finns anledning att anta att patienten skulle ha motsatt sig personuppgiftsbehand- lingen. Detta regleras i 4 kap. 2 § lagen om nationell läkemedelslista.
3.5.10Direktåtkomst till uppgifter i registret och om spärrning av uppgifter
Med direktåtkomst avses vanligtvis att någon har direkt tillgång till någon annans register eller databas och på egen hand kan söka infor- mation men utan att kunna påverka innehållet i registret eller data- basen. I prop. 2017/18:223 anges bl.a. följande om regleringen om direktåtkomst i nationella läkemedelslistan.91 Högsta förvaltnings- domstolen har i ett avgörande som avsåg utlämnande av uppgifter i form av upptagning mellan myndigheter ansett att gränsdragningen mellan vad som är direktåtkomst och annat utlämnande på medium för automatiserad behandling beror på om den aktuella uppgiften kan anses förvarad hos den mottagande myndigheten enligt 2 kap.
3 § andra stycket tryckfrihetsförordningen. Avgörande är således om uppgiften är tillgänglig för myndigheten med tekniskt hjälpmedel som myndigheten själv utnyttjar för överföring i sådan form att den kan läsas, avlyssnas eller på annat sätt uppfattas, HFD 2015 ref. 61. Högsta förvaltningsdomstolens dom kan tolkas så att den tekniska
91Prop. 2017/18:223 Nationell läkemedelslista, s. 143 f.
Gällande rätt |
SOU 2025:71 |
utformningen av en myndighets system för utlämnande av uppgifter kan bli avgörande för om utlämnandet ska anses som direktåtkomst eller som annat utlämnande på medium för automatiserad behandling. I fråga om den nationella läkemedelslistan är det E-hälsomyndigheten som kommer att utforma den tekniska lösningen för utlämnade av uppgifter från registret. Regeringen anser att den föreslagna lagen om nationell läkemedelslista bör vara så teknikneutral och flexibel som möjligt så att den inte behöver förändras i takt med den tekniska utvecklingen eller till följd av förändringar av myndigheternas behov av att behandla personuppgifter. För det fall att den tekniska lös- ningen för den nationella läkemedelslistan utformas på så sätt att den är att beteckna som direktåtkomst anser regeringen att det be- hövs särskilda bestämmelser om att direktåtkomst i sådana fall är tillåten. Regeringen anser därför att det i lagen om nationell läke- medelslista bör regleras att utlämnande av uppgifter under vissa i lagen angivna förutsättningar kan göras genom direktåtkomst.
Reglerna om direktåtkomst och spärrande av uppgifter är nära knutna till varandra. Nedan följer en beskrivning av de bestämmel- ser i lagen om nationell läkemedelslista som reglerar detta.
Expedierande personal på öppenvårdsapotek
Expedierande personal på öppenvårdsapotek har för ändamålet expe- diering av läkemedel eller andra varor som förskrivits direktåtkomst till en patients uppgifter i registret utan patientens samtycke. Detta gäller med undantag för uppgift om ordinationsorsak där samtycke krävs. Rätten till direktåtkomst avser uppgifter som registrerats i nationella läkemedelslistan inom de senaste 24 månaderna.92 För ändamålet underlättande av en patients läkemedelsanvändning får expedierande personal på öppenvårdsapotek med patientens sam- tycke ha direktåtkomst till andra uppgifter i nationella läkemedels- listan än uppgift om ordinationsorsak.93 Direktåtkomsten till upp- gifter är i dessa fall inte begränsad till uppgifter som registrerats inom de senaste 24 månaderna.
För personuppgiftsbehandling som görs på öppenvårdsapotek kan en patient spärra apotekspersonalens direktåtkomst till uppgifter
925 kap. 1 § lagen (2018:1212) om nationell läkemedelslista.
935 kap. 2 § lagen (2018:1212) om nationell läkemedelslista.
SOU 2025:71 |
Gällande rätt |
i nationella läkemedelslistan för ändamålet underlättande av en pati- ents läkemedelsanvändning. Patienten kan även spärra apoteksperso- nalens direktåtkomst till uppgift om ordinationsorsak vid person- uppgiftsbehandling för ändamålet expediering av läkemedel och andra varor som förskrivits.94
Hälso- och sjukvårdspersonal
Hälso- och sjukvårdspersonal som har behörighet att förskriva läke- medel eller andra varor får med patientens samtycke ha direktåtkomst till uppgifter i nationella läkemedelslistan. Det gäller för samtliga ändamål som rör hälso- och sjukvården. Dessa ändamål är som nämnts tidigare åstadkommande av en säker ordination av läkemedel och andra varor för en patient, beredande av vård eller behandling av en patient eller komplettering av en patientjournal.95 Det finns några undantag för kravet på samtycke till direktåtkomst. Det gäller dels uppgiften om att en patient fått särskilda läkemedel förskrivna, dels i vissa situationer när patienten är ur stånd att ge ett behövligt sam- tycke, se vidare nedan i avsnitt Åtkomst till uppgifter trots spärr i vissa fall.
Sjuksköterskor utan behörighet att förskriva läkemedel eller andra varor, dietister och farmaceuter i hälso- och sjukvården får med pati- entens samtycke också ha direktåtkomst till uppgifter i registret.
För dessa personalkategorier gäller detta enbart för ändamålen bere- dande av vård och behandling för en patient och komplettering av en patientjournal.96
Patienten har möjlighet att spärra direktåtkomst till sina upp- gifter i registret för samtliga ändamål som rör hälso- och sjukvår- den.97 Se dock nedan avsnitt Åtkomst till uppgifter trots spärr i vissa fall.
944 kap. 3 § första stycket lagen (2018:1212) om nationell läkemedelslista.
955 kap. 3 § 1 lagen (2018:1212) om nationell läkemedelslista.
965 kap. 3 § 2 lagen (2018:1212) om nationell läkemedelslista.
974 kap. 3 § första stycket lagen (2018:1212) om nationell läkemedelslista.
Gällande rätt |
SOU 2025:71 |
Patienten och dennes ombud
Under förutsättning att det inte ligger några spärrar för uppgifter i nationella läkemedelslistan enligt vad som anges nedan, se avsnitt Spärr i förhållande till patienten själv eller dennes vårdnadshavare, har patienten direktåtkomst till uppgifter om sig själv i registret. Patienten kan också genom fullmakt ge rätt till direktåtkomst till uppgifterna till en annan fysisk person. En sådan fullmakt ska finnas registrerad i nationella läkemedelslistan.98
Spärrar
Enligt lagens förarbeten gjordes följande överväganden inför att möjligheten att spärra uppgifter i registret infördes.99 Nationella läkemedelslistan möjliggör en bred tillgänglighet till patienters uppgifter. Möjligheten att få sina uppgifter spärrade är en viktig integritetshöjande insats men har begränsats till vissa angivna ända- mål för att på så sätt möjliggöra att ändamålen med personuppgifts- behandlingen i den nationella läkemedelslistan kan uppnås, samtidigt som patientens integritet skyddas. Med åtgärden spärrning kan pati- enten på ett enklare sätt än med ett nekat samtycke förhindra till- gängliggörandet av vissa utpekade uppgifter som patienten själv upp- fattar som särskilt integritetskränkande.
Om en patient spärrat uppgifter för direktåtkomst får utpekad hälso- och sjukvårdspersonal trots detta ha direktåtkomst till upp- giften att det finns spärrade uppgifter.100 Enligt lagens förarbeten motiveras denna möjlighet av att den som med patientens samtycke ges direktåtkomst till uppgifter i registret bör ha kännedom om att tillgängliggörandet inte avser samtliga de uppgifter om patienten som finns i registret. Vetskapen om att uppgifterna inte är fullstän- diga behövs för att hälso- och sjukvårdsbeslut inte ska fattas på fel- aktiga antaganden. Kännedom om att det finns spärrade uppgifter kan också initiera en önskvärd dialog med patienten.101
985 kap. 6 § lagen (2018:1212) om nationell läkemedelslista.
99Prop. 2017/18:223 Nationell läkemedelslista, s.136.
1004 kap. 3 § sista stycket och 5 kap. 3 § andra stycket lagen (2018:1212) om nationell läke- medelslista.
101Prop. 2017/18:223 Nationell läkemedelslista, s. 137 f.
SOU 2025:71 |
Gällande rätt |
En vårdnadshavare har inte rätt att få uppgifter om sitt barn spärrade.102 Med barn avses den som är under 18 år. Detta motsvarar bestämmelser i 4 kap. 4 § andra stycket patientdatalagen (2008:355). Avsikten med den bestämmelsen är att öka vårdpersonalens möjlig- heter att upptäcka barn som far illa och att bedöma om en anmälan ska göras till socialnämnden för att barnet ska få nödvändigt skydd. Detta skäl har ansetts väga tyngre än den integritetskränkning som kan uppstå till följd av att vårdnadshavare inte kan spärra sina barns uppgifter. Enligt prop. 2017/18:223 bör dessa avvägningar gälla även för den nationella läkemedelslistan.103
Åtkomst till uppgifter trots spärr i vissa fall
Det finns några undantag i lagen från att en spärr helt upprätthålls. En spärr som patienten begärt hindrar inte att utpekad hälso- och sjukvårdspersonal ges direktåtkomst till uppgifter i registret för vissa ändamål om patienten får dosdispenserade läkemedel.104
I de fall narkotiska eller andra särskilda läkemedel har förskrivits till en patient får direktåtkomst till den uppgiften ges till hälso- och sjukvårdspersonal som har behörighet att förskriva läkemedel, för samtliga ändamål som rör hälso- och sjukvården. Denna direkt- åtkomst får ges utan patientens samtycke och även om det finns spärrade uppgifter. Direktåtkomsten avser endast uppgiften om att en sådan förskrivning har gjorts, och inte till några andra uppgifter hänförliga till förskrivningen. Vetskapen om att en patient har fått narkotiska eller andra särskilda läkemedel förskrivna behövs för att inga hälso- eller sjukvårdsbeslut ska fattas på felaktiga antaganden, och för att initiera en önskvärd dialog mellan en patient och hälso- och sjukvårdspersonalen.105 I förarbetena anges vidare att utan sådan åtkomst kan det vara svårt för förskrivaren att utifrån tillgängliga uppgifter bedöma om det finns risk för missbruksproblematik eller uttag av läkemedel som överskrider de mängder som behövs för det personliga bruket, t.ex. för att patienten vill sälja läkemedlet vidare. Även om hälso- och sjukvårdspersonal inte kan få information om
1024 kap. 3 § andra stycket lagen (2018:1212) om nationell läkemedelslista.
103Prop. 2017/18:223 Nationell läkemedelslista, s. 138.
1044 kap. 3 § tredje stycket och 5 kap. 3 § tredje stycket lagen (2018:1212) om nationell läke- medelslista.
105Prop. 2017/18:223 Nationell läkemedelslista, s. 138.
Gällande rätt |
SOU 2025:71 |
vilket eller vilka läkemedel det handlar om kommer uppgiften sanno- likt att bidra till en mer kontrollerad förskrivning av denna typ av läkemedel. I lagens förarbeten gjordes vidare bedömningen att de potentiella skadeverkningarna som missbruk eller oegentlig uthämt- ning av den här typen av läkemedel har är ett tillräckligt starkt skäl för att tillåta direktåtkomst till denna övergripande uppgift. Det var därför befogat ur integritetssynpunkt att införa denna möjlighet.106 Direktåtkomsten får ges till sådana uppgifter som registrerats inom de senaste 24 månaderna.107 Skälet till tidsbegränsningen är att direkt- åtkomsten syftar till att bedöma risken för aktuella missbruksför- hållanden, t.ex. missbruksproblematik eller risk för uttag av läke- medel som inte bygger på ett personligt, medicinskt behov.108
Direktåtkomst får även ges till hälso- och sjukvårdspersonal som har behörighet att förskriva läkemedel och till sjuksköterska utan sådan behörighet om det är nödvändigt för att en patient ska kunna få den vård och behandling som patienten oundgängligen behöver och patienten inte kan ge sitt samtycke. Det gäller för samtliga de ändamål som rör hälso- och sjukvården. Direktåtkomsten gäller även för uppgifter som har spärrats.109 Avsikten med denna bestäm- melse är att det i en akut nödsituation ska vara möjligt att komma åt information i registret som kan antas ha betydelse för den vård och behandling som patienten oundgängligen behöver i sådana fall där det inte kan inväntas ett inhämtande av samtycke.110
Spärr i förhållande till patienten själv eller dennes vårdnadshavare
Direktåtkomst till uppgifter i nationella läkemedelslistan om ordina- tionsorsak kan i vissa fall spärras för patienten själv och för patien- tens ombud som genom fullmakt får ha direktåtkomst till registret.111 E-hälsomyndigheten ska spärra uppgift om ordinationsorsak för direktåtkomst av patienten om uppgiften inte får lämnas ut enligt 25 kap. 6 § offentlighet- och sekretesslagen (2009:400), förkortad OSL. 25 kap. 6 § OSL gäller i förhållande till den vård- eller behand- lingsbehövande själv för uppgift om hans eller hennes hälsotillstånd,
106Prop. 2017/18:223 Nationell läkemedelslista, s. 162.
1075 kap. 4 § andra stycket lagen (2018:1212) om nationell läkemedelslista.
108Prop. 2017/18:223 Nationell läkemedelslista, s. 162.
1095 kap. 5 § lagen (2018:1212) om nationell läkemedelslista.
110Prop. 2017/18:223 Nationell läkemedelslista, s. 162.
1114 kap. 4 § lagen (2018:1212) om nationell läkemedelslista.
SOU 2025:71 |
Gällande rätt |
om det med hänsyn till ändamålet med vården eller behandlingen är av synnerlig vikt att uppgiften inte lämnas till honom eller henne. Hälso- och sjukvårdspersonal som har behörighet att förskriva läke- medel som efter en prövning enligt 25 kap. 6 § OSL eller 6 kap. 12 § andra stycket patientsäkerhetslagen (2010:659) finner att uppgiften om ordinationsorsak inte får lämnas ut till patienten själv ska begära hos E-hälsomyndigheten att uppgiften ska spärras för direktåtkomst av patienten. Av 6 kap. 12 § andra stycket patientsäkerhetslagen följer att tystnadsplikt som gäller för en uppgift om en patients hälsotill- stånd även gäller i förhållande till patienten själv, om det med hänsyn till ändamålet med hälso- och sjukvården är av synnerlig vikt att uppgiften inte lämnas till patienten.
E-hälsomyndigheten ska även spärra en uppgift om en underårig i den nationella läkemedelslistan för direktåtkomst av vårdnadshavaren om uppgiften inte får lämnas ut enligt 12 kap. 3 § OSL. Av 12 kap.
3 § OSL följer att sekretess till skydd för en enskild underårig gäller även i förhållande till dennes vårdnadshavare. Sekretessen gäller dock inte i förhållande vårdnadshavaren i den utsträckning denne enligt 6 kap. 11 § föräldrabalken har rätt och skyldighet att bestämma i frågor som rör den underåriges personliga angelägenheter, såvida det inte kan antas att den underårige lider betydande men om upp- giften röjs för vårdnadshavaren, eller om det annars anges i OSL. Spärren innebär att vårdnadshavaren inte får direktåtkomst till upp- giften. Även i dessa fall ska hälso- och sjukvårdspersonal som har behörighet att förskriva läkemedel och som efter en prövning enligt 12 kap. 3 § OSL eller 6 kap. 12 § andra stycket patientsäkerhets- lagen finner att en uppgift om en underårig i nationella läkemedels- listan inte får lämnas ut till dennes vårdnadshavare, begära att E-hälso- myndigheten spärrar uppgiften för direktåtkomst av vårdnadshavaren.
Hävande av spärr
En spärr som patienten begärt ska endast hävas av E-hälsomyndig- heten om patienten samtycker till det.112
Om E-hälsomyndigheten spärrat uppgift om ordinationsorsak för direktåtkomst av patienten själv eller uppgifter om en underårig för direktåtkomst av dennes vårdnadshavare efter begäran av hälso-
1124 kap. 5 § lagen (2018:1212) om nationell läkemedelslista.
Gällande rätt |
SOU 2025:71 |
och sjukvårdspersonal enligt vad som beskrivits ovan, ska E-hälso- myndigheten häva spärren efter begäran om det av hälso- och sjuk- vårdspersonal. Spärren ska hävas om den uppgift som spärrats kan lämnas ut till patienten respektive vårdnadshavaren.113
3.5.11E-hälsomyndighetens uppgifts- och informationsskyldighet
För bestämmelserna i lagen om nationell läkemedelslista som ger rätt till direktåtkomst till uppgifter i registret finns motsvarande bestämmelser i lagen som ålägger E-hälsomyndigheten att lämna ut de aktuella uppgifterna. Enligt 6 kap. 1 och 2 §§ ska E-hälsomyndig- heten lämna ut de uppgifter som omfattas av direktåtkomst för expe- dierande apotekspersonal, hälso- och sjukvårdspersonal som har behörighet att förskriva läkemedel eller andra varor, sjuksköterska utan sådan behörighet samt till dietist och farmaceut i hälso- och sjukvården.
På motsvarande sätt ska E-hälsomyndigheten lämna vissa upp- gifter för i lagen angivna ändamål till
1.regioner som ska ersätta kostnader för läkemedelsförmåner eller för läkemedel som är kostnadsfria för patienten enligt smittskydds- lagen (2004:168),
2.förskrivare eller verksamhetschef där förskrivaren tjänstgör,
3.Socialstyrelsen,
4.Inspektionen för vård och omsorg,
5.Tandvårds- och läkemedelsförmånsverket, samt
6.Läkemedelsverket.114
Lagen om nationell läkemedelslista ålägger också E-hälsomyndig- heten att informera Inspektionen för vård och omsorg om vad som framkommer vid E-hälsomyndighetens kontroll av de elektroniska system som används av den som bedriver verksamhet inom hälso- och sjukvården för direktåtkomst till uppgifter från den nationella läkemedelslistan. Inspektionen för vård och omsorg ska även infor- meras om att någon som bedriver hälso- och sjukvårdsverksamhet
1134 kap. 6 § lagen (2018:1212) om nationell läkemedelslista.
1146 kap. 3–8 §§ lagen (2018:1212) om nationell läkemedelslista.
SOU 2025:71 |
Gällande rätt |
inte lämnar de uppgifter till E-hälsomyndigheten som åligger aktö- ren enligt lagen om nationell läkemedelslista.115
Lagen innehåller också en upplysningsbestämmelse om den skyl- dighet för E-hälsomyndigheten att lämna viss information som åter- finns i 2 kap. 10 b § lagen (2009:366) om handel med läkemedel. En- ligt detta lagrum ska E-hälsomyndigheten informera Läkemedelsverket om det som framkommer vid en kontroll av det elektroniska system för direktåtkomst som en tillståndsinnehavare för öppenvårdsapoteks- verksamhet använder eller om en sådan tillståndshavare inte lämnar vissa uppgifter som föreskrivs i lagen om handel med läkemedel.116
Slutligen åläggs E-hälsomyndigheten en skyldighet, utöver vad som framgår av artiklarna 13 och 14 i EU:s dataskyddsförordning, att informera den som registreras om ett antal saker. Informationen ska enligt 7 kap. 3 § lagen om nationell läkemedelslista innefatta
–vilka uppgifter registret får innehålla,
–tystnadsplikts- och säkerhetsbestämmelser,
–rätten enligt artikel 82 i EU:s dataskyddsförordning och 7 kap. 1 § lagen (2018:218) med kompletterande bestämmelser till EU:s dataskyddsförordning till skadestånd vid behandling av personuppgifter i strid med lagen om nationell läkemedelslista,
–sökbegränsningar,
–utlämnande av uppgifter på medium för automatiserad behand- ling,
–direktåtkomst, samtycke och spärrning,
–behandling av uppgifter om patienter som får dosdispenserade läkemedel och
–att registreringen inte är frivillig, med de undantag som framgår av lagen.117
1157 kap. 1 § lagen (2018:1212) om nationell läkemedelslista.
1167 kap. 2 § lagen (2018:1212) om nationell läkemedelslista.
1177 kap. 3 § lagen (2018:1212) om nationell läkemedelslista.
Gällande rätt |
SOU 2025:71 |
3.5.12Behörigheter och åtkomstkontroll
Enligt 8 kap. 1 § lagen om nationell läkemedelslista ska E-hälsomyn- digheten bestämma villkor för tilldelning av behörighet till den som arbetar hos myndigheten för åtkomst till nationella läkemedelslistan. Behörigheten ska begränsas till det som behövs för att den som arbe- tar hos myndigheten ska kunna fullgöra sina arbetsuppgifter där.
Åtkomsten till uppgifter i registret ska dokumenteras så att åtkomsten kan kontrolleras. Vidare anges att myndigheten systematiskt och återkommande ska kontrollera om någon obehörigen tar del av uppgifter i registret.
Vad gäller direktåtkomst ska E-hälsomyndigheten försäkra sig om att behörighets- och säkerhetsfrågor är lösta på ett sätt som är tillfredsställande ur integritetssynpunkt och att behörigheten hos den som ska få direktåtkomst är begränsad till att endast gälla sådana uppgifter som denne har rätt att få ut enligt lagen innan direktåtkomst får ges till uppgifter i den nationella läkemedelslistan.118
3.5.13Krav på hälso- och sjukvården och öppenvårdsapotek
Lagen om nationell läkemedelslista ålägger den som bedriver verk- samhet inom hälso- och sjukvården som innefattar ordination och förskrivning av läkemedel att ha ett elektroniskt system som gör det möjligt att få direktåtkomst till uppgifter i nationella läkemedels- listan samt att vid en elektronisk förskrivning lämna de uppgifter till den nationella läkemedelslistan som anges i lagen.119 Med anled- ning av de svårigheter som dessa systemkrav medför för vårdgivarna har ikraftträdandet av dessa skjutits fram. Kraven ska vara uppfyllda senast den 1 december 2025.120
På motsvarande sätt åläggs den som har tillstånd att bedriva öppen- vårdsapotek att ha ett elektroniskt system som gör det möjligt att få direktåtkomst till uppgifter hos E-hälsomyndigheten och vid expe- diering av en förskrivning lämna vissa uppgifter till myndigheten. Detta följer av 2 kap. 6 § 5 och 6 i lagen (2009:366) om handel med läkemedel.
1188 kap. 2 § lagen (2018:1212) om nationell läkemedelslista.
1199 kap. 1 § lagen (2018:1212) om nationell läkemedelslista.
120Se lagen (2023:152) om ändring i lagen (2018:1212) om nationell läkemedelslista.
SOU 2025:71 |
Gällande rätt |
3.5.14Avgifter och föreskriftsrätt
E-hälsomyndigheten har rätt att ta ut avgifter från den som bedriver öppenvårdsapotek för att täcka kostnaderna för att föra den natio- nella läkemedelslistan, se 10 kap. 1 § lagen om nationell läkemedels- lista. Myndigheten ges också bemyndigande att meddela föreskrifter om avgiftens storlek.121 Det har E-hälsomyndigheten gjort i före- skrifterna (HSLF-FS 2021:28) om avgifter för den som har tillstånd att driva öppenvårdsapotek.
Socialstyrelsen ges bemyndigande att meddela förskrifter om koder för ordinationsorsak.122 Socialstyrelsen har inte utnyttjat denna föreskriftsrätt men har på regeringens uppdrag utvecklat en nationell källa för ordinationsorsak i form av ett strukturerat kod- system för ordinationer.123
3.5.15Ikraftträdande m.m.
Lagen om nationell läkemedelslista trädde till största delen i kraft den 1 maj 2021. Den bestämmelse i lagen som reglerar skyldigheten för den som bedriver verksamhet inom hälso- och sjukvården att ha ett elektroniskt system som gör det möjligt att få direktåtkomst till uppgifter ur registret och att vid elektronisk förskrivning kunna lämna uppgifter till registret (9 kap. 1 §) träder i kraft den 1 december 2025. Samma ikraftträdandedatum gäller för skyldigheten för E-hälsomyn- digheten i 7 kap. 1 § att informera Inspektionen för vård och omsorg om vad som framkommer vid kontroll av sådana system eller om att den som bedriver verksamhet inom hälso- och sjukvården inte lämnar de uppgifter till registret som den ska.
I en promemoria har regeringen föreslagit att skyldigheten att lämna uppgift om ordinationsorsak och uppgift om senaste datum för när läkemedelsbehandlingen ska följas upp eller avslutas till natio- nell läkemedelslista vid en elektronisk förskrivning ska senareläggas till den 1 september 2028.124 Förslaget remitterades till Lagrådet i mars 2025.
12110 kap. 2 § lagen (2018:1212) om nationell läkemedelslista och 2 § förordningen (2021:67) om nationell läkemedelslista.
12210 kap. 3 § lagen (2018:1212) om nationell läkemedelslista. och 3 § förordningen (2021:67) om nationell läkemedelslista.
123Se Socialstyrelsens webbplats, Kodsystem för ordinationsorsak – Socialstyrelsen.
124Åtgärder för en effektiv och patientsäker anslutning till nationell läkemedelslista (S2024/02118), s. 17.
4Nationell läkemedelslista – nuläge och närliggande initiativ
I detta kapitel behandlar utredningen den nationella läkemedelslistan i dag, pågående initiativ och de utmaningar som finns kopplat till införandet. Avslutningsvis beskrivs olika initiativ som pågår, eller nyligen avslutats, inom hälsodata- och läkemedelsområdet och som har påverkan på utredningens arbete. Kapitlet syftar till att beskriva de grundläggande förutsättningarna för utredningens arbete och vidare utveckling av förslag.
4.1Införandet av den nationella läkemedelslistan
Bakgrunden till den nationella läkemedelslistan beskrivs utförligt i departementspromemorian Nationell läkemedelslista och den efter- följande propositionen med samma namn.1,2 I korthet innebär listan ett register över förskrivna och expedierade läkemedel och andra varor som, genom att en gemensam bild möjliggörs för patient, vård- givare och öppenvårdsapotek, ska förbättra patientsäkerheten. Genom lagen (2018:1212) om nationell läkemedelslista ska alla förskrivare, med patientens samtycke och om uppgifterna inte spärrats, få tillgång till information om förskrivna och expedierade läkemedel. Patienten ges, med viss möjlighet till inskränkning, tillgång till motsvarande uppgifter om sig själv. Listan innebär också att vissa nya informa- tionsmängder ska kunna utbytas kopplat till förskrivningarna. Det handlar om information om ordinationsorsak och information om senaste datum för när läkemedelsbehandlingen ska följas upp eller avslutas. Expedierande personal på apotek ges också tillgång till informationen för att kunna expediera förskrivningar och för under-
1Ds 2016:44 Nationell läkemedelslista.
2Prop. 2017/18:223 Nationell läkemedelslista, s. 23 ff.
177
Nationell läkemedelslista – nuläge och närliggande initiativ |
SOU 2025:71 |
lättande av en patients läkemedelsanvändning. Införandet av den nationella läkemedelslistan i sin helhet har dock dragit ut på tiden. Nedan redogörs kortfattat för ikraftträdandet.
Bestämmelsen i 9 kap. 1 § lagen om nationell läkemedelslista, med krav på att den som bedriver verksamhet inom hälso- och sjukvården som innefattar ordination och förskrivning av läkemedel eller andra varor dels ska ha ett elektroniskt system som gör det möjligt att få direktåtkomst till uppgifter i den nationella läkemedelslistan, dels vid en elektronisk förskrivning lämna de uppgifter till den nationella läkemedelslistan som anges i lagen, skulle ursprungligen träda i kraft den 1 juni 2022. Även den informationsskyldighet som följer av 7 kap. 1 § i lagen skulle träda i kraft den 1 juni 2022. I övriga delar skulle lagen om nationell läkemedelslista träda i kraft den 1 juni 2020.3
I enlighet med förslagen i propositionen Senarelagt införande av nationell läkemedelslista och bastjänstgöring för läkare flyttades ikraft- trädandet fram till den 1 maj 2023 i fråga om 7 kap. 1 § och 9 kap. 1 § och för lagen i övrigt till den 1 maj 2021.4 Framskjutandet berodde bl.a. på att Sveriges Kommuner och Regioner, i det följande SKR, inkommit med en hemställan till regeringen där SKR förde fram att utbrottet av covid-19 gjorde att förutsättningar saknades för genom- förande av ett stort nationellt utvecklings- och införandeprojekt som nationell läkemedelslista.5
Genom en lagändring som föregicks av propositionen Senarelagd anslutning till nationell läkemedelslista sköts delar av lagens ikraft- trädande upp ännu en gång. Det gällde ånyo bestämmelserna i 7 kap. 1 § och 9 kap. 1 § där ikraftträdandet flyttades fram till den 1 decem- ber 2025.6 Framflyttandet berodde på att samtliga regioner inte be- döms hinna genomföra de anpassningar som krävs för en s.k. full- ständig anslutning med möjlighet att föra över uppgifter enligt det nya gränssnittet, bl.a. på grund av att införandet av nya vårdinfor- mationssystem dragit ut på tiden.7
Under hösten år 2024 har SKR ånyo lämnat in en hemställan till Socialdepartementet att flytta fram vissa delar av ikraftträdandet.8
3Ikraftträdandebestämmelsen till lagens ursprungliga lydelse, SFS 2018:1212. Se även a.a., s. 200.
4SFS 2020:305 samt prop. 2019/20:158 Senarelagt införande av nationell läkemedelslista och bastjänstgöring för läkare, s. 19.
5A.a., s. 17.
6SFS 2023:152 samt prop. 2022/23:57 Senarelagd anslutning till nationell läkemedelslista, s. 11.
7A.a., s. 10.
8Sveriges kommuner och regioner, 2024, Hemställan om åtgärder för att uppnå en effektiv anslutning till Nationella Läkemedelslistan, dnr SKR2024/01292.
SOU 2025:71 |
Nationell läkemedelslista – nuläge och närliggande initiativ |
SKR bedömer att regionerna inte fullt ut kan lämna uppgifter till registret enligt de nya specifikationerna förrän de nya vårdinforma- tionssystemen är införda, dvs. efter perioden från år 2025 till år 2029. Det handlar då om det som avses i 9 kap 1 § 2 i lagen. I en prome- moria har regeringen föreslagit att skyldigheten att lämna vissa upp- gifter till nationell läkemedelslista vid en elektronisk förskrivning ska senareläggas till den 1 september 2028.9 Förslaget remitterades till Lagrådet i mars 2025.10
Sammanfattningsvis innebär detta att den nationella läkemedel- listan i dag finns så till vida att det nya registret ersatt det tidigare receptregistret och läkemedelsförteckningen. De nya informations- mängderna ordinationsorsak och senaste datum för när läkemedels- behandlingen ska följas upp eller avslutas registreras än så länge endast i registret genom de fåtal system som anslutit med skrivmöjlighet enligt de nya specifikationerna, f.n. Pascal och Förskrivningskollen.11 De flesta vårdgivare kan därmed ännu inte lämna uppgifter enligt det nya format som implementeras.
4.2Nuvarande användning och funktionssätt
Trots att alla vårdgivare ännu inte fullt ut anslutit till registret natio- nell läkemedelslista så är registret i drift och receptregistret och läkemedelsförteckningen är avvecklade. I väntan på att vårdgivarnas system tekniskt anpassats ansluter vårdgivare till läkemedelslistan genom den s.k. transformatorn (se vidare 4.2.5 nedan). Samtidigt finns vissa nya tjänster för patienter och förskrivare tillgängliga via E-hälsomyndighetens webbplats, se vidare nedan.
4.2.1Läkemedelskollen – för patienten och dennes ombud
Läkemedelskollen är en tjänst hos E-hälsomyndigheten där en patient, eller i förekommande fall patientens ombud, kan komma åt vissa uppgifter från den nationella läkemedelslistan. Här kan patienten
9Åtgärder för en effektiv och patientsäker anslutning till nationell läkemedelslista (S2024/02118), s. 17.
10Lagrådsremiss, Åtgärder för en effektiv och patientsäker anslutning till den nationella läke- medelslistan.
11Se https://www.ehalsomyndigheten.se/yrkesverksam/nationella-lakemedelslistan/folj- anslutningen-till-nationella-lakemedelslistan/, besökt 2025-04-12.
Nationell läkemedelslista – nuläge och närliggande initiativ |
SOU 2025:71 |
ta del av information om sina egna recept, recept för sina barn under 13 år och för den man fått fullmakt att agera ombud för. Informa- tionen i Läkemedelskollen är i dag inte kopplad till information från ordinationer i patientjournalen. Eftersom informationen som visas i Läkemedelskollen bygger på receptinformation som registreras i nationella läkemedelslistan finns därför inte information om
–läkemedel som administreras eller överlämnas till en patient, exempelvis på en vårdinrättning, utan att något recept skrivs,
–receptfria läkemedel som inte har förskrivits,
–vaccinationer som inte har förskrivits,
–förskrivningar som är gjorda utanför Sverige12 samt
–information föranledd av en justering i en ordination som inte föranlett en ändrad eller förnyad förskrivning.
Via Läkemedelskollen kan patienter över 18 år också få information om på vilken nivå de befinner sig i den så kallade ”högkostnads- trappan”, dvs. information om vilken kostnadsreducering man enligt lagen (2002:160) om läkemedelsförmåner m.m. kan erhålla vid nästkommande receptexpedition.13
En patient kan också via Läkemedelskollen elektronisk lämna fullmakt för andra att utföra dennes apoteksärenden och få direkt- åtkomst till patientens förskrivningar i nationella läkemedelslistan. Det går dock inte, varken elektroniskt eller på annat sätt, att lämna fullmakt för att ta del av information om tidigare genomförda expe- ditioner. En patient eller ett ombud kan också via Läkemedelskollen se vilka fullmakter de fått eller gett. En elektronisk fullmakt är som längst giltig i fyra år, men kan när som helst avslutas av fullmakts- givaren eller av ombudet.
12Recept utfärdat av en förskrivare som är behörig i annat EES-land och som inte är elektro- niskt ska inte registreras i den nationella läkemedelslistan, se 7 kap 4 § Läkemedelsverkets föreskrifter (HSLF-FS 2021:75) om förordnande och utlämnande av läkemedel och teknisk sprit. När en utländsk förskrivning expedieras i Sverige registreras dock uttaget i nationella läkemedelslistan. Uttaget registreras som ett uttag mot pappersrecept och beroende på om förskrivningen innehåller ett svenskt personnummer kopplas uttaget till patientens övriga upp- gifter i läkemedelslistan.
13Högkostnadsskyddet innebär att en patient år 2024 som mest betalar 2 850 kr för läkemedel som omfattas av läkemedelsförmånen under ett år. Upp till kostnaden 1 485 kr betalar patien- ten hela läkemedelskostnaden själv. Därefter sker en stegvis ökande prisreduktion fram till man når maxbeloppet 2 850 kr.
SOU 2025:71 |
Nationell läkemedelslista – nuläge och närliggande initiativ |
Via Läkemedelskollen går det även att besvara begäran om lämna- nde av samtycke för att ta del av receptinformation som gjorts från hälso- och sjukvården. Det går också att se de samtycken till detta som sedan tidigare är lämnade. Det finns också möjlighet att där av- sluta lämnade medgivanden. I Läkemedelskollen kan patienter även hantera spärrar i den nationella läkemedelslistan avseende förskriv- ningar, behandlingsorsak samt uttag på pappersrecept.
All åtkomst till den nationella läkemedelslistan loggas och är möj- lig för den berörde enskilde att ta del av.
Sammanfattningsvis kan sägas att Läkemedelskollen är den väg som staten, genom E-hälsomyndigheten, upprättat för patienten att få direktåtkomst och hantera andras åtkomst till sina uppgifter i den nationella läkemedelslistan.
4.2.2Andra källor för patienten till information om recept och läkemedel
Vid sidan av Läkemedelskollen finns andra källor, eller ingångar, för patienten att nå information om sina läkemedel, dels via öppenvårds- apotek, dels via 1177.
Via öppenvårdsapotek
Många apoteksaktörer bedriver verksamhet även genom distans- handel. Aktörerna tillhandahåller web-tjänster eller appar, vilket gör det möjligt för patienter att beställa sina läkemedel genom dessa. En patient kan i dessa fall, efter att ha identifierat sig med hjälp av en elektronisk id-handling, ta del av information om aktuella samt utgångna eller slutexpedierade recept. En vårdnadshavare kan även ta del information för sina barn upp till 13 års ålder. Ett ombud är dock begränsad i att denne inte kan ta del av information om ut- gångna eller slutexpedierade recept. Tjänsten ger även tillgång till information om receptinnehavarens aktuella nivå i högkostnads- skyddet.
Informationen som visas hämtas från den nationella läkemedels- listan. Samtliga apoteksaktörer måste följa de krav som ställts upp av E-hälsomyndigheten angående vilken information som ska pre- senteras och hur detta görs. Så länge detta följs finns dock frihet att
Nationell läkemedelslista – nuläge och närliggande initiativ |
SOU 2025:71 |
utforma gränssnittet gentemot patienten. De olika tjänsterna kan därför se olika ut. E-hälsomyndighetens krav publiceras i den elek- troniska källan Handbok för vård- och apotekstjänster.14
Via e-tjänsten 1177 journal
Sajten 1177.se tillhandahåller i dag två möjligheter för patienter att, efter att ha loggat in med elektronisk id-handling, ta del av informa- tion om sina läkemedelsbehandlingar. Dels finns möjlighet att ta del av vissa uppgifter om läkemedelsbehandling som en del av infor- mationen i e-tjänsten 1177 journal, dels tillhandahåller sajten en direktkoppling till E-hälsomyndighetens tjänst Läkemedelskollen (se 4.2.1 ovan). De två tjänsterna innehåller delvis olika information då journaltjänsten medger tillgång till ordinationer och förskriv- ningar från anslutna vårdgivare medan Läkemedelskollen möjliggör tillgång till förskrivningar från alla vårdgivare och expedierade läke- medel från alla öppenvårdsapotek men helt saknar tillgång till infor- mation från ordinationer. Information om t.ex. läkemedelsnamn i en och samma läkemedelsbehandling kan därför skilja sig åt i de olika tjänsterna då ordination kan göras på substans, recept måste förskrivas på en produkt och patienten kan erhålla ett utbytt läke- medel på öppenvårdsapotek.
Det är frivilligt för vårdgivare att tillgängliggöra information via 1177 journal. Det är därför endast vissa vårdgivare som tillgängliggör information om läkemedelsbehandlingar. Ifall en vårdgivare anslutit sig och valt att dela information om läkemedelsbehandlingar är det dock inte säkert att de delar information från vårdgivarens samtliga elektroniska system som hanterar information om en patients läke- medel. Kvaliteten på informationen är också beroende av hur god grunddokumentationen är. Privata vårdgivare som saknar avtal med offentliga vårdgivare får i dag inte ansluta till 1177 journal och kan därmed inte dela information via tjänsten. I nuläget (2024-09-13) uppges 93 vårdgivare, varav 15 regioner, lämna information om läke- medel från journalen via 1177.15 Enligt företagsregistret finns drygt 15 800 företag med relevant verksamhet inom sektorn som skulle
14https://samarbetsyta.ehalsomyndigheten.se/handboken/latest, besökt 2024-09-13.
151177.se, informationen kan endast återfinnas i e-tjänsten journal i inloggat läge.
SOU 2025:71 |
Nationell läkemedelslista – nuläge och närliggande initiativ |
kunna vara aktuella.16 Den bild över läkemedelsbehandlingar som till- handahålls via 1177 journal varierar därmed för olika patienter bero- ende på hos vilka vårdgivare och vid vilka verksamheter de får sin vård.
Det framgår inte av den allmänna informationen i 1177 journal vilken typ av information som finns registrerad, om det är uppgifter från ordinationer eller receptuppgifter. Det framgår inte heller om informationen begränsas till information om receptförskrivna läke- medel eller om det även omfattar sådana läkemedel som administreras av sjukvårdpersonal. För att som patient förstå vilken information man faktiskt har tillgång till behöver man därför känna till vilken in- formation som finns registrerad i olika journalhandlingar och jäm- föra med vad som presenteras i tjänsten. Läkemedelsinformationen i 1177 journal presenterar inte heller historisk information. Av sajten framgår också att om du har dosdispenserade läkemedel kan journalens information om läkemedel vara felaktig. Då ska du i stället använda listor från dosdispenseringen.17
Sammanfattningsvis kan sägas att 1177 journal är den väg som regionerna, genom Inera, upprättat för patienten att få direktåt- komst och till sina uppgifter om aktuella läkemedelsbehandlingar.
4.2.3Särskilt om tillgång till information om läkemedelsbehandlingar för minderåriga
Vårdnadshavare är i dag begränsade i vilken vårdinformation de genom olika e-tjänster kan ta del av för minderåriga, t.ex. vad avser läkemed- elsbehandlingar. Vårdnadshavare kan t.ex. i dag inte ta del av infor- mation om förskrivningar och expedierade läkemedel via Läkemedels- kollen för barn från och med att barnet fyllt 13 år. Vårdnadshavare kan sedan år 2019 inte heller beställa läkemedel genom att få recept expedierade för sina barn över 13 år genom apoteksaktörernas webb- och apptjänster. Begränsningen beror i korthet på att det för barn som är 13 år och äldre krävs en sekretessprövning i varje enskilt fall innan vårdnadshavare kan få tillgång till receptinformation. Det finns dock ingen teknisk begränsning för minderåriga själva att logga in och beställa läkemedel via ett apoteks e-tjänster om inte förskriv-
16Sökning i Företagsregistret vid Statistiska centralbyrån, 2025-01-30, Privat eller utländsk ägarkontroll, SNI-koderna 86101, 86102, 86103, 86211, 86212, 86221, 86222 samt 86902.
17A.a.
Nationell läkemedelslista – nuläge och närliggande initiativ |
SOU 2025:71 |
aren har begränsat uttaget.18 För att själv logga in i Läkemedelskollen behöver patienten däremot vara över 18 år, dvs. barn kan inte heller själva få tillgång till information om sina recept eller uthämtade läke- medel via tjänsten. En utmanande situation för patienter och öppen- vårdsapotek är när recept till ungdomar mellan 13 och 18 år på t.ex. läkemedel för behandling av adhd begränsas av förskrivaren så att endast vårdnadshavare kan hämta ut dessa från öppenvårdsapotek. I dessa fall är e-handel normalt inte möjlig. Apotekspersonalen är även vid expediering på fysiska apotek begränsade i vilken informa- tion de kan delge en vårdnadshavare i dessa fall.
Via e-tjänsten 1177 journal kan vårdnadshavare till barn under
12 år se all information om barnets läkemedel. När barnet är 12–13 år kan vårdnadshavaren endast se information knuten till de förskriv- ningar som är giltiga för expediering vid tillfället för sökningen i tjänsten. Från 13 års ålder gäller generellt att varken vårdnadshavare eller den minderårige själv har tillgång till någon information via 1177 journal, dvs. inte heller information om pågående läkemedels- behandlingar. Från 16 års ålder får den minderårige själv tillgång till information via tjänsterna. Det finns dock under vissa förutsättningar möjlighet för både vårdnadshavare och/eller den minderårige själv att ansöka om att få utökad tillgång till tjänsterna i åldern 13 till 18 år. Sådan tillgång beslutas i så fall oftast per vårdenhet. För patienter som behandlas vid flera vårdenheter kan det därmed vara komplext att erhålla utökad åtkomst då det ofta saknas en central funktion eller samordnad hantering för dessa frågor.
För att få information om minderårigas läkemedelsbehandling behöver den minderårige eller vårdnadshavaren ofta i stället söka kontakt med sin läkare eller gå till ett öppenvårdsapoteks fysiska handelslokal. I dessa fall görs en sekretessprövning i samband med utlämnandet.
Sammanfattningsvis kan utredningen konstatera att frågor om tillgång till information om minderårigas läkemedelsbehandling är svår och berör både frågor om integritet och säkerhet. Frågan är heller inte unik för läkemedelsområdet utan berör tillgång till all vårdinformation. Regeringen har tagit initiativ till en översyn på
18Utifrån allmänna avtalsrättsliga principer har apoteksaktörena åldersgräns i köpevillkor, men de är olika formulerade och de behöver inte vara något som det finns kontroller av.
SOU 2025:71 |
Nationell läkemedelslista – nuläge och närliggande initiativ |
området som har remitterats.19 Utredningen berör dessa frågor även i avsnitt 9.7.
4.2.4Förskrivningskollen – för förskrivaren och annan vårdpersonal
Itjänsten Förskrivningskollen som tillhandahålls av E-hälsomyndig- heten kan läkare, sjuksköterskor, dietister, barnmorskor, tandläkare, tandhygienister och farmaceuter i vården, med patientens samtycke och under de förutsättningar som anges i lagen (2018:1212) om nationell läkemedelslista, se patientens förskrivna och uthämtade läkemedel och andra varor som lämnats ut på apotek. Inledningsvis var Förskrivningskollen också det enda sätt som vårdpersonal hade för att få tillgång till information i den nationella läkemedelslistan. Informationen hämtas från den nationella läkemedelslistan och utgör inte journalinformation. Förskrivningskollen är inte tänkt att vara den huvudsakliga tjänsten för vårdpersonalens tillgång till informa- tion i den nationella läkemedelslistan på längre sikt. Informationen
i den nationella läkemedelslistan ska genom en integration i stället kunna konsumeras direkt i vårdgivarens vårdinformationssystem. Förskrivningskollen utgör dock den fristående ingång som tillhanda- hålls för dem som ännu inte har en integration, som reservalternativ eller för t.ex. fritidsförskrivare som inte har tillgång till ett elektro- niskt vårdinformationssystem.
I Förskrivningskollen visas inte information om patienter som saknar ett giltigt svenskt personnummer eller avlidna patienter. För personer med skyddad identitet döljs viss information för att inte röja skyddade uppgifter. Tillgången till information om läkemedels- behandlingar i nationella e-tjänster för grupper som saknar svenskt personnummer är naturligtvis också viktig av patientsäkerhetsskäl men behöver alltid vägas mot frågan om en säker identifiering av patienten. En nationell hantering av identitetsfrågan är därmed av betydelse, t.ex. genom en gemensam syn på och användning av sam- ordningsnummer.20 Eftersom informationen som visas i Förskriv- ningskollen bygger på receptinformation som registreras i nationella läkemedelslistan finns inte heller information om
19Elektronisk tillgång till barns uppgifter inom hälso- och sjukvården och tandvården (Ds 2023:26).
20Se bl.a. prop. 2021/22:276 Stärkt system för samordningsnummer.
Nationell läkemedelslista – nuläge och närliggande initiativ |
SOU 2025:71 |
–läkemedel som administreras eller överlämnas till en patient, exem- pelvis på en vårdinrättning, utan att något recept skrivs,
–receptfria läkemedel som inte har förskrivits,
–vaccinationer som inte har förskrivits,
–förskrivningar som är gjorda utanför Sverige21 samt
–information föranledd av en justering i en ordination som inte för- anlett en ändrad eller förnyad förskrivning.
Förskrivare kan via Förskrivningskollen också hantera spärrar för uppgifter om barn och ungdomar (oavsett ålder, se även 4.2.3 ovan) i förhållande till vårdnadshavare eller ombud. Om en sådan spärr är registrerad i nationella läkemedelslistan visas inte förskrivningen eller uthämtade läkemedel eller varor för vårdnadshavare och deras ombud i Läkemedelskollen, på utskrifter från nationella läkemedelslistan eller
iapotekens e-handelssystem. Spärrar som införts i nationella läke- medelslistan har i dagsläget ingen koppling till spärrar enligt patient- datalagen (2008:355) eller lagen (2022:913) om sammanhållen vård- och omsorgsdokumentation som eventuellt gjorts i en vårdgivares journal (se vidare om spärrar i avsnitt 10.6).
Det finns än så länge endast få, och små, studier som analyserar användningen av Förskrivningskollen och informationen i den natio- nella läkemedelslistan. I en nyligen publicerad artikel undersöktes bl.a. förskrivares uppfattning.22 Undersökningen genomfördes kring årsskiftet mellan åren 2021 och 2022 strax efter det att den nya tjäns- ten fanns tillgänglig. I artikeln konstateras bl.a. att tjänsten vid tid- punkten för undersökningen endast användes av 755 unika användare per månad. I detta ingår ”fritidsförskrivare” som använt Förskrivnings- kollen som ett förskrivningsverktyg. I oktober 2023 hade antalet unika användare ökat till drygt 4 900 varav knappt 1 600 nyttjat tjänsten för att förskriva.23 Antalet unika inloggningar för helåret 2023 var knappt 15 000. Uppgifterna ska ställas i relation till de
21Receptet är utfärdat av en förskrivare som är behörig i annat EES-land ska inte registreras i den nationella läkemedelslistan, se 7 kap 4 § Läkemedelsverkets föreskrifter (HSLF-FS 2021:75) om förordnande och utlämnande av läkemedel och teknisk sprit. När en utländsk för- skrivning expedieras i Sverige registreras dock uttaget i Nationella läkemedelslistan. Uttaget registreras som ett uttag pappersrecept och beroende på om förskrivningen innehåller ett svenskt personnummer eller inte kopplas uttaget till patientens läkemedelslista.
22Bergman, F., Hammar, T. (2023). Healthcare professionals’ perceptions of a web-based application for using the new National Medication List in Sweden. Digital Health. 9, s. 1–12.
23Uppgifter direkt från E-hälsomyndigheten till utredningen.
SOU 2025:71 |
Nationell läkemedelslista – nuläge och närliggande initiativ |
dryga 41 000 läkare och 111 000 sjuksköterskor som, vid tillfället för undersökningen, arbetade i hälso- och sjukvården och hade kun- nat använda tjänsten.
Av de 288 personer som svarade på ovan nämnda undersökning fanns både de som använt och de som inte använt tjänsten. Syftet med att inkludera personer som ännu inte använt tjänsten var att identifiera möjliga barriärer till användning. 43 procent av respon- denterna var läkare, 29 procent sjuksköterskor och 23 procent kli- niska farmaceuter. Av de som använt Förskrivningskollen var 57 pro- cent kliniska farmaceuter och 37 procent läkare. Undersökningen visar på både positiva och negativa uppfattningar om tjänsten. För- väntningen att läkemedelsanvändningen blir säkrare med korrekt information och en gemensam bild av en patients förskrivningar lyftes fram. Det framkom dock att det föreligger en farhåga kopp- lad till att den information man får tillgång till endast kommer från recept och därmed inte i full bemärkelse utgör en nationell läkemede- lista. Det uttrycktes också en oro för att förskrivare måste arbeta i och hämta information ur parallella system. Även otillräcklig kun- skap om vårdens behov i utvecklingen av system lyftes fram som en farhåga. Oro kring samtyckeshanteringen och patientens möjlig- heter att spärra information i registret var ett annat område som lyftes fram då det dels anses ta mycket tid och innebära patientsäker- hetsrisker att information görs oåtkomlig för hälso- och sjukvårds- personal.
En grupp som enligt artikeln såg positivt på användningen av För- skrivningskollen var kliniska farmaceuter som tyckte att tillgången till informationen underlättar deras arbete. De kliniska farmaceuterna såg också positivt på att kunna se förskrivningar från andra vårdgivare. Vad gäller eventuella hinder som föreligger för att använda tjänsten lyftes att användargränssnittet är otydligt och att det utan integration är tidsödande då man t.ex. behöver separat inloggning. Man lyfte också riskerna med att informationen i Förskrivningskollen inte är klinisk information, t.ex. ordinationsinformation, och att det där- med kan ge en falsk trygghet. Den ovan nämnda studien genom- fördes tidigt och bygger på ett litet underlag men visar på de första uppfattningarna från användning och förväntningarna på tjänsten. Förhoppningsvis följer fler undersökningar kring användningen av informationen längre fram och som bygger på större urval.
Nationell läkemedelslista – nuläge och närliggande initiativ |
SOU 2025:71 |
Chefläkarnätverket lyfter i en rapport om risker med den natio- nella läkemedelslistan fram riskerna med att förskrivning eller inhämt- ande av uppgifter via den externa tjänsten Förskrivningskollen riskerar leda till att förskrivare inte uppdaterar läkemedelslistorna i journal- systemet och att framtida beslut då grundas på bristfällig eller felaktig information.24 Som framgick av inledningen till detta avsnitt är dock inte Förskrivningskollen tänkt att utgöra den primära tjänsten för att konsumera information i den nationella läkemedelslistan. Nätverkets rapport baserades till stor del på en situation där en integration mot vårdinformationssystemen inte kom till stånd eller sköts på framtiden och Förskrivningskollen därmed fick en central roll för alla förskrivare.
Förskrivningskollen är den av staten tillhandahållna lösningen för att kunna genomföra elektroniska förskrivningar för dem som inte har någon annan möjlighet. De flesta större vårdgivare har ett vård- informationssystem som i dag medger elektronisk förskrivning och som kommer anpassas till den nationella läkemedelslistan. Vid sidan av dessa större vårdinformationssystem finns enklare system eller appar liknande Förskrivningskollen men som utvecklas av privata aktörer.25
4.2.5Förskrivning av läkemedel och transformatorn
Sverige var först i världen med elektroniska recept. Det första receptet skickades redan år 1983 som en del i ett gemensamt projekt mellan dåvarande Apoteksbolaget och Landstinget i Jönköpings län. Fler lokala och regionala projekt följde och år 1999 beslutades att stor- satsa på e-recept. År 2015 var 98 procent av recepten elektroniska.26 Sedan år 2022 är det ett författningsreglerat krav att förskrivning av läkemedel till människa som huvudregel ska göras elektroniskt. För- skrivning får göras på receptblankett i vissa särskilt angivna undan- tagsfall t.ex. vid teknisk störning som omöjliggör elektronisk för- skrivning.27 Detta innebär att alla vårdgivare behöver ha tillgång till ett system för elektronisk förskrivning. Förskrivningskollen kan, för den som är behörig förskrivare och som inte har tillgång till ett eget
24Nätverket Sveriges chefläkare, 2022, Riskanalys av Nationella läkemedelslistan (NLL), s. 43.
25Se t.ex. Alfa eCare Recept, www.e-recept.se/.
26https://www.apoteket.se/om-apoteket/apotekets-historia/vagvisaren/e-recept-en-digital- revolution/, besökt 2024-01-29.
274 kap. 1 § Läkemedelsverkets föreskrifter (HSLF-FS 2021:75) om förordnande och utläm- nande av läkemedel och teknisk sprit.
SOU 2025:71 |
Nationell läkemedelslista – nuläge och närliggande initiativ |
elektroniskt system för förskrivning, också användas för att utfärda recept men informationen behöver då också registreras separat i patientjournalen. Om förskrivaren däremot har tillgång till ett elek- troniskt system för förskrivning av recept, ska detta enligt E-hälso- myndigheten alltid användas i första hand.28 Förskrivningskollen fun- gerar som ett reservsystem för dem som saknar tillgång till ett system eller när driftstörningar uppstår även för dem som genom vårdgivaren har tillgång till ett för förskrivning avsett elektroniskt system. För- skrivningar skapade i Förskrivningskollen syns inte automatiskt i de ordinarie vårdinformationssystemen förrän systemen är fullt ut anpas- sade och anslutna till den nationella läkemedelslistan, för närvarande först efter den 1 december 2025. Förskrivningar gjorda i Förskrivnings- kollen behöver därför journalföras separat och innebär därmed dubbel- arbete. Under år 2023 genomfördes drygt 55 000 förskrivningar (mellan 4 000 och 5 200 per månad) i Förskrivningskollen.29
Elektronisk förskrivning har länge skett genom en standard som kallats nationellt e-receptformat, ofta förkortat NEF. I och med ut- vecklingen av den nationella läkemedelslistan behöver denna standard fasas ut till förmån för mer modern teknik. Utbyte av information i den nationella läkemedelslistan sker genom den internationella stan- darden Fast Health Interoperability Resources, förkortat FHIR. I vän- tan på att alla system anpassas till FHIR tillhandahåller E-hälsomyn- digheten en ”översättningstjänst” kallad transformatorn.
Transformatorn
Transformatorn möjliggör att aktörssystem, för vård- och apoteks- aktörer, med befintliga integrationer till det tidigare receptregistret och läkemedelsförteckningen fortsatt kan skicka och hantera e-recept, få tillgång till information om patientens uthämtade läkemedel samt expedierade recept. Detta görs genom att nationella läkemedelslistan via transformatorn tillhandahåller tekniska tjänstegränssnitt som är helt kompatibla med de tjänstegränssnitt som tidigare tillhandahölls för receptregistret och läkemedelsförteckningen. All översättning som krävs (transformering) mellan dessa gränssnitt och den natio- nella läkemedelslistan görs av transformatorn. Detta gäller även över-
28Se https://www.ehalsomyndigheten.se/yrkesverksam/vard/forskrivningskollen/, besökt 2024-12-16.
29Uppgifter till utredningen från E-hälsomyndigheten.
Nationell läkemedelslista – nuläge och närliggande initiativ |
SOU 2025:71 |
sättning av information mellan olika informationsmodeller och gällande regelverk avseende de övergångsregler som gäller. Denna tekniska lösning möjliggör inte vidare utveckling så att den fulla funktionaliteten i nationella läkemedelslistan kan implementeras, t.ex. att vårdpersonal kan ta del av information från den nationella läkemedelslistan direkt i vårdinformationssystemet. Begränsningen gäller även tillägget av vissa nya informationsmängder och möjlig- heten till tvåvägskommunikation för att uppdatera förskrivningar i vårdinformationssystemen.
4.2.6Pågående utveckling
Det pågår ett intensivt arbete hos E-hälsomyndigheten och hos systemleverantörer av vårdinformationssystem och av expedierings- system för apotek så att de kan ansluta till den nationella läkemedels- listan i enlighet med kraven i lagen (2018:1212) om nationell läke- medelslista. Transformatorn kommer utifrån gällande regelverk och nu gällande planering att stängas ner i december 2025 då bestäm- melsen om direktåtkomst och lämnande av uppgifter i samband med förskrivning träder i kraft.30 Om lagen ändras i enlighet med för- slagen i den promemoria som remitterades i december 2024 kom- mer dock transformatorn åtminstone delvis vara i drift för vårdak- törerna fram till och med år 2028.31
E-hälsomyndigheten har för att underlätta anslutningsprocessen möjliggjort för en stegvis anslutning. Den stegvisa anslutningen möjliggör, för de aktörerna som så önskar, att ansluta i olika takt utifrån hur fort utvecklingen av de anslutande systemen går.
Den stegvisa anslutningen innebär i korthet att vårdgivare fram till december 2025 kan fortsätta skicka e-recept enligt det äldre NEF- formatet men att de redan tidigare börjar läsa information enligt FHIR-standarden. Från och med den 1 december 2025 måste vård- givare kunna registrera eller ”skicka” information enligt FHIR, in- klusive de nya informationsmängderna ordinationsorsak samt senaste
309 kap. 1 § lagen (2018:1212) om nationell läkemedelslista.
31Promemoria – Åtgärder för en effektiv och patientsäker anslutning till nationell läkemedels- lista, S2024/02118.
SOU 2025:71 |
Nationell läkemedelslista – nuläge och närliggande initiativ |
datum för när läkemedelsbehandlingen ska följas upp eller avslutas.32 De ska också kunna registrera åtkomstsamtycke, hämta och visa förskriv- ningar och uthämtade läkemedel och andra förskrivna varor. Under en ytterligare övergångsperiod ges de möjlighet att ange dosering och administrationssätt i fritext. Från slutet av år 2028 ska aktörerna sedan kunna förnya, ersätta och uppdatera förskrivningar, systemet ska kunna visa alla versioner av en förskrivning, förskrivningskedjor och parallella förskrivningar och det ska finnas en funktion för strukturerad dos och koder för dosenhet och administreringssätt.
Den 25 januari 2024 meddelade E-hälsomyndigheten att den första apoteks- respektive vårdaktören anslutits till den nationella läke- medelslistan enligt det nya sättet att utbyta information som följer av lagstiftningen.33 Den privata vårdaktör som anslutit sig har i nu- läget endast läsmöjlighet, men nästa steg blir att också kunna skicka information enligt det nya formatet. För apoteksaktören gällde det anslutning av kundgränssnittet för e-handel. Efter detta har flera aktörer anslutit efter hand. Värt att notera är att Ineras tjänst Pascal anslöt med full funktionalitet i maj 202434 och att även Region Stockholm anslöt sitt huvudjournalsystem med läsfunktionalitet i oktober–november 202435.
Lagen (2018:1212) om nationell läkemedelslista ställer krav på att hälso- och sjukvårdens elektroniska system ska möjliggöra direkt- åtkomst till uppgifter i registret nationell läkemedelslista samt att vårdgivare ska lämna de uppgifter som anges i lagen till registret vid elektronisk förskrivning.36 Det anges dock inte uttryckligen i lagen att vårdgivarnas system ska ha kopplingar till registret som medför att ordinationer och förskrivningar uppdateras vid ändringar, så kallad synkronisering. I propositionen Nationell läkemedelslista angav reger- ingen att en sådan synkronisering ryms inom ändamålet
32Om förslagen i promemorian Åtgärder för en effektiv och patientsäker anslutning till natio- nell läkemedelslista, S2024/02118, beslutas kommer det inte att vara ett krav att lämna upp- gifter om ordinationsorsak eller senaste datum för när läkemedelsbehandlingen ska följas upp eller avslutas förrän från och med den 1 september 2028. Någon ändring avseende detta är som angivits ovan dock ännu inte beslutad.
33E-hälsomyndigheten, Milstolpe i införandet av Nationella läkemedelslistan – första aktör- erna är anslutna, pressmeddelande 2024-01-25.
34E-hälsomyndigheten, Nu får vårdpersonal i kommunerna tillgång till Nationella läkemedels- listan, pressmeddelande 2024-05-28.
35E-hälsomyndigheten, Nu påbörjar Region Stockholm anslutningen till Nationella läkemedels- listan, pressmeddelande 2024-10-06.
369 kap. 1 § lagen (2018:1212) om nationell läkemedelslista.
Nationell läkemedelslista – nuläge och närliggande initiativ |
SOU 2025:71 |
komplettering av en patientjournal.37 Regeringen bedömde vidare att funktionalitet för synkronisering vore önskvärt för att en sam- lad källa för information om en patients förskrivna läkemedel eller andra varor ska få maximal nytta. E-hälsomyndigheten behöver där- för tillgängliggöra uppgifterna i ett format som möjliggör fullständig spårbarhet och lokal lagring.38 Regeringen pekade vidare på regerings- uppdrag till E-hälsomyndigheten där det specificeras att den natio- nella läkemedelslistan ska bidra till minskad dubbeldokumentation genom att informationsinnehållet utformas utifrån vårdens system för journaldokumentation. Hur informationen används av de olika aktörerna beror på deras syfte och behov, så länge uppgifterna är inhämtade med ett giltigt ändamål för åtkomst. Det är dock viktigt att notera att den formen av systemintegrering inte är ett krav utan en möjlighet för den som bedriver hälso- och sjukvårdsverksamhet.39
Även om det saknas ett uttryckligt krav i lagen på vårdgivare att åstadkomma synkronisering av information finns det enligt resone- manget ovan inget i lagen som hindrar detta. Tvärtom finns i förarbe- tena stöd för att så bör ske. Det kan till och med vara så att en syn- kronisering är nödvändig för att upprätthålla andra krav som åligger vårdgivare, t.ex. enligt patientsäkerhetslagen (2010:659). Det är i så fall upp till vårdgivaren att säkerställa att sådana krav ställs på journal- systemsleverantörerna. Synkronisering av informationen är också av betydelse för den samhällsekonomiska effekthemtagning som be- skrevs i samband med departementspromemorian år 2016.40
4.2.7Förslag om vidare utveckling
Redan i promemorian om den nationella läkemedelslistan beskrevs potentiella framtida utvecklingsmöjligheter.41 Ett par av dessa har redan tagits om hand i andra regeringsuppdrag eller utredningar, t.ex. frågan om elektronisk förskrivning som huvudregel vilket är ett krav sedan maj år 2022 genom ändringar i Läkemedelsverkets föreskrifter (HSLF-FS 2021:75) om förordnande och utlämnande
37Prop. 2017/18:223 Nationell läkemedelslista, s. 184. Ändamålet komplettering av en patient- journal anges i 3 kap. 4 § 3 lagen (2018:1212) om nationell läkemedelslista.
38A.a.
39A.a.
40Ds 2016:44 Nationell läkemedelslista, s. 270 ff.
41Ds 2016:44 Nationell läkemedelslista, s. 247 ff.
SOU 2025:71 |
Nationell läkemedelslista – nuläge och närliggande initiativ |
av läkemedel och teknisk sprit.42 Även frågan om expedieringar av svenska recept utomlands har utretts.43
Ett par frågor som lyfts i promemorian återstår dock. En sådan fråga är komplettering av registret med information om andra än förskrivna läkemedel. Här lyfts t.ex. frågan om tillgång till informa- tion om patientens s.k. rekvisitionsläkemedel44 för att möjliggöra att hälso- och sjukvårdspersonal med förskrivningsrätt ska kunna ta ställning till patientens samlade läkemedelsbehandling inför fat- tande av nya beslut om behandling. I promemorian förs också ett resonemang kring behovet av information om administrerade vac- ciner och huruvida den nationella läkemedelslistan är en tänkbar plats för att samla sådan information.45 Det förs även ett resonemang om behovet av andra informationsmängder som uppmärksamhets- och varningsinformation från vården eller apotek.46
4.3Utmaningar med nuvarande utformning av nationella läkemedelslistan
I detta avsnitt beskrivs de huvudsakliga utmaningar som förts fram avseende den nationella läkemedelslistan. Det är dels utmaningar som uppstått i och med ikraftträdandet av lagen (2018:1212) om nationell läkemedelslista och tillämpningen av lagen, dels utmaningar som kvarstår även efter att departementspromemorian om nationell läkemedelslista skrevs år 2016. Avslutningsvis redovisas några nya identifierade utmaningar.
42Läkemedelsverket. 2019, Att införa elektronisk förskrivning som huvudregel, dnr 4.3.1-2019- 028702.
43SOU 2021:102 E-recept inom EES.
44Begreppet rekvisitionsläkemedel används ibland för att beteckna sådana läkemedel som administreras eller överlämnas av hälso- och sjukvårdspersonal. Begreppet kan dock vara missvisande och i denna utrednings direktiv används uttrycket sådana läkemedel som patienter får vid behandling inom hälso- och sjukvården.
45Ds 2016:44 Nationell läkemedelslista, s. 255 ff.
46A.a., s. 256 ff.
Nationell läkemedelslista – nuläge och närliggande initiativ |
SOU 2025:71 |
4.3.1Utmaningar med gällande lag enligt E-hälsomyndigheten
E-hälsomyndigheten har i en promemoria daterad i mars 2021 sam- manställt ett antal av myndigheten identifierade ändringsbehov i lagen (2018:1212) om nationell läkemedelslista.47 Det rör bl.a. regi- sterinnehåll, ändamålen för personuppgiftsbehandling, samtycke vid fullmakt och förskrivares rätt till åtkomst till egna förskrivningar. Flera av de framförda ändringsbehoven återfinns även i utredningens kommittédirektiv. Utredningen återkommer till E-hälsomyndig- hetens promemoria i kap. 10 i anslutning till utredningens översyn av lagen i dess gällande lydelse.
4.3.2Utvecklingen och införandet av den nationella läkemedelslistan
Implementeringen av den nationella läkemedelslistan har varit för- enad med ett antal utmaningar. Det är många aktörer som är berörda av lagstiftningen, såväl statliga myndigheter, offentliga och privata vårdgivare som apoteksaktörer. Oavsett antalet aktörer som berörs är det i slutänden enskilda människor som ska använda de system som har kopplingar till registret nationell läkemedelslista, många människor. I vården arbetar mer än 250 000 personer som hälso- och sjukvårdspersonal varav många har möjlighet att ta del av informa- tion i den nationella läkemedelslistan. Av dessa är drygt 43 000 läkare och 116 000 sjuksköterskor.48 Fler än 6 300 farmaceuter arbetar på öppenvårdsapotek49 och knappt 600 apotekare och 460 receptarier arbetar i hälso- och sjukvården50. Alla dessa personer ska inte bara ta till sig en teknisk lösning, de ska också förstå vilken information de har tillgång till och kunna anpassa sig till nya arbetsprocesser och använda informationen, för patientens bästa.
47E-hälsomyndigheten, 2021, Vidareutveckling av den nationella läkemedelslistan, dnr 2021/01058, 2021-03-03.
48Socialstyrelsens statistikdatabas 2024-09-17. Hälso- och sjukvårdspersonal, Riket, Offentlig och privat regi, Sysselsatta inom hälso- och sjukvård, Alla näringsgrenar, Ålder: -, Båda könen, 2022.
49Socialstyrelsens statistikdatabas 2024-09-17. Hälso- och sjukvårdspersonal, Riket, Offentlig och privat regi, Alla sysselsatta, 477 Övrig specialiserad butikshandel med hushållsvaror, Ålder: -, Båda könen, 2022.
50Socialstyrelsens statistikdatabas 2024-09-17. Hälso- och sjukvårdspersonal, Apotekare, och receptarier, Riket, Offentlig och privat regi, Alla sysselsatta, Ålder: -, Båda könen, 2022.
SOU 2025:71 |
Nationell läkemedelslista – nuläge och närliggande initiativ |
Det är inte enbart vård- och apotekspersonal som ska kunna an- vända informationen. Även alla patienter har tillgång till den natio- nella läkemedelslistan och behöver förstå vilken information de har tillgång till och vad den betyder.
Nyttan med den nationella läkemedelslistan uppstår först när berörda personer har tillgång till informationen på ett sätt som gör att de också kan tillgodogöra sig den. Detta är en grundläggande patientsäkerhetsfråga.
Ny teknik införs i vården
Riksdagens beslut att inrätta registret nationell läkemedelslista sam- manföll i tid med regionernas beslut att inleda upphandling av nya journal- eller vårdinformationssystem då dessa i princip hade nått gränsen för sin tekniska livslängd.
Sverige var tidigt med att införa digitala journaler i den offentligt finansierade vården. Detta gjordes inledningsvis genom att pappers- journalen digitiserades51. Med tiden har systemen utvecklats, digi- taliserats, för att bättre stödja processer och flera så kallade moduler har byggts på och till systemen. I dag är journalsystem eller, som det ofta kallas, vårdinformationssystem komplexa med många bero- enden. Detta gäller särskilt för vårdgivare som bedriver många olika typer av vårdverksamheter och försöker lösa många av verksam- heternas behov i ett och samma vårdinformationssystem. Sådan är situationen för t.ex. regionerna. För en mindre, specialiserad, vårdgivare kan situationen vara mindre komplex då man kan nyttja mer specialiserade eller nischade system.
Vissa länder som hittills har haft en låg digitaliseringsgrad går nu i några avseenden om Sverige.52 Det beror till viss del på att dessa länder inte behöver byta ut befintliga, äldre system, utan de inför system vilket ur vissa aspekter är enklare. Svensk hälso- och sjuk- vård står i dag inför ett större teknikskifte. Flera regioner har påbör- jat detta eller kommer att byta ut eller uppgradera sina vårdinfor- mationssystem.
51Digitisera innebär att göra om något som är fysiskt eller analogt till digitalt, att digitalisera är ett vidare begrepp som inkluderar att också i större grad dra nytta av de digitala möjlighet- erna i en process.
52EU-kommissionen, 2023, eGovernment Benchmark 2023 Insight report.
Nationell läkemedelslista – nuläge och närliggande initiativ |
SOU 2025:71 |
Vid införande eller utbyte av teknik och system måste de nya systemen vara tidsenliga, kostnadseffektiva och i linje med sam- hällets övriga tekniska förutsättningar. Att byta ut vårdinformations- system är en mycket omfattande och komplex operation, särskilt som det sker i en verksamhet utsatt för ett hårt tryck med brist på kapacitet och höga operativa kvalitetskrav. Det finns alltid risker med att allt inte blir som planerat och att systemen behöver ytter- ligare anpassas av patientsäkerhetsskäl. Detta har också tydligt fram- gått i media under senhösten 2024 och våren 2025 kopplat till de systemskiften som regionerna påbörjat. Om man ska dra nytta av teknikutvecklingen innebär nya systemförändringar av funktiona- litet som även möjliggör förändrade arbetssätt. Att införa nya vård- informationsystem är därför en förändring som tar tid, och som innan den satt sig, riskerar att påverka patientsäkerhet och effektivitet. Trots detta kan det vara nödvändigt. Teknisk utrustning och system behöver därför kunna användas under många år för att motivera de risker och kostnader som en investering medför.
En utmanande tid
Det är således i en tid när många stora aktörer i den offentligt finan- sierade sjukvården genomför omfattande systembyten som den natio- nella läkemedelslistan ska implementeras. Systembytena har tagit, och kommer även fortsatt att ta, stora resurser och tid i anspråk. Delvis beror detta på att det inte har funnits färdigutvecklade system, eller system som är helt anpassade för den svenska hälso- och sjuk- vården, att direkt köpa in och införa i verksamheten. Det finns inga system som från början varit anpassade till den nationella läkemedels- listan eftersom de tekniska specifikationerna och kraven för anslut- ning tagits fram av E-hälsomyndigheten efter hand.
Vårdgivarna är dock inte de enda aktörerna som behöver anpassa sig och sina system till den nationella läkemedelslistan. Även apoteks- branschen påverkas och ibland kan en frustration noteras att takten i anpassning och anslutning går olika fort. Det är i detta sammanhang värt att framhålla att det sannolikt inte går att jämföra utveckling och byte av ett komplext vårdinformationssystem som omfattar många hälso- och sjukvårdsverksamheter med t.ex. utveckling och anslutning av ett system för receptexpedition. Särskilt inte som hela
SOU 2025:71 |
Nationell läkemedelslista – nuläge och närliggande initiativ |
vårdinformationssystemet samtidigt ska bytas ut och genomgå en avsevärd modernisering.
I rådande situation måste vårdgivarna, i väntan på de att de nya systemen blir färdigutvecklade och breddinförda, fortsatt ha kvar och använda sina äldre system. Att anpassa dessa äldre system, som redan är planerade att fasas ut, till ett nytt register med ny teknik innebär kostnader, som kan vara svåra att motivera. Det kan också i vissa fall vara svårt eller helt omöjligt att tekniskt anpassa det äldre systemet på nödvändigt sätt. När lagen om nationell läkemedelslista beslutades år 2018 var bytet av vårdinformation känt, däremot har tidsplanen för breddinförandet försenats med tiden vilket ändå lett till att flera av de äldre systemen nu anpassas för att kunna ansluta till den nationella läkemedelslistan.53 Sett till vad som i dag är känt kanske en tidig anpassning av äldre system varit ett alternativ som borde ha övervägts tidigare. Det är i vilket fall ostridigt att ovan be- skrivna omständigheter har påverkat och fortsatt påverkar införandet av den nationella läkemedelslistan.
Förändringarna kommer fortgå
Utifrån vad som ovan sagts finns det också skäl att blicka framåt. Anpassningen till registret nationell läkemedelslista är vare sig den enda eller sista anpassningen till andra system, krav eller standarder som svensk hälso- och sjukvård behöver göra. En sådan utveckling kommer i framtiden sannolikt inte heller enskilt drivas av svenska huvudmän, vårdgivare eller intressen. Den 26 mars 2025 trädde EU- förordningen om det europeiska hälsodataområdet i kraft. EU-för- ordningen ställer nya krav på anpassning för utbyte av data nationellt och inom EU vilket bl.a. inkluderar information om elektroniska recept, elektronisk information om expedieringar och viss annan information om läkemedelsbehandling och användning av medicin- tekniska produkter. Flera svenska utredningar har också lämnat för- slag på den offentliga sektorns och hälso- och sjukvårdens interopera- bilitet, se vidare avsnitt 4.4 nedan. Med anledning av vad som ovan sagts kan utredningen konstatera att det gyllene tillfälle när tiden står still sannolikt aldrig kommer att inträffa. Att genomföra förän-
53Se t.ex. anpassningen av TakeCare i region Stockholm.
Nationell läkemedelslista – nuläge och närliggande initiativ |
SOU 2025:71 |
dringar i förändringstider kommer vara det normala och något som organisationer behöver planera för och vara förberedda på.
Ny teknik innebär nya arbetsprocesser
De systembyten som diskuterats i föregående avsnitt är inte enbart en fråga om införande av ny teknik. Även om de första digitala jour- nalsystemen var en enkel digitisering av pappersjournalen, och där- med inte påverkade arbetsprocesserna nämnvärt, så har systemen i dag utvecklats med olika typer av funktioner och digitala kliniska beslutsstöd. Tekniken möjliggör eller tvingar fram förändringar. Det handlar därför till minst lika stor del om att förändringarna kommer att påverka hälso- och sjukvårdens och öppenvårdsapotekens arbets- processer med ordination, förskrivning och expediering av läkemedel. Målsättningen med den nationella läkemedelslistan är att skapa för- utsättningar för bättre patientsäkerhet. För att det ska realiseras krävs att listan utgör ett bra stöd för att förändra hälso- och sjukvårdens och öppenvårdsapotekens arbetsprocesser så att de blir både säkrare och effektivare. En sådan förändring kräver utbildning och förankring hos medarbetarna, både i hälso- och sjukvården och på öppenvårds- apotek. Förändringarna kan även innebära omställningar som blir märkbara för patienter och som därmed kräver en särskild informa- tionsinsats. Samverkan mellan de som berörs av processen samt lyhördhet för olika aktörers roller och behov blir därmed central.
Sett till att det arbetar ungefär 160 000 läkare och sjuksköterskor i hälso- och sjukvården skulle en timmes utbildning motsvara drygt 80 årsarbetskrafter medan en dags utbildning i stället skulle motsvara runt 660 årsarbetskrafter. En sådan investering innebär både direkta kostnader och ett produktionsbortfall i vården. Motsvarande tids- åtgång för öppenvårdsapotek skulle vara 3 eller 24 årsarbetskrafter. En informationsinsats till dem som berörs av förändringar kopplade till förskrivna läkemedel måste nå de dryga 7 miljoner personer som årligen hämtar ut minst ett läkemedel på recept.54 Dagens processer för ordination, förskrivning och expediering av läkemedel och mot- svarande för medicintekniska produkter beskrivs närmare i kapitel 5. Behovet av utveckling av arbetsprocesser beskrivs vidare i kapitel 15.
54https://www.socialstyrelsen.se/statistik-och-data/statistik/alla-statistikamnen/lakemedel/, besökt 2024-09-18.
SOU 2025:71 |
Nationell läkemedelslista – nuläge och närliggande initiativ |
Fortsatta oklarheter om synkroniserad information
I och med att utveckling och införande av system pågår både hos E-hälsomyndigheten, hos systemleverantörer i hälso- och sjukvården och hos apoteksaktörer, finns många osäkerheter om förutsättning- arna för att införa den nationella läkemedelslistan fullt ut till december 2025. Införandet riskerar att till del skjutas fram till år 2028 (se av- snitt 4.1).
En annan av de osäkerheter som diskuteras är om man kommer att kunna uppnå ett utbyte av information mellan hälso- och sjuk- vården och den nationella läkemedelslistan som innebär att ordina- tioner i journalen och förskrivningar i den nationella läkemedelistan kommer att vara uppdaterade och synkroniserade. Kommer t.ex. en dokumenterad justering i journalen av den dos en patient ska ta av ett läkemedel att även visas i den aktuella förskrivningen i nationella läkemedelslistan utan att några särskilda åtgärder behöver vidtas, och utan att förskrivningen behöver makuleras och en ny utfärdas? Och vad händer med ansvaret och hur uppdateras informationen när en ändring görs av en annan vårdgivare än den ursprungliga? Dessa frågor är av betydelse för huruvida de nyttor, och därmed den ökade patientsäkerhet som den nationella läkemedelslistan avser åstad- komma, infrias.
En samlad bild av en patients läkemedelsbehandling, oavsett var patienten har fått sina läkemedel ordinerade eller av vem, är en del av den målbild som finns med den nationella läkemedelslistan. Pati- enten ska genom listan få tillgång till en samlad informationskälla som gör det lättare för honom eller henne att följa och ha insyn i den ordinerade läkemedelsbehandlingen. Behörig vårdpersonal ska få bättre förutsättningar för att öka kvaliteten i läkemedelsprocessen genom åtkomst till information som behövs för en patientsäker ordi- nation och hantering av läkemedel. Behörig personal på öppenvårds- apotek ska kunna expediera läkemedel på ett ännu säkrare sätt än vad som är fallet i dag.55
I detta sammanhang är det viktigt att framhålla att en patients samlade läkemedelsbehandling består av patientens alla aktuella ordi- nerade läkemedel, dag för dag. En ordination behöver inte alltid inne- bära att det finns ett motsvarande, aktuellt, recept. Det gäller t.ex. tiden mellan att ett recept slutexpedierats fram tills att patientens
55Ds 2016:44 Nationell läkemedelslista, s. 164.
Nationell läkemedelslista – nuläge och närliggande initiativ |
SOU 2025:71 |
uthämtade läkemedel tar slut och vid vissa dosjusteringar som be- slutas av förskrivare eller av sjuksköterska, som i enlighet med Social- styrelsens föreskrifter kan ha rätt att justera dos av vissa läkemedel utifrån vissa mät- eller målvärden, efter att receptet utfärdats.56 Ett giltigt recept behöver inte heller alltid motsvaras av en aktuell ordi- nation, t.ex. i samband med utebliven makulering av receptet t.ex. efter utsättning av en läkemedelsbehandling. En förutsättning för ökad patientsäkerhet, och därigenom också en samhällsekonomisk effekthemtagning, är att informationen tillgängliggörs så att den stöd- jer arbetsprocesser i vården med lättillgänglig och relevant informa- tion. Att det förekommer osäkerheter i denna del är försvårande för implementeringen av nationella läkemedelslistan och det är viktigt att fördjupa förståelsen för möjliga hinder och lösningar. Utredning- ens bedömning är att det inte föreligger lagstiftningshinder, utan att det främst handlar om frågor som behöver lösas i samförstånd av aktörerna som utvecklar registret och de system som ska anslutas. Därigenom kan den målbild som ligger till grund för lagen realiseras.57
Även om många av utmaningarna som beskrivs i detta avsnitt hänför sig till den nationella läkemedelslistan så som den redan är beslutad, så har dessa även betydelse för en fortsatt utveckling av registret i enlighet med vad som framgår av utredningens direktiv. Det är därför viktigt att identifierade utmaningar beaktas i det fortsatta arbetet och att arbetet utgår från realistiska tidsramar.
4.3.3Namnet nationell läkemedelslista
Namnet nationell läkemedelslista har varit en källa till diskussion sedan lagen beslutades. Begreppet ”läkemedelslista”definieras i 3 kap. 1 § Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordination och hantering av läkemedel i hälso- och sjukvården som lista med uppgifter om läkemedelsordinationer som avser en viss patient. Begreppet finns också med samma lydelse i Socialstyrelsens termbank.58 Socialstyrelsen använder begreppet kopplat till de läke- medelsgenomgångar som regleras i 11 kap. i nämnd föreskrift.59
56Se 6 kap. 8 § Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordi- nation och hantering av läkemedel i hälso- och sjukvården.
57Se även prop. 2017/18:223 Nationell läkemedelslista, s. 184.
58Socialstyrelsens termbank, beslutad 2017.
59Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordination och han- tering av läkemedel i hälso- och sjukvården.
SOU 2025:71 |
Nationell läkemedelslista – nuläge och närliggande initiativ |
I allmänna råd nämns även den nationella läkemedelslistan som en av flera källor till information.60
Företrädare för vården menar att det finns en risk att namnet natio- nell läkemedelslista felaktigt tolkas som att det avspeglar en nationell samling av de ordinationslistor som avses i Socialstyrelsens före- skrifter när det, så som registerinnehållet är i dag, i själva verket hand- lar om en nationell lista över förskrivna och expedierade läkemedel och vissa varor. Dessa informationsmängder är inte överensstäm- mande och enligt vårdföreträdarna även viktiga att skilja åt. Det har även framförts till utredningen att den nationella läkemedelslistan är en komponent i E-hälsomyndighetens produkter Vård- och Apo- tekstjänster som klassas som ett nationellt medicinskt informations- system, förkortat NMI, och därmed måste följa de föreskrifter som gäller för sådana system.61 Av föreskrifterna framgår t.ex. att i märk- ning, i systemets bruksanvisning eller i annan produktinformation får det inte förekomma text, namn, varumärken, bilder och figura- tiva eller icke figurativa symboler som kan vilseleda användaren eller patienten vad gäller systemets avsedda ändamål, säkerhet och pre- standa genom bl.a. att ange en oriktig föreställning avseende funk- tioner eller egenskaper som systemet inte har eller underlåta att informera användaren eller patienten om en sannolik risk i samband med användning av det medicinska informationssystemet i enlighet med dess avsedda ändamål.62 Utredningen kan konstatera att före- skrifterna inte fanns när lagen om nationell läkemedelslista besluta- des men att de, precis som alla andra författningar och föreskrifter naturligtvis ska beaktas när själva systemet tas fram och implemen- teras. Tjänsterna Läkemedelskollen och Förskrivningskollen (se av- snitt 4.2 ovan) är t.ex. registrerade NMI:er och ska därmed uppfylla de krav som finns i föreskrifterna.63,64
Det finns många fördelar med att ha entydiga definitioner av be- grepp som används i olika situationer inom samma sakområde. Det underlättar både förståelse och kommunikation och minskar riskerna för missförstånd. Om det finns en möjlighet att välja att använda
60Allmänna råd till 11 kap. 5 § ovan nämnd föreskrift.
61Se 2 § Läkemedelsverkets föreskrifter (HSLF-FS 2022:42) om nationella medicinska infor- mationssystem (NMI).
622 kap. 6 § ovan nämnda föreskrift.
63Läkemedelskollen, NMI-ID: EHM-LMK3-v1, Tillverkare: E-hälsomyndigheten, Södra Lång- gatan 60, 392 31 Kalmar.
64Förskrivningskollen, NMI-ID: EHM-FK2-v3, Tillverkare: E-hälsomyndigheten, Södra Lång- gatan 60, 392 31 Kalmar.
Nationell läkemedelslista – nuläge och närliggande initiativ |
SOU 2025:71 |
begrepp som minskar risken för missförstånd är det att föredra. Samtidigt är det inte ovanligt att i enskilda författningar behöva definiera begrepp. 3 kap. 1 § i HSLF-FS 2017:37 inleds också med ”i dessa föreskrifter och allmänna råd avses med”, dvs. det är tydligt att definitionen gäller i ett visst sammanhang. Det förekommer, men är långt ifrån alltid så, att legaldefinitioner görs utifrån en termino- logisk analys i en bredare kontext. Det är inte givet att det mest läm- pliga namnet för en samling läkemedelsordinationer i en journal, sett i en större kontext, är läkemedelslista. Att begrepp definieras i enskilda föreskrifter hindrar inte heller att samma begrepp används allmänspråkligt. En läkemedelslista är helt enkelt en lista med olika läkemedel. Detta begrepp kan behöva användas i många olika sam- manhang.
I förarbetena till lagen om nationell läkemedelslista angav reger- ingen att beteckningen nationell läkemedelslista förvisso inte är opro- blematisk men att fördelarna med det föreslagna namnet vägde tyngre än nackdelarna.65 Regeringen anförde tre skäl för detta. För det första kan det inte uteslutas att registret framöver kommer inne- hålla fler informationsmängder än förskrivningar. Ett annat skäl att behålla beteckningen nationell läkemedelslista är att den har använts i samband med framtagningen av departementspromemorian med samma namn. Benämningen nationell läkemedelslista har också fått en del medieexponering varför den får antas ha blivit känd i en för- hållandevis bred krets.66 Det kan konstateras att regeringens ambi- tion med den nationella läkemedelslistan var en större samstämmighet mellan ordinationer och förskrivningar vilket, om det infrias på det sättet, skulle kunna göra användningen av begreppet mindre proble- matisk.
4.3.4Ändamålet forskning
Registret nationell läkemedelslista är i första hand tänkt för primär- användning av data genom att vård- och apotekspersonal samt pati- eten själv får direktåtkomst till uppgifter för olika ändamål. Det finns också ett antal specificerade övriga ändamål kopplat till sekundär-
65Nationell läkemedelslista, prop. 2017/18:223, s. 53 ff.
66A.a., s. 54.
SOU 2025:71 |
Nationell läkemedelslista – nuläge och närliggande initiativ |
användning i 3 kap. 5 § lagen (2018:1212) om nationell läkemedels- lista.
Av promemorian som föregick lagen framgår att registret inte ska kunna användas som ett hälsodataregister. De ändamål som an- ges i lagen ska vara särskilda och på ett tydligt sätt vara kopplade till de personuppgifter som ingår i registret. Det ska också framgå hur de förhåller sig till de behov som finns hos olika aktörer att behandla uppgifterna. Det ska inte råda någon tvekan om att, när det gäller behandling av personuppgifter som skulle tillåtas utöver de ändamål som gäller i dag för behandling av uppgifter i recept- registret, dessa endast får avse en patient åt gången. Det nya registret ska inte kunna användas för forskning eller andra ändamål som bru- kar vara förknippade med behandling av personuppgifter i hälsodata- register.67 Regeringen gjorde i den efterföljande propositionen i stort samma bedömningar.68
Syftet med registret är inte heller att man ska kunna följa upp och forska om enskilda läkemedel. För detta ändamål finns andra hälsodataregister t.ex. läkemedelsregistret69 och nationella vaccina- tionsregistret70 som förs av Socialstyrelsen respektive Folkhälsomyn- digheten. Läkemedelsregistret har brister i detta avseende genom att det inte omfattar läkemedel som ges i vården utan enbart förskrivna läkemedel. Det finns nu ett förslag att inrätta ett nytt hälsodataregi- ster, registret över administrerade läkemedel. Samtidigt föreslås läke- medelsregistret byta namn till registret över expedierade läkemedel.71 Därmed skulle informationsbehovet för sekundäranvändning till stora delar vara tillgodosett (se även utredningens tilläggsuppdrag i kap. 17).
Forskning om användningen av registret nationell läkemedelslista
Införandet av registret nationell läkemedelslista är en stor föränd- ring för vård och apotek. Det är därför viktigt att fortsätta generera kunskap om både vilka positiva och negativa effekter som kommer av registret och dess användning. Att kunna forska i anslutning till
67Nationell läkemedelslista, Ds 2016:44, s. 163.
68Prop. 2017/18:223 Nationell läkemedelslista, s. 100 f.
69Se förordningen (2005:363) om läkemedelsregister hos Socialstyrelsen.
70Se lagen (2012:453) om register över nationella vaccinationsprogram m.m.
71SOU 2024:57 Ett nytt regelverk för hälsodataregister, s. 287 ff.
Nationell läkemedelslista – nuläge och närliggande initiativ |
SOU 2025:71 |
den nationella läkemedelslistan är därmed av betydelse för fortsatt utveckling av t.ex. patientsäkerheten. Bland annat Nätverket Sveriges Läkemedelskommittéer poängterade också i remissvaret på departe- mentspromemorian att de ansåg det både onödigt och obegripligt att inte kunna använda registret på aggregerad nivå för forskning och utveckling av vårdens kvalitet.72 Synpunkten delades av bl.a. Apotekar- societeten, Region Örebro län och Svenska läkaresällskapet.73,74,75 Behovet av tillgång till uppgifter handlar inte enbart om data för att genomföra läkemedelsepidemiologisk forskning om användning och effekter av läkemedel. Till det finns de ovan nämnda hälsodataregi- stren samt annan data från journalsystem. Det handlar snarare om att analysera recept som registrerats i nationella läkemedelslistan för att t.ex. undersöka förekomsten av dubbletter eller fel i registret, vilka läkemedel som hämtas ut och vilka som inte gör det, från vilka system recepten kommer, om recept ändras eller makuleras, eller för att jäm- föra informationen i journalsystemens läkemedelslistor med informa- tionen i registret. I och med att E-hälsomyndighetens beslutsstöd för farmakologisk analys, Elektroniskt expertstöd förkortat EES, är kopplat till registret och analyserar förekomsten av potentiella pro- blem skulle forskare även kunna se värdet i att använda den data som genereras där för forskning.
Av propositionen Nationell läkemedelslista framgår att vetenskap- lig forskning inte är oförenlig med de syften och ändamål som regi- stret har.76 I och med det faktum att uppgifterna från den nationella läkemedelslistan kommer att finnas i Socialstyrelsens läkemedels- register, anser regeringen att eventuella förfrågningar om forskning eller liknande aktiviteter bör hänvisas till den myndigheten.77 Utred- ningen kan dock konstatera att det finns behov av forskning som inte kan besvaras via Socialstyrelsens register, nämligen ovan nämnda frågeställningar som är hänförliga till själva registret nationell läke- medelslista och dess användning. Utredningen gör bedömningen att det bör finnas visst utrymme för att, med stöd av regeringens tidigare bedömningar, genomföra forskning på registret när det inte
72Nätverket Sveriges Läkemedelskommittéer, Nationell läkemedelslista – synpunkter från LOK (dnr Komm2023/00650/S 2023:09-30).
73Apotekarsocieteten, Remissvar avseende Ds 2016:44 Nationell läkemedelslista dnr S2017/ 00117/FS.
74Region Örebro län, Yttrande över remiss; Ds 2016:44 Nationell läkemedelslista (dnr 17RS273).
75Svenska Läkaresällskapet, Remissvar Nationell läkemedelslista Ds 2016:44.
76Prop. 2017/18:223 Nationell läkemedelslista, s. 227.
77Prop. 2017/18:223 Nationell läkemedelslista, s. 101.
SOU 2025:71 |
Nationell läkemedelslista – nuläge och närliggande initiativ |
handlar om frågor av epidemiologisk art som kan besvaras genom andra hälsodataregister.
4.3.5Ändamålet tillsyn
Hälso- och sjukvården och dess personal står under tillsyn av Inspek- tionen för vård och omsorg, i det följande förkortat IVO.78 Syftet med IVO:s tillsyn är att granska att befolkningen får vård och om- sorg som är säker, har god kvalitet och bedrivs i enlighet med lagar och andra föreskrifter. Ett patient- och brukarperspektiv ska genom- syra tillsynen. Tillsynen ska därutöver planeras och genomföras med utgångspunkt i egna riskanalyser om inte annat följer av lag, förord- ning eller särskilt beslut från regeringen.79
För att kunna bedriva sitt tillsynsuppdrag är IVO i behov av att få tillgång till olika uppgifter, t.ex. om förskrivningar. IVO använder öppna data och beställer statistik från Socialstyrelsen eftersom sekre- tesslagstiftningen innebär att IVO endast kan få tillgång till uppgift- erna på en aggregerad nivå i betydelsen att en uppgiftssammanställning inte innehåller direkt utpekande personuppgifter.80 På läkemedels- området finns också t.ex. reglering i 6 kap. 6 § lagen (2018:1212) om nationell läkemedelslista om att E-hälsomyndigheten till IVO ska lämna ut uppgifter om en läkares eller tandläkares förskrivning av narkotiskt läkemedel eller annat särskilt läkemedel.
IVO har framhållit vikten av att myndigheten får tillgång till ytterligare uppgifter ur olika register för att myndigheten ska kunna bedriva sin tillsyn på ett effektivt sätt. Ett underlag som beskriver dessa behov har delgetts utredningen och beskrivs kortfattat nedan.81 Även Riksrevisionen har i rapporten Statens tillsyn över apotek och partihandel med läkemedel lyft behovet av IVO:s tillgång till utökade uppgifter om expedieringar för en ändamålsenlig tillsyn.82 Revisionen framförde vidare i rapporten Läkemedelsförskrivningen
–statens styrning och tillsyn att regeringen inte har gett IVO tillräck-
787 kap. 1 § patientsäkerhetslagen (2010:659).
792 § ovan nämnda författning.
80SOU 2024:57 Ett nytt regelverk för hälsodataregister, s. 70.
81IVO:s behov av uppgifter/data, dnr Komm2023/00650/S 2023:09-46.
82Riksrevisionen, 2022, Statens tillsyn över apotek och partihandel med läkemedel, RIR 2022:11, s. 56 ff.
Nationell läkemedelslista – nuläge och närliggande initiativ |
SOU 2025:71 |
liga förutsättningar för att kunna genomföra en riskbaserad egen- initierad tillsyn av läkemedelsförskrivarna.83
Inspektionen för vård och omsorgs utökade behov av tillgång till uppgifter om läkemedelsbehandlingar
IVO uppger att de, för att förbättra patientsäkerheten, behöver få tillgång till registerdata i den riskbaserade tillsynen. Det handlar t.ex. om att få en bättre grund för att inleda tillsyn jämfört med i dag då myndigheten till stor del förlitar sig på olika former av tips. Även om E-hälsomyndigheten sedan tidigare har en uppgiftsskyldighet gentemot IVO om att lämna ut uppgifter om en läkares eller tand- läkares förskrivning av narkotiskt läkemedel eller annat särskilt läke- medel har IVO inte möjlighet att använda registerdata i den risk- baserade tillsynen. E-hälsomyndigheten lämnar inte ut all data på området utan endast uppgifter om ett visst tillsynsobjekt. IVO har därför små möjligheter att på egen hand styra tillsynen till där den kan tänkas göra störst nytta. Om IVO hade tillgång till uppgifter om all förskrivning skulle IVO kunna identifiera granskningsobjekt ut- ifrån avvikande förskrivningsmönster exempelvis om det förskrivs mycket narkotiska preparat eller frikostig förskrivning av dyra läke- medel och läkemedel utanför ordination.
IVO menar också att de har behov av att få tillgång till uppgifter om förskrivning av fler läkemedelstyper t.ex. antibiotika och medel som används för bl.a. estetiska injektionsbehandlingar, t.ex. botuli- numtoxin. Detta eftersom även felaktiga förskrivningar av sådana andra läkemedel kan innebära risker för patientsäkerheten och indi- kera bristande kompetens eller olämplighet hos förskrivaren. IVO har också behov av att få tillgång till uppgifter om ordinationsorsak för att exempelvis kunna tillsyna förskrivningen av antibiotika.
När det gäller förskrivningar utförda av andra yrkeskategorier än läkare och tandläkare, t.ex. sjuksköterskor, finns det i dagsläget ingen möjlighet för IVO att fullgöra sitt tillsynsuppdrag eftersom de inte förskriver narkotiska eller andra särskilda läkemedel. Även sådana andra förskrivningar kan innebära risker eller vara olämpliga av andra skäl. Det kan gälla t.ex. förskrivning av stora mängder förbruknings-
83Riksrevisionen, 2023. Läkemedelsförskrivningen – statens styrning och tillsyn, RiR 2023:23, s. 89.
SOU 2025:71 |
Nationell läkemedelslista – nuläge och närliggande initiativ |
artiklar. IVO bedömer att de därför behöver tillgång till uppgifter om dessa förskrivningar.
IVO har även visst tillsynsansvar över apotek och apotekspersonal. Med tillgång till uppgifter om expedieringar för samtliga läkemedel per apotek, menar IVO att myndigheten t.ex. skulle kunna identifiera apotek som uppvisar ett avvikande mönster gällande expedieringen av vissa begärliga läkemedel såsom tillväxthormoner och narkotika- klassade läkemedel. E-hälsomyndigheten har i dag ingen uppgifts- skyldighet vad gäller uppgifter om apotek och apotekspersonal till IVO. För att få ta del av uppgifter från E-hälsomyndigheten inom ramen för ett pågående tillsynsärende krävs därför att IVO begär att uppgifterna lämnas ut från E-hälsomyndigheten. I en sådan situa- tion krävs att någon sekretessbrytande bestämmelse är tillämplig.
Utredningen kan konstatera att IVO:s nuvarande möjlighet att få tillgång till uppgifter är i linje med vad som tidigare angavs i 16 § lagen (1996:1156) om receptregister. Införandet av lagen (2018:1212) om nationell läkemedelslista har därmed inte minskat myndighetens möjligheter till tillsyn. IVO har i remissvaret på departementspro- memorian Nationell läkemedelslista, Ds 2016:44, tagit upp det utök- ade behovet av uppgifter för tillsyn. Utredningen kan konstatera att regeringen i propositionen som föregick lagen berörde frågan. Regeringen ansåg då att frågan behöver analyseras närmare innan den kan bli föremål för reglering. Analysen kunde emellertid inte göras inom ramen för det lagstiftningsärendet.84
Regeringen har i september 2024 beslutat att tillkalla en särskild utredare för att genomföra en översyn av vissa frågor om dokumen- tation, begränsningar och tillsyn avseende läkemedelsförskrivningar (Dir. 2024:82). I uppdraget ingår bl.a. att analysera och ta ställning till om IVO och Tandvårds- och läkemedelsförmånsverket bör få utökade möjligheter att ta del av uppgifter vid tillsynen över läke- medelsförskrivningar som påverkar läkemedelsförmånerna och om ansvaret för tillsynen behöver förtydligas samt att analysera om det finns behov av ändringar i reglerna för dokumentation i och åtkomst till patientjournaler för att bättre kunna följa upp läkemedelsförskriv- ningar. I och med detta uppdrag bör flera av de utmaningar IVO upplever kunna åtgärdas.
84Prop. 2017/18:223 Nationell läkemedelslista, s. 99.
Nationell läkemedelslista – nuläge och närliggande initiativ |
SOU 2025:71 |
4.3.6Andra sekundäranvändningsändamål
Även andra statliga myndigheter har behov av att ta del av informa- tion om behandlingar med läkemedel och medicintekniska produkter. Myndigheter som är vårdgivare har t.ex. behov av uppgifter i primär- användningssyfte vilket exemplifieras i avsnitt 5.4. Registret natio- nell läkemedelslista syftar i första hand till att dela uppgifter mellan patienter, vårdgivare och öppenvårdsapotek i primäranvändningssyfte, men det finns i lagen också vissa ändamål kopplat till sekundäranvänd- ning av data. I detta avsnitt beskrivs vad andra myndigheter fram- fört om ytterligare behov av information för sekundäranvändning.
Folkhälsomyndighetens behov
Folkhälsomyndigheten har framfört till utredningen att myndig- heten ser ett behov av att kunna hämta uppgifter ur registret natio- nell läkemedelslista för fler sekundäranvändningsändamål än vad som i dag är möjligt. Utredningen redogör nedan kort för dessa behov. Folkhälsomyndighetens behov kopplat till uppgifter om vacciner behandlas i kapitel 9 och i kapitel 17.
Rationell antibiotikaanvändning och antibiotikaresistens
Enligt 19 § förordningen (2021:248) med instruktion för Folkhälso- myndigheten ska myndigheten främja insatser på lokal och regional nivå i frågor som rör rationell antibiotikaanvändning och antibiotika- resistens. Uppföljning är en viktig del av att motverka uppkomst och spridning av antimikrobiell resistens. Det är även en patientsäkerhets- fråga att kunna följa att rätt läkemedel används vid rätt indikation.
Dessutom är uppföljning och jämförelse mellan regioner en fråga om jämlik vård. Folkhälsomyndigheten följer därför kontinuerligt försäljningen av antimikrobiella läkemedel i Sverige.
En viktig del i uppföljningen är enligt myndigheten att samman- ställa och återkoppla data om antimikrobiella läkemedel till relevanta målgrupper som underlag till lokalt förbättringsarbete i vården. För att möjliggöra uppföljningen får Folkhälsomyndigheten i dag tillgång till försäljningsuppgifter från E-hälsomyndigheten. Dessa uppgifter saknar koppling till läkemedlets avsedda användning. Diagnoskopp-
SOU 2025:71 |
Nationell läkemedelslista – nuläge och närliggande initiativ |
lade data kan i dag fås för uppföljning i primärvård via Primärvårds- kvalitet och för slutenvård via Infektionsverktyget. Dessa verktyg har utvecklats i syfte att verksamheter med hjälp av sina egna data ska genomföra lokalt förbättringsarbete och även kunna jämföra sig med andra verksamheter. Avsikten har inte varit nationell analys och uppföljning. Användning av och uppkoppling till dessa verktyg är frivillig och täckningsgraden har därför varierat över tid.
Folkhälsomyndigheten har framfört till utredningen att en mer heltäckande tillgång till uppgifter som även omfattar en koppling till läkemedlets tänkta användning, t.ex. genom tillgång till ordina- tionsorsak, är av betydelse för att kunna utvärdera användningen i relation till behandlingsrekommendationer. Tillgång till sådana upp- gifter skulle enligt myndigheten medföra att mer specifika insatser skulle kunna utvecklas för att främja en mer ansvarsfull användning för antimikrobiella läkemedel.
Myndigheten har också framfört ett behov av att kunna genom- föra uppföljning av hur kvalitetsindikatorer för behandling följs vid digitala vårdbesök. Digitala vårdbesök blir allt vanligare och uppfölj- ningen av förskrivningen vid den typen av vårdbesök är angelägen. Strama, Strategigruppen för rationell antibiotikaanvändning och minskad antibiotikaresistens, har t.ex. tagit fram rekommendationer för vilka indikationer där diagnos kan ställas vid digitalt besök. En- ligt myndigheten skulle en bättre uppföljning kunna åstadkommas genom att de arbetsplatskoder som ska anges vid förskrivning till- delas så att det går att särskilja olika former för vårdbesök.
Läkemedelsverkets behov
Läkemedelsverket har framfört till utredningen att de ser ett behov av uppgifter från den nationella läkemedelslistan i arbete med att ut- reda och bevaka tillgång och efterfrågan till läkemedel och ta fram nationell lägesbild i syfte att förebygga och hantera rest- och brist- situationer. I de delar som berör läkemedel trädde den 1 mars 2022 förordningen (EU) 2022/123 i kraft som ger den Europeiska läke- medelsmyndigheten, ofta förkortat EMA, en förstärkt roll vid kris- beredskap och krishantering avseende läkemedel och medicintekniska
Nationell läkemedelslista – nuläge och närliggande initiativ |
SOU 2025:71 |
produkter.85 Inom ramen för denna förordning ska behörig myndig- het lämna uppgifter om bl.a. volym förskrivna, försålda och lager av läkemedel i syfte av att visa på Sveriges behov och tillgång till läke- medel. Sedan den 1 december 2024 är Läkemedelsverket utsedd till sådan behörig myndighet.86 För försäljningsdata och lagerdata har myndigheten genomfört en förstudie och tagit fram författnings- förslag. Detta bereds vidare i Regeringskansliet. Vad avser volymer av förskrivna läkemedel har inte motsvarande arbete genomförts ännu. Myndigheten ser därför ett behov av att eventuellt få tillgång till uppgifter efterfrågade volymer av förskrivna läkemedel genom den nationella läkemedelslistan.
4.4Andra utredningar och initiativ som berör utredningens uppdrag
Parallellt med vår utredning har pågått ett flertal utredningar och initiativ på både svensk och europeisk nivå kopplat till hälsodata- frågor. Dessa utredningar har mer eller mindre tydliga samband och beroenden med de frågor vår utredning ska utreda. I det följande beskrivs nyligen avslutade eller pågående utredningar och initiativ av betydelse för den nationella läkemedelslistan och som utredningen beaktat i sitt arbete.
4.4.1Utvecklad reglering och styrning av interoperabilitet vid datadelning inom den offentliga förvaltningen och från den offentliga förvaltningen till externa aktörer (I 2022:03)
Regeringen gav år 2022 en särskild utredare i uppdrag att analysera befintlig styrning och reglering av interoperabilitet vid datadelning inom den offentliga förvaltningen och från den offentliga förvalt- ningen till externa aktörer. I uppdraget ingick att föreslå om och hur styrning och reglering av interoperabilitet bör och kan utveck-
85Europaparlamentets och rådets förordning (EU) 2022/123 av den 25 januari 2022 om en förstärkt roll för Europeiska läkemedelsmyndigheten vid krisberedskap och krishantering avseende läkemedel och medicintekniska produkter.
8629 a § förordningen (2020:57) med instruktion för Läkemedelsverket.
SOU 2025:71 |
Nationell läkemedelslista – nuläge och närliggande initiativ |
las med syfte att öka den offentliga förvaltningens förmåga att sam- verka digitalt.87
Utredningen om interoperabilitet vid datadelning föreslog i betänk- andet En reform för datadelning, SOU 2023:96, bl.a. att det ska vara ett politiskt mål att offentlig förvaltnings mest angelägna datadel- ning ska vara fullt interoperabel senast år 2030.88 Utredningen fann att de politiska ambitionerna avseende interoperabilitet av myndig- heter och andra aktörer uppfattades som otydliga. I andra länder, såsom Finland, Danmark, Norge och Frankrike var både ambitio- nerna för och styrningen av förvaltningen tydligare.89
Utredningen konstaterade att det saknas nationell styrning som gäller för hela den offentliga förvaltningen i syfte att data som delas ska vara interoperabel eller att den ska delas på ett interoperabelt sätt.90 Nivån av nationell, förvaltningsgemensam, interoperabilitet är inte tillräcklig för att realisera datadelningens nyttor eller för att uppnå EU:s eller Sveriges mål för offentlig förvaltnings digitalisering och styrningen är inte tillräcklig för att möta kommande EU-krav på interoperabilitet. Våra nordiska grannländer har samtliga kommit betydligt längre än Sverige i att skapa regelverk och system för inter- operabilitet.91 Utredningen föreslog därför ökad styrning genom en lag om den offentliga förvaltningens interoperabilitet.92 Behov identi- fierades av fortsatt utredning av förutsättningarna för att införa styr- ning av interoperabilitet inom fler sektorer eller områden motsvar- ande Utredningen om infrastruktur för hälsodata som nationellt intresse (S 2022:10) som beskrivs vidare nedan.
I avsnitt 8.12.1 återkommer utredningen till förslagen i SOU 2023:96.
87Dir. 2022:118, Utvecklad reglering och styrning av interoperabilitet vid datadelning inom den offentliga förvaltningen och från den offentliga förvaltningen till externa aktörer.
88SOU 2023:96 En reform för datadelning, s. 200.
89A.a.
90A.a., s. 201.
91A.a.
92A.a.
Nationell läkemedelslista – nuläge och närliggande initiativ |
SOU 2025:71 |
4.4.2Utredningen om infrastruktur för hälsodata som nationellt intresse (S 2022:10)
Regeringen gav år 2022 en särskild utredare i uppdrag att analysera och lämna förslag på åtgärder för att åstadkomma en bättre och säk- rare informationsförsörjning av hälsodata mellan system och aktörer inom hälso- och sjukvårdssektorn.93 Utredningen lämnade sitt betänk- ande Delad hälsodata – dubbel nytta – Regler för ökad interoperabilitet i hälso- och sjukvården, SOU 2024:33, i maj 2024.
Utredningen anser att det behövs ett statligt åtagande för hälso- och sjukvårdens interoperabilitet i vilket det ingår att stödja och styra hälso- och sjukvården att uppnå interoperabilitet genom att främja en nationell likriktning mot standarder som i möjligaste mån är öppna, internationella och implementationsnära. Utredningen bedömde att det är lämpligast för staten att i första hand styra situationer när vård- givare gör uppgifter om en patient tillgängliga för andra vårdgivare. Det kompletterar den styrning som redan finns för hur uppgifter ska dokumenteras i hälso- och sjukvården.94 Utredningen ansåg att gemensamma nationella specifikationer för delning av information via standardiserade API:er är den mest ändamålsenliga och samhälls- ekonomiska vägen att inom en rimlig tidsram nå interoperabilitet mellan så många aktörer som möjligt i svensk hälso- och sjukvård.95 Utredningen föreslog vidare att E-hälsomyndigheten ska ansvara för att ta fram och förvalta interoperabilitetslösningar96 (främst specifi- kationer) för hälso- och sjukvården.97 Lösningarna ska tas fram i sam- verkan med andra statliga myndigheter och i samarbete med hälso- och sjukvårdens aktörer i syfte att ge dessa aktörer möjlighet att bidra till att skapa så ändamålsenliga lösningar som möjligt.98 Utredningen framhöll att arbetet behöver utgå från ett verksamhetsperspektiv eftersom interoperabilitet och digitalisering syftar till att lösa problem i befintliga arbetssätt och är ett medel för verksamhetsutveckling. Ökad kvalitet i vården kan uppnås dels genom att rätt information finns tillgänglig när och där den behövs, dels genom automatisering
93Dir. 2022:98, Hälsodata som nationellt intresse – en lagstiftning för interoperabilitet.
94SOU 2024:33 Delad hälsodata – dubbel nytta, s. 222 ff.
95A.a., s. 229 ff.
96En interoperabilitetslösning är en återanvändbar resurs som beskriver rättsliga, organisa- toriska, semantiska eller tekniska förutsättningar.
97SOU 2024:33 Delad hälsodata – dubbel nytta, s. 245 ff.
98A.a., s. 232 ff.
SOU 2025:71 |
Nationell läkemedelslista – nuläge och närliggande initiativ |
av moment som i dag genererar onödig administration och onödig efterfrågan.
Vilka interoperabilitetslösningar som vården behöver och hur de ska utformas är beslut av strategisk karaktär där flera aktörer behö- ver involveras i beslutsprocessen. Staten behöver säkerställa att inve- steringar i vårdens digitala infrastruktur är långsiktigt hållbara, kost- nadseffektiva och i möjligaste mån blir återanvändningsbara. En förutsättning för att kunna ställa krav på samtliga vårdgivare att till- gängliggöra uppgifter är att staten samtidigt tillhandahåller en teknisk infrastruktur som möjliggör datadelning. Vidare föreslås att både kraven på hur uppgifter ska delas och kravet på att uppgifter delas ska bli föremål för statlig tillsyn, av IVO.99
Vårdgivare och huvudmän har långtgående skyldigheter att dela uppgifter om patienter för sekundära ändamål så som uppföljning, forskning och statistik, vilka alla fyller viktiga samhällsfunktioner. Uppgiftsskyldigheten kan orsaka administrativt dubbelarbete för vårdpersonal eftersom det har saknats ett ramverk för hur vårdens data ska standardiseras. En enhetlig struktur för vårdens informa- tionsförsörjning ger möjlighet att ställa krav på samordning så att krav på vårdgivare att använda vissa standarder och interoperabili- tetslösningar för vårdändamål, så långt som möjligt även ställs när samma data begärs in av statliga myndigheter för andra, sekundära, ändamål. Utredningen föreslog därför skyldighet för Socialstyrelsen att, vid föreskrifter om utfärdande av intyg samt fullgörande av uppgiftsskyldighet till de nationella hälsodataregistren, beakta de interoperabilitetslösningar för hälso- och sjukvården som tagits fram av E-hälsomyndigheten.100
I avsnitt 8.12.2 återkommer utredningen till förslagen i SOU 2024:33.
4.4.3Bättre förutsättningar för uppföljning av hälso- och sjukvården (S 2023:02)
Tillgången till hälsodata är av central betydelse för att ta fram under- lag för bättre beslutsfattande, för forskning och för att följa upp och utveckla hälso- och sjukvården. Samtidigt är tillgången till viktiga uppgifter begränsad, bl.a. uppgifter från öppenvården och uppgifter
99A.a., s. 293 ff.
100A.a., s. 287.
Nationell läkemedelslista – nuläge och närliggande initiativ |
SOU 2025:71 |
om rekvisitionsläkemedel101. Regeringen gav år 2023 en särskild utred- are uppdrag att se över bl.a. regelverket för hälsodataregister.102 Utredningen, som antog namnet Utredningen om hälsodataregister, lämnade sitt betänkande Ett nytt regelverk för hälsodataregister, SOU 2024:57, i augusti 2024.
Utredningen om hälsodataregister bedömde att det finns behov av en ökad tydlighet, transparens och förutsebarhet i den behand- ling av personuppgifter som utförs i hälsodataregister. Regelverket för hälsodataregister behöver också anpassas till den utveckling som skett i fråga om reglering av dataskydd. Utredningen föreslog därför en ny lag och en anslutande förordning för behandlingen av personuppgifter i hälsodataregister, hälsodataregisterlagen respek- tive hälsodataregisterförordningen.103
Lagen utformas som en ramlag av generell karaktär och ska kunna gälla för Socialstyrelsens befintliga hälsodataregister likväl som för framtida ännu ej inrättade hälsodataregister. I lagen ska framgå att syftet med hälsodataregister är att bidra till ökad kunskap för att utveckla och förbättra hälso- och sjukvården samt stärka folk- hälsan. Till skillnad från dagens förordningsstruktur föreslår utred- ningen att de nu gällande sex förordningarna ersätts av en gemensam förordning. Genom att samla de bestämmelser som gäller för hälso- dataregister i en förordning blir det enklare att få en överblick av regelverket, vilket ger bättre förutsättningar för en enhetlig tolkning och tillämpning av reglerna.104 Utredningen föreslår också ändringar i flera av registren. Nedan beskrivs de som är av relevans för vår utredning.
I dag samlas uppgifter om förskrivna läkemedel i det s.k. läke- medelsregistret. Behovet av att, för sekundäranvändningsändamål, även samla uppgifter om rekvisitionsläkemedel på individnivå i ett centralt register har varit känt länge. Flera myndigheter och privata aktörer har behov av sådana uppgifter för att kunna fullgöra sina uppdrag på ett ändamålsenligt sätt enligt författning, regleringsbrev och regeringsuppdrag eller för att driva utvecklingen av hälso- och
101I direktivet till Utredningen om hälsodataregister används begreppet rekvisitionsläkemedel för att beteckna i huvudsak sådana läkemedel som administreras eller överlämnas av hälso- och sjukvårdspersonal. Vår utredning har valt att använda begreppet läkemedel som admini- streras eller överlämnas av hälso- och sjukvårdspersonal. De båda uttrycken torde i huvudsak omfatta samma läkemedelsbehandlingar.
102Dir. 2023:48, Bättre förutsättningar för uppföljning av hälso- och sjukvården.
103SOU 2024:57 Ett nytt regelverk för hälsodataregister, s. 113 ff.
104A.a.
SOU 2025:71 |
Nationell läkemedelslista – nuläge och närliggande initiativ |
sjukvården i önskad riktning. Utredningen om hälsodataregister före- slår därför att fler uppgifter om rekvisitionsläkemedel ska samlas in från slutenvården och den specialiserade öppenvården till ett nytt hälsodataregister hos Socialstyrelsen benämnt registret över admini- strerade läkemedel.105 Uppgifter om rekvisitionsläkemedel bör enligt den utredningen i nuläget inte samlas in via registret nationell läke- medelslista.106
I utredningens arbete framkom att det finns ett behov av att samla in uppgifter som avser såväl ordinerade som administrerade rekvisi- tionsläkemedel.107 I nuläget bör insamlingen dock i huvudsak avse uppgifter om rekvisitionsläkemedel som har administrerats inom hälso- och sjukvården. Förutom uppgifter om patienter och uppgifter av administrativ karaktär ska insamlingen omfatta uppgifter av medi- cinsk betydelse som avser det administrerade läkemedlet, admini- strerad dos och dosenhet samt när och hur läkemedlet har admini- strerats.108 Uppgifter om ordinationer begränsas till uppgift om ordinationsorsak.
Utredningen föreslog vidare att Socialstyrelsen bör få i uppdrag att utreda vilka behov som finns av att samla in uppgifter även om rekvisitionsläkemedel från primärvården inklusive den kommunala hälso- och sjukvården. I uppdraget bör också ingå att analysera vård- givarnas förutsättningar att lämna sådana uppgifter till ett hälsodata- register.109 Genom tilläggsdirektiv har detta uppdrag i stället ankom- mit på vår utredning att utreda, se vidare kapitel 17.
4.4.4En mer ändamålsenlig och effektiv ordning för de nationella vaccinationsprogrammen och det nationella vaccinationsregistret (S 2022:13)
Regeringen gav år 2022 en särskild utredare uppdrag att göra en översyn av regleringen av de nationella vaccinationsprogrammen och det nationella vaccinationsregistret i syfte att säkerställa att de nationella vaccinationsprogrammen och det nationella vaccinations- registret är ändamålsenliga och effektiva, med beaktande av erfaren-
105A.a., s. 287 ff.
106A.a., s. 281.
107A.a., s. 268 ff.
108A.a., s. 272 ff.
109A.a., s. 265 ff.
Nationell läkemedelslista – nuläge och närliggande initiativ |
SOU 2025:71 |
heterna från covid-19 pandemin.110 Vaccinationsprogramsutredningen lämnade sitt betänkande Ett samordnat vaccinationsarbete – för effek- tivare hantering av kommande vacciner, SOU 2024:2, i januari 2024.
I stort anser Vaccinationsprogramsutredningen att beslutspro- cessen och ansvarsfördelningen för nationella vaccinationsprogram är ändamålsenliga. Det bör fortsatt vara Folkhälsomyndigheten som följer vaccinationsprogrammen och vid behov tar fram förslag till ändringar som regeringen sedan tar beslut om. Vidare anser utred- ningen att nuvarande utvärderingsprocess för nationella vaccinations- program tar rimlig tid och inte bör tidsättas.111 Utredningen föreslår även att utvidga tillämpningsområdet för lagen om register över nationella vaccinationsprogram m.m. till att också omfatta regionala vaccinationsprogram. Utredningen föreslår följande:
–Tillämpningsområdet för lagen om register över nationella vacci- nationsprogram m.m. utökas till att även omfatta regionala vacci- nationsprogram. Den uttryckliga hänvisningen till vaccinationer mot sjukdomen covid-19 tas samtidigt bort.
–Ett tillägg görs i lagen om att rapporteringen ska ske skyndsamt.
–Regleringen görs mer flexibel genom att regeringen bemyndigas att närmare bestämma vilka variabler som ska rapporteras till registret.
Utredningen berör dessa frågor närmare dels i kapitel 9 men även i kapitel 17.
4.4.5Patientöversikter i EES (S 2020:10)
Regeringen gav år 2020 en särskild utredare uppdrag att kartlägga informationsflöden och ansvarsfördelning i fråga om förskrivning och expediering av elektroniska recept (e-recept) inom Europeiska ekonomiska samarbetsområdet, i det följande EES.112 Genom tilläggs- direktiv gav regeringen utredaren i uppdrag att även utreda frågor som rör gränsöverskridande patientöversikter inom EES.113 Utred-
110Dir. 2022:109, En mer ändamålsenlig och effektiv ordning för de nationella vaccinations- programmen och det nationella vaccinationsregistret.
111SOU 2024:2 Ett samordnat vaccinationsarbete – för effektivare hantering av kommande vacciner, s. 211 ff.
112Dir. 2020:80, Vissa frågor om förskrivning och expediering av elektroniska recept inom EES.
113Dir. 2021:91, Tilläggsdirektiv till Utredningen om e-recept inom EES (S 2020:10).
SOU 2025:71 |
Nationell läkemedelslista – nuläge och närliggande initiativ |
ningen om e-recept och patientöversikter inom EES överlämnade sitt betänkande Patientöversikter inom EES och Sverige, SOU 2023:13, i mars 2023.
Utredningen har tagit fram förslag för att informationsutbytet av patientöversikter inom EES ska bli möjligt. Utredningen har utgått från förslag som inkluderar såväl privata som offentliga vårdgivare oavsett finansieringsform. Tjänsten patientöversikt inom EES syftar till att ge alla individer samt behandlande hälso- och sjukvårdsper- sonal, tillgång till utvalda uppgifter om individens hälsa och vård från hemlandet vid behov av oplanerad eller planerad vård i ett annat EES- land. Behandling av patienter utan information om deras medicinska tillstånd och bakgrund är riskfyllt och potentiellt farligt. Genom att möjliggöra tillgång till utvalda uppgifter om patientens hälsa och vård ökar patientsäkerheten och förutsättningar för god och säker vård stärks, bl.a. genom att risken för vårdskador reduceras.
Utredningen föreslog bl.a. ändringar i patientdatalagen (2008:355) och i lagen (2022:913) om sammanhållen vård- och omsorgsdoku- mentation genom bl.a. införande av krav på att vårdgivare, med vissa undantag, ska ge E-hälsomyndigheten elektronisk tillgång till upp- gifter om en patient för att tillföras en patientöversikt inom EES och från E-hälsomyndigheten elektroniskt kunna ta del av sådan patient- översikt.
E-hälsomyndighetens uppdrag som nationell kontaktpunkt för e-hälsa enligt patientrörlighetsdirektivet föreslås anges i förord- ningen (2013:1031) med instruktion för E-hälsomyndigheten. Det föreslås också att E-hälsomyndigheten får ett uppdrag att tillhanda- hålla tjänster och infrastruktur för informationsutbytet.114
Utredningen föreslog också ett nytt ändamål för personuppgifts- behandling i lagen (2018:1212) om nationell läkemedelslista. För- slaget innebär att personuppgifter får behandlas om det är nödvändigt för tillförande av uppgifter till en patientöversikt som ska samman- ställas, översättas och förmedlas i enlighet med 7 § 3 förordningen (0000:000) om personuppgiftsbehandling vid E-hälsomyndigheten i samband med hantering av patientöversikter.115
Utredningens betydelse har minskat genom ikraftträdandet av EU-förordningen om det europeiska hälsodataområdet där patient-
114A.a., s. 307 ff.
115A.a., s. 376.
Nationell läkemedelslista – nuläge och närliggande initiativ |
SOU 2025:71 |
översikter blir en obligatorisk del. Delar av de överväganden utred- ningen gjort är dock av relevans även för vår utredning.
4.4.6Utökade medicinska kompetenser i kommunen (S 2023:07)
Regeringen gav 2023 en särskild utredare i uppdrag att analysera och föreslå åtgärder för att stärka den medicinska kompetensen i kommunal hälso- och sjukvård.116 I direktiven anges att utredaren bl.a. ska lämna förslag om att stärka kommunernas möjlighet att säkra tillgång till läkare i kommunal hälso- och sjukvård. Utredningen lämnade i november 2024 betänkandet Stärkt medicinsk kompetens i kommunal hälso- och sjukvård, SOU 2024:72.
Av betänkandet framgår att den största potentialen till en bättre och mer välfungerande läkarmedverkan i kommunal hälso- och sjukvård finns i att stärka de befintliga strukturerna för samverkan mellan region och kommun. Att genomföra stora organisatoriska förändringar eller inleda en generell översyn av huvudmannaskapet för läkarinsatser i kommunal hälso- och sjukvård anser utredningen inte vara ändamålsenligt. Det har inte heller framförts från någon aktör att en större omorganisation skulle underlätta dagens utman- ingar. Den enklaste och snabbaste vägen för att säkra tillgången till läkare i den kommunala hälso- och sjukvården är att genomföra ett antal riktade åtgärder.
Utredningen föreslår ett formellt lagkrav på tillgång till medicinsk bedömning dygnet runt i den kommunala hälso- och sjukvården genom att kommunerna ska kunna garantera tillgång till medicinsk bedömning av en sjuksköterska och att regionerna ska garantera till- gång till medicinsk bedömning av läkare. Utredningen bedömer vidare att det i dag inte är tillåtet för kommunerna att anställa eller anlita egna läkare för patientnära kliniskt arbete. Utredningen visar att den modell som är praktiskt genomförbar utan omfattande ingrepp i hälso- och sjukvårdens grundstruktur är en modell som baseras på frivillig- het. De föreslår därför att det inte längre ska vara förbjudet för kommunerna att anställa, anlita eller finansiera läkare för patient- nära kliniskt arbete i den egna kommunala hälso- och sjukvården.
116Dir. 2023:98, Stärkt medicinsk kompetens i kommunal hälso- och sjukvård.
SOU 2025:71 |
Nationell läkemedelslista – nuläge och närliggande initiativ |
Det ska inte finnas någon skyldighet för kommunerna att anställa läkare. Tvärtom innebär förslaget inte någon inskränkning i regioner- nas grundläggande ansvar för läkarmedverkan. Regionerna kommer även framöver ha det fullständiga huvudmannaansvaret för läkar- insatser i kommunal hälso- och sjukvård. Förslag medför en ny frihet för kommunerna att anställa läkare och därmed en flexibilitet att kunna agera vid behov, särskilt i tider av extraordinära händelser eller vid förhöjd beredskap.117
4.4.7Uppdrag att möjliggöra en nationell digital infrastruktur för hälsodata (S 2024:A)
Regeringen gav i januari 2024 en utredare i uppdrag att biträda Social- departementet med att dels analysera och föreslå åtgärder som möjlig- gör en nationell digital infrastruktur för hälsodata, dels analysera och ta fram förslag kopplade till den kommande EU-förordningen om det europeiska hälsodataområdet, EHDS.118 Genom tilläggs- direktiv beslutat den 3 juli 2024 ska utredaren även analysera de rätts- liga förutsättningarna för att kunna inrätta en nationell vårdförmed- ling med särskilt fokus på en nationell katalog över vårdgivare och utförare av socialtjänst. Utredaren ska även analysera och ta ställning till vilka anpassningar av nationell rätt som är nödvändiga respek- tive lämpliga att göra med anledning av EU:s förslag till förordning om det europeiska hälsodataområdet.119 Utredningen har som en första delrapport lämnat uppgifter kring kostnadsuppskattningar och finansieringsförslag av EHDS.120 Utredningen behandlar detta vidare i konsekvensbeskrivningarna, se kapitel 18.
EHDS har betydelse för vår utredning och de förslag vi kommer att lämna. Anpassningen av svensk rätt till EHDS, särskilt av lagen (2018:1212) om nationell läkemedelslista, patientdatalagen (2009:356) och lagen (2022:913) om sammanhållen vård- och omsorgsdoku- mentation, är av betydelse för vår utredning. S 2024:A ska lämna sina förslag efter det att vi lämnat vårt betänkande.
117SOU 2024:72 Stärkt medicinsk kompetens i kommunal hälso- och sjukvård, s. 146 ff.
118Uppdrag att möjliggöra en nationell digital infrastruktur för hälsodata, S2024/00100.
119Ändrat uppdrag om att möjliggöra en nationell digital infrastruktur för hälsodata (S2024:A), S2024/01340.
120Det europeiska hälsodataområdet – kostnadsuppskattningar och finansieringsförslag, promemoria, S2024/00960-1.
Nationell läkemedelslista – nuläge och närliggande initiativ |
SOU 2025:71 |
4.4.8Vissa regeringsuppdrag av betydelse för utredningens arbete
I det följande redogör utredningen för vissa regeringsuppdrag av betydelse för utredningens arbete.
Ett framtida farmaceutsortiment
Läkemedelsverket har fått i uppdrag att utreda hur en reglering som innebär att vissa receptfria läkemedel enbart får säljas efter rådgivning från farmaceut bör utformas.121
Läkemedelsverket ser att ett så kallat farmaceutsortiment kan utgöra en ytterligare kategori av receptfria läkemedel. Den nya kate- gorin föreslås kännetecknas av särskilda krav på rådgivning och Läkemedelsverket föreslår därför att den nya kategorin ska benämnas ”Receptfria läkemedel med särskilda krav på rådgivning”.122 Naloxon i form av nässprej är sedan 2024 godkänt för receptfri försäljning på öppenvårdsapotek, som ett led i att öka tillgängligheten till naloxon. Godkännandet är förenat med villkor att farmaceut lämnar viss råd- givning vid försäljningen. Detta kan sägas utgöra ett första exempel på den nya kategorin, även om inga beslut i övrigt har tagits gällande receptfria läkemedel. Bedömningen av vilka receptfria läkemedel som ska ingå i den nya kategorin föreslås utgå från tre kriterier rörande patientsäkerhet, folk- och djurhälsa respektive miljö, varav ett eller flera behöver uppfyllas.123 Läkemedelsverket föreslår att receptfria läkemedel med särskilda krav på rådgivning ska kunna få tillhanda- hållas av alla öppenvårdsapotek som klarar av att uppfylla de särskilda krav som ställs.124
Läkemedelsverket menar att regleringen kan ha påverkan på till- gänglighet av läkemedel, patientsäkerhet samt hälso- och sjukvården i stort, men vill samtidigt belysa att effekterna av att införa en ny kategori i hög utsträckning kommer att bero av vilka produkter som i framtiden bedöms kunna ingå i densamma. Med stöd av en genom- förd internationell utblick och under arbetet genomförda samråd, bedömer Läkemedelsverket i nuläget inte att något större antal pro-
121Uppdrag om farmaceutsortiment (S2023/01610).
122Läkemedelsverket, 2024, Uppdrag om farmaceutsortiment, slutredovisning från Läkemedels- verket, dnr 1.1.8-2023-041314, s. 13 ff.
123A.a., s. 22 ff.
124A.a., s. 36 ff.
SOU 2025:71 |
Nationell läkemedelslista – nuläge och närliggande initiativ |
dukter kommer att bli aktuella för den nya kategorin.125 Den nya kategorin öppnar dock enligt myndigheten upp för möjligheten att i framtiden kunna tillgängliggöra läkemedel i en alltmer föränderlig värld och i ett samhälle i kontinuerlig utveckling.
Uppdraget är av betydelse för vår utredning då en förskjutning av läkemedel från receptbelagt till receptfritt läkemedel med krav på särskild rådgivning gör att dessa läkemedel, som i dag omfattas av de översikter om en patients läkemedelsbehandling som finns, inte längre kommer att göra det. Förutsättningarna att fånga infor- mation om dessa behandlingar förändras därmed och blir likställd med övrig egenvård med receptfria läkemedel.
En färdplan för en framtida nationell digital infrastruktur för hälso- och sjukvården
E-hälsomyndigheten har haft i uppdrag av regeringen att ta fram ett förslag till färdplan för genomförande av en nationell digital infra- struktur för hälso- och sjukvården.126 Uppdraget har redovisats i två delar.127 Med begreppet nationell digital infrastruktur avser myndig- heten en infrastruktur som uppfyller två kriterier. Det första är att infrastrukturen ska kunna användas av alla aktörer och det andra att staten ska ha ansvar för infrastrukturen. I det ingår att infrastrukturen ska förvaltas av en aktör som kan bemyndigas att meddela föreskrifter och utöva andra uppgifter som är förbehållna staten och dess myndig- heter. 128
Infrastrukturen kan ses som stommen till det ekosystem som hälsodataområdet utgör. Infrastrukturen syftar bl.a. till att skapa bättre förutsättningar för invånaren att få tillgång till och kontroll över sina egna hälsodata, effektivisera arbetssätten för verksamhe- terna, att bättre kunna nyttja data för att utveckla vården, bedriva forskning och att skapa bättre möjligheter för beslutsfattande. Detta åstadkommer man bl.a. genom att använda gemensamma standarder och specifikationer.
125A.a., s. 55 ff.
126Uppdrag att ta fram ett förslag till färdplan för genomförandet av en nationell digital infrastruktur för hälso- och sjukvården, S2023/02108.
127E-hälsomyndigheten, 2023, Förslag till övergripande färdplan för genomförandet av en nationell digital infrastruktur för hälso- och sjukvården, dnr 2023/02689.
128E-hälsomyndigheten, 2024, Förslag till färdplan för genomförandet av en nationell digital infrastruktur för hälso- och sjukvården, dnr 2023/02689.
Nationell läkemedelslista – nuläge och närliggande initiativ |
SOU 2025:71 |
E-hälsomyndigheten föreslår att den nationella digitala infra- strukturen ska bestå av en rad olika komponenter och strukturer. Dessa föreslås vara relativt tekniskt fristående från varandra och vara återanvändningsbara (även kallat modulära), eftersom ett sådant till- vägagångssätt gör det lättare att utveckla infrastrukturen stegvis allt eftersom nya behov uppstår. Därtill minskar de ekonomiska riskerna eftersom hela infrastrukturen inte byggs som en enda stor del.
Det är i huvudsak aktörerna inom sektorn som kommer att an- vända infrastrukturen för att utveckla tjänster för verksamhet och invånare. Bland dessa aktörer ingår även statliga myndigheter inklusive E-hälsomyndigheten, vilka kommer att kunna nyttja infrastrukturen för att utveckla de tjänster som regeringen prioriterar. Uppbyggnaden av den digitala infrastrukturen innebär inte att E-hälsomyndigheten kommer att ta över interna system från andra myndigheter. Snarare kan E-hälsomyndigheten ses som leverantör av den infrastruktur som de olika aktörerna kan, eller i vissa fall ska, använda vid framtagande av sina respektive tjänster.
Den nationella digitala infrastrukturen behöver utvecklas av flera myndigheter. Den grundläggande förvaltningsgemensamma infra- strukturen bedömer myndigheten i första hand bör utvecklas inom ramen för Ena – Sveriges digitala infrastruktur (se vidare nedan). Ett exempel på en sådan del är byggblocket identitet.
För de sektorsspecifika delarna bedömer myndigheten att det i första hand är E-hälsomyndigheten som bör ansvara för utvecklingen av infrastrukturen. Det kan dock bli aktuellt att drift hanteras, eller att vissa komponenter utvecklas, av andra myndigheter och organisa- tioner inom sektorn.
För att säkerställa en sammanhängande och långsiktig utveckling av den nationella infrastrukturen föreslår myndigheten en funktion för stöd och styrning som ska ansvara för att hålla ihop arbetet. Denna funktion föreslår myndigheten ska vara placerad på E-hälsomyndig- heten. Funktionen är enligt myndigheten en grundförutsättning för att det ska gå att utveckla en nationell digital infrastruktur. Det är dock helt avgörande att arbetet bedrivs i bred nationell samverkan med berörda aktörer. Funktionen för interoperabilitet, som myndig- heten har i uppdrag att etablera, är en del av funktionen för stöd och styrning.
SOU 2025:71 |
Nationell läkemedelslista – nuläge och närliggande initiativ |
En nationell teknisk lösning som möjliggör automatisk informationsöverföring till nationella kvalitetsregister
E-hälsomyndigheten har även utrett förutsättningarna för att ut- veckla en nationell teknisk lösning som ska möjliggöra automatisk informationsöverföring till nationella kvalitetsregister.129
Myndigheten konstaterar att förslaget till förordning om det euro- peiska hälsodataområdet, EHDS, innebär utmaningar och möjlig- heter som har bäring på uppdraget. EHDS förväntas bl.a. innebära att alla vårdinformationssystem och vårdgivare i Sverige behöver ansluta till den nationella digitala infrastrukturen för att tillgänglig- göra olika typer av hälsodata. Myndigheten lämnar därför förslaget att påbörja etableringen av en nationell interoperabilitetslösning för att på sikt möjliggöra en ökad grad av automatisk informationsöver- föring till nationella kvalitetsregister samt förbättra förutsättningar för informationsutbyte enligt EHDS och andra tillämpningar.
Även om kvalitetsregister inte är något som vår utredning behand- lar finns det i rapporten delar som knyter an till den nationella digitala infrastrukturen. Det finns en tydlig inriktning från regeringen att staten genom sina myndigheter ska ansvara för den nationella digi- tala infrastrukturen för hälso- och sjukvård, tandvård och social- tjänst. Infrastrukturen ska vara tillgänglig för samtliga vårdgivare, såväl offentliga som privata. Sverige behöver därför ett skifte mot en modern och enhetlig teknik och informatik enligt internationella standarder.
E-hälsomyndigheten har genom regeringsuppdraget fått i upp- drag att utreda förutsättningarna för utveckling av en nationell tek- nisk lösning som möjliggör automatisk informationsöverföring till nationella kvalitetsregister. E-hälsomyndighetens målsättning är att den digitala infrastrukturen ska kunna stödja flera olika användnings- fall, inklusive de användningsfall som kvalitetsregisterrapporteringen har behov av. På så sätt formas en långsiktigt hållbar strategi och ett effektivt resursutnyttjande med återanvändbarhet i fokus.130
En av de tydliga leveranser som utredningen beskriver i rapporten är en förutsättningsskapande komponent för tjänsteadressering. Kom- ponenten behövs för federerade lösningar. Syftet med tjänsteadres- seringen är att göra det möjligt för ett system att slå upp information
129E-hälsomyndigheten, 2024, Förutsättningar för en lösning som möjliggör automatisk infor- mationsöverföring till nationella kvalitetsregister – Slutredovisning, dnr 2023/02685.
130A.a., s. 18–19.
Nationell läkemedelslista – nuläge och närliggande initiativ |
SOU 2025:71 |
i en central katalog om hur API:er kan nås i syfte att interagera med andra aktörer. En central källa för adresseringsinformation innebär att aktörerna inte behöver underhålla denna information själva i sina system.131
De delar som E-hälsomyndigheten beskriver i de ovan nämnda rapporterna är viktiga utgångspunkter att beakta i utredningens fortsatta arbete och vid utvecklingen av förslag.
4.5Sveriges digitala infrastruktur – Ena
Regeringen uppdrog i december 2019 åt Bolagsverket, Domstols- verket, E-hälsomyndigheten, Försäkringskassan, Lantmäteriet, Myndigheten för digital förvaltning, Myndigheten för samhälls- skydd och beredskap, Riksarkivet samt Skatteverket att tillsammans etablera en förvaltningsgemensam digital infrastruktur för informa- tionsutbyte.132 Arbetet skulle ta utgångspunkt i de förslag som presenterats i rapporten från regeringsuppdraget om säkert och effektivt informationsutbyte inom den offentliga sektorn. Myndig- heterna rapporterade där om genomförd behovsanalys där man identifierat och prioriterat förvaltningsgemensamma behov. Behovs- analysen lyfte prioriterade behov kopplade till informationshanter- ing, tillit och säkerhet, informationsutbyte och digitala tjänster.133
Myndigheten för digital förvaltning leder arbetet med den eta- blerade förvaltningsgemensamma digitala infrastrukturen så att information ska kunna utbytas säkert och effektivt. Själva infra- strukturen byggs upp genom etablering av så kallade byggblock, grunddatadomäner och kompetensområden. Digital post, identitet eller mina ärenden är exempel på olika byggblock medan fastighets- och geografisk information, företag eller hälsa, vård och omsorg utgör exempel på grunddatadomäner.134 Ett kompetensområde byggs upp av resurser från en eller flera organisationer i syfte att ge stöd och agera bollplank inom områden som exempelvis infor-
131A.a., s. 30.
132Uppdrag att etablera en förvaltningsgemensam digital infrastruktur för informations- utbyte, I2019/03306/DF.
133Myndigheten för digitalisering mfl. 2019, Säkert och effektivt elektroniskt informationsutbyte inom den offentliga sektorn, DIGG dnr 2019-100.
134Myndigheten för digitalisering. 2022, Bilaga 1: Förteckning över komponenter i Ena – Sveriges digitala infrastruktur, dnr 2022-0087.
SOU 2025:71 |
Nationell läkemedelslista – nuläge och närliggande initiativ |
mationssäkerhet, arkitektur, juridik eller grunddata. Varje område leds av en ansvarig myndighet.
E-hälsomyndigheten ansvarar för grunddatadomänen hälsa, vård och omsorg samt byggblocket tillitsramverk.135 I praktiken innebär det att E-hälsomyndigheten kan knyta olika infrastrukturuppdrag till Ena. Därmed kan de kunskaper och erfarenheter som skapas genom t.ex. en nationell funktion för interoperabilitet bidra till ökade nyttor även inom andra områden eller grunddatadomäner. Myndigheten anger t.ex. i en rapport angående infrastruktur för nationella kvalitets- register att lösningen ska bygga på den sektorsspecifika infrastruk- turen för hälsa, vård och omsorg inom ramen för Ena – Sveriges digi- tala infrastruktur. Den skulle på sikt även kunna användas till andra eller framtida ändamål, exempelvis ändamål som kan följa av EHDS.136 Myndigheten anger vidare att den föreslagna interoperabilitetslös- ningen ska baseras på Enas byggblock där exempelvis säkerhetsmeka- nismerna ska utgå från byggblocken i kategorin Tillit och Säkerhet. Genom det arbete som görs för att ta fram en nationell interopera- bilitetslösning för en sektor som till stor del hanterar känsliga per- sonuppgifter, kan nya insikter och behov identifieras vilka i sin tur kan bidra till vidareutvecklingen av Ena.137 E-hälsomyndigheten ser vidare att infrastrukturen även behöver kunna utnyttjas för sådana scenarier där information från flera vårdgivare efterfrågas, exempel- vis e-recept och patientöversikter över landgränser, sammanhållen journalföring, nationellt datautrymme för bilddiagnostik eller för att möta framtida krav såsom EU-kommissionens förslag på för- ordning om inrättande av EHDS. För att möta dessa behov behöver infrastrukturen kompletteras med ytterligare funktioner såsom informationslokalisering, t.ex. genom patientdataindex, informa- tionsaggregering, orkestrering samt kodverkskälla.138
Genom att samla den nationella digitala infrastrukturen under en huvudansvarig myndighet, Myndigheten för digital förvaltning, och bygga upp en förvaltningsmodell som bygger på byggblock, grunddatadomäner och kompetensområden kan därmed hela sam- hället nyttja de synergier som uppstår. Vissa byggblock torde också
135https://www.digg.se/ledning-och-samordning/ena---sveriges-digitala-infrastruktur/om- ena/ansvar-och-finansiering#h-Rapporterochredovisningar, besökt 2024-09-24.
136E-hälsomyndigheten, 2021, Förstudie om digital nationell infrastruktur för nationella kvalitets- register Slutredovisning, regeringsuppdrag S2021/06170, s. 4.
137A.a., s. 19.
138A.a., s. 31.
Nationell läkemedelslista – nuläge och närliggande initiativ |
SOU 2025:71 |
vara gemensamma och kunna nyttjas myndighetsöverskridande oav- sett domän, t.ex. identitet eller mina ärenden. Digg lämnade också i februari 2025 en rapport om den långsiktiga utvecklingen och förvalt- ningen av Ena.139 I rapporten föreslås målbilden år 2030 vara att
–alla människor kan använda enkla och trygga digitala tjänster i mötet med offentlig sektor,
–offentlig sektor drar nytta av data, teknik och smartare arbets- sätt för att nå sina mål,
–Sverige har en sammanhållen digital infrastruktur som ökar effektiviteten och motståndskraften i samhället.140
Initiativen kring den nationella digitala infrastrukturen är av direkt betydelse för utredningens arbete och den fortsatta utvecklingen av förslag.
139Myndigheten för digital förvaltning, 2025, Förslag till långsiktig utveckling och förvaltning av Ena – Slutredovisning av uppdrag till Myndigheten för digital förvaltning att utreda hur Sveriges digitala infrastruktur bör utvecklas och förvaltas, dnr 2024–4511.
140A.a., s. 12.
5Processer för en patients behandling med ordinerat läkemedel eller medicinteknisk produkt
I det föregående kapitlet beskrev utredningen nuläget kring den nationella läkemedelslistan, utmaningar med den fortsatta utveck- lingen och ett antal olika omvärldsfaktorer som påverkar hälsodata- eller läkemedelsområdet. Detta kapitel inleds med ett avsnitt om patientjournalen. Därefter ges en översikt av processerna när ett behov uppstår som innebär att en patient ordineras ett läkemedel eller en medicinteknisk produkt. Kapitlet avslutas med ett särskilt avsnitt om statliga vårdgivares verksamhet.
Patientjournalen, processerna och de arbetssätt som dessa leder till är av betydelse för utredningens vidare utveckling av förslag samt en del i uppdraget att kartlägga de arbetsprocesser som används inom hälso- och sjukvården respektive öppenvårdsapoteken vid ordination och förskrivning respektive vid expediering av läkemedel och föreslå hur de kan anpassas till registret nationell läkemedels- lista. Utredningens förslag i denna del utvecklas i kapitel 15.
Patienten i centrum – processer utan tydlig början eller slut
Hälso- och sjukvård börjar och slutar alltid med patienten. Det är patientens hälsotillstånd eller risk för ohälsa och därmed efterföljande behov av utredning eller behandling som står i centrum för utförandet av hälso- och sjukvård eller tandvård. För utredning och behandling, inklusive förebyggande åtgärder, har hälso- och sjukvårdspersonalen tillgång till många olika metoder eller åtgärder. För behandling kan t.ex. nämnas kirurgi, sjukgymnastik, omvårdnad och livsstilsför-
227
Processer för en patients behandling med ordinerat läkemedel ... |
SOU 2025:71 |
ändring. Läkemedel och medicintekniska produkter är viktiga in- slag i, och komplement till, dessa metoder och åtgärder. Läkemedel utgjorde t.ex. år 2022 cirka 9,5 procent av hälso- och sjukvårdsbud- geten.1 Sju miljoner personer hämtade år 2023 ut minst ett läkemedel på recept.2
Vägen från ordination till patientens användning av ett läkemedel bör, enligt vad e-hälsokommittén beskrev år 2015, inte beskrivas som en kedja utan som en process utan tydlig början eller slut. En process som också innefattar återföring av information.3 Vår utred- ning gör ingen annan bedömning. En läkemedelsprocess är en del av en större vårdprocess och omfattar bl.a. moment som att utreda och bedöma, ordinera, iordningställa administrera, förskriva, expe- diera, informera, använda och följa upp. Alla moment ingår inte alltid och momenten är inte alltid tydligt sekventiella. Information till patienten, likväl som dokumentation av uppgifter, sker löpande av både hälso- och sjukvårdspersonal i vården och av apotekspersonal på öppenvårdsapotek. Även om utredningen endast noterat tidigare beskrivningar av en läkemedelsprocess utgår utredningen i det fort- satta arbetet ifrån att en motsvarande process kan beskrivas för åt- minstone vissa medicintekniska produkter.
Läkemedels- och medicinteknikprocesserna involverar, förutom patienten själv och eventuellt dennes närstående eller resurspersoner, hälso- och sjukvårdpersonal, personal på öppenvårdsapotek samt i vissa fall personal vid andra försäljnings- eller utlämningsställen.
5.1Patientjournalen
Patientjournalen är ett viktigt redskap vid utförande av vård och därmed också en viktig del i läkemedels- och medicinteknikpro- cesserna. Syftet med att föra en patientjournal är i första hand att bidra till en god och säker vård av patienten.4 Nedan följer en sam- manfattning av regleringen av patientjournaler och särskilt om dess betydelse för behandling med läkemedel och medicintekniska pro- dukter.
1https://www.lif.se/lakemedelsstatistik/kostnader-for-lakemedel-i-sverige/, besökt 2024-09-24.
2https://www.socialstyrelsen.se/statistik-och-data/statistik/alla-statistikamnen/lakemedel/, besökt 2024-09-24.
3SOU 2015:32 Nästa fas i e-hälsoarbetet, s. 74.
43 kap. 2 § patientdatalagen (2008:355).
SOU 2025:71 |
Processer för en patients behandling med ordinerat läkemedel ... |
5.1.1Skyldigheten att föra patientjournal
Patientdatalagen (2008:355) fastställer att vid vård av patienter ska det föras patientjournal. En patientjournal ska föras för varje patient och får inte vara gemensam för flera patienter.5 Hälso- och sjukvård definieras i patientdatalagen som verksamhet som avses i någon av ett flertal lagar som räknas upp i definitionen, däribland hälso- och sjukvårdslagen (2017:30) och tandvårdslagen (1985:125). Däremot anges inte lagen (2009:366) om handel med läkemedel vilket bl.a. innebär att verksamhet vid öppenvårdsapotek inte omfattas av kravet att föra patientjournal.
En patientjournal definieras i patientdatalagen som en eller flera journalhandlingar som rör samma patient.6 Journalhandlingar i sin tur utgör framställning i skrift eller bild samt upptagning som kan läsas, avlyssnas eller på annat sätt uppfattas endast med tekniskt hjälpmedel. Journalhandlingar upprättas eller inkommer i samband med vården av en patient och innehåller uppgifter om patientens hälsotillstånd eller andra personliga förhållanden, eller uppgifter om vidtagna eller planerade vårdåtgärder.7
Kravet på att föra patientjournal gäller både hos offentliga och privata vårdgivare. Skyldigheten att föra patientjournal har begränsats till personer som tillhör hälso- och sjukvårdspersonalen. Skyldigheten gäller dock inte all hälso- och sjukvårdspersonal utan endast dem som har mera centrala och självständiga arbetsuppgifter inom hälso- och sjukvården.8 Skyldigheten att föra patientjournal vid vård av patienter omfattar i första hand den som har legitimation eller sär- skilt förordnande att utöva ett visst yrke inom hälso- och sjukvården eller tandvården. I vissa fall är även icke-legitimerad personal skyldig att föra patientjournal.9 De journalhandlingar som upprättas inom hälso- och sjukvården ska vara skrivna på svenska språket, vara tyd- ligt utformade och så lätta som möjligt att förstå för patienten. Reger- ingen eller den myndighet som regeringen bestämmer får dock med- dela föreskrifter om att en sådan journalhandling får vara skriven på ett annat språk än svenska.10
53 kap. 1 § ovan nämnda författning.
61 kap. 3 § ovan nämnda författning.
71 kap. 3 § ovan nämnda författning.
8Prop. 1984:85/189 om patientjournal m.m., s. 46.
93 kap. 3 § patientdatalagen (2008:355).
103 kap. 13 § ovan nämnda författning.
Processer för en patients behandling med ordinerat läkemedel ... |
SOU 2025:71 |
Att en patientjournal ska föras för varje patient betyder inte att det för varje patient ska finnas endast en journal. För samma patient kan det finnas flera patientjournaler hos en och samma vårdgivare. De som hos en vårdgivare deltar i vården av en patient får föra en gemensam journal om denne. Vidare anses det uppenbart att de pri- vata vårdgivarna för patientjournal var för sig, men en privat vård- givare kan liksom en offentlig ha flera patientjournaler för en pati- ent.11 Det är också möjligt för flera vårdgivare, privata och offentliga, att samla uppgifter eller journalhandlingar i en gemensam databas eller ett gemensamt vårdinformationssystem och genom direktåt- komst medge varandra tillgång till de olika uppgifterna.12 Begreppet kallades ursprungligen sammanhållen journalföring men benämns
i dag sammanhållen vård- och omsorgsdokumentation även om innebörden för hälso- och sjukvården är densamma.13
I Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2016:40) om journalföring och behandling av personuppgifter i hälso- och sjukvården finns bestämmelser om patientjournalens struktur och innehåll. Det anges att vårdgivaren ska säkerställa att de uppgifter som finns dokumenterade i en patientjournal finns tillgängliga på ett överskådligt sätt för den hälso- och sjukvårdspersonal som är behörig att ta del av uppgifterna.14 Av allmänna råd till föreskrifterna framgår att de delar av en patients journal som hör till en och samma individanpassade vårdprocess bör hållas samman.
Som angetts ovan är syftet med att föra en patientjournal i första hand att bidra till en god och säker vård av patienten. Patientjour- nalen är ett stöd för vård och behandling av patienten. Hälso- och sjukvårdspersonal som inte har träffat patienten tidigare kan använda patientjournalen för att bedöma vilka åtgärder som behöver vidtas för att kunna ge patienten en god och säker vård. En patientjournal är även en informationskälla för patienten, uppföljning och utveckling av verksamheten, tillsyn och rättsliga krav, uppgiftsskyldighet enligt lag, samt forskning.15
11Prop. 1984/85:189 om patientjournal m.m., s. 37.
12Prop. 2007/08:126 Patientdatalag m.m., s. 105.
13Prop. 2021/22:177 Sammanhållen vård- och omsorgsdokumentation, s. 68.
145 kap. 1 § Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2016:40) om journal- föring och behandling av personuppgifter i hälso- och sjukvården.
153 kap. 2 § patientdatalagen (2008:355).
SOU 2025:71 |
Processer för en patients behandling med ordinerat läkemedel ... |
Innehållet i en patientjournal
En patientjournal får innehålla endast de uppgifter som behövs för de ändamål som anges i 2 kap. 4 § första stycket 1 och 2 patient- datalagen.16 Kravet på att föra patientjournal gäller således bara den individinriktade verksamheten inom hälso- och sjukvården.
En patientjournal ska innehålla de uppgifter som behövs för en god och säker vård av patienten. Om uppgifterna finns tillgängliga, ska en patientjournal alltid innehålla
1.uppgift om patientens identitet,
2.väsentliga uppgifter om bakgrunden till vården,
3.uppgift om ställd diagnos och anledning till mera betydande åtgärder,
4.väsentliga uppgifter om vidtagna och planerade åtgärder,
5.uppgift om den information som lämnats till patienten, dennes vårdnadshavare och övriga närstående och om de ställningsta- ganden som gjorts i fråga om val av behandlingsalternativ och om möjligheten till en ny medicinsk bedömning, samt
6.uppgift om att en patient har beslutat att avstå från viss vård eller behandling.17
Patientjournalen ska vidare innehålla uppgift om vem som har gjort en viss anteckning i journalen och när anteckningen gjordes.18 Patient- datalagen reglerar således vad som får finnas i en patientjournal.19,20 Därutöver finns bestämmelser i andra författningar om vad patient- journalen får eller ska innehålla, se t.ex. smittskyddslagen (2004:168) och förordningen (1991:1472) om psykiatrisk tvångsvård och rätts- psykiatrisk vård. Vidare innehåller Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2016:40) om journalföring och behandling av personuppgifter i hälso- och sjukvården bl.a. bestämmelser om innehållet i patientjournalen liksom Socialstyrelsens föreskrifter och allmänna råd (2017:37) om ordination och hantering av läke- medel i hälso- och sjukvården.
163 kap. 5 § ovan nämnda författning.
173 kap. 6 § ovan nämnda författning.
183 kap. 6 § ovan nämnda författning.
193 kap. 7 § ovan nämnda författning.
20Prop. 2007/08:126 Patientdatalag m.m., s. 93.
Processer för en patients behandling med ordinerat läkemedel ... |
SOU 2025:71 |
Hälso- och sjukvårdspersonalens tillgång till journaluppgifter
Vem som helst får inte ta del av uppgifter i en patientjournal. Den som arbetar hos en vårdgivare får ta del av dokumenterade uppgifter om en patient endast om han eller hon deltar i vården av patienten eller av annat skäl behöver uppgifterna för sitt arbete inom hälso- och sjukvården.21 En vårdgivare ska bestämma villkor för tilldelning av behörighet för åtkomst till sådana uppgifter om patienter som förs helt eller delvis automatiserat. Sådan behörighet ska begränsas till vad som behövs för att den enskilde ska kunna fullgöra sina arbetsuppgifter inom hälso- och sjukvården.22
Personuppgifter som dokumenterats för ändamål som anges i 2 kap. 4 § första stycket 1 och 2 patientdatalagen hos en vårdenhet eller inom en vårdprocess får inte göras tillgängliga genom elektro- nisk åtkomst för den som arbetar vid en annan vårdenhet eller inom en annan vårdprocess hos samma vårdgivare, om patienten motsätter sig det. I sådana fall ska uppgiften genast spärras. Vårdnadshavare till ett barn har dock inte rätt att spärra uppgifter om barnet. Upp- gift om att det finns spärrade uppgifter får vara tillgänglig för andra vårdenheter eller vårdprocesser.23
Direktåtkomst
Utlämnande genom direktåtkomst till personuppgifter är tillåten endast i den utsträckning som anges i lag eller förordning. Om en region eller en kommun bedriver hälso- och sjukvård genom flera myndigheter, får en sådan myndighet ha direktåtkomst till person- uppgifter som behandlas av någon annan sådan myndighet i samma region eller kommun.24 Så kan t.ex. vara fallet när sjukvården i en region inordnas under olika nämnder, t.ex. en primärvårdsnämnd och en hälso- och sjukvårdsnämnd.
Ilagen (2022:913) om sammanhållen vård- och omsorgsdoku- mentation finns bestämmelser om tillgång, genom direktåtkomst eller annat elektroniskt utlämnande, till andra vårdgivares uppgifter om patienter genom sammanhållen vård- och omsorgsdokumen- tation.
214 kap. 1 § patientdatalagen (2008:355).
224 kap. 2 § ovan nämnda författning.
234 kap. 4 § ovan nämnda författning.
245 kap. 4 § ovan nämnda författning.
SOU 2025:71 |
Processer för en patients behandling med ordinerat läkemedel ... |
Bevarandetid
En journalhandling ska bevaras minst tio år efter det att den sista uppgiften fördes in i handlingen.25 Särskilda bestämmelser om be- varande av journalhandlingar som tagits om hand efter beslut av Inspektionen för vård och omsorg finns i 9 kap. 4 § patientdata- lagen.26 Socialstyrelsen får meddela föreskrifter om att vissa slags journalhandlingar ska bevaras under längre tid.27 Socialstyrelsen har meddelat sådana föreskrifter i bl.a.
–Socialstyrelsens föreskrifter (SOSFS 2009:29) om transfusion av blodkomponenter,
–Socialstyrelsens föreskrifter (SOSFS 2009:30) om donation och tillvaratagande av vävnader och celler,
–Socialstyrelsens föreskrifter och allmänna råd (SOSFS 2009:32) om användning av vävnader och celler i hälso- och sjukvården och vid klinisk forskning,
–Socialstyrelsens föreskrifter (SOSFS 2012:14) om hantering av mänskliga organ avsedda för transplantation.
Vissa av ovan nämnda föreskrifter grundar sig på EU-rättsliga krav på bevarandetider där det i vissa fall ställs krav på bevarande i 30 år.
5.1.2Vad avgränsar en patientjournal
Begreppet patientjournal avser en eller flera journalhandlingar som rör samma patient. Journalhandlingar utgör framställning i skrift eller bild samt upptagning som kan läsas, avlyssnas eller på annat sätt uppfattas endast med tekniskt hjälpmedel. Journalhandlingar upprättas eller inkommer i samband med vården av en patient och innehåller uppgifter om patientens hälsotillstånd eller andra person- liga förhållanden, eller uppgifter om vidtagna eller planerade vårdåt- gärder.28 Så långt är patientjournalen tydligt avgränsad i lagstiftningen. Mer diffust blir det när man ska ange var en journal börjar och slutar och vad som är en eller flera fristående journaler beträffande en
253 kap. 17 § första stycket patientdatalagen (2008:355).
263 kap. 17 § andra stycket ovan nämnd författning.
274 § patientdataförordningen (2008:360).
281 kap. 3 § patientdatalagen (2008:355).
Processer för en patients behandling med ordinerat läkemedel ... |
SOU 2025:71 |
patient. Inte minst gäller det vid elektronisk patientjournalföring i ett informationssystem som är gemensamt för alla vårdenheter och alla journalföringspliktiga yrkeskategorier inom en vårdgivares verk- samhet. Begreppet patientjournal blir i denna bemärkelse snarast en samlingsbeteckning för alla de olika slags journalhandlingar som, helt och hållet beroende på hur journalföringen är organiserad, med tiden samlas kring en patient.29
Betydelsen av sammanhållen vård- och omsorgsdokumentation
Genom systemet med sammanhållen journalföring gavs möjlighet för sjukvårdshuvudmännen och de privata vårdgivarna att på frivillig väg bygga upp system för elektroniskt utlämnande i gemensamma databaser eller andra gränsöverskridande informationssystem för vårddokumentation.30 Systemet innebär att vårdgivare under vissa förutsättningar kan få direktåtkomst till varandras elektroniska journalhandlingar och andra personuppgifter som behandlas för ändamål som rör vårddokumentation. Begreppet direktåtkomst används i dag i olika registerförfattningar med något varierande innebörd. De specifika särdrag som enligt vedertagen uppfattning karaktäriserar direktåtkomsten, när det begreppet används för att beskriva en viss form av elektroniskt utlämnande, är främst att den som är ansvarig för informationen inte har kontroll över vilka upp- gifter som en mottagare vid ett visst tillfälle tar del av – automatiserad tillgång – och att mottagaren av informationen inte kan påverka inne- hållet i det informationssystem eller register som informationen lämnas ut från.31 Mottagaren har möjlighet att ta del av innehållet i t.ex. en elektronisk handling utan att för den skull kunna ändra i eller tillföra ny information till de uppgifter som utlämnaren ansvarar för.
Det grundläggande systemet för patientjournalföring behövde enligt regeringen inte förändras för att vara tillämpligt vid samman- hållen journalföring. Begreppet patientjournal är närmast en samman- hållande term för den samling av sinsemellan fristående journalhand- lingar som har det gemensamt att de i vidare mening berör vården
29Prop. 2007/08:126 Patientdatalag m.m., s. 80.
30A.a., s. 105.
31Se t.ex. prop. 2004/05:164 Tullverkets brottsbekämpning – Effektivare uppgiftsbehandling, s. 83.
SOU 2025:71 |
Processer för en patients behandling med ordinerat läkemedel ... |
av en patient.32 Regeringen ansåg att det för själva begreppet patient- journal inte innebär någon avgörande skillnad om journalhandlingar samlas från flera vårdgivare eller inte. En patientjournal kan med andra ord bestå av journalhandlingar från en enda eller från flera vårdgivare. Regeringen såg alltså inte anledning att införa en helt ny juridisk begreppsfigur för det senare fallet. Fortfarande är emeller- tid ansvaret för själva journalföringen i första hand knutet till den journalföringspliktiga yrkesutövaren. Varje elektronisk journalhand- ling kom genom förslaget även i fortsättningen att vara knuten till en viss vårdgivare som ansvarar för handlingar som upprättas eller inkommer i den egna verksamheten.33 Av ovanstående står det också klart att även om två eller flera vårdgivare samverkar inom ramen för sammanhållen vård- och omsorgsdokumentation är det inte möjligt för yrkesutövare från olika vårdgivare att lägga till eller ändra informa- tion i en journalhandling som har sitt ursprung från en annan vård- givare. Sammanhållen vård- och omsorgsdokumentation innebär endast en möjlighet att, genom direktåtkomst eller annat elektro- niskt utlämnande, läsa information.
Begreppet patientjournal måste tolkas brett
Man kan av ovanstående konstatera att begreppet patientjournal måste tolkas brett och att det som regeringen anger avser en sam- ling av journalhandlingar kring en enskild patient. Sådana journal- handlingar kan komma från flera olika vårdgivare och lagras i ett gemensamt system eller databas.
Det finns hos varje vårdgivare där patienten får vård åtminstone minst en journal avseende patienten. Det kan dock inte uteslutas att det finns vad som skulle kunna betraktas som flera patientjour- naler, avgränsade av de olika elektroniska informationssystem som används i vården. Flera regioner har ett huvudsakligt vårdinforma- tionssystem som täcker journalföringen vid många av de olika verk- samheterna, både vid sjukhus och i primärvård. I regionerna före- kommer dock ofta ett flertal separata system för specialiserade verksamheter vilka inte alltid är helt integrerade med varandra. Det kan då inte uteslutas att dessa kan betraktas som olika patientjour-
32Prop. 1984/85:189 Om patientjournallag m.m., s. 15.
33Prop. 2007/08:126 Patientdatalag m.m., s. 106.
Processer för en patients behandling med ordinerat läkemedel ... |
SOU 2025:71 |
naler när patienten har fått vård inom olika sådana verksamheter. För mindre vårdgivare, t.ex. privata utförare av hälso- och sjukvård eller tandvård, begränsas sannolikt verksamheten ofta till ett informa- tionssystem och endast en patientjournal.
Det finns vad utredningen erfar ingen komplett sammanställning av alla informationssystem som innehåller patientjournaler. Det finns en viss sammanställning av de av regionernas system som innehåller information om ordinerade läkemedel i en av Läkemedels- verket nyligen publicerad rapport om uppföljning av rekvisitions- läkemedel.34 Av rapporten framgår att det finns separata system med information om ordinerade läkemedel för kemoterapi, intensiv- vård, anestesi och radiologi.35 Sannolikt finns även separata system för dokumentation av t.ex. radiofarmaka även om detta inte ingick i den aktuella kartläggningen. Alla dessa olika system, från olika leve- rantörer, kan ha helt olika informationsstruktur och bygga på olika informatiska modeller vilket försvårar utbyte av information mellan system.
I Socialstyrelsens föreskrifter finns bestämmelser om att doku- menterade läkemedelsordinationer ska hållas samlade i patientjour- nalen.36 Eftersom patientjournalen måste tolkas brett och kan bestå av journalhandlingar från flera olika vårdgivare framstår det som oklart var avgränsningen enligt Socialstyrelsens föreskrifter ska göras. Läke- medelsverket fick i sitt arbete med uppföljning av rekvisitionsläke- medel extrahera data ur ett flertal olika it-system i varje region. Detta talar för att det finns flera olika listor över ordinationer för en och samma patient i en region och att dessa avgränsas av de olika systemen. Om systemen sammantaget bildade en patientjournal borde det finnas en samlad lista med läkemedelsordinationer hos vårdgivaren.
34Läkemedelsverket, 2022, Rekvisitionsläkemedel i epidemiologiska studier – Individdata på läkemedel administrerade utan receptförskrivning, baserat på rutinregistrering i sjukvårdens it- system, dnr 4.3.1-2019-096455.
35A.a., s. 14.
366 kap. 12 § Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordina- tion och hantering av läkemedel i hälso- och sjukvården.
SOU 2025:71 |
Processer för en patients behandling med ordinerat läkemedel ... |
5.1.3Patientjournalen är den mest centrala källan till information av betydelse för beslut om och genomförande av vård
Patientjournaler har funnits länge och har med tiden övergått från att föras på papper till att utgöra en integrerad del i moderna vård- informationssystem. Patientjournalen utgör alltjämt ett viktigt red- skap för att dokumentera och följa upp patientens vård. Patientjour- nalen innehåller mängder av uppgifter om t.ex. sjukdomshistoria, utredningar, laboratorieresultat och andra mätvärden, tidigare be- dömningar, bilder och utlåtanden från radiologiska undersökningar
m.m.Alla dessa uppgifter behövs för att tillsammans med patienten fatta beslut om vård och behandling. I denna del kan patientjour- nalen inte ersättas av annan dokumentation. Patientjournalen är, och kommer förbli, den mest centrala källan till information kring en patients vård. Patientjournaler är dock inte tillgängliga för alla, t.ex. personal vid öppenvårdsapotek, som deltar i processerna kring behandling med läkemedel och medicinteknik.
5.2Läkemedelsprocessen
Läkemedelsbehandling är en viktig komponent i behandlingen vid många hälsotillstånd. För vissa kroniska tillstånd är den helt domi- nerande. Det är också en behandlingsmetod som ständigt utvecklas genom nya vetenskapliga landvinningar. Med hjälp av läkemedel kan vi i dag bl.a. förebygga, bota eller lindra sjukdom, eller symtom på sjukdom, med väldigt goda resultat. Felaktigt använda kan dock läkemedel skapa stor skada hos patienten. Begreppet läkemedels- process myntades av E-hälsokommittén år 2015 för att beskriva de olika processer som är relaterade till ordination och expediering av läkemedel.37 Utredningen har valt att använda samma begrepp. Utred- ningen noterar dock att för att en läkemedelsordination ska vara möjlig att genomföra behöver den alltid föregås av andra åtgärder som utredning och bedömning av det aktuella tillståndet. Att detalje- rat beskriva dessa processer och därtill kopplade krav på dokumen- tation ligger dock utanför denna utrednings uppdrag.
37SOU 2015:32 Nästa fas i e-hälsoarbetet, s. 74.
Processer för en patients behandling med ordinerat läkemedel ... |
SOU 2025:71 |
En läkemedelsbehandling tar sin utgångspunkt i en patients hälso- tillstånd och med patienten som huvudperson. Bortsett från när en patient själv, eller med hjälp av apotekspersonal, fattar beslut om egenvård38 med receptfria läkemedel för lindrigare åkommor så star- tar processen i mötet mellan patient och utredande eller behand- lande hälso- och sjukvårdspersonal. Innan frågan om läkemedels- behandling eller ordination av medicintekniska produkter aktualiseras behöver hälsotillståndet utredas eller följas upp. En process för att tillgodose en patients behov av läkemedel, som en del i sin behand- ling, inkluderar sedan bl.a. vårdens processer med att ordinera, för- skriva eller administrera läkemedel samt att informera om och följa upp läkemedelsbehandlingen. Där ingår också öppenvårdsapotekens processer med att expediera och informera om läkemedel. Processen slutar först när patientens aktuella läkemedelsanvändning slutligen upphör. Vägen från ordination till patientens användning av ett läke- medel kan därför precis som e-hälsokommittén beskrev år 2015, inte beskrivas som en kedja utan som en process utan tydlig början eller slut.39 Hälso- och sjukvårdens del i läkemedelsprocessen finns bl.a. nyligen beskriven av Nätverket Sveriges chefläkare och tar sin utgångspunkt i Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordination och hantering av läkemedel i hälso- och sjukvården.40
Ordination och förskrivning av läkemedel är reglerat huvudsak- ligen i föreskrifter från Socialstyrelsen och Läkemedelsverket. Före- skriftsbestämmelserna samspelar, är omfattande och innehåller många detaljerade krav. I det följande avsnittet beskrivs en mer generell process, med utgångspunkt att det är en läkare som patienten möter i vårdsituationen. För sjuksköterskor, tandläkare och andra personal- kategorier med viss förskrivningsrätt, finns andra krav som också behöver beaktas. Sådana särskilda bestämmelser lyfts fram när de bedöms vara relevanta för sammanhanget.
38Notera att begreppet egenvård används delvis olika inom hälso- och sjukvården och i apotekssektorn. Se även avsnitt 15.3.7.
39SOU 2015:32 Nästa fas i e-hälsoarbetet, s. 74.
40Nätverket Sveriges chefläkare, 2022, Riskanalys av Nationella läkemedelslistan (NLL), s. 18.
SOU 2025:71 |
Processer för en patients behandling med ordinerat läkemedel ... |
5.2.1Patientens behov av läkemedelsbehandling
I samband med att en patient sökt vård, och i den vidare utredningen av patientens hälsotillstånd eller sjukdom, kan ett behov av en ny eller ändrad41 behandling identifieras. Innan ett beslut om vilken eller vilka behandlingar som ska erbjudas patienten ska den som överväger att ordinera ett läkemedel säkerställa att ordinationen är lämplig med utgångspunkt i patientens behov, förutsättningar och önskemål. Beslutet ska, när det är möjligt, tas i samråd med patienten eller dennes närstående.42 När det finns flera behandlingsalternativ som står i överensstämmelse med vetenskap och beprövad erfaren- het ska också patienten få möjlighet att välja det alternativ som han eller hon föredrar.43 Den som ordinerar ett läkemedel ska särskilt göra en lämplighetsbedömning där hänsyn tas till patientens hälso- tillstånd, ålder, kön, läkemedelsanvändning, pågående behandling och utredning, överkänslighet mot läkemedel, och eventuella gravi- ditet eller amning. Vid bedömningen ska även läkemedlets kontra- indikationer och andra viktiga faktorer för läkemedelsbehandlingen beaktas. Bedömningen ska göras såväl vid insättning eller utsättning av ett läkemedel, som vid ändring eller förlängning av en pågående läkemedelsbehandling.44
Som underlag för bedömning av läkemedelsanvändningen behöver den som står inför att fatta beslut om en läkemedelsordination bl.a. information om patientens aktuella och avslutade läkemedelsordi- nationer, en så kallad läkemedelslista som omfattar både receptför- skrivna läkemedel och sådana eventuella läkemedel som patienten regelbundet får administrerade av hälso- och sjukvårdspersonal. Listan behöver, om möjligt, kompletteras med bl.a. information från patien- ten om vilka av de ordinerade läkemedlen patienten faktisk använder, vilka eventuella receptfria läkemedel45 patienten använder samt hur behandlingen i praktiken fungerar för patienten.
Ett beslut om läkemedelsbehandling kan innebära en eller flera nya läkemedelsordinationer, att en eller flera tidigare gjorda ordina-
41Inom ramen för ändring ryms även en avslutad behandling.
42Se bl.a. 5 kap. patientlagen (2014:821).
437 kap. 1 § första stycket patientlagen (2014:821).
44Se 6 kap. 2 § Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordina- tion och hantering av läkemedel i hälso- och sjukvården.
45I begreppet receptfria läkemedel ingår även vissa utvärtes läkemedel, godkända naturläke- medel, registrerade traditionella växtbaserade läkemedel samt registrerade homeopatiska läkemedel.
Processer för en patients behandling med ordinerat läkemedel ... |
SOU 2025:71 |
tioner ändras eller avslutas eller en kombination av ovanstående. Ändring av en ordination kan t.ex. innebära byte av läkemedel, ändrad dos, ändrad behandlingstid eller ny ansvarig ordinatör dvs. övertagande av medicinskt ansvar.
Om ett beslut om ny eller ändrad läkemedelsbehandling tas ska den som fattar beslutet också alltid planera för en uppföljning. I upp- följningen ingår att bestämma tidpunkten för ett ställningstagande till eventuell fortsättning av behandlingen, eller för att bestämma ett datum för när den ordinerade läkemedelsbehandlingen ska av- slutas.46 Detta gäller oavsett om vårdkontakten sker med t.ex. en läkare, tandläkare eller sjuksköterska med förskrivningsrätt. I plane- ringen av uppföljningen är det också viktigt att beakta på vilket sätt uppföljningen ska genomföras, t.ex. genom ett återbesök eller ett telefonsamtal och om särskilda labprover behöver tas inför uppfölj- ningen.
5.2.2Läkemedelsordinationen
Begreppet ordination definieras av Socialstyrelsen som ett beslut av behörig hälso- och sjukvårdspersonal som är avsett att påverka en patients hälsotillstånd genom en hälso- och sjukvårdsåtgärd.47 Ett beslut om läkemedelsbehandling kan leda till en eller flera ordina- tioner av läkemedel. En läkemedelsordination måste innehålla till- räckligt med information för att den ska vara patientsäker. För detta krävs bl.a. att den är entydig och att det klart går att förstå vilket läkemedel som patienten ska administreras samt varför, när och hur läkemedlet ska användas. Detta är närmare preciserat i Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordination och hantering av läkemedel i hälso- och sjukvården. Av föreskrifterna framgår att läkemedelsordinationer ska dokumenteras i patientjour- nalen på ett strukturerat sätt och i ett enhetligt format.48 Dokumen- terade läkemedelsordinationer ska dessutom hållas samlade i patient- journalen.49 De uppgifter om en läkemedelsordination som ska dokumenteras enligt Socialstyrelsens föreskrifter är
466 kap. 5 § Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordina- tion och hantering av läkemedel i hälso- och sjukvården.
47https://termbank.socialstyrelsen.se/?TermId=710, beslutad år 2017.
486 kap. 9 § ovan nämnd föreskrift.
496 kap. 12 § ovan nämnd föreskrift.
SOU 2025:71 |
Processer för en patients behandling med ordinerat läkemedel ... |
–läkemedelsnamn eller aktiv substans,
–läkemedelsform,
–läkemedlets styrka,
–dosering,
–administreringssätt,
–administreringstillfällen,
–läkemedelsbehandlingens längd,
–ordinationsorsak,
–när och hur läkemedelsbehandlingen ska följas upp eller avslutas,
–i förekommande fall, anledningen till att läkemedlet inte får bytas ut mot ett likvärdigt läkemedel, och
–sådana övriga uppgifter som behövs för en säker hantering av läkemedlet.
Uppgiften om dosering ska anges i ett strukturerat format. Om doseringen anges som en vidbehovsordination, ska även uppgiften om maxdos per dygn dokumenteras.50 Även uppgift om admini- streringssätt kan anges strukturerat i enlighet med kodverk.
Uppgift om ordinationsorsak består av två delar, behandlings- orsak och behandlingsändamål samt ändringsorsak. Behandlingsor- sak är den medicinska anledning som ligger till grund för ordinatio- nen, t.ex. ångestsyndrom. Behandlingsändamål är en patientvänlig form av behandlingsorsaken. I samma exempel som ovan skulle det motsvaras av mot oro och ångest. Ändringsorsak är den orsak som ligger till grund för att en ändring, inklusive ett avslut, av ordinatio- nen genomförs. Det finns åtta ändringsorsaker bl.a. biverkning, bristande effekt, uppnådd effekt eller förändrat hälsotillstånd. Både behandlingsorsak, behandlingsändamål och ändringsorsak följer av ett nationellt kodverk, nationell källa för ordinationsorsak som för- valtas av Socialstyrelsen.51 Uppgiften om ordinationsorsak bör vid
506 kap. 10 § ovan nämnd föreskrift.
51https://www.socialstyrelsen.se/kunskapsstod-och-regler/omraden/e- halsa/tillampning/kodsystem-for-ordinationsorsak/, besökt 2024-09-25.
Processer för en patients behandling med ordinerat läkemedel ... |
SOU 2025:71 |
dokumentation anges genom användning av Socialstyrelsens natio- nella källa för ordinationsorsak.52
Samlad information om läkemedelsordinationer i patientjournalen
Strukturerad, samlad och tillgänglig information om patientens ordine- rade läkemedel är nödvändig för att bibehålla en god patientsäkerhet vid ordination och hantering av läkemedel. Brister i hur läkemedels- informationen presenteras och görs tillgänglig för den hälso- och sjukvårdspersonal som ordinerar och hanterar läkemedel kan med- föra att viktig information tappas bort eller inte uppmärksammas och riskera att patienter drabbas av läkemedelsrelaterade vårdskador. Att det finns en strukturerad läkemedelsinformation är särskilt vik- tigt med tanke på att det normalt sett är flera olika personer invol- verade i patientens läkemedelsanvändning.53
Läkemedelsordinationer ska dokumenteras i patientjournalen på ett strukturerat sätt och i ett enhetligt format. Som ett allmänt råd till 6 kap. 9 § HSLF-FS 2017:37 anges att dokumentationen av läke- medelsordinationer bör göras elektroniskt. Vikten av en strukturerad dokumentation följer även av vissa bestämmelser i Socialstyrelsens föreskrifter och allmänna råd (HSLFFS 2016:40) om journalföring och behandling av personuppgifter i hälso- och sjukvården. Vård- givaren ska säkerställa att de uppgifter som finns dokumenterade
i en patientjournal finns tillgängliga på ett överskådligt sätt för den hälso- och sjukvårdspersonal som är behörig att ta del av uppgif- terna.54 Att detta förutsätter strukturering framgår av 5 kap. 2 § HSLF-FS 2016:40 som föreskriver att vårdgivaren ska säkerställa att uppgifterna i en patientjournal är entydiga. I de allmänna råden till bestämmelsen hänvisas till Socialstyrelsens termbank och olika system för klassifikationer och kodverk, som kan vara verktyg för att uppnå denna entydighet.55
526 kap. 10 § Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordina- tion och hantering av läkemedel i hälso- och sjukvården.
53Socialstyrelsen, 2019, Ordination och hantering av läkemedel i hälso- och sjukvården. Hand- bok vid tillämpningen av Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordination och hantering av läkemedel i hälso- och sjukvården, s. 17.
545 kap. 1 § Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2016:40) om journal- föring och behandling av personuppgifter.
55Socialstyrelsen, 2019, Ordination och hantering av läkemedel i hälso- och sjukvården. Hand- bok vid tillämpningen av Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordination och hantering av läkemedel i hälso- och sjukvården, s. 17.
SOU 2025:71 |
Processer för en patients behandling med ordinerat läkemedel ... |
Vårddokumentationen ska vara ett ändamålsenligt verktyg för patientens vård och behandling, oavsett var dokumentationen ska användas. Därför är det viktigt att använda en enhetlig och jämför- bar terminologi. Väldefinierade begrepp och entydiga termer är sär- skilt viktiga vid sammanhållen journalföring så att olika vårdgivare och yrkesgrupper tolkar informationen på samma sätt.56
Trots vad som ovan angetts har det till utredningen framförts att det vid vissa åtgärder i hälso- och sjukvården är mest ändamåls- enligt och bäst ur ett patientsäkerhetsperspektiv att dokumentera en läkemedelsordination som fritext i direkt anslutning till den övriga vårdåtgärd som vidtas. Det har vidare framförts att en dubbel doku- mentation av dessa ordinationer skulle utgöra en administrativ börda. Utredningen bedömer dock mot bakgrund av ovanstående att det
i dag endast finns ett mycket litet utrymme för att ange läkemedels- ordinationer i löpande fritext och att ordinationerna ska hållas sam- lade i patientjournalen. Det framstår som att detta enklast görs i en sådan lista som beskrivs i 11 kap. 5–7 §§ HSLF-FS 2017:37. Det får förutsättas att de flesta digitala vårdinformationssystem på markna- den i dag, mer än sju år efter det att föreskrifterna beslutades, är anpassade till föreskrifternas krav och att det med tekniskt stöd går att undvika dubbeldokumentation.
Vad som däremot fortfarande är oklart är vad som avgränsar en patientjournal och därmed huruvida det hos en vårdgivare kan finnas flera patientjournaler och därmed flera olika läkemedelslistor (se 5.1.2 ovan).
Ansvaret för en läkemedelsordination
Redan år 2009 såg Nätverket för Sveriges Läkemedelskommittéer ett behov av att beskriva ansvaret för patientens ordinerade läke- medel och en samlad läkemedelslista. Behovet grundade sig bl.a. i att allt fler landsting, numer regioner, fått en samlad läkemedelslista inom sitt område. Läkemedelslistan skapades via en läkemedelsmodul i ett gemensamt journalsystem eller via en applikation som hämtar data från olika journalsystem.57 År 2014 uppdaterades dokumentet
56Prop. 2007/08:126 Patientdatalag m.m., s. 89.
57Nätverket Sveriges Läkemedelskommittéer, 2009, Patientens samlade läkemedelslista – ansvar och riktlinjer för hantering i öppen vård.
Processer för en patients behandling med ordinerat läkemedel ... |
SOU 2025:71 |
gemensamt av Nätverket och Sveriges Läkarförbund.58 Ett längre resonemang om innebörden av rekommendationerna i det senare dokumentet finns publicerade i Läkartidningen år 2015.59 Något vidare implementeringsarbete med rekommendationerna har dock vad utredningen erfar aldrig skett i praktiken även om rekommen- dationerna fortfarande används och det ofta refereras till dokumen- tet i olika sammanhang. Även artikeln i Läkartidningen är fortfa- rande i hög grad relevant. Rekommendationerna togs fram innan Socialstyrelsen arbetade om och beslutade nuvarande föreskrifter om ordination och hantering av läkemedel i hälso- och sjukvården och utgjorde ett underlag i revisionen. Rekommendationerna är skrivna ur ett läkarperspektiv men bör i tillämpliga delar kunna an- vändas av alla som har rätt att förskriva60 och därmed rätt att ordi- nera läkemedel, t.ex. tandläkare och sjuksköterskor med förskriv- ningsrätt.
Enligt patientsäkerhetslagen (2010:659) bär den som tillhör hälso- och sjukvårdspersonalen själv ansvaret för hur han eller hon fullgör sina arbetsuppgifter.61 Det innebär bl.a. att personalen har ett yrkes- ansvar för alla de beslut de fattar, även om läkemedelsbehandling.
Vid ett beslut ingår att väga samman alla de relevanta uppgifter om patientens hälsotillstånd och behandling som är kända eller fram- kommer. Det gäller även när det kommer till att t.ex. inte göra en ny eller förändra en befintlig läkemedelsordination. Ibland benämns ett ställningstagande till en tidigare gjord ordination som inte leder till någon ändring för bekräftande ordination.62 Ansvaret att vid läke- medelsordination beakta att en ordination är lämplig med utgångs- punkt i patientens behov är uttryckt i 6 kap. 2 § HSLF-FS 2017:37. Under förutsättning att inget särskilt framkommer kring patientens hälsotillstånd så tar dock den hälso- och sjukvårdspersonal som möter patienten inte över ansvaret för uppföljning av de läkemedels- behandlingar som är ordinerade av andra förskrivare sedan tidigare.
58Sveriges Läkarförbund och Nätverket Sveriges Läkemedelskommittéer, 2014, Ansvar för patientens ordinerade läkemedel – läkemedelslista.
59Hoffman, M., Lövström, R., Läkarens olika roller och ansvar för patientens läkemedelslista, Läkartidningen, 2015;112:C949.
60Endast den hälso- och sjukvårdspersonal som är behörig att förordna eller förskriva ett läkemedel enligt de författningar som anges i 2–5 §§ är behörig att ordinera läkemedlet, se
5kap. 1 § Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordination och hantering av läkemedel i hälso- och sjukvården.
616 kap. 2 § första stycket patientsäkerhetslagen (2010:659).
62Sveriges Kommuner och Regioner, 2023, Rapport gemensamma begrepp inom läkemedels- området, dnr SKR2023/02148.
SOU 2025:71 |
Processer för en patients behandling med ordinerat läkemedel ... |
Det är i vissa fall inte heller möjligt eftersom t.ex. sjuksköterskor eller tandläkare saknar den yrkeskompetens som krävs och därmed inte heller är behöriga att ordinera alla läkemedel.
Om det vid en vårdkontakt skulle framkomma uppgifter om patientens hälsotillstånd som föranleder att en tidigare gjord ordi- nation behöver ändras har hälso- och sjukvårdspersonalen ett an- svar att hantera detta, oavsett vem som ursprungligen ordinerat behandlingen. Hur detta görs beror bl.a. på om frågan behöver hanteras omedelbart eller kan anstå. Ibland kan den som uppmärk- sammar problemet själv åtgärda detta och genomföra ändringen medan det i andra fall innebär att man behöver uppmärksamma den person som gjort ordinationen, eller vårdenhet där ordinationen gjorts, på behovet. Det ska i sammanhanget noteras att även en tandläkare eller en sjuksköterska kan uppmärksamma problem re- laterade till en läkemedelsordination som de inte själva gjort och inte heller är behöriga att göra. I ett sådant fall har tandläkaren eller sjuksköterskan ett ansvar att informera den som kan vidta den nöd- vändiga åtgärden för att komma tillrätta med problemet som man noterat. Det ska för tydlighetens skull också nämnas att även vård- givaren har ett ansvar för att den som ordinerar läkemedel har de förutsättningar som krävs och att det finns ändamålsenliga rutiner på plats. Enligt patientsäkerhetslagen (2010:659) ska vårdgivaren planera, leda och kontrollera verksamheten på ett sätt som leder till att kravet på god vård i hälso- och sjukvårdslagen (2017:30) respek- tive tandvårdslagen (1985:125) upprätthålls.63 Som framgår ovan varierar också förutsättningarna att kunna ta ett helhetsansvar för olika yrkeskategorier. Ingen kan åläggas att ta ett ansvar som sträcker sig längre än vad den egna yrkeskompetensen möjliggör, t.ex. kan inte en tandläkare ta ansvar för och bedöma en behandling av hjärt- svikt.
Avslutningsvis är det också värt att nämna att en ändrad läke- medelsordination i patientjournalen också kan kräva att det aktivt genomförs en ändring av en sedan tidigare utfärdad förskrivning.
633 kap. 1 § patientsäkerhetslagen (2010:659).
Processer för en patients behandling med ordinerat läkemedel ... |
SOU 2025:71 |
Särskilt om sjuksköterskor och läkemedelsordinationer
Som framgick av föregående avsnitt har vissa sjuksköterskor behö- righet att förskriva läkemedel. Med behörigheten att förskriva läke- medel följer också behörigheten att ordinera motsvarande läkemedel.64 Förskrivningsrätten omfattar vissa läkemedel i enlighet med vad som anges i Läkemedelsverkets föreskrifter (HSLF-FS 2021:75) om för- ordnande och utlämnande av läkemedel och teknisk sprit och förut- sätter att vissa utbildningskrav är uppfyllda.65
Enligt 9 § Socialstyrelsens föreskrifter (HSLF-FS 2018:43) om behörighet för sjuksköterskor att förskriva och ordinera läkemedel får en sjuksköterska som har genomgått antingen specialistutbild- ning till distriktssköterska eller specialistutbildning inom hälso- och sjukvård för barn och ungdomar också ordinera läkemedel för vaccination i enlighet med vissa vaccinationsprogram.
Vissa ytterligare behörigheter för sjuksköterskor
Ett generellt direktiv om läkemedelsbehandling är ett beslut om läkemedelsbehandling som gäller patienter på en viss vårdenhet och vid särskilt angivna tillstånd.66 Ett generellt direktiv om läkemedels- behandling gör det möjligt att vid behov ge patienter som vårdas vid en viss vårdenhet läkemedel utan att det finns en individuell ordina- tion. Sjuksköterskor får också iordningställa och administrera läke- medel efter generella direktiv om läkemedelsbehandling utfärdade av läkare. Ett generellt direktiv ska vara skriftligt och innehålla upp- gifter om läkemedelsnamn eller aktiv substans, läkemedelsform, läkemedlets styrka, dosering, maxdos, administreringssätt, indika- tioner och kontraindikationer, samt antalet tillfällen som läkemedlet får ges utan att en läkare kontaktas. Generella direktiv om läkemedels- behandling ska utfärdas restriktivt och omprövas återkommande.67 Innan ett läkemedel med stöd av ett generellt direktiv om läke- medelsbehandling iordningställs och administreras eller överlämnas
64Se 5 kap. 1 § Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordi- nation och hantering av läkemedel i hälso- och sjukvården.
65Se 4–5 §§ Socialstyrelsens föreskrifter (HSLF-FS 2018:43) om behörighet för sjuksköter- skor att förskriva och ordinera läkemedel.
663 kap. 1 § Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordina- tion och hantering av läkemedel i hälso- och sjukvården.
676 kap. 6 § Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordina- tion och hantering av läkemedel i hälso- och sjukvården.
SOU 2025:71 |
Processer för en patients behandling med ordinerat läkemedel ... |
till en patient ska en sjuksköterska göra en bedömning av patientens behov av läkemedlet och kontrollera läkemedlets indikation och kontraindikationer. Bedömningen ska dokumenteras i patientjour- nalen.68
Även om en sjuksköterska inte har behörighet att ordinera ett visst läkemedel, får han eller hon justera doseringen inom en befint- lig läkemedelsordination i de situationer där doseringen är beroende av en patients individuella mål- eller mätvärden.69 Exempel på läke- medelsbehandling där doseringen är beroende av mål- eller mätvärden är behandling med warfarin där dosen justeras utifrån PK (INR)- värde och behandling med insulin där dosen justeras utifrån blod- sockervärde. Den som ordinerar en sådan läkemedelsbehandling bestämmer en initial dosering samt de mål- eller mätvärden som ska ligga till grund för dosjusteringen. Utifrån de i ordinationen givna mål- eller mätvärdena kan en sjuksköterska justera doseringen utifrån patientens aktuella värden. Doseringen får justeras endast om det är förenligt med en god och säker vård av patienten och den ska göras med utgångspunkt i patientens behov. När en dosering har justerats ska det dokumenteras i patientjournalen.70
Ska det ordinerade läkemedlet förskrivas?
När en patient är inskriven på sjukhus är det naturligt att flertalet läkemedel som ordineras också administreras av vårdpersonal eller överlämnas till patienten själv för administrering. Vad gäller sedan tidigare pågående läkemedelsbehandling ska hälso- och sjukvårds- personalen vid inskrivningen ta ställning till om patienten har möj- lighet att själv fortsätta ansvara för denna eller om läkemedlet i stället ska administreras eller överlämnas av hälso- och sjukvårdspersonal.71 Bestämmelser kring iordningställande, administrering och över- lämning av läkemedel finns i kapitel 7 och 8 i HSLF-FS 2017:37.
För patienter i öppen vård, eller vid utskrivning från sluten vård, behöver fler överväganden göras. Om det handlar om ett för patien- ten nytt läkemedel, och läkemedlet kan hanteras av patienten själv,
686 kap. 7 § ovan nämnda föreskrift.
696 kap. 8 § första stycket ovan nämnda föreskrift.
706 kap. 8 § andra stycket ovan nämnda föreskrift.
7110 kap. 1 § Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordina- tion och hantering av läkemedel i hälso- och sjukvården.
Processer för en patients behandling med ordinerat läkemedel ... |
SOU 2025:71 |
utfärdas normalt ett recept så att patienten kan hämta ut detta på öppenvårdsapotek. För att en förskrivning ska komma i fråga be- höver det aktuella läkemedlet vara utformat på ett sätt så att patien- ten med en rimlig utbildningsinsats kan hantera det själv. De flesta patienter, men inte alla, kan hantera en tablettbehandling på egen hand eller med stöd av anhörig. Vissa patienter kan efter utbildning även hantera t.ex. subkutana injektioner själva. Ibland finns hjälp- medel som gör det enklare, eller utgör en förutsättning, för att patien- ten ska kunna administrera sitt läkemedel. T.ex. utgör injektions- sprutor och kanyler ibland en förutsättning för administrering medan droppstöd kan underlätta administreringen av ögondroppar. Det behöver därför i varje enskilt fall göras en bedömning av det aktu- ella läkemedlet i kombination med patientens förmåga till egenvård72 innan en receptförskrivning genomförs. När läkemedel ordineras till barn behöver dessutom en bedömning även innefatta möjlig- heterna för barnet att få hjälp med läkemedelsbehandlingen av vård- nadshavare, på förskola eller i skola.
Om patienten inte kan hantera läkemedlet själv, eller med hjälp av någon i sin närhet, behöver det göras en bedömning av hur läke- medlet bäst tillhandahålls. Det kan handla om att läkemedlet admini- streras av hälso- och sjukvårdspersonal vid besök på en distrikts- sköterskemottagning eller en öppenvårdsmottagning på ett sjukhus, eller att patienten får hjälp genom olika stödinsatser av hälso- och sjukvårdspersonal i hemmet. I vissa fall är det då inte aktuellt med en förskrivning av läkemedlet på recept. Läkemedlet rekvireras då i stället och tillhandahålls i samband med vårdkontakten.
Andra aspekter som behöver vägas in när ett läkemedel ordineras är om det aktuella läkemedlet är så potent, eller har potentiella biverk- ningar, som innebär att det behöver ges under övervakning av hälso- och sjukvårdspersonal. I vissa fall framgår det av läkemedlets god- kännande att det måste ges av vårdpersonal eller under övervakning av hälso- och sjukvårdspersonal. I så fall behöver det antingen ges på en vårdinrättning eller av hälso- och sjukvårdspersonal i hemmet.
Sammanfattningsvis är det många olika bedömningar som behö- ver göras när ett läkemedel ordineras eller när en tidigare ordination
72Med egenvård avses i sammanhanget en hälso- och sjukvårdsåtgärd som behandlande hälso- och sjukvårdspersonal har bedömt att en patient kan utföra själv eller med hjälp av någon annan. När egenvård utförs gäller inte hälso- och sjukvårdslagen (2017:30).
SOU 2025:71 |
Processer för en patients behandling med ordinerat läkemedel ... |
ändras. Det som kan förskrivas till en patient kan behöva hanteras på annat sätt för en annan.
5.2.3Förskrivning
Förskrivningen, eller receptet, uppstod långt tillbaka i tiden utifrån att det fanns ett behov av att förmedla information om en läkemedels- ordination från dåtidens läkare till dåtidens farmaceuter. Det finns uppgifter om skriftliga recept från år 2600 f.Kr. i Babylonien. I Sverige finns recept bevarade från åtminstone år 1705.73 Recepten innehöll från början information om kompositionen, vilka ingredienser som skulle blandas, till vem och varför. Även om receptet som med- delande mellan vård och apotek har funnits länge har innehållet och strukturen med tiden förändrats utifrån behov och förutsättningar. I takt med att standardiserade beredningar och industriell tillverk- ning av läkemedel infördes minskade t.ex. behovet av att ange själva kompositionen på receptet. Någonstans på 1980-talet övergick receptet från att vara i fritext till att bli ett strukturerat formulär med olika fält för i förväg definierade informationsmängder. Efter- hand har information relaterat till betalning och kostnadsreducering också införts som en uppgift som ska anges på receptet. Sedan
1 maj 2022 finns krav på att recept till människa som huvudregel ska vara elektroniska.74
Receptet är fortfarande i första hand ett meddelande från vård till apotek. Syftet är att patienten ska få tillgång till aktuellt läke- medel och kunna använda det på ett korrekt och säkert sätt genom en entydig och säker expedition.
När hälso- och sjukvårdpersonalen konstaterat att ett ordinerat läkemedel ska förskrivas (se 5.2.2 ovan) finns detaljerade bestäm- melser för det förfarandet i Läkemedelsverkets föreskrifter (HSLF- FS 2021:75) om förordnande och utlämnande av läkemedel och teknisk sprit. De uppgifter som ska anges på ett recept utgör till stor del sådan information som redan ingår i läkemedelsordina-
73”Recept och receptkuvert”, Apotekarsocietetens museum, hämtad 06 februari 2024 https://apotekarsocieteten.museum/objects/c148-75703/.
744 kap. 1 § Läkemedelsverkets föreskrifter (HSLF-FS 2021:75) om förordnande och utlämnande av läkemedel och teknisk sprit.
Processer för en patients behandling med ordinerat läkemedel ... |
SOU 2025:71 |
tionen, men receptet kompletteras också med annan information.75 Det gäller t.ex. information som riktar sig till patienten om hur denne ska använda läkemedlet och uppgifter som riktar sig till öppenvårds- apoteket och som ligger till grund för vad patienten ska betala, upp- gift om utbyte av läkemedlet får ske, om patienten och behandlingen omfattas av läkemedelsförmånen samt förskrivaruppgifter. De skillna- der som finns mot vilka uppgifter som ska dokumenteras om ordina- tionen är att denna bl.a. får uttryckas som aktiv substans samt innehål- ler vissa uppgifter som uttrycks på ett sätt som är mer ändamålsenligt för vårdpersonal. T.ex. finns en skillnad mellan ordinationens behand- lingsorsak och receptet behandlingsändamål (se avsnitt 5.2.2), hur dosering och administrering beskrivs eller att ordinationen också ska innehålla information om uppföljning eller avslut av behandling. Dessa uppgifter ska, om de är av särskild betydelse, även anges på receptet. Detta framgår kanske tydligast av föreskrifternas 4 kap. 7 § där det anges att anvisningar beträffande dosering, användning och behand- lingsändamål ska anges så att patienten kan använda läkemedlet eller den tekniska spriten på rätt sätt.
Kraven på information i receptet är hög. Vid förskrivning till människa ska förskrivaren ange samtliga uppgifter så tydligt att risk för feltolkning undviks. Svenska uttryck för sjukdomar och symp- tom ska användas där så är möjligt. Förkortningar ska undvikas. Anvisningar beträffande dosering, användning och behandlings- ändamål ska anges så att patienten kan använda läkemedlet eller den tekniska spriten på rätt sätt.76 I vägledningen till bestämmelsen fram- går att tydliga recept är en förutsättning för en säker läkemedelshan- tering och läkemedelsanvändning samt att om det visar sig under be- handlingens gång att det förskrivna läkemedlet inte längre är aktuellt, ska förskrivaren vidta lämpliga åtgärder för att förhindra ytterligare expediering av receptet.77
Tillgången till en giltig förskrivning, ett recept, är det sista ledet i en kedja för att patienten ska kunna hämta ut sitt läkemedel på
75Jfr 4 kap. 8 § ovan nämnda föreskrift samt 6 kap. 10 § Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordination och hantering av läkemedel i hälso- och sjukvården.
764 kap. 7 § Läkemedelsverkets föreskrifter (HSLF-FS 2021:75) om förordnande och utlämnande av läkemedel och teknisk sprit.
77Vägledning till Läkemedelsverkets föreskrifter (HSLF-FS 2021:75) om förordnande och utlämnande av läkemedel och teknisk sprit.
SOU 2025:71 |
Processer för en patients behandling med ordinerat läkemedel ... |
öppenvårdsapotek. Ett recept, undantaget telefonrecept,78 har en maximal giltighetstid på 12 månader, men innebär ofta att patienten kan behandlas i upp emot 15 månader med det läkemedel receptet avser.79 Förskrivaren kan dock välja att förkorta receptets giltig- hetstid. Under giltighetstiden får receptet itereras, dvs. expedieras flera gånger. Det är förskrivaren som bestämmer om ett recept ska få itereras och i så fall ska förskrivaren ange på receptet för hur många uttag receptet är giltigt. Om inga begränsningar finns angivna så kan patienten begära att få samtliga uttag expedierade vid första tillfället. Det finns dock begränsningar i förordningen (2002:687) om läkemedelsförmåner m.m. kring hur mycket läkemedel som får hämtas ut om läkemedlet ska subventioneras inom läkemedelsför- månen.80
En läkemedelsordination kan vara aktuell under en kortare eller en längre period än ett recepts giltighetstid. En ordination av en smärtlindrande behandling kan t.ex. vara tänkt för en kortare period, men receptet utfärdas med flera uttag och giltighetstiden förkortas inte. I praktiken kommer receptet finnas kvar och möjligt att expe- diera efter det att patientens besvär upphört. Omvänt kan en ordi- nation av en välkontrollerad astma behöva fortgå långt längre än vad receptets giltighetstid är. Receptet är en förmedlare av informa- tion för att patienten ska kunna hämta ut sitt läkemedel på ett öppen- vårdsapotek och använda det på ett korrekt sätt. Receptets begrän- sade giltighetstid innebär att patienten, om den ska fortsätta sin behandling, behöver ett nytt recept minst en gång per år.
Sammanfattningsvis innehåller receptet delar av informationen som ingår i ordinationen, patientanpassad information av betydelse för patientens egenvård81 och uppgifter av betydelse för betalning.
78Telefonrecept gäller för ett utlämnande inom två veckor från den dag receptet utfärdas om inte förskrivaren anger kortare giltighetstid, 4 kap. 15 § tredje stycket Läkemedelsverkets föreskrifter (HSLF-FS 2021:75) om förordnande och utlämnande av läkemedel och teknisk sprit.
7911 § lagen (2002:160) om läkemedelsförmåner m.m. samt 4 kap. 15 § Läkemedelsverkets föreskrifter (HSLF-FS 2021:75) om förordnande och utlämnande av läkemedel och teknisk sprit.
80Enligt 2 § förordningen (2002:687) om läkemedelsförmåner m.m. får läkemedelsförmåner enligt 5 § lagen (2002:160) om läkemedelsförmåner m.m. och kostnadsfrihet enligt 19 § samma lag inte avse större mängd läkemedel eller andra varor än som motsvarar det beräk- nade behovet för 90 dagar eller, om lämplig förpackningsstorlek för 90 dagar saknas, närmast större förpackning. Detta gäller dock inte varor som avses i 18 § 1 nämnda lag.
81Med egenvård avses i sammanhanget en hälso- och sjukvårdsåtgärd som behandlande hälso- och sjukvårdspersonal har bedömt att en patient kan utföra själv eller med hjälp av någon annan. När egenvård utförs gäller inte hälso- och sjukvårdslagen (2017:30).
Processer för en patients behandling med ordinerat läkemedel ... |
SOU 2025:71 |
Receptet är därmed en del i kedjan som syftar till att patienten får tillgång till sitt läkemedel och att läkemedelsbehandlingen ska ske säkert och med önskvärt resultat.
Särskilt om dosdispensering
Vissa patienter kan av olika skäl få sina läkemedel dosdispenserade. För sådana förskrivningar gäller särskilda regler. Recept till patient med dosdispenserade läkemedel ska utfärdas i elektroniskt system- stöd avsett för detta. Om förskrivning i sådant särskilt systemstöd inte är möjlig ska förskrivningen göras på annat tillämpligt sätt i enlighet med vad som i övrigt anges i föreskrifter. Det ska framgå av receptet om läkemedlet ska dosdispenseras.82
I praktiken genomförs förskrivningar av dosdispenserade läke- medel direkt i systemet Pascal. Vissa vårdinformationssystem är integrerade mot registret nationell läkemedelslista på så sätt att informationen från förskrivningen i Pascal också registreras som en ordination i vårdinformationssystemet. I andra system är förskriv- ning av dosdispenserade läkemedel inte integrerat och det krävs i dessa fall en dubbel dokumentation för att uppdatera ordinationen i vårdinformationssystemet. I vissa regioner har man därför beslu- tat att inte dokumentera ordinationer för förskrivningar gjorda i Pascal även i patientjournalen.83
Utifrån ovanstående kan utredningen konstatera två saker. Dels utgår förskrivningar i Pascal inte ifrån ordinationen, dvs. det avviker från den i övrigt beskrivna processen. För det andra förekommer det att Socialstyrelsens föreskrifter om en samlad lista över läkemedels- ordinationer i patientjournalen systematiskt frångås.
Förnyelse av förskrivning kräver förnyad medicinsk bedömning
Förnyelse av recept är ett begrepp som använts under lång tid när en patient får slut på, och är i behov av mer, receptförskrivna läke- medel för att kunna fortsätta sin behandling och receptets giltig- hetstid har löpt ut eller alla uttag är gjorda. Situationen kan t.ex.
824 kap. 3 § Läkemedelsverkets föreskrifter (HSLF-FS 2021:75) om förordnande och utlämnande av läkemedel och teknisk sprit.
83Se t.ex. Region Östergötland, Journalföring av läkemedelsinformation i Region Östergötland, dokumentnummer 18153, version 14, s. 13.
SOU 2025:71 |
Processer för en patients behandling med ordinerat läkemedel ... |
uppstå i det ovan nämnda fallet vid behandling av astma. Det är inte alltid som frågan om receptförnyelse aktualiseras i samband med en fysisk vårdkontakt där patientens hälsotillstånd närmare kan under- sökas. Det är inte heller säkert att det sker genom en distanskontakt i form av t.ex. ett digitalt möte, utan frågan kan ställas av patienten genom en skriftlig distanskontakt eller elektronisk tjänst, såsom via 1177. Det gäller i dessa senare fall för förskrivaren att utifrån vad som framkommit eller t.ex. andra uppgifter i patientjournalen ta ställning till om en förnyelse kan ske utan närmare kontakt eller undersökning. Uppgifter som föranleder ett ändrat ställningstagande kan t.ex. framgå av patientjournalen.
Att förnya ett recept är alltså inte enbart att betrakta som en administrativ handling. För att ett recept ska kunna förnyas behö- ver alltid en förnyad medicinsk bedömning av patienten och dennes behov genomföras. En sådan bedömning kan i många fall vara relativt okomplicerad och kunna genomföras på kort tid, men ibland kan det ha framkommit nya uppgifter som gör att en receptförnyelse är direkt olämplig och läkemedelsordinationen ska ändras eller avslutas.84
5.2.4Behovet av information till patienten i samband med ordination och förskrivning
Som beskrevs inledningsvis börjar och slutar läkemedelsprocessen med patienten. Läkemedelsbehandlingen tar sin utgångpunkt i pati- entens hälsotillstånd och slutar, förhoppningsvis, i en korrekt läke- medelsanvändning som gör att patienten helt tillfrisknar, upplever mindre symtom av sin sjukdom eller skyddas mot framtida ohälsa. För att uppnå detta är information till patienten helt avgörande, i synnerhet när patienten själv ska ansvara för administreringen av läkemedlen.
På en övergripande nivå behöver patienten förstå vad det övergri- pande målet med, och förväntade resultatet av behandlingen är. Mer specifikt behöver patienten information som omfattar bl.a. hur mycket av ett läkemedel som ska tas, hur ofta och länge det ska tas, hur och varför läkemedlet ska tas och om det är något patienten ska tänka på vid användningen. Det sista kan exempelvis vara att inta läkemedlet i samband med måltid eller att inte ta läkemedlet sam-
84För en mer omfattande beskrivning, se Hoffman M., Isacsson M., Lövström R. Vem har ansvaret för fortsatt läkemedelsbehandling? Läkartidningen, 2024;121:23163.
Processer för en patients behandling med ordinerat läkemedel ... |
SOU 2025:71 |
tidigt som ett annat läkemedel intas för att undvika oönskad inter- aktion. Det är också viktigt att patienten känner till tecken på att läkemedlet har avsedd effekt eller om sådana kan noteras85, tecken på att behandlingen inte fungerar och att förnyad kontakt ska tas med vården.
I patientlagen (2014:821) finns allmänna bestämmelser om att patienten ska få information om bl.a. det förväntade vård- och be- handlingsförloppet samt väsentliga risker för komplikationer och biverkningar.86 Patienten ska bl.a. också få information om möjlig- heten att välja behandlingsalternativ.87 Ett övergripande krav på att ge patienten nödvändig information om läkemedel finns i 13 kap.
1 § läkemedelslagen (2015:315). Där anges att den som förordnar eller lämnar ut läkemedel särskilt ska iaktta kraven på sakkunnig och omsorgsfull vård samt på upplysning till och samråd med pati- enten eller företrädare för denne. Det finns även detaljregler på före- skriftsnivå rörande information som ska ges till patienten i samband med att läkemedel ordineras eller förskrivs. Patienten ska t.ex. få individuellt anpassad information, inklusive en ny läkemedelslista, som resultat av sådana läkemedelsgenomgångar som beskrivs i
11 kapitlet Socialstyrelsens föreskrifter och allmänna råd (HSLF- FS 2017:37) om ordination och hantering av läkemedel i hälso- och sjukvården. Dessa krav riktar sig dock enbart till de patienter som är 75 år eller äldre och som är ordinerade minst fem läkemedel. Några specifika krav på information om användningen av läkemedel till yngre patienter eller till dem som har färre än fem läkemedel finns inte i dessa föreskrifter. Det är dock uppenbart att även dessa pati- enter behöver information och skyldigheten följer bl.a. av den ovan nämnda bestämmelsen i läkemedelslagen.
Bestämmelser om informationsskyldighet finns även i Läkemedels- verkets föreskrifter (HSLF-FS 2021:75) om förordnande och utläm- nande av läkemedel och teknisk sprit. Vid förskrivning till människa av läkemedel som kan påverka reaktionsförmågan och därmed för- mågan att uppträda som trafikant eller utföra riskfyllt eller precisions- krävande arbete ska förskrivaren särskilt upplysa patienten om det.88
85Inte all behandling har för patienten, på kort sikt, noterbar effekt, I dessa fall krävs annan form av uppföljning som laboratorieprover eller radiologiska undersökningar för att verifiera effekten.
863 kap. 1 § patientlagen (2014:821).
873 kap. 2 § ovan nämnd författning.
884 kap. 16 § första stycket Läkemedelsverkets föreskrifter (HSLF-FS 2021:75) om för- ordnande och utlämnande av läkemedel och teknisk sprit.
SOU 2025:71 |
Processer för en patients behandling med ordinerat läkemedel ... |
Vid förskrivning av licensläkemedel, extemporeläkemedel och lager- beredning ska förskrivaren också särskilt beakta patientens behov av information.89 Vårdgivaren ska också säkerställa att patienten informeras om att ett läkemedel kan komma att bytas ut mot ett likvärdigt läkemedel på ett öppenvårdsapotek i enlighet med 21 § lagen (2002:160) om läkemedelsförmåner m.m.90
Förskrivare får i enlighet med 3 kap. HSLF-FS 2021:75 lämna ut vissa läkemedel som patienten ska administrera själv efter att ett vård- besök avslutats. Förskrivaren ska vid sådant utlämnande av läkemedel lämna de anvisningar som är nödvändiga för att patienten ska kunna använda läkemedlet på rätt sätt. Liksom vid förskrivning av läke- medel som kan påverka reaktionsförmågan och därmed förmågan att uppträda som trafikant eller utföra riskfyllt eller precisionskrä- vande arbete ska förskrivaren vid utlämnande av sådana läkemedel särskilt upplysa patienten om detta.91
5.2.5Uppföljning
Som framgick av avsnitt 5.2.2 ska det när ett läkemedel ordineras alltid planeras för när och hur behandlingen ska följas upp. En vik- tig del i en uppföljning blir att ta ställning till eventuell fortsättning av behandlingen, eller att bestämma ett datum för när den ordinerade läkemedelsbehandlingen ska avslutas. Av vårdgivarens rutiner för ordination och hantering av läkemedel ska framgå hur vårdgivaren säkerställer att ordinerade läkemedelsbehandlingar följs upp.92
Som framgick av inledningen till detta kapitel kan inte läkemedels- processen alltid ses som en kedja av händelser utan blir mer av ett cykliskt förlopp med flera processteg. Uppföljning behöver därmed inte vara ett senare steg i läkemedelsprocessen utan kan, beroende på situation, vara den första delen av processen då beslut ska tas om en läkemedelsbehandling. Uppföljning av en läkemedelsbehandling kan t.ex. behöva göras kort efter insättning av ett nytt läkemedel, som en del vid återbesök, vid regelbundna uppföljningar av kroniska
894 kap. 16 § andra stycket ovan nämnda föreskrift.
906 kap. 4 § Socialstyrelsen föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordination och hantering av läkemedel i hälso- och sjukvården.
913 kap. 5 § Läkemedelsverkets föreskrifter (HSLF-FS 2021:75) om förordnande och utlämnande av läkemedel och teknisk sprit.
926 kap. 17 § Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordina- tion och hantering av läkemedel i hälso- och sjukvården.
Processer för en patients behandling med ordinerat läkemedel ... |
SOU 2025:71 |
sjukdomstillstånd eller i samband med att ny läkemedelsbehandling blir aktuell. Uppföljningen ska alltid dokumenteras.
Sveriges Kommuner och Regioner har i sitt arbete med struktu- rerad vårdinformation arbetat med bl.a. läkemedelsordination och konstaterar inom ramen för regionernas gemensamma kunskaps- styrning att begreppet kan delas in i tre underkategorier; insätt- ningsordination, ändringsordination och bekräftande ordination. En insättningsordination avser en ordination av en för patienten ny läkemedelsbehandling. En ändringsordination är ett beslut att ändra en tidigare gjord ordination som bl.a. inkluderar utsättningsordina- tion, pauserad ordination och återupptagen ordination. En bekräf- tande läkemedelsordination eller en ändringsordination kan vara en del i, eller resultatet av, uppföljning av en läkemedelsbehandling. En bekräftande ordination innebär att behörig hälso- och sjukvårds- personal har uppmärksammat patientens hälsotillstånd och bedömt att en viss läkemedelsbehandling inte behöver förändras utifrån det som är känt.93 Den bekräftande ordinationen dokumenteras ofta inte.
5.2.6Expediering av läkemedel på öppenvårdsapotek
Öppenvårdsapotekens verksamhet regleras huvudsakligen i lagen (2009:366) om handel med läkemedel. Där framgår att öppenvårds- apoteken ska verka för en god och säker läkemedelsanvändning genom att
1.säkerställa att konsumenten så snart det kan ske får tillgång till förordnade läkemedel och varor,
2.ge sakkunnig och individuellt anpassad information och rådgiv- ning, och
3.genomföra och upplysa om utbyte av läkemedel.94
Öppenvårdsapoteken har därmed en viktig roll i läkemedelsprocessen och har uttryckliga krav i lagstiftningen på att ge information och rådgivning om läkemedel till patienter.
93Sveriges Kommuner och Regioner, 2023, Rapport gemensamma begrepp inom läkemedels- området, dnr SKR2023/02148.
942 kap. 3 a § lagen (2009:366) om handel med läkemedel.
SOU 2025:71 |
Processer för en patients behandling med ordinerat läkemedel ... |
Detaljbestämmelser om expediering av läkemedel finns i Läke- medelsverkets föreskrifter (HSLF-FS 2021:75) om förordnande och utlämnande av läkemedel och teknisk sprit. Farmaceuter har utifrån regelverken till uppgift bl.a. att göra en lämplighetsbedöm- ning av förskrivningen, att även utifrån andra aspekter kontrollera förskrivningen och ska ge patienten information och rådgivning om läkemedlet. En farmaceut ska göra en bedömning av om expedie- ringen är lämplig med hänsyn till den som receptet avser och dennes behov. Vid expediering av ett recept till människa ska vid bedöm- ningen även patientens samtliga recept i elektronisk form samt infor- mation om expedierade läkemedel beaktas.95 Detta är möjligt genom att expedierande personal på öppenvårdsapotek har tillgång till in- formation om patientens förskrivna och expedierade läkemedel i den nationella läkemedelslistan. Vid expediering av en förskrivning finns det ett krav i lagen om handel med läkemedel på att det är en farma- ceut som ska lämna sådan information och rådgivning som apoteks- personal ska göra enligt lagen. Dessutom ska en farmaceut utföra de övriga uppgifter som har särskild betydelse för en säker hantering och användning av läkemedlet. Farmaceuten ska så långt det är möjligt säkerställa att läkemedlet kan användas på rätt sätt.96
Apotekspersonalens möjligheter att hjälpa enskilda patienter avgränsas till sådana frågor som kan lösas utifrån öppenvårdsapo- tekens uppdrag, utifrån personalens kunskap och kompetens samt utifrån den information om patienten de har tillgång till. Apoteks- personal är t.ex. inte behöriga att ändra en ordination eller som huvudregel inte heller att ändra i en förskrivning.97 De har heller inte tillgång till patientjournalen. Det handlar därför huvudsakligen om frågor kring behandlingen relaterade till de läkemedel som för- skrivs på recept och receptfria läkemedel. För att farmaceuten ska kunna utföra sina uppgifter behövs både kunskap om, och tillgång till, läkemedlens produktinformation samt information om varför patienten ska använda läkemedlet och hur det är tänkt att läkemedlet ska användas. Den senare informationen hämtas från förskrivningen. Utifrån informationen på receptet, läkemedlens produktinformation
958 kap. 11 § Läkemedelsverkets föreskrifter (HSLF-FS 2021:75) om förordnande och utlämnande av läkemedel och teknisk sprit.
962 kap. 9 a § lagen (2009:366) om handel med läkemedel.
97En farmaceut kan göra vissa ändringar i ett recept efter att kontakt tagits med förskrivaren samt vissa i föreskrifterna angivna ändringar utan sådan föregående kontakt, se 8 kap. 13–15 §§ Läkemedelsverkets föreskrifter (2021:75) om förordnande och utlämnande av läkemedel och teknisk sprit.
Processer för en patients behandling med ordinerat läkemedel ... |
SOU 2025:71 |
och i dialog med patienten eller dennes ombud anpassar farmaceuten den muntliga informationen i syfte att patienten ska kunna använda sina läkemedel på rätt sätt. Farmaceuten har också möjlighet att i dialog under mötet fånga upp eventuella oklarheter eller problem med patientens läkemedelsanvändning. Beroende på problemets art och utifrån sin kompetens kan farmaceuten lösa detta genom rådgiv- ning eller, om frågan är mer komplex eller kräver en medicinsk bedöm- ning, kontakta eller hänvisa patienten till förskrivaren.
Apotekspersonalen saknar tillgång till informationen i patientjour- nalen och därmed även informationen om vilka läkemedelsbehand- lingar patienten får i vården. Verksamhet enligt lagen om handel med läkemedel omfattas inte av patientdatalagen (2008:355) eller av lagen (2022:913) om sammanhållen vård- och omsorgsdokumen- tation utan av apoteksdatalagen (2009:367) (för ett bredare resone- mang om öppenvårdsapotekens uppdrag och möjliga avgränsningar, se avsnitt 8.12.3). Öppenvårdsapotek har därigenom inte åtkomst till de läkemedelslistor eller ordinationer som finns i patientjour- nalen och måste därför basera sitt arbete på den information som finns i förskrivningen och som framkommer i dialog med patienten eller dennes ombud. Det är med den informationen som grund som farmaceuten ska utföra sitt uppdrag. Det ställer därmed krav på att den information som anges i förskrivningen stämmer överens med den information som finns i patientens läkemedelslista i journalen för att inte riskera att patienten får motstridig information.
Apotekspersonal har också i samband med expediering av läke- medel tillgång bl.a. till uppgifter kopplade till betalning och finan- siering av läkemedel inom läkemedelsförmånen för att patienten ska få rätt kostnadsreducering. Öppenvårdsapotek ska även byta ut läkemedel enligt bestämmelserna i lagen (2002:160) om läkemedels- förmåner m.m. och informera patienten och förskrivaren i samband med att utbyte sker. Frågor om information till förskrivare relaterat till utbyte behandlas vidare i avsnitt 10.9.
5.2.7Särskilt om läkemedel vid ett vårdtillfälle
Det finns många olika situationer när en patient skrivs in på en vårdinrättning för att erhålla vård. Omfattningen eller komplexi- teten av de olika läkemedelsbehandlingar som är aktuella skiljer sig
SOU 2025:71 |
Processer för en patients behandling med ordinerat läkemedel ... |
åt vid t.ex. psykiatrisk heldygnsvård, infektionssjukvård, akutbehand- ling vid hjärtinfarkt, vård i samband med en höftledsoperation eller vid vård till följd av en skottskada.
När en patient skrivs in för ett vårdtillfälle behöver det göras en bedömning av lämpligheten av de läkemedel som sedan tidigare ordi- nerats. Vid inskrivning ska hälso- och sjukvårdspersonalen ta ställ- ning till om patienten har möjlighet att själv fortsätta ansvara för sin pågående läkemedelsbehandling eller om läkemedlet ska admini- streras eller överlämnas av hälso- och sjukvårdspersonal.98 Som an- getts ovan ska också patienten, om den är över 75 år och har fler än fem ordinerade läkemedel, erbjudas en enkel läkemedelsgenomgång.99 Om patienten har kvarstående läkemedelsrelaterade problem eller där det finns en misstanke om sådana problem ska patienten erbju- das en fördjupad läkemedelsgenomgång.100 Inskrivningen och över- synen av patientens läkemedelsbehandling kan därmed, grundat på patientens medicinska behov och planerade vård under vårdtiden, föranleda ändringar i befintliga ordinationer, avslutande av ordina- tion eller behov av nya ordinationer. Informationen behöver också värderas i samband med varje ny läkemedelsbehandling som kan bli aktuell under vårdtillfället.
Vid vårdtillfället kommer läkemedelsbehandlingen kunna om- fatta både läkemedel som patienten ansvarar för och hanterar själv, t.ex. en inhalator för behandling av astma, och sådana där hälso- och sjukvårdspersonalen tar över ansvaret.
Beroende på om vårdtillfället sker i den region där patienten nor- malt får sin vård, oftast den region där patienten är folkbokförd, eller om det sker i en annan region kan det vara olika lätt att samla rele- vant information om aktuell läkemedelsbehandling. Insamlingen kan underlättas om flera vårdgivare använder samma vårdinforma- tionssystem och kan dela information genom sammanhållen vård- och omsorgsdokumentation. Med dagens regionalt och nationellt specialiserade vård, patientens valmöjligheter och regionernas skyl- digheter att erbjuda vård på annan ort när vårdgarantin inte kan upprätthållas inom regionen, är det inte alltid som vårdtillfället sker i hemregionen. Behovet av att kunna dela journalinformation över regiongränser ökar som en följd av detta. Genom patientrörlighets-
9810 kap. 1 § Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordina- tion och hantering av läkemedel i hälso- och sjukvården.
9911 kap. 3 § ovan nämnda föreskrift.
10011 kap. 10 § ovan nämnda föreskrift.
Processer för en patients behandling med ordinerat läkemedel ... |
SOU 2025:71 |
direktivet finns möjlighet att söka vård i andra EU-länder.101 Även om denna möjlighet i dag inte utnyttjas i någon större omfattning, så understryker det de ökade behoven av att kunna dela journalin- formation bredare än tidigare. Sammantaget betyder detta att det inte är självklart att all den information som är relevant för patien- tens läkemedelsbehandlingar och som behöver inhämtas finns i läkemedelslistan i den aktuella vårdgivarens journal. För att ha en tillräckligt komplett bild av patientens läkemedelsbehandling be- höver ibland information hämtas från flera vårdgivare, regioner och i vissa fall från vårdgivare i andra länder (se vidare avsnitt 6.1.1 an- gående patientrörlighet).
5.2.8Betydelsen av läkemedelslistan i läkemedelsprocessen
En samlad, uppdaterad läkemedelslista är av stor betydelse för pati- entsäkerheten. Det är centralt för såväl patientens egen användning av läkemedel, hälso- och sjukvårdspersonalen som deltar i patien- tens vård och för apotekspersonal som ska expediera läkemedel eller ge råd. Utan en sammanställning över aktuell läkemedelsbehand- ling går det inte att ha nödvändig överblick över de läkemedel som patienten använder. För patienten handlar det om att veta vilket läke- medel de ska ta ur vilken förpackning, i vilken dos, när ska läkemed- let tas och vem som ansvarar för behandlingen. Avsaknad av en överblick skapar patientsäkerhetsrisker. Patienten riskerar att ta fel läkemedel, i fel dos vid fel tillfälle, eller till och med ta samma läke- medel i dubbel dos om de har fått olika generika expedierade för samma behandling. Vårdpersonalen riskerar att missa bl.a. olämplig läkemedelsanvändning eller interaktioner mellan läkemedel. I de processbeskrivningar som bl.a. Nätverket Sveriges chefläkare gör är läkemedelslistan i form av patientens ordinerade läkemedelsbehand- lingar central.102 Socialstyrelsen definierar i sina föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordination och hantering av läkemedel i hälso- och sjukvården en läkemedelslista som en lista med uppgifter om läkemedelsordinationer som avser en viss patient.
I flera regioner, t.ex. region Östergötland och Örebro, framgår att
101Se Europaparlamentets och rådets direktiv 2011/24/EU av den 9 mars 2011 om tillämp- ningen av patienträttigheter vid gränsöverskridande hälso- och sjukvård.
102Nätverket Sveriges chefläkare, 2022, Riskanalys av Nationella läkemedelslistan (NLL), s. 18 ff.
SOU 2025:71 |
Processer för en patients behandling med ordinerat läkemedel ... |
läkemedelslistan i regionen ska visa patientens samlade läkemedels- behandling inklusive receptfria läkemedel och naturläkemedel som är av vikt för resten av patientens läkemedelsbehandling.103,104 Läke- medelslistan i patientjournalen bygger alltså i dessa fall på ordina- tioner som sedan tidigare finns registrerade i patientjournalen kom- pletterat med andra uppgifter som inhämtas på annat sätt, bl.a. från patienten själv, och därefter registreras. Det är en självklarhet att även sådana receptfria läkemedel som patienten själv valt att använda kan ha betydelse för såväl det aktuella tillståndet som för valet av annan behandling.
Läkemedelslistan och läkemedelsgenomgångar
Läkemedelslistan nämns i dag i Socialstyrelsens föreskrifter HSLF- FS 2017:37 i kapitlet om läkemedelsgenomgångar.105 Här framgår bl.a. att vårdgivaren i vissa situationer ska erbjuda patienter som är 75 år eller äldre och som är ordinerade minst fem läkemedel en enkel läkemedelsgenomgång.106 Vårdgivaren ska även erbjuda patienter som har läkemedelsrelaterade problem, eller där det finns misstanke om sådana problem, en enkel läkemedelsgenomgång.107 Vid en enkel läkemedelsgenomgång ska det med utgångspunkt i tillgänglig doku- mentation och patientens egna uppgifter så långt möjligt kartläggas vilka läkemedel patienten är ordinerad och varför, vilka av dessa läkemedel patienten använder, samt vilka övriga läkemedel patienten använder. Läkaren ska kontrollera om läkemedelslistan är korrekt samt göra en bedömning av om läkemedelsbehandlingen är ändamåls- enlig och säker.108 I det allmänna rådet till den sistnämnda bestäm- melsen framgår att vid kartläggningen kan uppgifter behöva hämtas in från den egna vårdgivarens och andra vårdgivares journalhand- lingar samt från den nationella läkemedelslistan. Om patienten begär det eller om patienten inte själv kan lämna uppgifterna, bör uppgif- terna om möjligt hämtas in från närstående.
103Region Östergötland, Journalföring av läkemedelsinformation i Region Östergötland, dokumentnummer 18153, version 14.
104Region Örebro, Ordination och hantering av läkemedel, riktlinjer och rutiner (Gröna häftet), dokumentnummer 688488, revision R3.
10511 kap. Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordination och hantering av läkemedel i hälso- och sjukvården.
10611 kap. 3 § ovan nämnda föreskrift.
10711 kap. 4 § ovan nämnda föreskrift.
10811 kap. 5 § ovan nämnda föreskrift.
Processer för en patients behandling med ordinerat läkemedel ... |
SOU 2025:71 |
Flera experter i utredningen har framfört att mycket av det som omfattas av en enkel läkemedelsgenomgång egentligen även måste genomföras i samband med en läkemedelsordination för att man ska uppfylla de krav på lämplighetsbedömning utifrån patientens behov som anges i 6 kap. 2 § HSLF-FS 2017:37, även om begreppet läkeme- delsgenomgång eller läkemedelslista inte nämns i det sammanhanget i föreskrifterna. Detta har också framförts till Socialstyrelsen som konstaterat att det kan finnas skäl att se över bestämmelserna om enkla läkemedelsgenomgångar och bl.a. utreda möjligheten att ta bort begränsningen med avseende på ålder och antal läkemedel och att tydliggöra läkarens ansvar att genomföra en enkel läkemedels- genomgång vid varje ordination av läkemedel, samt vid andra behand- lingssituationer där det bedöms lämpligt.109
Av Nätverket Sveriges chefläkares processbeskrivningar framgår också att man i kartläggningen inför ett eventuellt insättande av en ny läkemedelsbehandling alltid ska upprätta en lista över vid detta tillfälle aktuella läkemedelsordinationer i patientens journal. Listan utgör sedan ett av de underlag som används i den fortsatta bedöm- ningen kring en eventuell ordination eller ordinationsändring (se avsnitt 5.2.2 ovan). När bedömningen är klar och alla nya eller änd- rade ordinationer är upprättade ska listan skrivas ut, lämnas till pati- enten och utgöra ett underlag för patientens egen administrering av läkemedel.
Läkemedelslistan är en del av patientjournalen
Det kan, trots kravet på en samlad läkemedelslista i varje patient- journal, finnas flera läkemedelslistor för en enskild patient hos en och samma vårdgivare. Detta möjliggörs genom att vissa vårdgivare använder flera olika vårdinformationssystem (se även avsnitt 5.1.2). Oftast verkar alla receptförskrivna läkemedel dokumenteras i ett och samma system men även andra läkemedel som ordinerats kan vara av relevans vid bedömning av patientens tillstånd eller vid ny eller ändrad läkemedelsbehandling. Som framgått ovan behöver alltid en samlad bedömning av alla relevanta faktorer som kan på- verka tänkt behandling vägas in vid behandlingsbeslut.
109Socialstyrelsen, 2019, Läkemedelsgenomgångar – En uppföljning och utvärdering av Socialstyrelsens föreskrifter om läkemedelsgenomgångar i 11 kap. HSLF-FS 2017:3, s. 58.
SOU 2025:71 |
Processer för en patients behandling med ordinerat läkemedel ... |
Det kan också förekomma ytterligare läkemedelslistor avseende patienten hos andra privata eller offentliga vårdgivare i den egna regionen eller i andra regioner. Flera regioner har möjliggjort för privata och kommunala vårdgivare som har avtal med regionen att ansluta sig till regionens vårdinformationssystem. I dessa fall kan information, så länge den inte spärrats, delas mellan vårdgivarna i enlighet med lagen (2022:913) om sammanhållen vård- och omsorgs- dokumentation. Situationen kan komma att förbättras om nationella patientöversikter (se avsnitt 7.2) nyttjas i större utsträckning eller genom att fler aktörer framöver använder samma vårdinformations- systemen och därigenom ges ökade möjligheter till sammanhållen vårddokumentation. Tills vidare tvingas dock hälso- och sjukvårds- personalen på olika sätt utreda om de har en tillräckligt komplett bild som utgångspunkt för vidare bedömningar. I den mån det fram- kommer uppgifter som inte finns tillgängliga i patientjournalen ska dessa dokumenteras i den lokala läkemedelslistan i enlighet med lokala rutiner. Särskilda utmaningar med att få en komplett bild av en patients pågående läkemedelsbehandling råder då Kriminalvården eller Statens institutionsstyrelse tar över vårdgivaransvaret (se av- snitt 5.4 nedan).
Det kan utifrån ovanstående konstateras att det i dag inte går att utgå ifrån att det finns vad som kan betraktas som en för patienten komplett läkemedelslista i patientjournalen ens i en enskild region. Därmed framstår det som utmanande att uppfylla en del av de skyl- digheter i de föreskrifter som ligger till grund för en patientsäker läkemedelsprocess.
Behöver bilden vara fullständigt komplett?
I sammanhanget kan det vara värt att beakta att det är en viss skillnad mellan en teoretiskt sett fullständigt komplett bild och vad som är en tillräckligt god bild av en patients läkemedelsbehandling vid en given tidpunkt. I t.ex. en region med ett och samma journalsystem för primärvården såväl som för den öppna specialiserade vården på sjukhus borde det i många fall för de flesta patienter finnas möjlig- het att få en relativt god bild av patientens ordinerade läkemedel som är relevanta över tid, även om denna inte är fullständigt komplett.
Processer för en patients behandling med ordinerat läkemedel ... |
SOU 2025:71 |
I de fall länets kommuner och vårdgivare som har avtal med regio- nen har möjlighet att använda samma vårdinformationssystem som regionen så kan bilden bli än mer komplett genom möjligheterna till sammanhållen vård- och omsorgsdokumentation. En sådan sam- lad bild påverkas dock av eventuella spärrar som patienten valt att införa i journalen. Utredningen har dock uppfattat att det är relativt ovanligt att spärrar förekommer.
Svårigheten ligger i att bedöma om bilden är tillräckligt kom- plett i varje enskilt fall. Det saknas i dagsläget förutsättningar att på ett enhetligt sätt samla all information om patienten även besöker privata vårdgivare eller får vård i en annan region.
Patientrörlighetens eventuella påverkan på innehållet i läkemedelslistan
Genom det s.k. vårdvalet finns flera möjligheter för enskilda att välja utförare av offentligt finansierad vård. Inom den öppna vården finns möjlighet att välja utförare även i andra regioner än hemregio- nen. Dagens levnadsmönster och arbetspendling innebär mycket större rörlighet över regiongränser än vad som var vanligt för 20–30 år sedan. Detta påverkar även hur befolkningen söker och konsume- rar vård. Det är t.ex. i dag möjligt att ”lista sig” på en vårdcentral i en annan region än den man bor i. Den möjligheten kan utnyttjas t.ex. när det underlättar vårdbesök för den enskilde i anslutning till arbetet. Patientrörlighet påverkas också av andra faktorer som vård- garanti och regional eller nationell specialisering i vården. Det står också patienten fritt att i stället för offentligfinansierad vård välja privat finansierad vård, eller vård som del av en försäkringslösning. En något utförligare beskrivning kring rörlighet av patienter finns i avsnitt 6.1.
Den fortsatta utvecklingen av patientrörligheten inom landet och mellan vårdgivare är ytterligare en aspekt som påverkar förut- sättningarna för att åstadkomma en tillräckligt komplett bild av en patients läkemedelsordinationer. Vårdens utveckling mot ökad spe- cialisering, valfrihetsreformer och internationalisering kommer sam- mantaget ställa ökade krav på informationshanteringen.
SOU 2025:71 |
Processer för en patients behandling med ordinerat läkemedel ... |
5.2.9Patientens läkemedelsanvändning
Patientens kunskap om, förståelse för och delaktighet i sin behand- ling är central för ett gott behandlingsresultat. Detta gäller oavsett vilken typ av behandling det gäller. Vad som beskrivs i avsnitt 5.2.1 till 5.2.8 syftar ytterst till att patienten ska erhålla en trygg och säker läkemedelsbehandling oavsett om den sker genom att patienten själv hanterar sina läkemedel eller om patienten får sina läkemedel admini- strerade i hälso- och sjukvården. För patienten är det viktig att hela tiden veta vilket läkemedel som ska användas mot vad, i vilken dos, när läkemedlet ska administreras och vem som ska kontaktas om det uppstår frågor (se även 5.2.4).
För patienten gäller det inte bara att hålla ordning på eventuella receptförskrivna läkemedel. Patienten behöver också kunna använda och redogöra för sådan receptfri behandling som patienten själv tagit beslut om, både när denne möter personal i hälso- och sjukvården och på öppenvårdsapotek. För patienten är det dessutom viktigt att känna till vilka eventuella läkemedel denne får administrerade av hälso- och sjukvårdspersonal och varför. Ofta, men inte alltid, sker sådan behandling regelbundet. I många fall gäller det också läkemedel där effekten sitter i under längre tid.
5.2.10Personuppgiftsbehandling inom läkemedelsprocessen
Genom hela läkemedelsprocessen sker personuppgiftsbehandling och ofta av känsliga personuppgifter. I detta avsnitt redovisar utred- ningen i stora drag vilken personuppgiftsbehandling som är nödvän- dig i processens olika delar och med stöd av vilken lagstiftning det sker. Liksom i redovisningen ovan startar redovisningen i detta av- snitt i mötet mellan patient och hälso- och sjukvårdspersonal.
Patientens behov av läkemedelsbehandling
När hälso- och sjukvårdspersonal möter patienten och ska ta ställ- ning till dennes hälsotillstånd behöver personalen ha tillgång till patientens journal hos aktuell vårdgivare. Enligt 4 kap. 1 § patient- datalagen (2008:355) får den som arbetar hos en vårdgivare ta del av dokumenterade uppgifter om en patient endast om han eller hon
Processer för en patients behandling med ordinerat läkemedel ... |
SOU 2025:71 |
deltar i vården av patienten eller av annat skäl behöver uppgifterna för sitt arbete inom hälso- och sjukvården. En vårdgivare är person- uppgiftsansvarig för den behandling av personuppgifter som vård- givaren utför. I en region och en kommun är varje myndighet som bedriver hälso- och sjukvård personuppgiftsansvarig för den behand- ling av personuppgifter som myndigheten utför.110 Vårdgivaren ska bestämma villkor för tilldelning av behörighet för åtkomst till sådana uppgifter om patienter som förs helt eller delvis automatiserat. Sådan behörighet ska begränsas till vad som behövs för att den enskilde ska kunna fullgöra sina arbetsuppgifter inom hälso- och sjukvården.111 Vårdgivaren ska också se till att åtkomst till sådana uppgifter om patienter som förs helt eller delvis automatiserat dokumenteras och kan kontrolleras och ska göra systematiska och återkommande kon- troller av om någon obehörigen kommer åt sådana uppgifter.112
Personuppgifter får behandlas inom hälso- och sjukvården bl.a. om det behövs för att fullgöra de skyldigheter som anges i 3 kap. patientdatalagen och för att upprätta annan dokumentation som behövs i och för vården av patienter samt för administration som rör patienter och som syftar till att ge vård i enskilda fall eller som annars föranleds av vård i enskilda fall.113 I 3 kap. patientdatalagen regleras skyldigheten att föra patientjournal.
Hälso- och sjukvårdspersonalen kan också behöva få tillgång till uppgifter i andra vårdgivares journaler som rör den aktuella patienten för att få en helhetsbild av patientens pågående behandlingar. Hur åtkomst till sådana uppgifter kan medges regleras i lagen (2022:913) om sammanhållen vård- och omsorgsdokumentation, nedan kallad SVOD. Under förutsättning bl.a. att patienten inte motsatt sig sådan delning av uppgifter114 får åtkomst ges genom direktåtkomst eller annat elektroniskt utlämnande, till personuppgifter som behandlas av andra vårdgivare eller av omsorgsgivare (utredningen begränsar här sin redovisning till åtkomst hos andra vårdgivare).115 En vård- givare får behandla uppgifter som en annan vårdgivare har gjort till- gängliga i enlighet med SVOD om
1102 kap. 6 § första stycket patientdatalagen (2008:355).
1114 kap. 2 § första stycket ovan nämnda författning.
1124 kap. 3 § första stycket ovan nämnda författning.
1132 kap. 4 § första stycket ovan nämnda författning.
114Förutsättningarna för åtkomsten anges i 2 kap. 2–6 §§ samt 3 kap. 1, 3, 5 och 6 §§ lagen (2022:913) om sammanhållen vård- och omsorgsdokumentation.
1152 kap. 1 § lagen (2022:913) om sammanhållen vård- och omsorgsdokumentation.
SOU 2025:71 |
Processer för en patients behandling med ordinerat läkemedel ... |
1.uppgifterna rör en patient som det finns en aktuell patientrela- tion med,
2.patienten samtycker till det, och
3.uppgifterna kan antas ha betydelse bl.a. för att inom hälso- och sjukvården förebygga, utreda eller behandla sjukdomar och ska- dor hos patienten.116
En vårdgivares personuppgiftsansvar omfattar även sådan behand- ling av personuppgifter som vårdgivaren, eller den myndighet i en region eller en kommun som är personuppgiftsansvarig, utför när vårdgivaren eller myndigheten genom direktåtkomst i ett enskilt fall bereder sig tillgång till personuppgifter om en patient hos en annan vårdgivare eller annan myndighet i samma region eller kom- mun.117
Det kan också vara relevant i samband med hälso- och sjukvårds- personalens bedömning av patientens aktuella hälsotillstånd att göra en kontroll i registret nationell läkemedelslista. När hälso- och sjuk- vårdspersonal gör en kontroll i registret av vilka förskrivningar som patienten har och vilka förskrivningar som också blivit expedierade får uppgifterna i registret behandlas för det enligt ändamålsbestäm- melserna i lagen (2018:1212) om nationell läkemedelslista. Det är främst ändamålen åstadkommande av en säker ordination av läke- medel och andra varor för en patient eller beredande av vård eller behandling av en patient som är aktuella i denna del av läkemedels- processen.118 Den personuppgiftsbehandling som utförs i registret nationell läkemedelslista vid kontrollen faller under vårdgivarens personuppgiftsansvar enligt patientdatalagen.
Läkemedelsordinationen
Vid beslut om ordination om en behandling ska hälso- och sjukvårds- personalen dokumentera detta i patientens journal. Det framgår av 3 kap. 1 § patientdatalagen att vid vård av patienter ska det föras patientjournal. Av Socialstyrelsens föreskrifter framgår mer i detalj
1163 kap. 1 § första stycket lagen (2022:913) om sammanhållen vård- och omsorgsdokumen- tation.
1172 kap. 6 § andra stycket patientdatalagen (2008:355), se också 4 kap. 1 § lagen (2022:913) om sammanhållen vård- och omsorgsdokumentation.
1183 kap. 4 § 1 och 2 lagen (2018:1212) om nationell läkemedelslista.
Processer för en patients behandling med ordinerat läkemedel ... |
SOU 2025:71 |
vad som ska finnas dokumenterat i patientens journal och även vad som ska dokumenteras specifikt vid en läkemedelsordination.119 Personuppgiftsbehandlingen som detta medför görs inom ramen för bestämmelserna i patientdatalagen.
Gjordes ingen kontroll i registret nationell läkemedelslista vid den inledande bedömningen av patientens hälsotillstånd, enligt vad som anges ovan, kan en sådan kontroll vara aktuell i samband med beslut om en läkemedelsordination. Enligt Socialstyrelsens föreskrifter ska den som ordinerar ett läkemedel säkerställa att ordinationen är lämplig med utgångspunkt i patientens behov. I den lämplighets- bedömningen ska bl.a. patientens hälsotillstånd, läkemedelsanvänd- ning och pågående behandling och utredning beaktas.120 Då kan bl.a. uppgifterna i registret innehålla relevant information. Hälso- och sjukvårdspersonalen med behörighet att förskriva läkemedel kan med patientens samtycke ta del av uppgifter i registret för ända- målen åstadkommande av en säker ordination av läkemedel och andra varor för en patient, beredande av vård eller behandling av en patient och komplettering av en patientjournal.121 Personuppgifts- behandlingen vid en sådan kontroll faller under vårdgivarens per- sonuppgiftsansvar enligt patientdatalagen.
Om patienten administreras ordinerat läkemedel i samband med vårdtillfället ska även detta dokumenteras i patientens journal och personuppgiftsbehandlingen i samband med detta faller under patient- datalagens bestämmelser.
Förskrivning
När beslut om patientens vård innebär att ett läkemedel ska förskrivas behöver hälso- och sjukvårdspersonalen utfärda ett recept. Det ska enligt huvudregeln göras elektroniskt.122 Om själva förskrivningen dokumenteras i vårdinformationssystemet är det patientdatalagen som reglerar personuppgiftsbehandlingen i samband med det, efter-
119Se 5 kap. i Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2016:40) om journalföring och behandling av personuppgifter i hälso- och sjukvården samt 6 kap. 10 § Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordination och hantering av läkemedel i hälso- och sjukvården.
1206 kap. 2 § Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordina- tion och hantering av läkemedel i hälso- och sjukvården.
1215 kap. 3 § lagen (2018:1212) om nationell läkemedelslista.
1224 kap. 1 § Läkemedelsverkets föreskrifter (HSLF-FS 2021:75) om förordnande och utlämnande av läkemedel och teknisk sprit.
SOU 2025:71 |
Processer för en patients behandling med ordinerat läkemedel ... |
som det är uppgifter som är hänförliga till vården av patienten. För- skrivningen ska också registreras i registret nationell läkemedels- lista.123 Personuppgiftsbehandling i samband med det får göras en- ligt ändamålsbestämmelsen avseende registrering av uppgifter om förskrivna läkemedel och andra varor som ska expedieras på öppen- vårdsapotek 3 kap. 2 § 1 lagen (2018:1212) om nationell läkemedels- lista. Vårdgivaren är personuppgiftsansvarig för personuppgifts- behandlingen.
Om någon kontroll av patientens uppgifter i registret nationell läkemedelslista inte gjordes under det inledande insamlandet av information om patientens pågående behandlingar, kan det ofta vara lämpligt att göra en sådan kontroll i samband med förskriv- ningen. Personuppgiftsbehandlingen som sker i samband med detta faller som angetts ovan under vårdgivarens personuppgiftsansvar enligt patientdatalagen.
Expediering av läkemedel på öppenvårdsapotek
När personal på öppenvårdsapotek behandlar personuppgifter i samband med detaljhandel med läkemedel, omfattas personuppgifts- behandlingen av apoteksdatalagens (2009:367) bestämmelser. Det är den som innehar tillstånd att bedriva öppenvårdsapoteksverk- samhet enligt lagen (2009:366) om handel med läkemedel (tillstånds- havaren), som är personuppgiftsansvarig för behandlingen.124
Personuppgifter hänförliga till konsumenter och till dem som är behöriga att förordna läkemedel får behandlas bl.a. för ändamålen expediering av förordnade läkemedel och sådana förordnade varor som omfattas av lagen (2002:160) om läkemedelsförmåner m.m. samt för åtgärder i anslutning till expedieringen, administrering av full- makter att hämta ut läkemedel och för hälsorelaterad kundservice.125
Vid expediering av recept får expedierande apotekspersonal be- handla personuppgifter i registret nationell läkemedelslista för ända- målet expediering av läkemedel och andra varor som förskrivits.126 En farmaceut ska enligt Läkemedelsverkets föreskrifter i samband med expediering av ett recept göra en bedömning av om expedie-
1239 kap. 1 § lagen (2018:1212) om nationell läkemedelslista.
1247 § apoteksdatalagen (2009:367).
1258 § ovan nämnda författning.
1263 kap. 2 § 1 lagen (2018:1212) om nationell läkemedelslista.
Processer för en patients behandling med ordinerat läkemedel ... |
SOU 2025:71 |
ringen är lämplig med hänsyn till den som receptet avser och dennes behov. Vid den bedömningen ska patientens samtliga recept i elek- tronisk form samt information om tidigare expedierade läkemedel som patienten fortfarande använder beaktas.127 En sådan kontroll förutsätter att farmaceuten har tillgång till uppgifter om patientens aktuella förskrivningar och tidigare utlämnade läkemedel i registret nationell läkemedelslista.
Om patienten behöver rådgivning om sin läkemedelsbehandling kan expedierande apotekspersonal också behandla personuppgifter i registret för ändamålet underlättande av en patients läkemedels- användning.128
Vid expediering av en förskrivning på öppenvårdsapotek ska vissa uppgifter lämnas till registret nationell läkemedelslista i sam- band med expedieringen.129 Det omfattar bl.a. uppgifter om läke- medlet som expedieras och uppgifter om kostnad och kostnads- reducering enligt lagen (2002:160) om läkemedelsförmåner m.m. Personuppgiftsbehandling som sker i samband med detta medges av ändamålen registrering av uppgifter om förskrivna läkemedel och andra varor som ska expedieras på öppenvårdsapotek och regi- strering av uppgifter för tillämpning av bestämmelser om läkemedels- förmåner i lagen (2018:1212) om nationell läkemedelslista.130
Den personuppgiftsbehandling som utförs av personal på öppen- vårdsapoteket i samband med samtliga dessa åtgärder i registret natio- nell läkemedelslista faller under tillståndshavarens personuppgifts- ansvar enligt apoteksdatalagen.
5.3Medicinteknikprocessen
Om läkemedelsprocessen är välbeskriven genom minst tjugo år av utredningar och rapporter kan inte detsamma sägas om medicin- teknikprocessen. Medicintekniska produkter samt deras dokumen- tation, försäljning och användning är inte lika tydligt reglerad som för läkemedel även om de nya EU-förordningarna för medicin- tekniska produkter och produkter för in-vitrodiagnostik gör att
1278 kap. 11 § Läkemedelsverkets föreskrifter (HSLF-FS 2021:75) om förordnande och utlämnande av läkemedel och andra varor.
1283 kap. 3 § samt 5 kap. 1 och 2 §§ lagen (2018:1212) om nationell läkemedelslista.
1292 kap. 6 § 5 lagen (2009:366) om handel med läkemedel.
1303 kap. 2 § 1 och 2 lagen (2018:1212) om nationell läkemedelslista.
SOU 2025:71 |
Processer för en patients behandling med ordinerat läkemedel ... |
gapet minskar något. Medicintekniska produkter utgör också en betydligt mer heterogen produktgrupp vilket gör att en enskild process inte heller är lika lätt att avgränsa eller beskriva. Utred- ningen börjar därför med att beskriva vad medicintekniska pro- dukter är.
5.3.1Vad är medicintekniska produkter?
Med medicinteknisk produkt avses en/ett instrument, apparat, anordning, programvara, implantat, reagens, material eller annan artikel som enligt tillverkaren är avsedd att, antingen separat eller i kombination, användas på människor för ett eller flera medicinska ändamål. De ändamål som avses är diagnos, profylax, övervakning, prediktion, prognos, behandling eller lindring av sjukdom; diagnos, övervakning, behandling, lindring av eller kompensation för en skada eller funktionsnedsättning; undersökning, ersättning eller ändring av anatomin eller av en fysiologisk eller patologisk process eller ett fysiologiskt eller patologiskt tillstånd; tillhandahållande av information genom undersökning in vitro av prover från människo- kroppen, inklusive donationer av organ, blod och vävnad, och som inte uppnår sin huvudsakliga, avsedda verkan i eller på människo- kroppen med hjälp av farmakologiska, immunologiska eller meta- boliska medel, men som kan understödjas i sin funktion av sådana medel.131 I en särskild EU-förordning definieras också medicin- tekniska produkter för in vitro-diagnostik.132
Medicintekniska produkter omfattar alltså många olika produkt- områden och det är omöjligt att här uttömmande exemplifiera dessa. Det är tillverkarens avsikt med produkten som avgör om produk- ten är en medicinteknisk produkt. I vissa fall kan även produktens funktion ha betydelse (ibland benämnt verkningsmekanismen). Vad produkten är avsedd för framgår bl.a. av märkningen, bruksanvis- ningen och i marknadsföringen. Två till utseendet lika produkter kan ha skillnader som gör att de ska följa olika regler.
131Artikel 2 Europaparlamentets och rådets förordning (EU) 2017/745 av den 5 april 2017 om medicintekniska produkter, om ändring av direktiv 2001/83/EG, förordning (EG)
nr 178/2002 och förordning (EG) nr 1223/2009 och om upphävande av rådets direktiv 90/385/EEG och 93/42/EEG.
132Artikel 2 Europaparlamentets och rådets förordning (EU) 2017/746 av den 5 april 2017 om medicintekniska produkter för in vitro-diagnostik och om upphävande av direktiv 98/79/EG och kommissionens beslut 2010/227/EU.
Processer för en patients behandling med ordinerat läkemedel ... |
SOU 2025:71 |
Kombinationsprodukter
Det förekommer också produkter som är en kombination av en medicinteknisk produkt och ett läkemedel. Dessa brukar betecknas kombinationsprodukter. Det kan då röra sig om en medicinteknisk produkt med en läkemedelskomponent, som t.ex när en stent för att vidga hjärtats kranskärl även innehåller ett läkemedel som fri- sätter ett celltillväxthämmande läkemedel som kortsiktigt minskar risken för att blodkärlet täpps till igen. I det här fallet ska den huvud- sakliga verkan med produkten inte uppnås med hjälp av farmakolo- giska, immunologiska eller metaboliska medel, utan läkemedlet har här en understödjande funktion. Denna typ av produkt ska vara CE-märkt enligt det medicintekniska regelverket.
Ett annat exempel på kombinationsprodukt är när en medicin- teknisk produkt är bipackad själva läkemedlet, t.ex. en kanyl som medföljer i läkemedlets förpackning. En sådan förpackning för ett läkemedel med en sampackad medicinteknisk produkt skulle i dags- läget ses som ett läkemedel, även om den ingående medicintekniska delen ska vara CE-märkt. Ytterligare ett annat exempel är när läke- medlet och den medicintekniska produkten är en integrerad enhet och läkemedlet är fyllt i en autoinjektor, där autoinjektorn utgör en medicinteknisk produkt. Denna autoinjektor behöver då inte vara CE-märkt men behöver uppfylla delar av kraven i det medicintek- niska regelverket.
Utredningen kommer, om inget annat anges, att betrakta kom- binationsprodukter utifrån det regelverk som är tillämpligt.
Exempel på olika medicintekniska produkter
Vissa medicintekniska produkter utgör förbrukningsartiklar, t.ex. plåster, kanyler eller stomimaterial, medan andra är av mer varaktig karaktär som t.ex. rullstolar och dialysmaskiner. Vissa produkter är tydligt patientbundna, såsom läkemedelspumpar eller pacemakers, medan andra kan användas för flera patienter t.ex. en magnetkamera eller en ultraljudsapparat. Implantat kan ibland vara helt livsavgörande, som med pacemaker eller en konstgjord hjärtklaff, eller göra att för- mågan till ett självständigt liv bibehålls genom exempelvis en höft- leds- eller knäprotes.
SOU 2025:71 |
Processer för en patients behandling med ordinerat läkemedel ... |
Även programvaror och appar är medicintekniska produkter när de t.ex. används för att diagnostisera, förebygga, övervaka, behandla eller lindra en sjukdom, t.ex. en app för egenmonitorering, registre- ring och rapportering av mätdata till hälso- och sjukvården. Även vårdinformationssystem som används för att t.ex. föra patientjour- nal utgör medicintekniska produkter.
Vissa medicintekniska produkter är närliggande till läkemedel. Det som skiljer dem åt är hur de uppnår sin verkan. Medicintekniska produkter får inte uppnå sin huvudsakliga avsedda verkan med hjälp av farmakologiska, immunologiska eller metaboliska medel. Exem- pel på produkter där det finns både läkemedel och medicintekniska produkter för samma användningsområde är lusschampo, ögon- droppar mot torra ögon eller vissa nässprayer för behandling av för- kylning. Vissa medicintekniska produkter kan som beskrevs ovan innehålla ett läkemedel, t.ex. en stent.
Precis som för läkemedel är utvecklingstakten för medicintek- niska produkter hög. Utvecklingen har haft stor påverkan på vård- kvalitet och möjligheterna till t.ex. utredning, övervakning, kommu- nikation och behandling. Medicintekniska produkter används också ofta för att underlätta, stödja eller övervaka behandling tillsammans med läkemedel. I följande avsnitt redogör utredningen för hur en medicintekniksprocess skulle kunna beskrivas.
5.3.2Patientens behov av medicintekniska produkter
Identifiering av behovet av att använda medicintekniska produkter uppstår som en del i samband med att patienten sökt vård eller att patienten utreds, vårdas, övervakas eller behandlas i hälso- och sjuk- vården. Eftersom medicintekniska produkter är ett mycket mer heterogent område än läkemedel ser behoven väldigt olika ut. Det finns inget enkelt sätt att dela in medicintekniska produkter utifrån hur de används. Vissa medicintekniska produkter är avsedda för patienten att använda själv. Andra produkter är sådana som används av hälso- och sjukvårdspersonalen i samband med vård och behand- ling, dessa beskrivs närmare i avsnitt 5.3.7 nedan.
Processer för en patients behandling med ordinerat läkemedel ... |
SOU 2025:71 |
Medicintekniska produkter som patienten hanterar själv
Ibland behövs medicintekniska produkter för patientens egenvård133. Det kan handla om produkter för att tillföra kroppen läkemedel, för egenkontroll av medicineringen, för rapportering av egenkon- troll (egenmonitorering), utrustning för hemdialys eller för andnings- hjälp, annan avancerad medicinsk utrustning för sjukvård i hemmet eller andra hjälpmedel. Medicintekniska produkter kan också be- hövas som en naturlig fortsättning på sådan behandling som utförts i hälso- och sjukvården, t.ex. efter en operation.
Hjälpmedel brukar delas in i hjälpmedel för det dagliga livet och hjälpmedel för vård och behandling. Hjälpmedel finns t.ex. inom områdena hörhjälpmedel, synhjälpmedel, inkontinenshjälpmedel, hjälp med kognitivt stöd, hjälpmedel för kommunikation, hjälp- medel för förflyttning och hjälpmedel i hemmet.134 Ett hjälpmedel för det dagliga livet är oftast en medicinteknisk produkt, men det kan också vara en vanlig konsumentprodukt. Konsumentprodukterna är, till skillnad från medicintekniska produkter, tillverkade för den vanliga konsumentmarknaden.135 Det kan t.ex. handla om smarta telefoner med en applikation som inte bedöms vara del i vård och behandling eller en burköppnare och därför inte är medicintekniska produkter. För konsumentprodukter som inte är medicintekniska produkter gäller inte regelverken för medicintekniska produkter utan produktsäkerhetslagen (2004:451), produktansvarslagen (1992:18), skadeståndslagen (1972:207) och konsumentköplagen (1990:932). Ett hjälpmedel för vård och behandling är däremot alltid en medi- cinteknisk produkt, t.ex. en TENS-apparat, rullstol eller en app ut- vecklad för egenmonitorering av behandling.
Det är inte självklart att patienten tänker på alla de produkter som omfattas som att de är medicintekniska produkter. Det är inte en självklarhet att en tejp eller ett plåster allmänt uppfattas som medicintekniska produkter.
133Med egenvård avses i sammanhanget en hälso- och sjukvårdsåtgärd som behandlande hälso- och sjukvårdspersonal har bedömt att en patient kan utföra själv eller med hjälp av någon annan. När egenvård utförs gäller inte hälso- och sjukvårdslagen (2017:30).
134https://www.1177.se/undersokning-behandling/hjalpmedel/sa-far-du-ett-hjalpmedel/att- fa-ett-hjalpmedel/, besökt 2024-08-27.
135Socialstyrelsen, 2016, Konsumentprodukter som hjälpmedel – En handbok för hälso- och sjukvården, ISBN 978-91-86633-43-1.
SOU 2025:71 |
Processer för en patients behandling med ordinerat läkemedel ... |
5.3.3Ordination och ansvar
Begreppet ordination definieras av Socialstyrelsen som ett beslut av behörig hälso- och sjukvårdspersonal som är avsett att påverka en patients hälsotillstånd genom en hälso- och sjukvårdsåtgärd.136 Be- greppet avgränsas inte till att enbart gälla läkemedel utan används inom flera olika områden, t.ex. i samband med ordination av spe- cialkost eller fysisk aktivitet. Även om ordination som begrepp definieras som ett medicinskt beslut är det tveksamt om alla beslut i hälso- och sjukvården ska betraktas som ordinationer. I svensk ordbok beskrivs t.ex. begreppet ordination som en instruktion om (viss) behandling eller medicinering vanligen utfärdad av läkare.137 Begreppet ordinera beskrivs som anvisa (något) som lämplig be- handling eller medicinering.138 Begreppen kan härledas till år 1761 respektive 1578. Eftersom medicintekniska produkter utgör en så heterogen produktgrupp med många olika användningsområden är det inte säkert att alla medicintekniska produkter ordineras. Be- greppet bör dock vara relevant att använda i samband med åtmin- stone sådana produkter som t.ex. ska lämnas ut till patienten för användning eller då information om användningen behöver över- föras till annan hälso- och sjukvårdspersonal.
För medicintekniska produkter finns inga särskilda föreskrifter kring ordination men enligt Socialstyrelsens föreskrifter (HSLF-FS 2021:52) om användning av medicintekniska produkter i hälso- och sjukvården ska varje vårdgivare bl.a. fastställa rutiner för förskriv- ning, utlämnande och tillförande av en medicinteknisk produkt till en patient.139 Därutöver gäller all annan reglering på hälso- och sjuk- vårdens område, t.ex. patientdatalagens (2008:355) krav på doku- mentation. En patientjournal ska bl.a. innehålla uppgift om ställd diagnos och anledning till mer betydande åtgärder och väsentliga uppgifter om vidtagna och planerade åtgärder.140 Även om ordina- tionen som enskilt moment inte uttryckligen regleras i Socialstyrelsens föreskrifter så regleras bl.a. ledningssystem (2 kap.), kompetens (3 kap.) och förskrivning (4 kap.). Av föreskrifterna framgår även att varje vårdgivare ska fastställa rutiner för användning och han-
136https://termbank.socialstyrelsen.se/?TermId=710, beslutad 2017.
137https://svenska.se/so/?id=158602, besökt 2025-01-02.
138https://svenska.se/so/?id=158606, besökt 2025-01-02.
1392 kap. 3 § Socialstyrelsens föreskrifter (HSLF-FS 2021:52) om användning av medicin- tekniska produkter i hälso- och sjukvården.
1403 kap. 6 § 3 och 4 patientdatalagen (2008:355).
Processer för en patients behandling med ordinerat läkemedel ... |
SOU 2025:71 |
tering av medicintekniska produkter i verksamheten.141 Föreskrif- ternas innehåller krav på att medicintekniska produkter som har förskrivits, lämnats ut eller tillförts till patienter ska kunna spåras.142 Enligt Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2016:40) om journalföring och behandling av personuppgifter i hälso- och sjukvården ska vårdgivaren säkerställa att en patient- journal, i förekommande fall, innehåller uppgifter om bl.a. de medi- cintekniska produkter som har förskrivits till, utlämnats till eller tillförts en patient på ett sådant sätt att de kan spåras.143 Sådana upp- gifter ska således dokumenteras. Även genom kravet att varje vård- givare ska fastställa rutiner för förskrivning, utlämnande och till- förande av en medicinteknisk produkt till en patient borde enligt utredningens bedömning åtminstone viss dokumentation om be- slutet att använda medicintekniska produkter finnas.
För medicintekniska produkter som förskrivs på hjälpmedels- kort för expediering på öppenvårdsapotek (se vidare 5.3.4 nedan) dokumenteras ingen separat ordination utan förskrivningen, dvs. hjälpmedelskortet, dokumenteras i stället ofta i vårdinformations- systemets läkemedelsmodul. Sannolikt hänger detta samman med att hjälpmedelskorten också är förskrivningar som när e-recept en gång i tiden infördes skulle överföras till apotek.
Alla ordinationer av medicintekniska produkter dokumenteras inte
Utredningen kan konstatera att det för ordinerade medicintekniska produkter saknas motsvarande krav på struktur och att informationen ska hållas samlad som finns för läkemedelsordinationer i Social- styrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordi- nation och hantering av läkemedel i hälso- och sjukvården. Utifrån de exempel som beskrivs i avsnitt 5.3.1 och vad som framgår av 5.3.2 kan man konstatera att all användning av medicintekniska produk- ter i samband med patientens vård sannolikt inte ordineras och doku- menteras, och om det görs sker det inte alltid strukturerat. Många åtgärder utgör i stället en del av fastslagna rutiner och processer
1412 kap. 2 § första stycket Socialstyrelsens föreskrifter (HSLF-FS 2021:52) om användning av medicintekniska produkter i hälso- och sjukvården.
1422 kap. 2 § 7 ovan nämnd föreskrift.
1435 kap. 5 § Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2016:40) om journal- föring och behandling av personuppgifter i hälso- och sjukvården.
SOU 2025:71 |
Processer för en patients behandling med ordinerat läkemedel ... |
kring arbetssätt. Skillnaderna i dokumentationen mellan olika pro- dukter eller produktgrupper kan enligt utredningens bedömning sannolikt delvis hänföras till bestämmelserna i patientdatalagen att dokumentera väsentliga uppgifter om vidtagna och planerade åtgär- der.144 Alla uppgifter är inte väsentliga och om precis allt skulle doku- menteras skulle journalerna bli alltför omfattande och svårhanterliga. Därför dokumenteras endast det som bedöms nödvändigt. Avdöm- ningen görs i dag i regionernas rutiner och av professionens bedöm- ningar. En annan orsak som bidrar till att uppgifter inte dokumen- teras strukturerat i patientjournalen kan vara att det än så länge saknas en enhetlig produktdatabas och kategorisering av medicintekniska produkter, se vidare avsnitt 8.7.
Andra aspekter på ordination av medicintekniska produkter
Även om det vad avser medicintekniska produkter inte finns samma specifika krav i föreskrifter på att beakta patientens tillstånd som i samband med ordination av läkemedel (se avsnitt 5.2.2) så finns be- stämmelser om att produkten ska samordnas med produkter som tidigare har förskrivits, lämnats ut eller tillförts till patienten samt att en bedömning ska göras av behovet av anpassning av patientens hemmiljö för att produkterna ska kunna fungera tillsammans på ett säkert sätt.145 Det finns också bestämmelser om information kring användning och att patienten ska instrueras och tränas.146 Därmed behöver det göras en bedömning av de medicintekniska produkterna i förhållande till varandra och i förhållande till annan behandling och patientens hälsotillstånd.
Enligt patientsäkerhetslagen (2010:659) bär den som tillhör hälso- och sjukvårdspersonalen själv ansvaret för hur han eller hon fullgör sina arbetsuppgifter.147 Det innebär bl.a. att man har ett ansvar för de beslut man fattar om att använda medicintekniska produkter, oav- sett om de dokumenteras som ordinerade eller inte. Till skillnad från ordination och förskrivning av läkemedel finns inte heller någon enhetlig reglering av vilken eller vilka yrkesgrupper som får ordi-
144Se 3 kap. 6 § patientdatalagen (2008:355).
1452 kap. 3 § 3 och 4 Socialstyrelsens föreskrifter (HSLF-FS 2021:52) om användning av medicintekniska produkter i hälso- och sjukvården.
1462 kap. 3 § 6 och 7 ovan nämnd föreskrift.
1476 kap. 2 § första stycket patientsäkerhetslagen (2010:659).
Processer för en patients behandling med ordinerat läkemedel ... |
SOU 2025:71 |
nera eller använda medicintekniska produkter. Detta har också ny- ligen konstaterats av Utredningen om subventionering av special- livsmedel till barn.148 Däremot är vissa procedurer där medicin- tekniska produkter ingår reglerade t.ex. abort149, blodgivning150, omskärelse151 eller obduktion152. Det finns också reglering av vissa förskrivningar, se vidare 5.3.4 nedan. I övrigt utgår ansvaret ifrån individens kompetens och med grund i de rutiner som beslutas med stöd av Socialstyrelsens föreskrifter, se vidare nedan. Mot bakgrund av ovanstående kan konstateras att det inte går att beskriva en lika tydlig medicinteknikprocess som för läkemedel men att många av de krav som finns för läkemedel ändå kan vara applicerbara och här- ledas genom andra bestämmelser.
5.3.4Förskrivning och utlämnande
Som framgår av föregående avsnitt finns viss reglering om förskriv- ning av medicintekniska produkter genom att vårdgivaren ska ha rutiner för förskrivning, utlämnande och tillförande av medicin- tekniska produkter till patient.153 I 4 kap. i Socialstyrelsens före- skrifter (HSLF-FS 2021:52) om användning av medicintekniska produkter i hälso- och sjukvården finns också särskilda bestämmel- ser om behörighet att förskriva vissa förbrukningsartiklar. Det hand- lar om förbrukningsartiklar för urininkontinens, för stomi och för att tillföra kroppen läkemedel eller för egenkontroll av medicine- ring. I dessa fall ska vårdgivaren bl.a. utse vem eller vilka av den behöriga hälso- och sjukvårdspersonalen som ska få förskrivnings- rätt för produkterna.154 Inkontinensartiklar kan förskrivas av sjuk- sköterskor, fysioterapeuter och barnmorskor anställda hos region, kommun eller vårdgivare som har avtal med region eller kommun, och som är utsedda av vårdgivaren.155 Inkontinensartiklar kan också förskrivas av läkare anställda i en region.156 Utöver vad som anges
148SOU 2023:71 Speciallivsmedel till barn inom öppen hälso- och sjukvård, s. 254.
149Se 5 § abortlagen (1974:595).
150Se 6 kap. 11 § Socialstyrelsens föreskrifter (SOSFS 2009:28) om blodverksamhet.
151Se 4–6 §§ lagen (2001:499) om omskärelse av pojkar.
152Se 11 och 20 §§ lagen (1995:832) om obduktion m.m.
1532 kap. 3 § Socialstyrelsens föreskrifter (HSLF-FS 2021:52) om användning av medicin- tekniska produkter i hälso- och sjukvården.
1544 kap. 1 § 1 ovan nämnd föreskrift.
1554 kap. 4 § ovan nämnd föreskrift.
1564 kap. 3 § ovan nämnd föreskrift.
SOU 2025:71 |
Processer för en patients behandling med ordinerat läkemedel ... |
ovan finns viss reglering för förskrivning av sådana förbruknings- artiklar som avses i 18 § 2 och 3 lagen (2002:160) om läkemedels- förmåner m.m. i de fall de ska subventioneras och lämnas ut via öppenvårdsapotek. Till skillnad från när det gäller läkemedel finns dock inget krav på elektronisk förskrivning som huvudregel för medicintekniska produkter157. Den reglering som nämns ovan är tydligt kopplad till, eller har sitt ursprung i, finansieringsfrågor snarare än i överväganden om patientsäkerhet.
Stora friheter att utforma egna system kring förskrivning och utlämnande
Eftersom försäljning av medicintekniska produkter inte är reglerad på samma sätt som för läkemedel finns stora friheter för vårdgivarna att själva besluta om när och hur eventuellt utlämnande som inte sker på öppenvårdsapotek ska gå till. Det innebär att patienten skulle kunna köpa många medicintekniska produkter på egen hand i detalj- handeln. Det står även vårdgivarna fritt att lämna ut medicintekniska produkter direkt till patient, t.ex. förbandsmateriel för fortsatt om- läggning av ett operationssår. I läkemedelssammanhang är utlämnande av läkemedel från en förskrivare strikt reglerat.158 Det står också vård- givarna fritt att för medicintekniska produkter inrätta andra system än via öppenvårdsapotek för distribution till patienter.
Det finns alltså möjligheter för vårdgivare att fritt besluta om och utfärda de underlag som behövs för utlämnande av medicin- tekniska produkter till patienter. Sådana underlag behövs, precis som vid förskrivning av läkemedel, som ett meddelande för att den som lämnar ut produkten ska veta vad som ska lämnas ut och vem som eventuellt ska betala. Om vårdgivaren ska betala behövs under- laget som en form av verifikation för betalningen. Även dessa under- lag refereras till som förskrivningar.159 Förskrivningar som görs för distribution av produkterna i regionens egen regi dokumenteras dock
157Se 4 kap. 1 § Läkemedelsverkets föreskrifter (HSLF-FS 2021:75) om förordnande och utlämnande av läkemedel och teknisk sprit.
1583 kap. Läkemedelsverkets föreskrifter (HSLF-FS 2016:34) om förordnande och utläm- nande av läkemedel och teknisk sprit.
159Se bl.a. Socialstyrelsens föreskrifter (HSLF-FS 2021:52) om användning av medicin- tekniska produkter i hälso- och sjukvården samt Socialstyrelsen, 2016, Konsumentprodukter som hjälpmedel – En handbok för hälso- och sjukvården, s. 19.
Processer för en patients behandling med ordinerat läkemedel ... |
SOU 2025:71 |
ofta i något annat externt system som t.ex. Sesam LMN160 men en ordination och förskrivning ska även sparas i patientjournalen.161 Vad utredningen erfar förs då inte dessa produkter in i journal- systemets läkemedelsmodul.
Begreppet förskrivning är i detta sammanhang otydligt
Det kan noteras att Socialstyrelsen i termbanken definierar begreppet förskrivning som utfärdande av recept, livsmedelsanvisning eller hjälp- medelskort av behörig hälso- och sjukvårdspersonal, dvs. de åtgärder som kommer av 18 § 2 och 3 lagen (2002:160) om läkemedelsför- måner m.m.162 Socialstyrelsen inkluderar i den definitionen inte övriga förskrivningar av förbrukningsartiklar för inkontinens eller hjälpmedel. Utfärdande av andra underlag för en patients behov av medicintekniska produkter förekommer för bl.a. diabetestekniska produkter och stomiprodukter trots att det finns en möjlighet att förskriva dessa på hjälpmedelskort för expediering inom förmånen på öppenvårdsapotek (se vidare nedan). Detta grundar sig i ovan beskrivna möjlighet för regionerna att inrätta egna system när de så finner lämpligt. Det kan inte heller uteslutas att motsvarande under- lag utfärdas för andra medicintekniska produkter.
Utformningen av dessa underlag, som kan kallas förskrivningar, är inte reglerad i detalj men ska beskrivas i rutiner enligt 2 kap. 3 § Socialstyrelsens föreskrifter (HSLF-FS 2021:52) om användning av medicintekniska produkter i hälso- och sjukvården. Behörighet att utfärda sådana underlag regleras dock inte i 4 kap. i samma föreskrift.
En annan produktkategori som nämnts i avsnitt 5.3.1 ovan är hjälpmedel. Åtminstone en del av dessa är att betrakta som medi- cintekniska produkter (t.ex. rullstolar, TENS- eller hörapparater). Kommuners och regioners skyldigheter att erbjuda hjälpmedel re- gleras i 8 kap. 7 § och 12 kap. 5 § hälso- och sjukvårdslagen (2017:30). Hjälpmedel utlämnas ofta från t.ex. en hjälpmedelscentral och även för detta utlämnande behövs ett underlag. Socialstyrelsen definierar detta som förskrivning av hjälpmedel.163 När sådan förskrivning avser
160Se https://www.visma.se/hjalpmedelshantering/lakemedelsnara-produkter/, besökt 2024-08-27.
161Se exempelvis Västra Götalandsregionen, Beställningsrutin Läkemedelsnära produkter, version 2024-04-25, s. 4–5.
162https://termbank.socialstyrelsen.se/?TermId=718, beslutad år 2020.
163https://termbank.socialstyrelsen.se/?TermId=178, beslutad år 2018.
SOU 2025:71 |
Processer för en patients behandling med ordinerat läkemedel ... |
hjälpmedel som är medicintekniska produkter ska Socialstyrelsens föreskrifter (HSLF-FS 2021:52) om användning av medicintekniska produkter i hälso- och sjukvården tillämpas.
Utifrån ovanstående står det klart att begreppet förskrivning vad avser medicintekniska produkter kan innebära olika saker och att det krävs tydlighet kring vad som avses i olika situationer. I detta betänkande används begreppet förskrivning både för sådana för- skrivningar som kommer av lagen om läkemedelsförmåner och för sådana andra underlag för införskaffande som utfärdas av vården riktade till en enskild patient.
Utlämnande via öppenvårdsapotek
I de fall den medicintekniska produkten ska användas av patienten själv behöver patienten få tillgång till den genom en butik, ett ut- lämningsställe eller hemleverans. Som beskrevs ovan kan det ske via öppenvårdsapotek eller annat utlämningsställe, beroende på hur under- laget, förskrivningen, är utformad och vem som ska betala. I de fall utlämningen sker via regionens upphandlade lösningar styrs för- farandet av deras rutiner och avtal med leverantören. För expedie- ring av hjälpmedelskort på öppenvårdsapotek finns inte heller några särskilda föreskrifter. Dock är handel med sprutor och kanyler re- glerad. Handel med sprutor eller kanyler får i Sverige endast bedri- vas av den som får bedriva sådan handel med läkemedel som avses i 4 kap. 1 § lagen (2009:366) om handel med läkemedel, eller har an- mält handeln till Läkemedelsverket.164 Försäljning av sprutor eller kanyler till den som inte har fyllt 20 år får endast ske om köparen kan styrka att produkterna behövs för köparens eget eller familje- medlems medicinska bruk.165 Den som bedriver handel med sprutor eller kanyler ska vidare iaktta att försäljning inte sker när omständig- heter ger anledning till misstanke att varan kan komma till använd- ning vid missbruk av narkotika eller dopningsmedel.166 I de fall för- säljningen eller utlämnandet sker mot ett av hälso- och sjukvården utfärdat underlag torde det stå klart att syftet är för medicinskt bruk.
1643 § lagen (2012:595) om införsel av och handel med sprutor och kanyler och 2 § förord- ningen (2012:596) om införsel av och handel med sprutor och kanyler.
1654 § lagen (2012:595) om införsel av och handel med sprutor och kanyler.
1663 § förordningen (2012:596) om införsel av och handel med sprutor och kanyler.
Processer för en patients behandling med ordinerat läkemedel ... |
SOU 2025:71 |
Försäljning och utlämnande via olika kanaler
I tabell 5.1 nedan redovisas uppgifter kring försäljningen av förbruk- ningsartiklar på hjälpmedelskort vid öppenvårdsapotek uppdelat på de tre huvudkategorierna inom förmånen. Det kan av tabellen tydligt utläsas vilka regioner som i huvudsak sköter förskrivning och dis- tribution av förbrukningsartiklar i egen regi. T.ex. hanterar Region Jönköpings län både stomi och diabetestekniska förbrukningsartik- lar i egen regi medan Region Kalmar endast hanterar diabetestekniska produkter i egen regi och ser ut att förskriva stomiprodukter för expediering på öppenvårdsapotek.
Tabell 5.1 Försäljning vid öppenvårdsapotek, förbrukningsartiklar på hjälpmedelskort
Antal förpackningar per tusen invånare år 2023
Län där patienten |
Y90 – förbruknings- |
Y92 – förbruknings- |
Y93 – förbruknings- |
är folkbokförd |
artiklar – stomi |
artiklar – diabetes |
artiklar – |
|
|
|
läkemedelsnära |
Stockholm |
135 |
62 |
25 |
Uppsala |
146 |
262 |
27 |
|
|
|
|
Södermanland |
199 |
344 |
27 |
Östergötland |
189 |
285 |
22 |
|
|
|
|
Jönköping |
26 |
9 |
23 |
Kronoberg |
199 |
229 |
22 |
|
|
|
|
Kalmar |
225 |
7 |
21 |
Gotland |
207 |
345 |
26 |
|
|
|
|
Blekinge |
237 |
259 |
22 |
Skåne |
179 |
237 |
21 |
|
|
|
|
Halland |
150 |
246 |
21 |
Västra Götaland |
2 |
6 |
14 |
|
|
|
|
Värmland |
224 |
356 |
19 |
Örebro |
163 |
303 |
28 |
|
|
|
|
Västmanland |
187 |
333 |
21 |
Dalarna |
191 |
326 |
21 |
|
|
|
|
Gävleborg |
231 |
298 |
22 |
Västernorrland |
289 |
5 |
24 |
Jämtland |
262 |
7 |
22 |
Västerbotten |
173 |
10 |
34 |
|
|
|
|
Norrbotten |
214 |
12 |
25 |
Riket |
142 |
144 |
22 |
Källa: Data bearbetade utifrån uppgifter från E-hälsomyndigheten och Statistiska centralbyrån.
SOU 2025:71 |
Processer för en patients behandling med ordinerat läkemedel ... |
Sammanfattningsvis kan det konstateras att medicintekniska pro- dukter kan förskrivas och lämnas ut på olika sätt via olika kanaler. Det finns inte på samma sätt som för läkemedel ett enhetligt flöde och det saknas en samlad nationell infrastruktur för förskrivning.
Många medicintekniska produkter kan patienten dessutom köpa själv hos någon av de återförsäljare som finns utan att det behöver finnas någon förskrivning som underlag för köpet.
5.3.5Uppföljning
Precis som för läkemedel ska användningen av medicintekniska produkter följas upp. Uppföljning är en naturlig del av hälso- och sjukvårdens verksamhet och utgår bl.a. ifrån att hälso- och sjuk- vårdsverksamhet ska bedrivas så att kraven på en god vård uppfylls. Det innebär bl.a. att vården särskilt ska vara av god kvalitet med en god hygienisk standard samt tillgodose patientens behov av trygg- het, kontinuitet och säkerhet.167 Vårdgivaren ska också vidta de åt- gärder som behövs för att förebygga att patienter drabbas av vård- skador.168 För att uppfylla detta måste patientens vård följas upp.
Av Socialstyrelsens föreskrifter framgår att vårdgivaren genom rutiner ska säkerställa att förskrivningen, utlämnandet eller tillföran- det till patienten följs upp och utvärderas fram till dess att behovet upphört eller ansvaret för patienten har övertagits av en annan vård- givare.169 Som framgår i det ovanstående, se avsnitt 5.2.5, har Sveriges Kommuner och Regioner inom ramen för sitt arbete med struktu- rerad vårddokumentation för läkemedel identifierat behovet av be- greppet bekräftande ordination för att beteckna en sådan situation då hälso- och sjukvårdspersonal bekräftar att de uppfattat att en patient använder en viss produkt och bedömer att, så vitt är känt, ingen förändring av ordinationen behövs. Motsvarande resonemang torde enligt utredningen vara tillämpligt även på medicintekniska produkter. Det kan dock vara svårt för hälso- och sjukvårdsperso- nalen att identifiera att en patient har eller använder en medicin- teknisk produkt då en samlad lista över ordinationer eller använd-
1675 kap. 1 § hälso- och sjukvårdslagen (2017:30).
1683 kap. 2 § patientsäkerhetslagen (2010:659).
1692 kap. 3 § 9 Socialstyrelsens föreskrifter (HSLF-FS 2021:52) om användning av medicin- tekniska produkter i hälso- och sjukvården.
Processer för en patients behandling med ordinerat läkemedel ... |
SOU 2025:71 |
ning enligt vad som beskrivits ovan saknas både i journalen och som en del av nationell infrastruktur.
5.3.6En samlad lista saknas
Mot bakgrund av det ovan beskrivna angående ordination och för- skrivning konstaterar utredningen att det saknas en samlad lista över en patients användning av medicintekniska produkter. Dels utgör området medicintekniska produkter ett mycket heterogent område, dels finns det inte lika detaljerade föreskriftskrav kring dokumentation som för läkemedel. Mycket av detaljerna är upp till vårdgivarna att fastställa i rutiner, vilka därmed inte är harmonise- rade. Det saknas också en nationell produktdatabas och kategorise- ring för sådana produkter som inte omfattas av 18 § 2 och 3 lagen (2002:160) om läkemedelsförmåner m.m. (se vidare avsnitt 8.7.2). En konsekvens av ovanstående är att ingen aktör kan hämta full- ständig information om en patients användning av medicintekniska produkter någonstans för att därigenom få en samlad bild av an- vändningen, varken patienten, hälso- och sjukvården eller apoteken. Information om ordinerade medicintekniska produkter bör som angetts ovan finnas dokumenterad i journalen, men är inte nöd- vändigtvis samlad eller strukturerad. Genom sammanhållen vård- och omsorgsdokumentation kan vissa vårdgivare sannolikt få åt- komst till delar av informationen, om de vet var de ska leta. Någon nationell strukturerad lista där patienten kan ta del av informatio- nen finns inte och det är oklart huruvida det för patienten går att hitta informationen via e-tjänsten 1177 Journal eller för vårdgivare via den Nationella patientöversikten, NPÖ.
Det som däremot finns är information om sådana förskrivningar, inklusive förskrivningar på hjälpmedelskort, som utfärdats och expedierats vid öppenvårdsapotek. Dessa förskrivningar omfattas av lagen (2018:1212) om nationell läkemedelslista. Som framgår av föregående avsnitt är det dock inte alla vårdgivare som förskriver sådana förbrukningsartiklar som avses i 18 § 2 och 3 i lagen (2002:160) om läkemedelsförmåner m.m. på hjälpmedelskort utan de har in- rättat egna underlag och system för utlämnande. Produkterna om- fattas i dessa fall inte av det nationella registret och inte ens på detta
SOU 2025:71 |
Processer för en patients behandling med ordinerat läkemedel ... |
område är bilden således komplett. Det är svårt att se hur patient- rörligheten och patientens möjlighet till översikt underlättas av detta.
5.3.7Medicintekniska produkter som tillförs i samband med ett vårdtillfälle
Som konstaterats finns det, beroende på hur man räknar, totalt cirka 800 000 unika medicintekniska produkter på den svenska mark- naden.170 Vissa är avsedda för patientens egen användning och för- skrivs och lämnas ut från något försäljningsställe. Andra medicin- tekniska produkter tillförs en patient i samband med ett besök eller ett vårdtillfälle. Det finns också många medicintekniska produkter som används som förbrukningsmaterial i samband med t.ex. ett operativt ingrepp, och som sedan kasseras.
Medicintekniska produkter i samband med behandling
Medicintekniska produkter kan behövas som en del i utredningen eller behandlingen vid ett vårdbesök eller vårdtillfälle. Ibland kan det röra sig om väldigt enkla produkter t.ex. ett plåster eller en kom- press och tejp efter en vaccination eller att patienten lämnat blod. För ett enklare kirurgiskt ingrepp som att ta bort ett misstänkt födelsemärke behövs inte heller mycket mer än lokalbedövning, en lämplig skalpell, sutur, ett plåster och en burk för vävnadsprovet. Vid mer komplicerade ingrepp blir listan av produkter betydligt mer omfattande. T.ex. används ofta flera läkemedel och medicin- tekniska produkter i samband med mer avancerade kirurgiska in- grepp. Patienten kan t.ex. sövas med ett narkosläkemedel som ges via infusion. För infusionen behövs infart, en venkateter, och in- fusionsaggregat. Vidare behöver narkosen övervakas med hjälp av medicinteknisk övervakningsutrustning. Kirurgen behöver för själva ingreppet olika medicintekniska instrument, ibland väldigt speciali- serade sådana. Under ingreppet kan också annan utrustning behöva användas för att underlätta arbetet, t.ex. sugutrustning för att hålla operationsområdet rent från kroppsvätskor. Även förbruknings- artiklar som kompresser, handskar, munskydd, operationsduk m.m.
170Uppgiften är några år gammal men utredningen har inte kunnat finna någon nyare uppgift.
Processer för en patients behandling med ordinerat läkemedel ... |
SOU 2025:71 |
behövs under arbetet.171 Avslutningsvis ska operationssåret sys ihop med sutur och täckas med ett förband. Exemplet ovan är inte på något sätt heltäckande men visar på omfattningen av olika medi- cintekniska produkter som kan behövas för att genomföra ett kirur- giskt ingrepp. I modern hälso- och sjukvård genomförs i dag många olika typer av undersökningar och ingrepp som omfattar många olika medicintekniska produkter.
De flesta av de ovan nämnda medicintekniska produkterna ordi- neras och dokumenteras inte strukturerat som enskilda produkter i patientjournalen. Det finns inget behov av det. Dessa dokumen- teras i stället ofta som en del av behandlingen. T.ex. förutsätts det ofta när ett läkemedel ordinerats för injektion eller infusion att den som utför åtgärden använder vissa medicintekniska produkter. Skill- nad kan göras om infusionen ska ges med eller utan pump.172 Vad som mer specifikt behöver användas för olika ingrepp framgår i stället ofta av skriftliga rutiner. Sådana dokument är oftast inte knutna till en enskild patient utan till proceduren i sig. Det finns dock medicin- tekniska produkter som är tydligt knutna till patienten, en sådan pro- duktgrupp är implantat eller invasiva produkter, t.ex. en pacemaker, en höftledsprotes eller ett dränage.
Omfattningen av produkter som används i samband med ett vårdtillfälle
Läkemedelsverket har inom ramen för ett regeringsuppdrag försökt identifiera vilka medicintekniska produkter som är relevanta att ha kännedom om tillgängligheten av.173 Myndigheten konstaterar att det är svårt att avgöra vilka produkter som är mer relevanta än andra. Även Socialstyrelsen har konstaterat att det utifrån beredskapsaspek- ter är svårt att uppskatta vilka medicintekniska produkter som är sär- skilt viktiga för sådan vård som inte kan anstå.174 Enligt uppgifter
171Vissa medicintekniska produkter som handskar och munskydd kan också utgöra personlig skyddsutrustning och då falla under reglerna för arbetsmiljö och arbetsmiljöverkets tillsyn.
172En infusion kan enklast ges genom att påsen hängs upp högre än infarten och att det hydrostatiska trycket från vätskan räcker för att driva infusionen. Om man vill erhålla en mer kontrollerad infusion där trycket, och därmed infusionshastigheten, kan regleras kan t.ex. en pump användas.
173Läkemedelsverket, 2023, Förstudie inför framtagandet av en nationell lägesbild över till- gången till läkemedel och medicintekniska produkter – Delredovisning gällande medicintekniska produkter, dnr 1.1.8-2022-01696, s. 15–16.
174Socialstyrelsen, 2024, Underlag för vilka sjukvårdsprodukter som bör omfattas av hälso- och sjukvårdens försörjningsberedskap, s. 22.
SOU 2025:71 |
Processer för en patients behandling med ordinerat läkemedel ... |
till Utredningen om hälso- och sjukvårdens beredskap (S 2018:09) hanterar regionerna i Mellansverige ungefär 50 000 medicintekniska artiklar i sitt beställningssortiment vilket innebär att dessa används vid utförandet av vård. Många av dessa är förbrukningsartiklar.175
Många produkter som beställs och används i samband med vård saknar sannolikt relevans att samla information om i en nationell lista. Det kan vara produkter som behövs för det aktuella ingreppet, men saknar varaktig betydelse för patienten eller dennes vård, med undantag för om någon specifik reaktion, t.ex. överkänslighet, upp- stått vid användningen.
En typ av medicintekniska produkter som dokumenteras noga är kirurgiska instrument. Där finns i hälso- och sjukvården rutiner för spårbarhet av t.ex. gallernummer vid sterilisering och dokumen- tation av vilka instrument som använts till vilken patient.176 Upp- gifterna lagras i patientjournalen av patientsäkerhetsskäl för att kunna spåra t.ex. smitta eller instrumentfel. Det är dock enligt utredningen svårt att se relevansen av att samla denna information i en nationell lista. Uppgifterna finns att tillgå lokalt i händelse av en avvikelse och efterföljande utredning.
Det finns dock produkter som tillförs patienten under ett vård- tillfälle som kan vara relevant att samla information om (se vidare kapitel 6). Det avser främst produkter som inte enbart tillfälligt tillförs patienten. Exempel på detta är olika former av implantat och slangar eller katetrar som helt eller delvis sätts in i patienten. Eftersom dessa produkter kan påverka annan vård och behöver följas upp finns särskilda behov kopplade till dessa produkter.
Särskilt om implantat och invasiva produkter
Implantat definieras i Europaparlamentets och rådets förordning (EU) 2017/745 om medicintekniska produkter.177 Ett implantat är en produkt, även sådan som helt eller delvis absorberas, som är av-
175SOU 2021:19 En stärkt försörjningsberedskap för hälso- och sjukvården, s. 153–154.
176Kravet på spårbarhet framgår av Europaparlamentets och rådets förordning (EU) 2017/745 av den 5 april 2017 om medicintekniska produkter, om ändring av direktiv 2001/83/EG, förordning (EG) nr 178/2002 och förordning (EG) nr 1223/2009 och om upphävande av rådets direktiv 90/385/EEG och 93/42/EEG.
177Europaparlamentets och rådets förordning (EU) 2017/745 av den 5 april 2017 om medicin- tekniska produkter, om ändring av direktiv 2001/83/EG, förordning (EG) nr 178/2002 och förordning (EG) nr 1223/2009 och om upphävande av rådets direktiv 90/385/EEG och 93/42/EEG.
Processer för en patients behandling med ordinerat läkemedel ... |
SOU 2025:71 |
sedd att helt föras in i människokroppen, eller att ersätta en epitelial yta eller ögats yta genom klinisk intervention och är avsedd att stanna i kroppen efter ingreppet. Även en produkt som är avsedd att delvis föras in i människokroppen genom klinisk intervention och att stanna kvar där i minst 30 dagar efter ingreppet ska anses vara ett implantat.178 Ett närliggande begrepp är invasiv produkt med vilket avses en pro- dukt som helt eller delvis tränger in i kroppen, antingen genom en kroppsöppning eller genom kroppens yta.179 Implantat kan också vara aktiva. Med aktiv produkt avses en produkt som för sin funk- tion är beroende av en annan energikälla än den som alstras direkt av människokroppen i detta syfte eller av jordens dragningskraft och som fungerar genom att ändra energitätheten eller genom energi- omvandling. Produkter som är avsedda att överföra energi, substanser eller andra element mellan en aktiv produkt och patienten utan någon väsentlig förändring ska inte anses vara aktiva produkter. Program- vara ska också anses vara en aktiv produkt.180 För aktiva implantat finns särskild reglering.181
Som framgår av definitionen i EU:s förordning om medicintekniska produkter är implantat produkter som är avsedda att stanna kvar i patienten i minst 30 dagar. Även invasiva produkter182 kan användas under en längre tid, t.ex. en perkutan endoskopisk gastrostomi, ofta kallad PEG, för sondmatning, kanylen som ansluter en insulinpump till kroppen eller en urinvägskateter. För implantat finns i den nämnda EU-förordningen särskilda bestämmelser om implantatkort och information. Där anges att tillverkaren av ett implantat tillsammans med produkten ska tillhandahålla a) information som gör det möj- ligt att identifiera produkten, inbegripet produktnamn, serienummer, partinummer (LOT), UDI, produktmodell samt tillverkarens namn, adress och webbplats, b) alla varningar, försiktighetsåtgärder eller andra åtgärder som patienten eller hälso- och sjukvårdspersonal ska vidta med avseende på ömsesidig påverkan som rimligen kan förut- ses i samband med yttre faktorer, läkarundersökningar eller miljö-
178Artikel 2.5 förordningen (EU) 2017/745.
179Artikel 2.6 förordningen (EU) 2017/745.
180Artikel 2.4 förordningen (EU) 2017/745.
181Kommissionens förordning (EU) nr 722/2012 av den 8 augusti 2012 om särskilda krav vad gäller de krav som fastställs i rådets direktiv 90/385/EEG och 93/42/EEG med avseende på aktiva medicintekniska produkter för implantation och medicintekniska produkter som tillverkas med hjälp av vävnader av animaliskt ursprung.
182Invasiv innebär att artikeln helt eller delvis tränger in i kroppen, antingen genom en kroppsöppning eller genom kroppens yta.
SOU 2025:71 |
Processer för en patients behandling med ordinerat läkemedel ... |
förhållanden som rimligen kan förutses, c) all information om pro- duktens förväntade livslängd och om all nödvändig uppföljning, d) all annan information för att säkerställa att patienten ska kunna använda produkten på ett säkert sätt, inklusive informationen i avsnitt 23.4 u i bilaga I till förordningen. Information ska ges, i syfte att tillhanda- hålla den till den patient i vilken produkten har implanterats, på ett sätt som gör informationen snabbt tillgänglig och på det eller de språk som den berörda medlemsstaten har fastställt. Informationen ska vara skriven på ett sätt som lätt kan förstås av en lekman och ska vid behov uppdateras. Uppdateringar av informationen ska göras tillgängliga för patienten via den webbplats som anges i EU-förord- ningen.
Tillverkaren ska dessutom tillhandahålla den information som avses i led a ovan på ett implantatkort som medföljer produkten.183
Utredningens fokus – patientbundna medicintekniska produkter
Utredningens arbete rör en fortsatt utveckling av den nationella läkemedelslistan. I uppdraget ingår att analysera om, och i så fall vilka, medicintekniska produkter som bör omfattas av den natio- nella läkemedelslistan. Utredningen kommer därför avgränsa upp- draget till sådana medicintekniska produkter som tydligt kan knytas till en enskild patients vård och behandling. Därmed omfattas t.ex. inte produkter som patientsängar, magnetkameror eller olika infor- mationssystem och appar av utredningens vidare arbete. Inte heller sådana medicintekniska produkter, t.ex. kirurgiska instrument eller förbrukningsartiklar, som ingår i en procedur som utförs av hälso- och sjukvårdspersonal omfattas.
Precis som vid läkemedelsbehandling gäller att de flesta medi- cintekniska produkter ingår som en del i en helhet kring patientens utredning, vård och behandling, ofta tillsammans med andra åtgärder. Behovet av patientbundna medicintekniska produkter tar sin ut- gångspunkt i patientens hälsotillstånd eller risk för ohälsa och inklu- derar moment som att ordinera, förskriva eller tillföra patienten den medicintekniska produkten samt att informera om och följa upp användningen av produkten. Även öppenvårdsapotekens eller andra utlämnings- eller försäljningsställens processer med att expe-
183Artikel 18.1 förordningen (EU) 2017/745.
Processer för en patients behandling med ordinerat läkemedel ... |
SOU 2025:71 |
diera och informera omfattas och processen slutar i patientens an- vändning av produkten. Bortsett från när en patient själv fattar beslut om att använda enklare medicintekniska produkter som t.ex. plåster eller lusschampo för lindrigare åkommor så startar medicinteknik- processen i mötet mellan patient och hälso- och sjukvårdspersonal.
5.4Särskilt om processer hos övriga vårdgivare
Enligt IVO:s vårdgivarregister har 35 statliga myndigheter anmält att de bedriver hälso- och sjukvårdsverksamhet. Vanligast före- kommande är psykologverksamhet och psykoterapi samt allmän hälso- och sjukvård. Majoriteten av de statliga myndigheter som tillhandahåller hälso- och sjukvård är universitet och högskolor samt några stora och medelstora myndigheter, exempelvis Försvars- makten, Kriminalvården och Statens institutionsstyrelse.184 Nedan följer en kort beskrivning av hälso- och sjukvårdsverksamheten vid Försvarsmakten, Kriminalvården och statens institutionsstyrelse. Avslutningsvis redogörs kort för verksamheten vid elevhälsan.
5.4.1Särskilt om hälso- och sjukvård i Försvarsmakten
Även om de processer som beskrivits i 5.2 och 5.3 i stort gäller all hälso- och sjukvård finns faktorer som gör Försvarsmaktens hälso- och sjukvård speciell. Försvarsmaktens uppgift är att försvara Sverige mot ett väpnat angrepp.185 Försvarsmakten ska också främja Sveriges säkerhet och hävda Sveriges territoriella integritet. Myndigheten ska ha förmåga att värna Sveriges suveräna rättigheter och svenska intressen samt att förebygga och hantera konflikter och krig såväl nationellt som internationellt.186
Försvarsmakten är en statlig vårdgivare som inom ramen för huvuduppgiften även bedriver hälso- och sjukvård i fred, kris och krig. I Sverige bedrivs vården inom ramen för grundorganisationen bl.a. företagshälsovård, daglig sjukvård för värnpliktiga och sjuk- vårdsberedskap under övningar. Ett allt viktigare inslag är också övningsverksamhet tillsammans med andra nationer, både i och
184SOU 2024:57 Ett nytt regelverk för hälsodataregister, s. 171.
1851 § förordning (2007:1266) med instruktion för Försvarsmakten.
1862 § i ovan nämnda författning.
SOU 2025:71 |
Processer för en patients behandling med ordinerat läkemedel ... |
utanför Sverige. Sådan övningsverksamhet omfattar även sjukvårds- resurser. En viktig del i fredstid är också att säkerställa och följa upp de medicinska krav som finns för t.ex. befattningshavare i flyg- och dyktjänst.
Försvarsmakten bedriver även hälso- och sjukvård utomlands inom utlandsstyrkan eller som en del i Natosamarbetet. I huvudsak handlar det om daglig sjukvård för de anställda i förbanden men det finns även god förmåga till akut omhändertagande och rutiner för hemtransport vid t.ex. stridsskador om så skulle behövas. Sjukvårds- kedjan i utlandet kan, beroende på insatsens förutsättningar, om- fatta stöd från flera nationer med t.ex. tillgång till fältsjukhus och taktiska eller strategiska medicinska transporter.
Försvarsmakten har i grundorganisationen i Sverige få sjukvårds- resurser tillgängliga för t.ex. prehospital- och avancerad traumavård. I den del det finns förband under utbildning är det inte säkert att den legitimerade sjukvårdspersonalen finns tillgänglig över tid efter- som dessa ofta har en anställning i den civila hälso- och sjukvården. Försvarsmaktens förmåga att bedriva prehospital- och avancerad traumavård kommer därför att finnas framför allt i krigsförbanden vilka tillgängliggörs först efter mobilisering. Vid denna tidpunkt inkallas den krigsplacerade hälso- och sjukvårdspersonalen som till stor del till vardags arbetar i den civila sjukvården.
Försvarsmaktens sjukvård omfattar hela kedjan från omedelbar kamrathjälp, vilket kan sägas motsvara första hjälpen, och ett första omhändertagande på stridsfältet av sjukvårdare och sjuktransporter med olika kvalificerade resurser, till avancerad traumavård på fält- sjukhus eller vård av civila vårdenheter. Verksamheten bedrivs av både legitimerad och icke legitimerad personal, som tjänstgör i För- svarsmakten hela tiden eller under viss tid och värnpliktig personal. Verksamheten bedrivs vid både fasta vårdinrättningar, som t.ex. För- svarshälsan, och på mobila enheter som fartyg, flygande-, hjul- och bandgående sjuktransportfordon samt vid fältsjukhus. Sjukvård be- drivs också på olika platser under övning och vid internationella in- satser av olika slag.
Vid krig kommer vård att bedrivas överallt där det är nödvän- digt. Hälso- och sjukvårdslagstiftningen gäller om inte annat sär- skilt anges också för Försvarsmaktens verksamhet.
Processer för en patients behandling med ordinerat läkemedel ... |
SOU 2025:71 |
Försvarsmaktens sjukvård har särskilda utmaningar
Som konstateras ovan skiljer sig Försvarsmaktens verksamhet avsevärt från övriga vårdgivare, inte minst i situationer då vård bedrivs i fält- förband och under fältmässiga förhållanden. Möjligheterna att utbyta information genom digitala system är beroende av uppkoppling mot nationella elektroniska tjänster. Vid internationell verksamhet kan även digitalt utbyte av information med andra länder vara aktuell och något Försvarsmakten behöver förhålla sig till, t.ex. inom ramen för Nato. Sådana standarder finns publicerade i standarddokument och utarbetas vid Nato Center of Excellence for Military Medicine.187,188 Försvarsmakten har i dag begränsad eller ingen uppkoppling mot nationella tjänster varken i den fast baserade sjukvården eller i fält- förbanden.
Under fredstida förhållanden i t.ex. Försvarshälsan liknar verk- samheten i stora drag annan företagshälsovård eller för de värnplik- tiga, primärvård. I dag används i huvudsak fortfarande pappersrecept då nuvarande journalsystem är anpassat för företagshälsovård och ännu inte är anslutet till nationella e-tjänster. I framtiden är det dock Försvarsmaktens ambition att införa ett system som i likhet med den civila hälso- och sjukvården kan ansluta till nationella e-tjänster.
I fältförbanden, i Sverige och utomlands, kan förhållandena vara annorlunda. Det är inte självklart att elektroniska system kan eller ska implementeras i hela hälso- och sjukvårdskedjan. Ambitionen som uttrycks är däremot att det till viss del ska införas elektroniska system med möjlighet till elektronisk kommunikation.189 Det är dock inte säkert att uppkoppling mot nationella elektroniska tjänster är möjlig att upprätthålla över tid. I den mån det är möjligt att upprätt- hålla, men bandbredden är begränsad, är det inte heller givet att det är hälso- och sjukvårdsverksamheten som är prioriterad över annan trafik. Försvarsmakten måste därför anpassa sin verksamhet utifrån de förutsättningar som råder. Det är en del i de militära förutsätt- ningarna. Detta kan även påverka möjligheterna att nyttja den natio- nella läkemedelslistan.
187Patient data exchange format for common core information (AMedP-5.1), Edition A Version 2, May 2018.
188Standards for data interchange between health information systems (AMedP-5.2), Edition A Version 1, August 2018.
189Samtal med Försvarsmakten 2024-04-24.
SOU 2025:71 |
Processer för en patients behandling med ordinerat läkemedel ... |
Försvarsmaktens behov av en samlad bild över en patients läkemedelsbehandling
Den fredstida sjukvården vid Försvarshälsan är en företagshälsovård för anställd personal och fungerar som kostnadsfri primärvård för värnpliktig personal och kadetter under utbildning. Att vara soldat är många gånger fysiskt krävande och kräver en god hälsa. För att få mönstra och genomföra värnplikt krävs också att man vid mönst- ringstillfället är frisk och har en god hälsa. Det är därför inte annat än i undantagsfall sannolikt att i Försvarsmaktens förband hitta svårt sjuka, multisjuka eller personer med kroniska sjukdomar som har stor påverkan på funktion. De som däremot väljer en yrkeskarriär i Försvarsmakten kan naturligtvis utveckla sjukdomar senare i livet. Det finns också många civilanställda i Försvarsmakten. Både den anställda personalen, värnpliktiga och kadetter kan söka och få vård inom den fredstida civila hälso- och sjukvården parallellt med sin anställning eller utbildning. Därmed finns både ett behov av att kunna ta del av, och dela information om, läkemedelsbehandling med andra vårdgivare. I den delen skiljer sig inte Försvarsmakten från övriga vårdgivare.
Försvarsmakten genomför även drogtester på personal. I utred- ningen av ett positivt drogtest är t.ex. tillgång till information om vilka läkemedel en person behandlas med relevant, såväl receptför- skrivna som sådana administrerade av hälso- och sjukvårdspersonal.
Inom fältförbanden är som konstaterats ovan förutsättningarna att dela information genom elektroniska system mer begränsad. I den vårdkedja som uppstår när en soldat eller sjöman skadas allvarligt finns naturligtvis ett stort behov av att dela information om genom- förd behandling i tidigare steg, t.ex. i överföringen från ett första akut omhändertagande på skadeplats till den första primärkirurgiska nivån vid t.ex. en förbandsplats. Sådan dokumentation börjar med enklare pappersjournaler.
Svårt skadade soldater kommer med stor sannolikhet slutligen tas om hand i den civila hälso- och sjukvården där det normala är att vården dokumenteras digitalt och att man kan ta del av informa- tion via olika elektroniska tjänster. Det finns naturligtvis en stor fördel om information gällande skadade soldater och sjömän fanns tillgänglig i sådana system.
Processer för en patients behandling med ordinerat läkemedel ... |
SOU 2025:71 |
Utredningen uppfattar att Försvarsmaktens ambition är att så långt möjligt följa samma tekniska standard som den civila vården. Utredningen uppfattar därför att det är Försvarsmaktens ambition att på sikt kunna dela och ta del av information från andra vårdgivare när elektroniska system används vilket inkluderar anslutning till den nationella läkemedelslistan. Detta gäller både i den fast baserade dagliga sjukvårdsverksamheten i Försvarshälsan såväl som i de mer rörliga fältförbanden. Dokumentation i Försvarsmaktens sjukvård kommer dock sannolikt aldrig i sin helhet kunna bli digital och det kommer alltid finnas behov av reservrutiner. Det är därför viktigt att all vårdpersonal som möter skadade soldater och sjömän är med- vetna om att bilden som ges i en elektronisk journal inte alltid är komplett.
5.4.2Särskilt om hälso- och sjukvården i Kriminalvården
Kriminalvården är en statlig myndighet med ansvar för fängelser, frivård och häkten. Myndigheten har bl.a. i uppdrag att verkställa straff och minska risken för återfall i brott. Myndigheten utför även personutredningar i brottmål.190
Även intagna personer kan ha behov av sjukvård. De kan sedan tidigare ha en sjukdom eller drabbas av sjukdom eller att behov av vård uppstår under vistelsen. Kriminalvården har ett stort ansvar för de personer som är intagna och häktade. I ansvaret ingår bl.a. att ombesörja att de får den hälso- och sjukvård som de har behov av eftersom den intagne inte fritt kan söka vård. Verksamheten inom Kriminalvården omfattas i dessa delar av samma hälso- och sjukvårds- lagstiftning som annan hälso- och sjukvårdsverksamhet.
En intagen som behöver hälso- och sjukvård ska vårdas enligt de anvisningar som ges av läkare. Om den intagne inte kan undersökas eller behandlas på ett lämpligt sätt på anstalten, ska den allmänna sjukvården anlitas. Om det behövs, ska den intagne föras över till sjukhus.191
Kriminalvården är vårdgivare och anmäld till vårdgivarregistret för verksamhet inom primärvård och psykiatri. För att kunna om- besörja de intagnas vård har alla häkten och fängelser en läkarmot-
190Information inhämtad från https://www.kriminalvarden.se/om-kriminalvarden/, den
15maj 2024, samt 1–2 §§ förordningen (2023:797) med instruktion för Kriminalvården.
1919 kap. 1 § fängelselagen (2010:610), 5 kap. 1 § häkteslagen (2010:611).
SOU 2025:71 |
Processer för en patients behandling med ordinerat läkemedel ... |
tagning där verksamhet bedrivs under kontorstid. Där finns dag- ligen en eller flera sjuksköterskor tillgängliga, och mottagningen fungerar ungefär som en vanlig vårdcentral. Allmänläkare finns på mottagningen en eller två gånger i veckan och på flera mottagningar arbetar även en psykiater på konsultbasis. Vid vissa verksamheter finns även barnmorska, fysioterapeut och arbetsterapeut. Det är en sjuksköterska som ansvarar för hanteringen av läkemedel som läkare ordinerar åt intagna. Läkemedlen beställs i dospåsar och delas sedan ut av kriminalvårdare med särskild utbildning. Om en intagen blir akut sjuk, behöver opereras, medicinskt övervakas eller få annan vård som kräver ett sjukhus resurser, följer personal från Kriminal- vården med vid överflyttningen. Den medföljande personalen utgör oftast inte hälso- och sjukvårdspersonal.
Tandvård
Intagna kan få akut tandvård vid behov. Grundläggande tandvård kan den intagna endast få om det lämpligen kan ske och är ända- målsenlig för verkställigheten.
Kriminalvården har särskilda utmaningar
En utmaning för Kriminalvården är behovet av att upprätthålla en hög grad av sekretess kring de intagna när information om deras hälso- och sjukvårdsbehandlingar delas. Det får inte framkomma att en person är intagen och inte heller var denne befinner sig eller vårdas. Sådan information kan utnyttjas för t.ex. fritagningsförsök. Uppgiften att en person är intagen för kriminalvård är också en uppgift som betraktas som känslig ur integritetssynpunkt. Av bl.a. dessa skäl är Kriminalvården ännu inte uppkopplad mot nationella e-tjänster, såsom nationell patientöversikt eller Pascal, ett system för bl.a. förskrivning av dosförpackade läkemedel. Myndigheten har ännu inte heller möjlighet att ansluta sin hälso- och sjukvårds- verksamhet till den nationella läkemedelslistan. Kriminalvården har i stället, precis som Försvarsmakten, haft elektroniska journalsystem som endast varit kopplade mot vårdverksamheten inom myndigheten. Kriminalvården planerar dock att genom införande av ett nytt jour-
Processer för en patients behandling med ordinerat läkemedel ... |
SOU 2025:71 |
nalsystem, med högt ställda krav på säkerhet, kunna ansluta till natio- nella e-tjänster framöver, inklusive den nationella läkemedelslistan.
Kriminalvården har av säkerhetsskäl behov av att kunna införa spärrar för patientens vårdinformation, t.ex. i e-tjänsten 1177 jour- nal på sajten 1177.se. Genom åtkomst till den informationen kan annars andra än den intagne själv få del av information om t.ex. bokade vårdtider, vilket kan utgöra en säkerhetsrisk.
I dag får många av Kriminalvårdens intagna som är i kontinuer- ligt behov av läkemedel sina läkemedel genom dosdispensering. Eftersom Kriminalvården ännu inte är ansluten till Pascal är det inte möjligt att förskriva läkemedel direkt i det systemet. Kriminal- vården förskriver inte läkemedel alls och saknar i dag t.ex. arbetsplats- kod. Om en lokal arbetsplatskod används vid förskrivning kan den bidra till att identifiera att patienten får vård genom Kriminalvården och vid vilken anstalt. Ordinationerna förs i stället över till dos- aktören genom en integration i journalsystemet. Detta kallas ofta för slutenvårdsdos och är en form av dosdispensering som även an- vänds av flera regioner som ett alternativ till manuell dispensering på vårdavdelning när patienter är inneliggande och har stabil läke- medelsbehandling. Slutenvårdsdos innebär både patientsäkerhets- fördelar och effektiv hantering av vårdpersonalens tid. Utöver detta förekommer manuell dispensering från lokala läkemedelsförråd för den intagnes behov.
Kriminalvården bär i dag kostnaden för de läkemedel som rekvi- reras och delas ut inom verksamheten, både för slutenvårdsdos och övriga läkemedel som rekvireras.
Kriminalvårdens behov av en samlad bild av en patients behandling
Inom Kriminalvården ser man medicinska behov av att på ett effek- tivare sätt kunna ta del av information om en patients vård utförd hos andra vårdgivare. Som beskrivits ovan kan man ännu inte dela patientinformation elektroniskt med externa aktörer. Särskilt när nyintagna eller nyligen häktade personer kommer till verksamheten finns ett behov av att klargöra patientens sjukdomshistoria inklu- sive vilka läkemedel och andra förskrivna varor patienten sedan tidigare är ordinerad. I dag läggs mycket tid på att kontakta olika vårdgivare och samla information. De finns även uppgifter att Kri-
SOU 2025:71 |
Processer för en patients behandling med ordinerat läkemedel ... |
minalvården vänder sig till öppenvårdsapotek för att få information om patientens aktuella recept, information som apotekspersonalen inte kan dela med sig av.
Kriminalvården tar över ansvaret för patienten i och med att patienten inte kan sköta t.ex. sina egna apoteksbesök eller hantera sina egna läkemedel efter intagning. Sådan vård som kan utföras inom Kriminalvården hanteras på den lokala läkarmottagningen, både av resurs- och säkerhetsskäl. Det inkluderar t.ex. administre- ring av sådana läkemedel som måste ges av sjukvårdspersonal, för- utsatt att det kan ske på ett säkert sätt i verksamheten och inte kräver t.ex. de särskilda resurserna på ett sjukhus. Om det skulle gå att dela vårdinformation digitalt skulle det göra verksamheten både mer patientsäker och effektiv.
Även när en intagen behöver sjukhusvård under sin tid inom Kriminalvården skulle ökad elektronisk delning av information vara en stor fördel. Vid inskrivning för vård på sjukhus finns t.ex. behov av att kunna ta del av vilka aktuella läkemedel patienten sedan tidi- gare är ordinerad. Sådan information skrivs i dag ut på papper till- sammans med remiss och skickas med patienten. På samma sätt måste information vid utskrivningen från sjukhus föras med till- baka till Kriminalvården. Detta sker på papper och ibland till viss del muntligen. Budbärare av informationen är i många av dessa fall den medföljande personalen, och denna är som regel inte hälso- och sjukvårdspersonal. Ökad digital delning av information är därför även i dessa fall en önskvärd utveckling. En förutsättning är dock att den sekretess som behöver upprätthållas kan säkerställas.
5.4.3Särskilt om hälso- och sjukvård hos Statens institutionsstyrelse
Statens institutionsstyrelse, i det följande förkortat SiS, är en myn- dighet som ansvarar för individuellt anpassad tvångsvård och be- handling av ungdomar med allvarliga psykosociala problem och vuxna med missbruksproblem. Myndighetens verksamhet sker i dessa delar på uppdrag av socialtjänsten. Myndigheten tar också emot ungdomar som har dömts till sluten ungdomsvård.
SiS bedriver verksamhet genom sådana hem som avses i 12 § lagen (1990:52) med särskilda bestämmelser om vård av unga, sär- skilda ungdomshem, samt genom sådana LVM-hem som avses i
Processer för en patients behandling med ordinerat läkemedel ... |
SOU 2025:71 |
22 och 23 §§ lagen (1988:870) om vård av missbrukare i vissa fall.192 Myndigheten svarar härvid för att de barn, unga och vuxna som vårdas vid myndigheten får en god, ändamålsenlig och rättssäker vård som ger bättre förutsättningar för ett socialt fungerande liv utan missbruk, kriminalitet och annat socialt nedbrytande bete- ende.193 Myndigheten verkställer också sluten ungdomsvård enligt 32 kap. 5 § brottsbalken. Verkställigheten av sluten ungdomsvård skall ske vid sådana särskilda ungdomshem som avses i 12 § lagen med särskilda bestämmelser om vård av unga.194
SiS har ett stort ansvar för de personer som vårdas eller behandlas i verksamheten. I ansvaret ingår bl.a. att ombesörja att de erbjuds den hälso- och sjukvård som de har behov av. Den verksamheten inom SiS omfattas av samma hälso- och sjukvårdslagstiftning som annan hälso- och sjukvårdsverksamhet. SiS är vårdgivare enligt hälso- och sjukvårdslagen (2017:30) och patientsäkerhetslagen (2010:659). SiS omfattas därmed i dessa delar av både patientdatalagen (2008:355) och lagen (2022:913) om sammanhållen vård och omsorgsdokumen- tation.
I den mån hälso- och sjukvårdsverksamheten inom SiS innefattar ordination och förskrivning av läkemedel eller andra varor omfattas myndigheten av kraven i lagen (2018:1212) om nationell läkemedels- lista på att ha ett elektroniskt system som gör det möjligt att få direkt- åtkomst till uppgifter i den nationella läkemedelslistan, och att vid en elektronisk förskrivning lämna de uppgifter till den nationella läkemedelslistan som närmare anges i lagen.195
Den som vårdas eller behandlas inom ramen för SiS verksamhet kan även ha behov av hälso- och sjukvård. En ungdom eller klient kan sedan tidigare ha en pågående sjukdom, eller drabbas av sjukdom eller att behov av vård uppstår av annan anledning under vistelsen. Rätten till sjukvård vad avser sluten ungdomsvård framgår av 19 § lagen (1998:603) om verkställighet av sluten ungdomsvård.
SiS bedriver öppen hälso- och sjukvård. Även om den övriga vår- den inom SiS bedrivs med stöd av tvång är hälso- och sjukvården som erbjuds frivillig, precis som för andra patienter.
1926 kap. 3 § socialtjänstlagen (2001:453) samt 1 § förordningen (2007:1132) med instruk- tion för Statens institutionsstyrelse.
1931 a § ovan nämnda författning.
194Se 1 § lagen (1998:603) om verkställighet av sluten ungdomsvård.
1959 kap. 1 § lagen (1018:1212) om nationell läkemedelslista.
SOU 2025:71 |
Processer för en patients behandling med ordinerat läkemedel ... |
Hos SiS arbetar sjuksköterskor, läkare och psykologer. Institu- tionscheferna är verksamhetschefer för hälso- och sjukvården på sina institutioner. De särskilda ungdomshemmen ska ha tillgång till läkare som bör ha specialistkompetens inom barn- och ungdoms- psykiatri eller allmän psykiatri. LVM-hemmen ska ha tillgång till läkare med särskilda kunskaper som passar för verksamheten. Både LVM-hem och särskilda ungdomshem bör enligt socialtjänstlagen också ha tillgång till psykologisk expertis.
För personer som blir omhändertagna enligt lagen om vård av missbrukare i vissa fall, LVM, kan tillståndet vara livshotande. Läkare hos annan vårdgivare ska, om det inte är uppenbart onödigt, under- söka klienterna innan de kommer till institutionen.196 När det behövs ska vården inledas på sjukhus.
Ungdomar på SiS särskilda ungdomshem kan också ha hälso- problem. För att vården hos SiS ska bli framgångsrik är det viktigt att samordna hälso- och sjukvårdsinsatserna med insatserna riktade mot orsaken till placeringen.
Läkemedelsbehandling är en naturlig del av hälso- och sjukvårds- insatserna även i SiS verksamhet. Behandlingen kan ske både genom att läkemedel förskrivs på recept eller att läkemedel ordineras och administreras av hälso- och sjukvårdspersonal. De läkare som anlitas av SiS kan vara anställda i verksamheten, arbeta på konsultbasis eller utgöra ett stöd från aktuell region, se vidare nedan.
Statens institutionsstyrelse har särskilda utmaningar med att dela patientinformation
Det är en utmaning för SiS att dela information om patienternas hälso- och sjukvårdsbehandlingar med andra vårdgivare eller an- höriga då det finns ett behov av att skydda uppgifter om dem som vårdas inom SiS. Det bör inte genom att patientuppgifter delas fram- komma att en person vårdas inom SiS eller var patienten geografiskt befinner sig eller vårdas. Sådan information kan utnyttjas för t.ex. fritagningsförsök. Uppgiften att en person vårdas vid SiS är också en uppgift som betraktas som känslig ur integritetssynpunkt. Om en ungdom eller en klient får ett vaccin administrerat under den tid man vårdas inom SiS blir uppgiften om vilken vårdgivare som admini-
1969 § lagen (1988:870) om vård av missbrukare i vissa fall.
Processer för en patients behandling med ordinerat läkemedel ... |
SOU 2025:71 |
strerat vaccinet känslig, särskilt om uppgifter om vaccinationer skulle lagras i register över lång tid.
SiS förskriver i dag läkemedel elektroniskt och använder samma system som en av de större regionerna i Sverige. Systemet kommer på sikt fasas ut men är under anpassning till kraven på vårdgivare i lagen om nationell läkemedelslista. SiS kommer, precis som övriga statliga vårdgivare, framöver behöva byta vårdinformationssystem. SiS använder Pascal för att förskriva dosdispenserade läkemedel.
SiS har, liksom Kriminalvården, behov att av säkerhetsskäl kunna införa spärrar för patientens vårdinformation, t.ex. i e-tjänsten 1177 journal på sajten 1177.se. Genom åtkomst till sådan information kan annars andra än den intagne få del av information om t.ex. bokade vårdtider, vilket kan utgöra en säkerhetsrisk.
Statens institutionsstyrelses behov av en samlad bild av en patients behandling
Inom SiS ser man behov av att på ett effektivare sätt kunna ta del av information om en patients vård utförd hos andra vårdgivare. Sär- skilt när nya vårdtagare placeras i verksamheten finns ett behov att, av patientsäkerhetsskäl, klargöra patientens sjukdomshistoria in- klusive vilka läkemedel och andra förskrivna varor patienten sedan tidigare är ordinerad. I dag läggs mycket tid på att kontakta olika vårdgivare och samla information. SiS har även ett behov av att kunna ta del av en patients vaccinationsstatus. SiS är i dag inte anslutna till den nationella patientöversikten. Ofta placeras vårdtagaren inte i samma kommun eller region där de tidigare bott. SiS tar i och med placeringen över läkemedelsansvaret för vårdtagaren eftersom denne inte kan sköta t.ex. sina egna apoteksbesök eller hantera sina egna läkemedel under vårdinsatsen inom SiS.
Den öppna hälso- och sjukvård som erbjuds vårdtagare organi- seras på olika sätt inom SiS verksamhet. Vården kan ges av vård- personal anställd vid SiS eller av personal anlitad på konsultbasis. Ibland utförs vården i stället av regionens hälso- och sjukvårds- personal och i vissa fall ordineras vården av regionens personal men t.ex. administreringen av ett läkemedel utförs av SiS anställda, eller kontrakterade, hälso- och sjukvårdspersonal vid LVM-hemmet eller det särskilda ungdomshemmet. Hur vården organiseras påverkar därmed var och hur dokumentationen över vården kommer att ske.
SOU 2025:71 |
Processer för en patients behandling med ordinerat läkemedel ... |
Läkemedelsordinationer kan antingen förekomma både i regionernas system och SiS system eller enbart i SiS egna system. De läkemedel som administreras vid SiS verksamheter dokumenteras dock alltid i SiS system.
Skulle en vårdtagare vara i behov av sluten hälso- och sjukvård genomförs denna vid regionens sjukhus. Även i dessa fall skulle ökad elektronisk delning av information vara en fördel. Vid inskriv- ning för vård på sjukhus finns t.ex. behov av att kunna ta del av vilka aktuella läkemedel patienten är ordinerad. Sådan information skrivs i dag ut på papper tillsammans med remiss och skickas med patienten. På samma sätt måste information vid utskrivningen från sjukhus föras med tillbaka till SiS. Detta sker på papper och ibland till viss del muntligen. Budbärare av informationen är i många av dessa fall den medföljande personalen, och denna är som regel inte hälso- och sjukvårdspersonal. Ökad digital delning av information är därför även i dessa fall en önskvärd utveckling. En förutsättning är dock att skyddet för vissa uppgifter kan säkerställas enligt vad som angetts ovan.
Den fragmenterade vården, och att SiS tar emot ungdomar och klienter från olika delar av landet, gör sammantaget att SiS har ett behov av att kunna få tillgång till en mer komplett bild av en patients samlade läkemedelsbehandling som omfattar både läkemedel som förskrivs och sådana läkemedel som ordineras och som ska admini- streras av hälso- och sjukvårdspersonal. En sådan sammanställning skulle avsevärt förbättra patientsäkerheten. SiS ser också ett behov av att ha samlad tillgång till information om sådana ordinerade varor (medicintekniska produkter) som behövs för att patienten ska kunna tillföra läkemedel eller för egenkontroll av medicinering, t.ex. vid behandling av diabetes med insulinpump. Detsamma gäller ordine- rade specialdestinerade livsmedel till barn. I de fall regionerna har infört egna system för denna distribution kommer SiS inte kunna ta del av detta genom registret nationell läkemedelslista.
5.4.4Särskilt om hälso- och sjukvård inom Elevhälsan
Av 25 § skollagen (2010:800) framgår att det för eleverna i förskole- klassen, grundskolan, anpassade grundskolan, sameskolan, special- skolan, gymnasieskolan och anpassade gymnasieskolan ska finnas
Processer för en patients behandling med ordinerat läkemedel ... |
SOU 2025:71 |
elevhälsa. Elevhälsan ska främst vara förebyggande och hälsofrämjande. Elevernas utveckling mot utbildningens mål ska stödjas. Elevhälsans arbete ska bedrivas på individ-, grupp- och skolenhetsnivå och ske i samverkan med lärare och övrig personal. Elevhälsan ska vara en del av skolans kvalitetsarbete. Vid behov ska elevhälsan samverka med hälso- och sjukvården och socialtjänsten. För medicinska, psyko- logiska, psykosociala och specialpedagogiska insatser ska det finnas tillgång till skolläkare, skolsköterska, psykolog, kurator och special- pedagog eller speciallärare.
Varje elev i grundskolan, anpassade grundskolan och special- skolan ska erbjudas minst tre hälsobesök som innefattar allmänna hälsokontroller. Varje elev i sameskolan ska erbjudas minst två hälso- besök som innefattar allmänna hälsokontroller. Hälsobesöken ska vara jämnt fördelade under skoltiden. Eleven ska dessutom mellan hälsobesöken erbjudas undersökning av syn och hörsel och andra begränsade hälsokontroller.197
Varje elev i gymnasieskolan och anpassade gymnasieskolan ska erbjudas minst ett hälsobesök som innefattar en allmän hälsokon- troll.198 Elever som avses i 27 § skollagen får vid behov anlita elev- hälsan för enkla sjukvårdsinsatser.199
Utifrån ovanstående kan utredningen konstatera att elevhälsan har ett brett uppdrag som bara till en liten del omfattar hälso- och sjukvård. Eftersom elevhälsan bedrivs inom ramen för alla kommu- ners skolverksamhet och vid alla privata skolor är antalet vårdgivare stort.
Det saknas i dag en sammanhållande nationell aktör att föra dia- log med angående elevhälsans verksamhet och behov. Ansvaret hos huvudmännen delas ofta mellan enheter som hanterar skolfrågor och hälso- och sjukvårdsfrågor.
När det gäller frågor om läkemedelsbehandling och användning av medicintekniska produkter är detta inte en central del inom elev- hälsans verksamhet bortsett från ett område, vaccinationer. Elevhälsan ansvarar för att erbjuda elever vissa av de vaccinationer som ingår i de allmänna vaccinationsprogrammen och som administreras efter det att barnen har lämnat barnhälsovårdens ansvar (se vidare kapi-
19727 § första stycket skollagen (2010:800).
19827 § tredje stycket ovan nämnda författning.
19928 § ovan nämnda författning.
SOU 2025:71 |
Processer för en patients behandling med ordinerat läkemedel ... |
tel 9).200 Vad utredningen erfar avgränsas elevhälsans behov av upp- gifter kring påbörjade läkemedelsbehandlingar därför till just vacci- nationer. Det har inte heller framkommit några andra behov av in- formation om behandling med medicintekniska produkter i elevhälsans verksamhet.
200Elever i förskoleklass omfattas i dag inte av elevhälsans ansvar, men detta föreslås ändras (se även SOU 2024:2 Ett samordnat vaccinationsarbete – för effektivare hantering av kommande vacciner, s. 248 ff.)
6Betydelsen av en samlad bild av patientens läkemedelsbehandling och behandling med vissa medicintekniska produkter
I departementspromemorian Nationell läkemedelslista och efter- följande proposition beskrivs bakgrunden till inrättandet av det register som i dag är den nationella läkemedelslistan.1,2 Där redo- görs bl.a. för de utmaningar och behov som finns avseende samlad läkemedelsinformation. Det som där anges äger fortsatt relevans. I detta betänkande ligger tyngdpunkten på att beskriva de tillkom- mande informationsmängder som utredningen har att analysera.
I det här kapitlet beskrivs därför betydelsen av att ha tillgång till en samlad bild av en patients läkemedelsbehandling med fokus på läke- medel som överlämnas eller administreras i hälso- och sjukvården samt vissa medicintekniska produkter. I vissa delar är det dock svårt att utelämna beskrivningar av information om läkemedel och medi- cintekniska produkter som förskrivs på recept respektive hjälpmedels- kort.
Tillgång till samlad information om en patients läkemedelsbehand- ling och behandling med vissa medicintekniska produkter är viktig i olika vårdsituationer, inte minst i övergångar mellan olika vårdgivare. Detta lyfts bl.a. fram i den nationella läkemedelsstrategin för åren 2024–2026.3 I princip kan tre typsituationer avseende läkemedels- behandlingar identifieras där det är relevant att få tillgång till sam- lad information:
1Ds 2016:44 Nationell läkemedelslista.
2Prop. 217/18:233 Nationell läkemedelslista.
3Nationell läkemedelsstrategi 2024–2026, s. 8.
305
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
SOU 2025:71 |
–Pågående aktiv läkemedelsbehandling.
–Avslutad läkemedelsbehandling där det administrerade läkemed- let fortfarande utövar farmakologisk effekt, t.ex. depåbered- ningar av antipsykotika, infusioner mot osteoporos m.m.
–Avslutade behandlingar med ingen kvarvarande farmakologisk effekt. Historisk behandling som kan ha betydelse i en övergri- pande medicinsk bedömning.
Ytterst syftar ökad tillgång till patientinformation till att stärka patientsäkerheten till skydd för den enskilde. Utredningen har valt att belysa behovet och nyttan av sådan information ur tre perspektiv, för patienten, för hälso- och sjukvårdspersonalen samt för apoteksper- sonalen4. I den mån andra nyttor än de som direkt berör patientsäker- heten framkommer så kommer även dessa lyftas fram.
6.1Allmänt om behovet av och förutsättningarna att dela patientinformation
När legitimerad hälso- och sjukvårdspersonal dokumenterar i pati- entjournalen är syftet i första hand att bidra till en god och säker vård för den enskilde. Informationen i patientjournalen riktar sig främst till hälso- och sjukvårdspersonal som behöver information för patientens fortsatta vård och behandling. Det är inte alltid den fortsatta vården eller behandlingen sker på samma vårdenhet och hos samma vårdgivare där den påbörjades. Informationen måste i dessa fall följa patienten över vårdgivargränser, mellan huvudmän, för att den fortsatt ska vara tillgänglig för behandlande hälso- och sjukvårdspersonal. Detta gäller även information om läkemedels- behandlingar och användningen av, eller behandling med, medicin- tekniska produkter.
Av patientdatalagen (2008:355) framgår att patientjournalen även är en informationskälla för patienten själv.5 Patientjournalen innehåller dokumentation över bland annat vad som framkommit vid vårdkontakter och olika prov- och testresultat. Det kan vara svårt för patienten att komma ihåg allt som sades vid en vårdkontakt
4Utredningen har här valt att låta begreppet apotekspersonal omfatta hälso- och sjukvårds- personal som arbetar på öppenvårdsapotek.
53 kap. 2 § patientdatalagen (2008:355).
SOU 2025:71 |
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
och därför finnas skäl för denne att gå tillbaka till vad som införts i journalen kring detta. Informationen i journalen kan därför användas som ett stöd för patienten i dennes fortsatta egenvård. Det gäller inte minst när patienten ska utföra åtgärder på egen hand såsom att admi- nistrera läkemedel, använda medicintekniska produkter eller genom- föra andra ordinerade åtgärder som rehabiliteringsövningar m.m.
Patienten kan också genom patientjournalen ta del av behandling som ges av sjukvårdspersonal t.ex. vilka läkemedel som administre- ras i hälso- och sjukvården och varför. Att en patient förstår kopp- lingen mellan sin sjukdom och behandlingen kan vara avgörande för behandlingsresultatet och informationen i journalen kan bidra till den förståelsen.
6.1.1Patientrörlighet ställer krav på informationsutbyte
Dagens moderna hälso- och sjukvård är komplex och specialiserings- graden är hög. Det finns olika möjligheter och omständigheter som gör att patienter söker eller erbjuds vård utanför den egna regionen, till exempel vid behov av omedelbar vård, genom valfrihetssystem, vårdgaranti eller på grund av att vården är specialiserad. Nedan följer en närmare beskrivning av några sådana situationer.
Reglering som stödjer patientrörlighet inom Sverige
Om någon som vistas inom en region utan att vara bosatt där behöver omedelbar hälso- och sjukvård, ska regionen erbjuda sådan vård.6 Det kan handla om situationer när någon plötsligt drabbas av en skada, t.ex. i samband med en olycka, men det kan också handla om ett plötsligt försämrat eller uppkommet sjukdomstillstånd varvid vård behöver ges omedelbart när patienten exempelvis vistas i sin sommarstuga.
Av hälso- och sjukvårdslagen (2017:30) framgår att regionen ska organisera primärvården så att alla som omfattas av regionens ansvar för hälso- och sjukvård kan välja utförare av hälso- och sjukvårds- tjänster samt välja och få tillgång till en fast läkarkontakt (vårdvals- system).7 Av patientlagen (2014:821) framgår vidare att en patient
68 kap. 4 § hälso- och sjukvårdslagen (2017:30).
77 kap. 3 § första stycket hälso- och sjukvårdslagen (2017:30).
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
SOU 2025:71 |
som omfattas av en regions ansvar för hälso- och sjukvård ska få möjlighet att välja utförare av offentligt finansierad öppen vård inom eller utom denna region.8 I dag finns möjlighet i flera regio- ner för patienter att även kontinuerligt välja en viss utförare utan- för den egna regionen, s.k. listning. Det finns också flera vårdgivare som erbjuder öppenvård genom distanskontakt9 i egen regi eller utifrån avtal med en eller flera regioner.
En region får också i andra fall erbjuda hälso- och sjukvård åt den som omfattas av en annan regions ansvar för hälso- och sjuk- vård, om regionerna kommer överens om det, eller det är fråga om nationell högspecialiserad vård.10 Regionerna koncentrerar t.ex. viss vård som kräver särskild kompetens inom samverkansregionerna
i enlighet med vad som anges i hälso- och sjukvårdsförordningen (2017:80).11 Sådan regional specialisering och koncentration av vården är frivillig. Ofta handlar det om vård som ges vid ett eller flera av de sju universitetssjukhusen. Vård kan också ges som natio- nellt högspecialiserad vård.12 Med nationell högspecialiserad vård avses i hälso- och sjukvårdslagen offentligt finansierad hälso- och sjukvård som behöver koncentreras till en eller flera enheter men inte till varje samverkansregion för att kvaliteten, patientsäkerheten och kunskapsutvecklingen ska kunna upprätthållas och ett effektivt användande av hälso- och sjukvårdens resurser ska kunna uppnås.13 Det är Socialstyrelsen som beslutar om vilken vård som ska vara nationellt specialiserad och på hur många platser sådan vård ska ges.14
Även i situationer när en region normalt tillhandahåller vård inom ett visst område kan det förekomma att patienten får vård i en annan region. Regionen ska erbjuda vårdgaranti åt den som omfattas av regionens ansvar enligt hälso- och sjukvårdslagen. Vårdgarantin ska innehålla en försäkran om att den enskilde inom viss tid får
89 kap. 1 § patientlagen (2014:821).
9Med distanskontakt avses vårdkontakt i öppen vård där hälso- och sjukvårdspersonal och patient är rumsligt åtskilda, https://termbank.socialstyrelsen.se/?TermId=780, beslutad 2017.
108 kap. 5 § hälso- och sjukvårdslagen (2017:30).
113 kap. 1 § hälso- och sjukvårdsförordningen (2017:80).
12Se 7 kap. 5 § hälso- och sjukvårdslagen (2017:30).
132 kap. 7 § ovan nämnda författning.
142 kap. 1 § hälso- och sjukvårdsförordning (2017:80).
SOU 2025:71 |
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
1.kontakt med primärvården,
2.en medicinsk bedömning av läkare eller annan legitimerad hälso- och sjukvårdspersonal inom primärvården,
3.besöka den specialiserade vården, och
4.planerad vård.15
När en region inte når upp till stipulerade tidskrav för när vård kan erbjudas ska regionen se till att patienten får vård hos en annan vård- givare utan extra kostnad för patienten.16 För att ytterligare öka möjligheterna att få vård i tid har regeringen tagit initiativ till en nationell vårdförmedling.17 Genom att synliggöra var kapacitet finns
ilandet ska väntande patienter snabbare erbjudas vård.18,19 Reger- ingen har också nyligen tillsatt en utredning för att ytterligare stärka vårdgarantin.20
En patient kan också söka vård i andra läder och inom EES är sådan vård i vissa fall ersättningsberättigad. En patient har rätt till ersättning för kostnader som har uppkommit till följd av att patien- ten har tagit emot vård i ett annat land inom EES om patienten, när kostnaderna uppkom, tillhörde den personkrets för vilken Sverige är behörigt att meddela sådant tillstånd till vård utanför bosättnings- medlemsstaten som avses i artikel 20 i förordning (EG) nr 883/2004. Dessutom ska vården ha tillhandahållits av hälso- och sjukvårds- personal och patienten skulle haft rätt att få vården bekostad av det allmänna om den tillhandahållits i Sverige.21
Vad som ovan beskrivits avser offentligt finansierad vård. Vård kan även utföras i privat regi och vara privat finansierad. Det fanns t.ex. år 2022 omkring 760 000 privata sjukförsäkringar tecknade i Sverige.22 All vård inom sjukförsäkringar utförs av privata vårdgivare.
159 kap. 1 § hälso- och sjukvårdslagen (2017:30).
169 kap. 2 § ovan nämnda författning.
17Prop. 2023/24:100 2024 års ekonomiska vårproposition.
18Uppdrag att ta fram förslag till en nationell plan för nationell vårdförmedling (S2023/02117 [delvis]).
19Uppdrag att genomföra insatser som stödjer och stärker patienters möjlighet att få vård hos andra vårdgivare med kortare väntetider (S2023/02119 [delvis]).
20Dir. 2024:50, Bättre styrning för en tillgänglig och jämlik hälso- och sjukvård med god kontinuitet.
215 § lagen (2013:513) om ersättning för kostnader till följd av vård i ett annat land inom Europeiska ekonomiska samarbetsområdet.
22https://www.svenskforsakring.se/aktuellt/nyheter/2023/antalet-sjukvardsforsakringar- fortsatter-att-oka/, besökt 2024-05-07.
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
SOU 2025:71 |
Detta har betydelse vid informationsförsörjning då informations- tjänster som omfattar offentligt finansierad vård många gånger inte är tillgängliga för privat finansierad vård.
Hur omfattande är patientrörligheten?
Socialstyrelsen analyserade år 2018 patientströmmar genom upp- gifter från patientregistret. Uppgifterna baserades på data fram till och med år 2016. Patientregistret innehåller uppgifter från alla vårdgivare som bedriver sluten vård och öppen specialiserad vård enligt hälso- och sjukvårdslagen.23
I rapporten konstateras bl.a. att andelen utomlänsvård utgör unge- fär 6 procent av den slutna vården och 4,5 procent av den öppna specialiserade vården.24 Andelen varierar dock från 2 till 15 procent mellan olika regioner vad avser sluten vård och 2 till 13 procent avseende specialiserad öppenvård. Rörligheten tenderar att vara större i de regioner som saknar universitetssjukhus och mindre hos de som inom regionen erbjuder regionalt specialiserad vård.25 Det är också skillnader i vilken typ av vård som utförs som utomläns- vård. Vad avser sluten vård är de tre största områdena internmedi- cinsk vård, ortopedisk vård och kirurgisk vård som alla står för cirka 11 procent vardera. Vad avser öppen specialiserad vård utgörs de tre största områdena av ögonsjukvård (17 procent), ortopedisk vård (13 procent) samt internmedicinsk vård (6,5 procent).26 Enligt uppgifter till utredningen är en uppdatering av rapporten på gång men ännu inte tillgänglig.
Mer aktuella uppgifter från Sveriges kommuner och regioner
bekräftar bilden att merparten av vården vid sjukhus ges i den region där patienten är folkbokförd (se tabell 6.1). Man kan även av detta underlag notera en skillnad i regioner med universitetssjukhus där inflödet av patienter är något större från andra regioner. Skillnaden är störst i de mindre regionerna, där rörligheten inom t.ex. sjukvårds- region Mellansverige (sjuklövern) blir tydligare än storregionerna Stockholm, Skåne och Västragötalandsregionen. Uppgifterna om-
23För en beskrivning av patientregistret se t.ex. SOU 2024:57 Ett nytt regelverk för hälso- dataregister, s. 71 ff.
24Socialstyrelsen, 2018, Patientströmmar över landstingsgränsen, s. 17.
25A.a., s. 30.
26A.a., s. 25–26.
SOU 2025:71 |
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
fattar dock enbart offentliga aktörer och vård vid sjukhus och säger inte heller något om rörligheten mellan vårdgivare inom den egna regionen. Uppgifterna behöver därför tolkas med viss försiktighet.
Tabell 6.1 |
Patientrörlighet mellan regioner |
|
|
|
|
|
|
|
Region |
|
Antal besök inom |
Antal besök från |
Andel besök från |
|
|
|
regionen |
annan region |
egen region |
|
|
|
|
|
01 |
Stockholms län* |
2 811 624 |
126 819 |
95,7% |
03 |
Uppsala län* |
546 354 |
63 802 |
89,5% |
|
|
|
|
|
04 |
Sörmlands län |
676 929 |
17 908 |
97,4% |
05 |
Östergötlands län* |
818 062 |
51 310 |
94,1% |
|
|
|
|
|
06 |
Jönköpings län |
668 175 |
19 720 |
97,1% |
07 |
Kronobergs län |
354 037 |
12 149 |
96,7% |
08 |
Kalmar län |
|
465 282 |
12 256 |
97,4% |
10 |
Blekinge län |
|
276 596 |
6 739 |
97,6% |
|
|
|
|
|
12 |
Region Skåne* |
2 220 353 |
70 582 |
96,9% |
13 |
Hallands län |
|
413 140 |
20 472 |
95,3% |
|
|
|
|
|
14 |
Västra Götalands regionen* |
2 377 966 |
78 901 |
96,8% |
17 |
Värmlands län |
512 823 |
10 559 |
98,0% |
18 |
Örebro län* |
|
522 759 |
30 956 |
94,4% |
19 |
Västmanlands län |
566 812 |
10 610 |
98,2% |
|
|
|
|
|
|
20 |
Dalarnas län |
|
533 751 |
15 063 |
97,3% |
21 |
Gävleborgs län |
503 980 |
17 655 |
96,6% |
|
|
|
|
|
22 |
Västernorrlands län |
468 141 |
13 376 |
97,2% |
23 |
Jämtlands län |
250 347 |
4 592 |
98,2% |
24 |
Västerbottens län* |
489 243 |
37 068 |
93,0% |
25 |
Norrbottens län |
376 473 |
6 100 |
98,4% |
* Markerar region med universitetssjukhus.
Tabellen visar uppgifter över antalet besök eller vårdkontakter, akuta och planerade, inom öppen eller sluten vård vid sjukhus. Tabellen är uppdelad på antal besök eller kontakter genomförda av invånare folkbokförda i den egna regionen respektive i en annan region. Data är hämtade från SKR:s KPP-databas för år 2022. Tabellen saknar uppgifter om strömmarna i primärvård och säger inget om ”privat-privat” vård.
Socialstyrelsen publicerar årligen statistik över den nationellt hög- specialiserade vården. Eftersom sådan vård ges vid maximalt 2–3 sjuk- hus i landet per tillståndsområde innebär det att flertalet av de pati- enter som får sådan vård behöver få det i en annan region än sin hemregion. År 2023 fick 7 503 patienter nationellt högspecialiserad
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
SOU 2025:71 |
vård. Det är mer än en dubblering jämfört med år 2022 (3 348 pati- enter).27
Som konstaterats ovan finns också en rörlighet över landsgränser. Enligt uppgifter från kommissionen beviljades 11 623 ärenden om vård i andra EU-länder år 2020. De flesta, 7 496 ärenden, gällde vård i Spanien. Av samma rapport kan man också utläsa att det i 2 506 ären- den beviljades vård i Sverige för patienter från andra länder. Den abso- luta merparten av dessa var från Danmark.28 Även för dessa patienter finns ett behov av att kunna dela vårdinformation, fast inte bara mellan vårdgivare i Sverige, utan mellan vårdgivare i olika länder.
Det kan alltså konstateras att en stor del av vården sker i den region där patienten är folkbokförd. Men även om mycket av en- skilda patienters vård fortfarande sker inom en region och hos ett fåtal vårdgivare, går det inte att utgå ifrån att så alltid är fallet. Patient- registret som utgör källan till Socialstyrelsens rapport är inte hel- täckande. Registret innehåller inte uppgifter från primärvården och det går därmed inte att dra slutsatser avseende patientströmmar inom primärvården eller mellan t.ex. den regionala och kommunala vården. Utredningens frågeställningar handlar om möjligheter till informationsdelningen mellan olika vårdgivare. Därmed är det inte enbart av intresse att analysera rörligheten mellan olika huvudmän och geografiska områden. Även rörlighet mellan vårdgivare, som potentiellt använder olika vårdinformationssystem är av intresse. Förutom exemplet avseende informationsdelning mellan kommu- nala och regionala vårdgivare ovan är det därmed intressant att ana- lysera rörlighet mellan offentliga och privata vårdgivare inom vård- valet i en region och sätta detta i relation till möjligheten att dela information. Dessa uppgifter går i nuläget inte att utläsa av tillgäng- liga rapporter. Det finns även begränsningar i uppgifter avseende rörlighet kopplad till besök hos andra professioner än läkare.
Statistiken ovan säger inte heller något om omfattningen av vården eller hur stora informationsdelningsbehov som finns för patienterna. Både Socialstyrelsens rapport och uppgifterna ovan lämnar kunskaps- luckor avseende rörlighet, och därmed potentiella informationsdel- ningsbehov mellan t.ex. offentliga och privata vårdgivare som inte använder samma system, besök hos andra yrkesgrupper än läkare
27https://www.socialstyrelsen.se/kunskapsstod-och-regler/regler-och-riktlinjer/nationell- hogspecialiserad-vard/arlig-uppfoljning/, besökt 2024-11-18.
28Europeiska kommissionen, 2021, Data on patient mobility under Directive 2011/24/EU Trend report reference years 2018–2020, s. 34.
SOU 2025:71 |
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
samt mellan regional och kommunal vård. Patientsäkerhetsvinsterna för den enskilde med ökad möjlighet till informationsdelning mellan vårdgivare kan därmed fortfarande vara stora.
Konsekvenser av bristande informationsdelning
Ett exempel på när informationsdelningen inte fungerat beskrivs i en rapport från Haverikommissionen år 2023 där fördröjningen av vård i ett fall av bukspottkörtelcancer beskrivs.29 Det aktuella fallet involverade både flera privata vårdgivare utifrån en sjukförsäkring samt flera offentliga vårdgivare. Det inkluderade flera vårdnivåer (primär och sekundär vård) och vård i åtminstone tre regioner, vid två universitetssjukhus. Rapporten beskriver ett enskilt fall men det illustrerar ändå att vi i dag har ett komplext hälso- och sjukvårds- system där det finns ett stort behov av att dela patientinformation. Det som aktualiserades i Haverikommissionens utredning var brister i hur information delades, eller snarare inte delades, mellan vårdgivare. Den ökade patientrörligheten, sedd tillsammans med de långtgående konsekvenser som informationsbortfall och kommunikationsproblem mellan vårdgivare kan få för den enskilde patienten, medför att det finns ett stort behov av att på ett säkert sätt kunna dela information om en patients vård och hälsotillstånd såväl inom som mellan olika vårdgivare.
Sammanfattningsvis aktualiserar frågan om patientrörlighet om det i en vårdsituation är ändamålsenligt att endast kunna ta del av information från den egna vårdgivarens journalsystem rörande en viss patient.
6.1.2Flera vårdgivare flera olika patientjournaler
Som framgick inledningsvis ska det vid vård av patienter föras patient- journal.30 Ett mer utvecklat resonemang om patientjournalen finns i avsnitt 5.1. Där konstateras bl.a. att det inte ens inom samma vård- givare är säkerställt att det endast finns en patientjournal utan att journalhandlingar ofta samlas och avgränsas av ett it-system samt
29Statens Haverikommission, 2021, Tillbud till allvarlig olycka – fördröjning av vård vid en oklar förändring i bukspottkörteln för vilken behandling inleddes den 23 mars 2021, dnr O-10/21.
303 kap. 1 § patientdatalagen (2008:355).
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
SOU 2025:71 |
av hur vårdgivaren i övrigt har organiserat sin verksamhet. När flera vårdgivare involveras i vården av en patient, t.ex. som en konsekvens av patientrörlighet, ökar antalet verksamheter där det förs patient- journal. När dessa olika elektroniska patientjournaler inte hålls samman påverkar det möjligheterna att kunna följa patientens vård och att kunna ta del av relevant information vid uppföljning samt inför nya medicinska beslut och behandlingar. Även om det finns juridiska möjligheter att dela information mellan vårdgivare som använder olika vårdinformationssystem genom sammanhållen vård- och omsorgsdokumentation finns fortfarande tekniska och seman- tiska utmaningar i interoperabiliteten. Flera regioner väljer bl.a. därför att erbjuda andra vårdgivare att använda samma vårdinformations- system som regionen upphandlar genom s.k. optioner. Detta under- lättar informationsdelningen till viss del (se vidare avsnitt 7.2.1).
6.1.3EU-förordningen om det europeiska hälsodataområdet
Även på europeisk nivå har behovet av tillgång till fler uppgifter ur patientjournaler identifierats. Av skäl 19 till EU-förordningen om det europeiska hälsodataområdet framgår:
Att hälso- och sjukvårdspersonal i rätt tid får full tillgång till patienters patientjournaler är grundläggande för att säkerställa vårdkontinuitet, undvika dubbelarbete och fel och minska kostnaderna. På grund av bris- tande interoperabilitet kan dock hälso- och sjukvårdspersonal i många fall inte få tillgång till sina patienters fullständiga patientjournaler och inte fatta optimala medicinska beslut om deras diagnos och behandling, vilket innebär avsevärda kostnader både för hälso- och sjukvårdssyste- men och för fysiska personer och kan leda till sämre hälsoutfall för fysiska personer. Elektroniska hälsodata som görs tillgängliga i ett interoperabelt format och som kan överföras mellan vårdgivare kan också minska hälso- och sjukvårdspersonalens administrativa börda när det gäller att manuellt föra in eller kopiera hälsodata mellan elek- troniska system. Därför bör hälso- och sjukvårdspersonal ges tillgång till lämpliga elektroniska medel, till exempel elektroniska anordningar och portaler för hälso- och sjukvårdspersonal eller andra tjänster för tillgång för hälso- och sjukvårdspersonal, för att använda personliga elektroniska hälsodata när de utför sitt arbete. Eftersom det är svårt att på ett uttömmande sätt i förväg fastställa vilka data från befintliga prio- riterade datakategorier som är medicinskt relevanta under en viss vård- episod bör hälso- och sjukvårdspersonal ha omfattande tillgång till data.31
31Skäl 19 till förordningen (EU) om det europeiska hälsodataområdet.
SOU 2025:71 |
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
6.2Underlag för behovsanalysen
Utredningen har, förutom den dialog som kontinuerligt förts med utredningens expert- och sakkunniggrupp, även träffat berörda aktö- rer för att genom dialogmöten inhämta information om olika yrkes- gruppers behov av kunskap om att en patient har fått läkemedel admi- nistrerade i hälso- och sjukvården. Utredningen har även träffat ett flertal patientorganisationer för att få en förståelse för patientens even- tuella nytta av att hälso- och sjukvårdspersonal och apotekspersonal i olika situationer har möjlighet att inhämta sådan information.32
Utredningen har därutöver genomfört tre enkätundersökningar riktade till patienter, hälso- och sjukvårds- samt apoteksperso- nal.33,34,35,36,37 Undersökningarna genomfördes under april och maj månad år 2024. Undersökningen som riktade sig till hälso- och sjuk- vårdspersonal distribuerades genom olika kanaler till läkare38, sjuk- sköterskor och kliniska farmaceuter. Drygt 1 200 patienter, 310 läkare, 95 sjuksköterskor, 41 kliniska farmaceuter och 113 farmaceuter som arbetar på apotek besvarade enkäterna.
Undersökningen som riktade sig till patienter var av mer kvanti- tativ karaktär medan de övriga undersökningarna var kvalitativa. En- kätsvaren har sammanställts och bearbetats av utredningen. Under- laget ger en bild av hur de tillfrågade grupperna uppfattar framför allt informationsbehovet kring läkemedelsbehandlingar och använd- ningen av medicintekniska produkter. I analysen i avsnitten 6.3 till och med 6.5 har utredningen beaktat dessa underlag.
6.3Patientens behov av information
Det finns goda skäl för patienten att vara delaktig i sin vård och att ta del av information om sin behandling. En påläst och kunnig patient som är delaktig i sin vård kan bidra till hälso- och sjukvårdsperso-
32Protokoll från dialogmöte 2024-01-31 (Komm2023/00650/S 2023:09-16).
33Sammanställning av enkät till patienter (Komm2023/00649/S 2023:09-23).
34Sammanställning av enkät till vårdpersonal – läkare (Komm2023/00649/S 2023:09-20).
35Sammanställning av enkät till vårdpersonal – sjuksköterskor (Komm2023/00649/S 2023:09-21).
36Sammanställning av enkät till vårdpersonal – kliniska farmaceuter (Komm2023/00649/S 2023:09-22).
37Sammanställning av enkät till apotekspersonal (Komm2023/00649/S 2023:09-19).
38Enkäten har till huvuddel besvarats av allmänläkare vilket påverkar analysen och de slut- satser som kan dras av denna.
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
SOU 2025:71 |
nalens möjligheter att hjälpa patienten, eftersom patienten bättre kan förstå och förmedla relevant information om och kring sin sjukdom och behandling. En påläst och kunnig patient har också förutsättningar att ta ansvar för och utföra korrekt egenvård och ökar följsamheten till behandling. Med egenvård avses i detta kapi- tel en hälso- och sjukvårdsåtgärd som behandlande hälso- och sjuk- vårdspersonal har bedömt att en patient kan utföra själv eller med hjälp av någon annan.39 Betydelsen av patientens kunskap och delak- tighet i vården lyfts bland annat fram i en nyligen publicerad rapport av Världshälsoorganisationen.40 Patientens tillgång till information stärker patientsäkerheten när patienten med stöd av informationen kan delta i vården på ett sätt som inte hade varit möjligt utan tillgång till samma information.
6.3.1Behovet av information om läkemedelsbehandlingar patienten ansvarar för själv
Användning av läkemedel är en av flera behandlingsmetoder för att förebygga eller behandla sjukdom. Läkemedel kan även tillföras kroppen i syfte att återställa, korrigera eller modifiera fysiologiska funktioner genom farmakologisk, immunologisk eller metabolisk verkan. Läkemedel kan också användas för att ställa diagnos.41 Läke- medel administreras av sjukvårdspersonal i hälso- och sjukvården eller av patienten själv genom egenvård. Patienter har därför ett be- hov av att ta del av information om sin läkemedelsbehandling för att förstå helheten och så att rätt läkemedel används på rätt sätt för rätt ändamål.
Patienten har störst behov av information om läkemedel som patienten själv ansvarar för och använder
När en patient vet varför ett läkemedel har ordinerats och vad det förväntas bidra till i behandlingen ökar också sannolikheten för att patienten fullföljer och tillgodogör sig läkemedelsbehandlingen.
392 § lagen (2022:1250) om egenvård.
40Världshälsoorganisationen, 2023, Framework for meaningful engagement of people living with noncommunicable diseases, and mental health and neurological conditions (ISBN 978- 92-4-007307-4), s. 13.
41Se definition i 2 kap. 1 § läkemedelslagen (2015:315).
SOU 2025:71 |
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
Hälso- och sjukvårds- och apotekspersonal kan ge patienten stöd, men oftast är det patienten själv som, vid egenvård, måste hålla ordning på vilka läkemedel som ska tas, när de ska tas och hur. Om patienten inte klarar detta själv eller med stöd av anhöriga finns möj- ligheter till åtgärder såsom dosdispensering av läkemedel eller andra vård- eller omsorgsåtgärder. Det vore dock olyckligt om sådana, ibland resurskrävande åtgärder, behöver sättas in endast för att pati- enten inte kan få tillgång till tillräcklig eller korrekt information.
Läkemedel är ofta potenta och kan, rätt använda, vara skillnaden mellan liv och död. Tvärtom kan de också fel använda, och ifall det värsta inträffar, vara skillnaden mellan just liv och död. Lyckligtvis är det senare inte särskilt vanligt förekommande. Däremot före- kommer det oftare att patienter får andra, lindrigare, vårdskador på grund av felaktig läkemedelsanvändning som orsakas av t.ex. dubbel- medicinering, felaktigt administrerad dos eller att behandlingen inte avslutats i tid. En del av dessa skador hade sannolikt kunnat undvikas med korrekt information. Det är därför viktigt att en patient får för- utsättningar att använda sina läkemedel så som det är avsett. Detta innebär att patienten behöver veta vilket läkemedel den ska ta, varför och när den ska ta det och hur det ska användas. Det är också vik- tigt att patienten förstår det förväntade behandlingsförloppet och vet vilka eventuella tecken som ska föranleda ny kontakt med vården. När det uppstår frågor är det, bl.a. därför, viktigt att veta vem som är ansvarig för läkemedelsbehandlingen och ska kontaktas.
Informationsrelaterade risker vid patienters egen läkemedelsbehandling
Det finns uppenbara informationsrelaterade risker i läkemedels- användningen när patienten själv ansvarar för läkemedelsbehand- lingen. Dessa uppstår bl.a. eftersom en läkemedelsordination kan ändras eller avslutas utan att motsvarande recept makuleras eller ändras och att patienten därmed fortsätter använda ett läkemedel efter utsättning42 eller fortsätter använda läkemedlet i fel styrka eller dos efter en ändring. Även om ett eller flera recept makuleras kan det finnas läkemedel kvar hemma hos patienten. Dessa läke-
42Utsättning – avslutande av behandling med ett visst läkemedel, som beslutats av behörig hälso- och sjukvårdspersonal, https://termbank.socialstyrelsen.se/article.php?tid=365, beslutad år 2013.
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
SOU 2025:71 |
medelsförpackningar är märkta med den dosering och tänkta an- vändning som gällde vid expeditionstillfället. Detta kan leda till såväl dubbelmedicinering som över- eller underanvändning av ett eller flera läkemedel. Omvänt innebär inte ett slutexpedierat recept med automatik att en patient ska sluta använda läkemedlet. Det är tvärtom normalfallet att en kronisk behandling fortgår minst tre månader efter sista uttaget på apotek. Sedan behöver en förnyad medicinsk bedömning göras och ett nytt recept eventuellt utfärdas.
När öppenvårdsapotek lämnar ut läkemedel som förskrivits på recept ska läkemedelsförpackningen förses med en etikett på ett sådant sätt att etiketten finns kvar under hela användningstiden.43 På etiketten finns bland annat instruktioner som ska hjälpa patien- ten till en korrekt läkemedelsanvändning. Informationen hämtas från receptet. I praktiken är dock inte alltid informationen korrekt annat än vid första expedieringstillfället då patienten kan ha fått en senare muntlig justering av ordinationen vid en telefonuppföljning med hälso- och sjukvården eller att en dosjustering inte åtföljts av ett nytt recept. Den korrekta, aktuella ordinerade doseringen ska då återfinnas i den läkemedelslista som finns i patientjournalen hos den aktuella vårdgivaren.44 I den enkätundersökning utredningen genomfört riktad till patienter uppger 56 procent av de som svarat att apoteksetiketten utgör en informationskälla till hur ett läkemedel ska användas.45 80 procent anger också att de får information munt- ligt i hälso- och sjukvården.
För vissa offentliga eller privata vårdgivare med avtal enligt lagen (2008:962) om valfrihetssystem, ofta förkortad LOV, finns informa- tion från patientjournalens läkemedelslista tillgänglig och åtkomlig för patienten via e-tjänsten 1177 Journal.46 Denna lista ska spegla de aktuella läkemedelsordinationerna från patientjournalen. I den enkätundersökning utredningen genomfört uppgav 51 procent av respondenterna att de använde denna lista för information om sina receptförskrivna läkemedel.47 Om informationen inte finns tillgäng-
438 kap. 19–25 §§ Läkemedelsverkets föreskrifter (HSLF-FS 2021:75) om förordnande och utlämnande av läkemedel och teknisk sprit.
44Se 6 kap. 9 och 12 §§ Socialstyrelsens föreskrifter och allmänna råd (2017:37) om ordina- tion och hantering av läkemedel i hälso- och sjukvården.
45Sammanställning av enkät till patienter (Komm2023/00649/ S 2023:09-23).
46Detta gäller dock inte ungdomar mellan 13 och 16 år då dessa vare sig själva eller deras vårdnadshavare har tillgång till informationen utan särskilt beslut från vårdgivaren. Se även avsnitt 9.7.
47Sammanställning av enkät till patienter (Komm2023/00649/ S 2023:09-23).
SOU 2025:71 |
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
lig elektroniskt, eller patienten inte har tillgång till denna, riskerar den lista patienten eventuellt har fått utskriven i samband med tidi- gare vårdbesök att vara inaktuell tills det att en ny utskriven lista finns tillgänglig. En sådan lista ska också skrivas ut i samband med utskrivning från ett slutenvårdstillfälle.48 Riskerna med detta är i princip desamma som när informationen på recepten inte uppdate- ras eller recepten makuleras. Skillnaden är att listan från journalen helt saknar information om vad som faktiskt expedierats på apotek.
Genom det generiska utbytet på apotek kan det läkemedel som patienten erhållit i samband med receptexpediering ha ett annat namn, komma i en annan förpackning och ha ett annat utseende än det läkemedel som förskrivits. Ofta erhålls olika läkemedel vid varje expediering vilket inte ovanligt är fyra gånger per år, per läkemedel. Även information relaterat till det generiska utbytet kan bidra till informationsrelaterade risker då läkemedel många gånger hämtas ut på apotek innan det är helt slut hemma. Om patienten t.ex. sedan tidigare har ett läkemedel hemma med ett namn och vid en senare expediering får ett läkemedel vars namn avviker väsentligt finns risk att patienten uppfattar det som två separata läkemedel som båda ska användas och resulterar i dubbelanvändning. Apoteket ska vid utbyte förse förpackningen med en etikett där information om bytet tydligt framgår. Texten på denna etikett kan dock vara mycket liten och vara utformad på olika sätt. Det pågår arbeten med att ensa utform- ningen av substansnamn och hur utbytesetiketten ser ut för att för- enkla för patienten.49
Via tjänsten Läkemedelskollen (se avsnitt 4.2.1) på E-hälsomyndig- hetens webbplats framgår tydligt vad som senast expedierats. Det framgår även i listan med sparade recept som patienten kan skriva ut eller spara ner genom tjänsten. I den läkemedelslista som vården skriver ut från patientjournalen, eller som patienten kan ta del av via e-tjänsten 1177 Journal, anges däremot enbart det ordinerade läkemedlet. Information om utbyte saknas i i dag i ordinationslistan eftersom de olika ordinationerna saknar koppling till vad som faktiskt expedierats på apotek.
Genom att olika listor, och vad som framgår av förpackningarna, kan innehålla olika information om läkemedelsnamn och dosering
4811 kap. 7 § Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordina- tion och hantering av läkemedel i hälso- och sjukvården.
49Läkemedelsverket, 2024, Uppdrag att förbereda för att ett läkemedels substansnamn ska ingå i register och vid utskrift till patient, dnr S2023/01931, s. 15 och 18 f.
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
SOU 2025:71 |
måste patienten lägga pussel. Informationshanteringen stödjer inte patienten. Detta bekräftas av en del av de som svarat på utredningens enkät.50 I sammanhanget är det också av vikt att notera att även om viss information om ordinationer i dag är tillgänglig för patienten via 1177 Journal så är inte alla vårdgivare anslutna, och alla har i dag heller inte möjlighet att ansluta. De som är anslutna har inte heller anslutit alla system där det finns information om läkemedelsbehand- lingar.
Hur svårt informationspusslet är för patienten beror naturligtvis på hur många bitar det är att pussla ihop, dvs. hur många läkemedel patienten har att hantera och hur många olika listor som förekommer. Det är skillnader i hur många läkemedel olika patienter använder beroende på vilken eller hur många sjukdomar patienten har. Flest läkemedel används ofta av multisjuka, äldre personer som också ofta är både sköra och kan lida av kognitiv svikt. En rationell infor- mationshantering som kan utgöra ett stöd för patientens egen läke- medelsbehandling är därmed av stor betydelse för patientsäkerheten.
6.3.2Patientens behov av information om läkemedel som administreras av sjukvårdspersonal
Alla sjukdomstillstånd kan inte behandlas med läkemedel som patien- ten eller dennes anhöriga kan eller ska hantera själva. Det finns flera anledningar till att sjukvårdspersonal behöver administrera läkemedel. Viss läkemedelsbehandling sker i samband med sådan vård som måste ske på sjukhus, t.ex. läkemedel som används i samband med olika operationer eller i samband med intensivvård. Det kan också röra behandling där administreringen av läkemedlet kräver medi- cinsk övervakning av hälso- och sjukvårdspersonal eller där bered- ningsformen inte är lämplig för patienten, t.ex. i samband med vissa injektioner eller infusioner i specialiserad öppenvård. Det kan gälla t.ex. cancerbehandling eller behandling vid multipel skleros.
Det förekommer också sjukdomstillstånd där patienten både behöver läkemedel som måste administreras av vårdpersonal och förskrivna läkemedel som patienten kan hantera själv genom egen- vård, detta är inte helt ovanligt inom t.ex. cancersjukvården. Hur gränsdragningen sker mellan vad som förskrivs och vad som ”delas
50Sammanställning av enkät till patienter (Komm2023/00649/ S 2023:09-23).
SOU 2025:71 |
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
ut” på annat sätt skiljer sig också åt mellan olika vårdgivare. Det kan bl.a. därför finnas skäl för patienten att ha en överblick över behandling som omfattar flera läkemedel än de som förskrivs.
Läkemedel i samband med ett vårdtillfälle
Vårdtillfällen kan uppstå av flera olika anledningar och vilken typ av vård patienten får påverkar naturligtvis läkemedelsbehandlingen. Detta är viktigt att beakta då inte all läkemedelsbehandling som ges i samband med ett vårdtillfälle med nödvändighet är av betydelse för patienten att känna till i detalj i efterhand.
För tydlighetens skull ska det sägas att läkemedelsbehandling
bara är en del av alla de åtgärder som kan behöva genomföras under själva vårdtillfället men eftersom detta betänkande rör just informa- tion om läkemedelsbehandling och användningen av vissa medicin- tekniska produkter avgränsar utredningen beskrivningarna till detta.
Akut vårdtillfälle i samband med olycka
Vid t.ex. en trafikolycka påbörjas administreringen av läkemedel sannolikt redan på skadeplatsen. Det kan handla om bl.a. smärt- stillande läkemedel och vätskor som administreras genom injektion eller infusion för att lindra smärta och kompensera för blodförlust. Väl inne på sjukhuset kan patienten behöva genomgå kirurgi. Under ingreppet ges patienten muskelrelaxerande läkemedel och sövs med narkosgas. Om patienten är svårt skadad kan läkemedel som påverkar hjärtats kraft och blodtryck behöva injiceras. Ofta är dessa senare läkemedel kortverkande och doseringen justeras kontinuerligt ut- ifrån patientens tillstånd. Efter operationen kan vissa läkemedel sättas ut och beroende på den fortsatta vårdens karaktär kan kortverkande läkemedel för t.ex. hjärta och blodtryck fortsatt ges under intensiv- vård. Patienten kan också i samband med operationen ges antibiotika för att förhindra en postoperativ infektion.
Inom ramen för den fortsatta postoperativa vården administreras t.ex. läkemedel för smärtlindring och insättning av blodförtunnande läkemedel för att förhindra blodpropp och fortsatt antibiotikabe- handling genomförs. Efter några dygn kanske patienten återhämtat sig så bra att utskrivning är möjlig. Sådan läkemedelsbehandling som
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
SOU 2025:71 |
då ska fortsätta ordineras och förskrivs ofta på recept. Det kan handla om t.ex. fortsatt behandling med blodförtunnande läkemedel, fort- satt smärtlindring och eventuellt något läkemedel för att få igång motoriken i mage och tarm. Denna uppräkning är inte komplett och varierar beroende på typ av skada och skadans omfattning såväl som patientens övriga sjukdomar. Exemplet visar dock på hur kom- plex situationen är, och då har vi bara redogjort för delar av läkemedels- behandlingen och lämnat all annan behandling åt sidan. Liknande situationer kan uppstå i samband med akut insjuknande i sjukdom, även om skadan och åtgärderna då kan se annorlunda ut.
Utifrån det scenario som målas upp ovan är det sannolikt inte relevant för en patient att i efterhand kunna ta del av information om alla de läkemedel som denne fått administrerade. Särskilt sådana läkemedel som administreras under den akuta fasen eller själva opera- tionen kan vara av mindre relevans för patienten att känna till detal- jerna kring. Det handlar i exemplet ovan t.ex. om narkosmedel, smärt- lindring och sådana läkemedel som påverkar hjärta och blodtryck. Ofta är det läkemedel som har kort effekt och inte längre påverkar patienten eller dennes hälsa när patienten skrivs ut från sjukhuset. Det går dock inte att säga att det aldrig finns situationer då det är relevant eller patienter som har ett intresse av att få tillgång till samt- lig information. Särskilt om patienten reagerat med en överkänslig- het kan det kännas skönt att själv ha kontroll och kunna ta del av och för framtiden ha tillgång till sådan information. Andra delar av behandlingen, sådan läkemedelsbehandling som påbörjas i samband med den postoperativa vården och som i vissa delar kanske ska fort- sätta efter utskrivning kan det däremot finnas större skäl att få in- formation om. Vi återkommer till detta längre fram.
Försämrande av sjukdomstillstånd
Ibland händer det att en patient behöver skrivas in för vård på sjuk- hus på grund av ett sedan tidigare känt men försämrat sjukdomstill- stånd. Det kan t.ex. gälla en försämrad hjärtsvikt eller astma, svår- kontrollerad diabetes, progress i cancersjukdom eller försämrad psykiatrisk sjukdom. Eftersom läkemedel är en så vanlig behand- lingsmetod är det inte ovanligt att patienten redan behandlas med ett eller flera läkemedel. Patientens samlade läkemedelsbehandling
SOU 2025:71 |
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
behöver därför kartläggas. Är patienten över 75 år och är ordinerad fem läkemedel eller fler ska dessutom en enkel läkemedelsgenom- gång erbjudas vid bl.a. inskrivning i sluten vård.51
Vid vårdtillfället kan patientens läkemedelsbehandling behöva förändras. Det aktuella tillståndet kan kräva att ny behandling inleds som ska fortgå efter vårdtillfället samt att sedan tidigare behandling avslutas eller att dosen justeras. Det kan också förekomma att det görs uppehåll i vissa behandlingar, eller att ett läkemedel läggas till, enbart under själva vårdtillfället.
Läkemedelsbehandlingen kan bestå av både läkemedel som pati- enten vid utskrivning kan ta över och sköta själv eller sådana läke- medel som måste administreras, t.ex. genom injektion, av sjukvårds- personal. Ofta, men inte alltid, ansvarar vårdpersonalen för att patienten administreras samtliga läkemedel när patienten är inskri- ven, även sådana som patienten sedan tidigare varit ordinerad. Vissa läkemedel, t.ex. inhalationsläkemedel, kan dock patienten ta med sig och, efter bedömning, fortsätta hantera själv. Ett urval av olika situationer som kan uppstå illustreras i figur 6.1.
5111 kap. 3 § Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordina- tion och hantering av läkemedel i hälso- och sjukvården.
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
SOU 2025:71 |
Figur 6.1 Schematisk illustration över olika situationer i som kan uppstå med avseende på läkemedelsbehandling i samband med inläggning på sjukhus
Blå pilar avser behandling patienten sköter själv i hemmet. Grå pilar avser behandling som administreras av hälso- och sjukvårdspersonal. Heldragen pil avser kontinuerlig behandling. Streckad pil avser vid behovs-dosering
Vårdtillfälle
Läkemedel A
Läkemedel B
Läkemedel C
Läkemedel D
Läkemedel E
Läkemedel F
Läkemedel G
Källa: Omarbetad från Läkemedelsverkets rapport Rekvisitionsläkemedel i epidemiologiska studier, dnr 4.3.1-2019-096455.
När en patient skrivs ut från sjukhusvården är det viktigt att denne har en korrekt uppfattning av och förståelse för den planerade fort- satta läkemedelsbehandlingen. Viktigast är förstås en aktuell lista över de läkemedel som fortsatt ska användas och varför de ska an- vändas. Men det finns också skäl för den övergripande förståelsen att kunna ta del av vilka förändringar som skett och vad som admi- nistrerades och i vilken dos under själva vårdtillfället. Patienten kanske minns det där extra läkemedlet som gavs under vårdtillfället, men nu inte ska användas. Men hur var det egentligen? Och vilket läkemedel var det patienten skulle sluta ta? De gamla förpackning- arna med läkemedel, med påklistrad apoteksetikett, som användes före vårdtillfället finns också kvar när patienten kommer hem (se
6.3.1ovan). Både styrka och dosering kan ha förändrats. Socialstyrelsen föreskriver att om patienten fått en läkemedelsgenomgång vid vård- tillfället ska en läkemedelsberättelse med uppgifter om vilka ordina- tioner som har ändrats, vilka andra åtgärder rörande läkemedels-
SOU 2025:71 |
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
behandlingen som har vidtagits, och orsakerna till de vidtagna åtgär- derna upprättas i journalen.52 Vid utskrivningen ska det även finnas uppdaterade uppgifter i patientjournalen om målen för läkemedels- behandlingen, när uppföljningen av behandlingen ska göras, och vilken vårdgivare eller vårdenhet som ska ansvara för uppföljningen. Därut- över ska det finnas en uppdaterad läkemedelslista i patientjournalen.53 Utmaningen med de ovan angivna bestämmelserna är att de i dag är tydligt knutna till när en läkemedelsgenomgång enligt kapitel 11 i Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordination och hantering av läkemedel i hälso- och sjukvården ska genomföras, vilket alltså inte är kravställt för alla patienter. Där- emot finns fortfarande krav i föreskrifternas kapitel 6 som måste be- aktas. Det har till utredningen framförts av flera av experterna att dessa delar av föreskrifterna därför skulle behöva ses över så att be- stämmelserna blev mer ändamålsenliga (se även avsnitt 5.2.8). Om patienten får med sig information, t.ex. en läkemedelsberättelse eller läkemedelslista, är det sannolikt i form av en utskrift. Utskriften är statisk och stämmer överens med den information som i dag finns i den nationella läkemedelslistan över t.ex. expedierade läkemedel.
Även om vårdpersonalen vid varje vårdtillfälle ska gå igenom aktu- ell medicinering och vilka förändringar som gjorts kan man förstå att det i samband med vårdtillfället kan vara mycket annan informa- tion som patienten ska ta till sig. Möjligheten att gå tillbaka till doku- mentationen i lugn och ro i efterhand kan därför vara av stor betydelse för att behandlingen ska kunna utföras på rätt sätt och därmed und- vika vårdskador. Även en tydligare koppling mellan informationen i olika patientjournaler och den nationella läkemedelslistan skulle minska antalet risker kopplade till informationshanteringen. Detta styrks också av den enkätundersökning utredningen genomfört.54
Läkemedel i samband med specialiserad öppenvård
Det förekommer att patienter, förutom de läkemedel de använder själva, också har behov av ett läkemedel som ges regelbundet av vård- personal mot t.ex. en kronisk sjukdom eller cancer. Det kan t.ex. vara
5211 kap. 15 § Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordina- tion och hantering av läkemedel i hälso- och sjukvården.
5311 kap. 16 § ovan nämnda författning.
54Sammanställning av enkät till patienter (Komm2023/00649/ S 2023:09-23).
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
SOU 2025:71 |
en återkommande injektion med s.k. GnRH-analoger vid prostata- cancer, intravenösa järnpreparat vid järnbrist, depotneuroleptika vid psykoser, lipidsänkande behandling vid primär hyperkolesterolemi eller intravenösa bisfosfonater mot benskörhet. Dessa läkemedel är lika viktiga för patientens vård som en kontinuerlig läkemedelsbehand- ling som patienten hanterar själv, även om läkemedlen administreras mer sällan (se fig. 6.2 nedan). Utredningen har inte kunnat finna någon samlad information om hur inbokningen av dessa admini- streringstillfällen sker, om ansvaret vilar på den enskilde patienten, om den verksamhet som ordinerat behandlingen kallar patienten eller om det är situationsberoende. Utredningen kan dock konsta- tera att det i vissa fall delegeras från ordinerande läkare till sjukskö- terska att planera in och kalla patienten för administrering.
Figur 6.2 Schematisk illustration över läkemedelsbehandling genom egenvård och parallell administrering i sjukvården
Blå pilar avser behandling patienten sköter själv i hemmet. Grå pilar avser behandling som administreras av hälso- och sjukvårdspersonal. Pilspetsen symboliserar administreringstillfället Heldragen pil avser kontinuerlig behandling. Streckad pil avser vid behovs-dosering
Läkemedel A
Läkemedel B
Läkemedel C
Läkemedel D
Läkemedel som administreras i vården
Läkemedel som förskrivs
Läkemedel som förskrivs, vid behov
Situation: A – injektion som ges av vårdpersonal månadsvis men med kvarstående effekt, B och C
–kontinuerlig behandling, egenvård, D – vid behovsanvändning, egenvård.
Vid cancerbehandling är det inte ovanligt att cytostatika eller immun- terapier administreras av vårdpersonal samtidigt som andra läkemedel hanteras av patienten själv genom egenvård (se fig. 6.3). Beroende på vårdgivare förekommer det att de läkemedel som administreras peroralt, och patienten därmed kan hantera själv, förskrivs på recept, hämtas på mottagning eller tillhandahålls via vårdgivarens personal i samband med hembesök, t.ex. i samband med avancerad sjukvård i hemmet, förkortat ASIH. ASIH kan ibland utföras som en del i vårdvalet. Så är fallet i t.ex. Region Stockholm. När läkemedelsbe- handling som patienten sköter själv inte förskrivs på recept utan delas ut i samband med vård i hemmet uppstår en särskilt komplex
SOU 2025:71 |
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
situation kring i vilken lista, eller via vilken tjänst, patienten kan ta del av sin samlade läkemedelsbehandling. Enda sättet i dag för pati- enten att ha reda på detta är om den fått en uppdaterad lista utskriven från patientjournalen. Den lista som finns i registret nationell läke- medelslista omfattar inte de läkemedel som överlämnas av vården.
Det är inte heller säkert att dessa finns med i den lista över ordine- rade läkemedel som presenteras i e-tjänsten 1177 Journal.
Det förekommer också läkemedel som patienten endast ska an- vända vid vissa specifika situationer. Hit hör t.ex. receptförskrivna läkemedel som adrenalinpennor eller kortisontabletter mot kraftiga allergiska- eller anafylaktiska reaktioner, glukagon vid för lågt blod- socker eller läkemedel som enbart ska användas under en period då sjukdomen förvärras (t.ex. ett skov). Andra exempel på situations- styrd läkemedelsbehandling som administreras av hälso- och sjuk- vårdspersonal är t.ex. järninfusioner som ges vid låga järnnivåer utifrån laboratoriesvar eller symtomstyrda injektioner av det muskel- avslappnande medlet botulinumtoxin.
Figur 6.3 Schematisk illustration över läkemedelsbehandling
vid egenvård parallellt med och administrering i sjukvården vid cancerbehandling
Blå pilar avser behandling patienten sköter själv i hemmet. Grå pilar avser behandling som administreras av hälso- och sjukvårdspersonal. Pilspetsen symboliserar administreringstillfället Heldragen pil avser kontinuerlig behandling. Streckad pil avser vid behovs-dosering
|
kur 1 |
|
kur 2 |
…n |
|
|
|
|
Läkemedel A |
|
|
|
|
Cancerbehandling |
Läkemedel B |
|
|
|
|
|
|
|
|
|
Läkemedel C |
|
|
|
|
|
Läkemedel D |
|
|
|
|
|
|
21 dagar |
|
|
21 dagar |
|
Läkemedel E |
|
|
|
|
Annan behandling |
Läkemedel F |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Läkemedel som administreras i vården |
|
|
|
|
Läkemedel som förskrivs |
|
|
|
|
Läkemedel som förskrivs, vid behov |
Situation: A – cytostatika som injiceras av vårdpersonal en gång per behandlingscykel. B och C – pero- rala cytostatika som administreras i två respektive tre veckor per cykel. D – Oral behandling för behand- ling av illamående, vid behov. E och F. Annan parallell receptförskriven behandling. Läkemedel B -D delas i vissa regioner ut direkt från mottagning utifrån ordinationen utan att receptförskrivning sker.
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
SOU 2025:71 |
Information om behandlingar med potentiellt livslång effekt
Utvecklingstakten i hela hälso- och sjukvårdssektorn är hög vilket gör att nya behandlingsmetoder ständigt utvecklas. Det är därför vik- tigt att även beakta aspekter på behandlingar som i dag är relativt nya och än så länge inte används i så stor omfattning. Det som är nytt i dag är kanske etablerat på bredden imorgon.
Till ovan nämnda kategori hör avancerade terapier, ofta förkortat ATMP efter engelskans Advanced Therapy Medicinal Products. Inom denna kategori av läkemedel ryms behandlingar som baseras på celler, vävnader eller gener. De delas in i somatiska cellterapier, genterapier och vävnadstekniska produkter, samt kombinations- läkemedel som innehåller avancerade terapiläkemedel. Vissa av dessa behandlingar är unika på det sättet att de har potential att kunna ge upp till livslång och därmed botande effekt. Sådana läkemedelsbehand- lingar ges kanske endast en gång och dokumenteras då i den journal där administreringen genomförs. Ges sådan behandling till små barn eller nyfödda eller som foster är det inte säkert att de personerna kommer uppfatta sig som sjuka och inte heller ha vårdbesök senare i livet för den aktuella sjukdomen. Samtidigt kan det vara relevant att ha samlad dokumentation om sådana potentiellt livslånga behand- lingar. I vissa fall finns krav på att information i patientjournalen ska sparas längre än vad som normalt anges i patientdatalagen (se avsnitt 5.1.1). Man kan ur ett patientperspektiv se likheter mellan dessa behandlingar och vaccinationer. Det är behandlingar som sker sällan, eventuellt behöver ges flera gånger med många års mellan- rum och där det finns skäl att kunna bevara och för en patient att ha tillgång till informationen när man senare i livet söker vård.
Information om vaccinationer
En särskild grupp av läkemedel som administreras av hälso- och sjukvårdspersonal är vacciner. Vaccinationer genomförs som pre- ventiva smittskyddsåtgärder genom t.ex. nationella allmänna och särskilda vaccinationsprogram men även andra vaccinationer före- kommer som t.ex. vaccination inför resor eller mot fästingburen smitta. Ett längre avsnitt om vaccinationer och utredningens be- dömningar kring dessa behandlas närmare i kapitel 9.
SOU 2025:71 |
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
Det allmänna vaccinationsprogrammet genomförs huvudsakli- gen i barnaåren genom barnhälsovårdens och elevhälsans försorg. Särskilda vaccinationsprogram riktar sig till utpekade riskgrupper, vanligtvis bland barn eller äldre. Nationella vaccinationsprogram är kostnadsfria för patienten medan regionalt beslutade vaccinations- program kan vara helt eller delvis subventionerade. Andra vaccina- tioner får patienten oftast bekosta själv. Särskilt när det gäller vacci- nationer mot fästingburen smitta och resevaccinationer finns ett stort inslag av privata utförare.
Gemensamt för vacciner är att de efter genomgången grundim- munisering utövar sin effekt under lång tid. Vissa av vaccinationerna i det allmänna vaccinationsprogrammet ger ett livslångt skydd. Vissa vacciner kräver en påfyllnadsdos efter 3–5 år medan andra har ett avsevärt längre skydd.
Eftersom vaccinationer är något som sker sällan, och ibland när tillfälle ges vid t.ex. en vaccinationsbuss på en parkering, är informa- tionen ofta spridd över flera vårdgivare och journalhandlingar. Infor- mationen kan också vara flera år gammal. Det är därför särskilt ut- manande för patienten att ha en samlad bild över sina vaccinationer. Viss nytillkommen information finns att tillgå i t.ex. e-tjänsten
1177 Journal eller via andra system som tillgängliggör information via webben. Dessa system utbyter dock inte information med varan- dra så en samlad bild saknas. I den enkätundersökning som utred- ningen genomfört riktad till patienter lyfts vacciner fram som ett område där det särskilt efterfrågas en samlad information om vilka vaccinationer man fått och när.55 89 procent av de tillfrågade angav att det uppfattas som helt avgörande eller väldigt värdefullt att få tillgång till sådan information, dels för att veta vilket skydd man kan förväntas ha och för att veta när nästa dos ska tas. Det finns patientsäkerhetsaspekter både på att vaccinera sig för ofta eller för sällan. För ofta innebär risk för biverkningar medan för sällan innebär en uppenbar risk för smitta och sjukdom då skyddet inte är fullgott. Okunskap om dosintervallet kan därmed även innebära en falsk trygghet.
55Sammanställning av enkät till patienter (Komm2023/00649/ S 2023:09-23).
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
SOU 2025:71 |
6.3.3Patientens samlade behov av information om läkemedel
Det kan konstateras att det finns ett behov och en vilja hos patien- ten att kunna ta del av samlad information om sin läkemedelsbehand- ling, som inkluderar både förskrivna läkemedel och läkemedel som administreras i sjukvården. Detta styrks av den enkätundersökning utredningen genomfört där många ger uttryck för behovet av en samlad bild.56 Informationen behöver även omfatta läkemedel som ges inom kliniska läkemedelsprövningar (se vidare 6.4.1. nedan).
Samtidigt är det viktigt att förstå att alla patienter är olika. Alla patienter behandlas inte med läkemedel som både förskrivs på recept och sådana läkemedel som administreras av hälso- och sjukvårds- personal. Vissa personer har svårinställd behandling och läggs oftare än andra in på sjukhus. Andra patienter kan vara stabila i sin läke- medelsbehandling över lång tid och endast få läkemedel förskrivna. Någon kan drabbas av en olycka och behöva opereras akut men i övrigt vara helt frisk. Vissa får vård hos flera olika vårdgivare och rör sig över regiongränser. Vilken vård man har behov av styr därför patientens syn på behovet av information. Det kan också utläsas av enkätsvaren. Det är därför viktigt att inse att en specifik lösning inte kommer passa alla.
Registret nationell läkemedelslista kommer sannolikt, om det är uppdaterat med aktuell ordinationsinformation, kunna tillgodose mångas behov, men inte allas. Det är inte heller alla som vill använda e-tjänster. I patientenkäten framkommer t.ex. att många i första hand vill ha kontakt med sin behandlande läkare, men att det ibland kan vara svårt att komma i kontakt med vården och att e-tjänster då blir ett komplement. Vissa uppger att de enbart vill ha information från, och bedömning av, sin behandlande läkare. Särskilt tydligt var detta för patienter med njursjukdom. Andra menar att de genom att få tillgång till information om alla behandlingar genom e-tjänster i större grad kan ta ansvar för sin behandling och bättre kan ta till sig informationen i hemmet, i lugn och ro, efter ett vårdbesök. Flera lyfter fram frågan om olika läkemedelsbehandlingar passar ihop eller vilka biverkningar en behandling kan ge. Patienten kan också behöva ha tillgång till sin samlade läkemedelslista inför blodgivning (se även 6.4.1 nedan). Vissa ser möjligheten att kunna koppla en
56Sammanställning av enkät till patienter (Komm2023/00649/ S 2023:09-23).
SOU 2025:71 |
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
sammanställd lista till andra tjänster som t.ex. Fass för att enkelt kunna ta reda på biverkningar, även av sådana läkemedel som man fått administrerade av sjukvårdspersonal. Även kopplingar till till- gänglighet på läkemedel nämns. Patienterna ser därmed olika former av vidareutveckling av tjänster baserat på den information som kan hämtas ur journalerna. Då användandet av sådana tjänster helt är upp till patienten själv kan det inte enligt utredningen ses som pro- blematiskt ur ett integritetsperspektiv så länge informationen, när den kopplas mot tjänsten, har en tillräckligt hög grad av säkerhet.
Att behoven som beskrivs ovan ser olika ut behöver inte betyda att en vidareutveckling av den nationella läkemedelslistan är fel väg att gå. Vid en vidareutveckling blir det däremot viktigt att beakta de olika behov som finns hos olika patienter och inte tro att alla pro- blem löses med en och samma lösning. En ökad användning av e-tjänster, för dem som kan och vill, ökar patientens delaktighet och avlastar enligt utredningens bedömning sannolikt vården och frigör resurser för dem som behöver annan vård eller annat stöd. Det kan t.ex. gälla om patienten finner svar på en fråga om en läke- medelsbehandling som denne annars hade behövt kontakta vården för att få svar på. Möjligheten till tillgång till information från patient- journalen genom direktåtkomst har funnits sedan nuvarande patient- datalagen (2008:355) trädde i kraft år 2008. Regeringen menade bl.a. att patientens direktåtkomst till sina patientuppgifter bidrar till möjligheter att på ett bättre sätt aktivt delta i sin vård.57 Reger- ingen menade också att direktåtkomst skulle kunna vara ett sätt att låta journalen följa patienten genom att denne då kan låta en vård- givare som han eller hon besöker för första gången, ta del av upp- gifterna.58 Tillgång till information om ordinationer skulle dess- utom innebära att patienten får tillgång till den senaste och mest korrekta informationen om sin läkemedelsbehandling. Detta skulle vara av särskild betydelse för förskrivna läkemedel vid t.ex. dos- justering.
57Prop. 2007/08:126 Patientdatalag m.m., s. 158.
58A.a.
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
SOU 2025:71 |
Betydelsen av information om olika typer av läkemedel
Som framgått av avsnitt 6.3.2. ovan är det inte helt enkelt att av- gränsa vilka läkemedelsbehandlingar som administreras i hälso- och sjukvården som patienten har behov av information om. Det är en- ligt utredningen svårt att avgränsa både utifrån viss typ av vård eller läkemedlets indikation eller användningsområde. T.ex. kan det finnas läkemedel som används i anslutning till ett akut vårdtillfälle som är relevant att ha kännedom om samtidigt som det finns vissa läke- medel som det sannolikt finns mindre relevans att ha kännedom om. Som beskrevs ovan gjorde inte regeringen några tydliga avgräns- ningar avseende information i en patientjournal när man år 2008 möjliggjorde patientens direktåtkomst till patientjournalen. De av- gränsningar som infördes var för de fall det finns skäl att åberopa sekretess gentemot patienten själv.
I promemorian om en nationell läkemedelslista angavs två huvud- sakliga områden för vilka det i framtiden kan vara relevant att möjlig- göra tillgång till information om behandlingen. Det handlar om:
1.rekvisitionsläkemedel i öppenvården som har effekt över långt tid och därmed en utdragen interaktionsrisk och
2.rekvisitionsläkemedel i öppenvården som ingår i samma substans- grupper som motsvarande receptförskrivna läkemedel och där det kan bero på lokala terapitraditioner eller – om läkemedlen är medicinsk likvärdiga – upphandlingsrelaterade skäl vilket läke- medel som patienten i slutändan får ordinerat.59
Ur patientens perspektiv borde det enligt utredningens bedömning i första hand vara användningen av läkemedlen som står i fokus, dvs. att kunna använda de läkemedel man själv ansvarar för och att ha kännedom om vilka läkemedel man regelbundet får i hälso- och sjuk- vården. Att ha tillgång till information som behövs för att kunna ha en samlad bild av aktuell pågående läkemedelsbehandling.
59Ds 2016:44 Nationell läkemedelslista, s. 253.
SOU 2025:71 |
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
I dag finns olika listor över läkemedelsbehandlingar
När det gäller förskrivna läkemedel har det flitigt diskuterats vilken av de olika tillgängliga listorna som bäst löser patientens behov av information. Som konstaterades i 6.3.1 finns listor tillgängliga för patienten via sjukvården, E-hälsomyndigheten och apotek. Dessa kan vara både i elektronisk och fysisk form. Utredningen kan kon- statera att det i dag inte finns en komplett samlad lista någonstans. Informationen i den nationella läkemedelslistan, tillgänglig via E-hälso- myndigheten och apotek, omfattar endast förskrivna och expedie- rade läkemedel. Listan ser likadan ut oavsett om den skrivs ut via E-hälsomyndighetens tjänster eller via apotek. Information om ordinerade och i vården administrerade läkemedel samlas i patient- journalen och kan skrivas ut av varje vårdgivare eller, om informa- tionen tillhandahålls via 1177, hämtas via e-tjänsten Journalen. Viss information kan också ibland tillgängliggöras elektroniskt direkt via en vårdgivares system. Så är fallet med t.ex. vissa vaccinationer. Informationen från vårdgivarna är dock inte komplett då den inte omfattar information från alla vårdgivare eller alla vårdgivares samt- liga system. För förskrivna läkemedel innehåller listan i patientjour- nalen inte heller information om vad som expedierats. Det kan därför vara svårt att enbart utifrån listan över ordinerade läkemedel reda ut vilka läkemedel som en patient ska ta, när det ska ske och hur. Detta diskuteras vidare i 8.2.1. Det finns utifrån ovanstående ett behov av att vidareutveckla tillgången till information för patienten.
6.3.4Behovet av information om medicintekniska produkter
I jämförelse med läkemedel är som tidigare konstaterats medicin- tekniska produkter ett väldigt heterogent område. Antalet produk- ter är mycket omfattande i många olika kategorier (se avsnitt 5.3.1). I detta avsnitt behandlas endast sådana medicintekniska produkter som används av en enskild patient.
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
SOU 2025:71 |
Medicintekniska produkter som används tillsammans med läkemedel
Vissa patienter har fortlöpande behov av både medicintekniska pro- dukter och läkemedel för en effektiv och säker behandling. Det gäller t.ex. patienter med diabetes där det krävs injektionskanyler (medicinteknisk produkt) för insulinpennan (läkemedel, men där själva injektionspennan är en medicinteknisk produkt, se 5.3.1). Alla typ 1-diabetiker och många typ 2-diabetiker kontrollerar också regelbundet sina blodsockernivåer. I dag finns olika sätt att kon- trollera sockret men gemensamt är att kontrollen utförs med medi- cintekniska produkter. Historiskt har det vanligaste sättet varit s.k. kapillär blodsockermätning där patienten genom ett ”stick i fing- ret” applicerar en droppe blod på en teststicka som placeras i en mätare. Både lancetten för att ta hål i fingret, teststickan och mätaren är medicintekniska produkter. Lancetten och teststickan är dess- utom engångsartiklar, dvs förbrukningsartiklar, medan själva mätaren används under flera år. På senare tid har det blivit vanligare med alternativa mätmetoder, s.k. kontinuerlig blodsockermätning, endera i realtid eller intermittent. Det sker med hjälp av en tunn fibertråd (glukossensor) som förs in några millimeter under huden. Sensorn är en medicinteknisk produkt som byts var 5–14 dag beroende på typ av mätare. Sensorn kan sedan läsas av via t.ex. en app i en mobil- telefon. Även appar för detta ändamål är medicintekniska produk- ter. Exemplen ovan visar, utifrån en enskild patientgrupp, att många olika typer av medicintekniska produkter kan behöva användas i genomförandet och uppföljningen av en läkemedelsbehandling.
Vissa av produkterna ovan, de som är att betrakta som förbruk- ningsartiklar, kan förskrivas på hjälpmedelskort (se avsnitt 5.3.4). För diabetikern i fallet ovan är det kanske till och med fler medicin- tekniska produkter att hålla ordning på än själva läkemedlet. För dem som använder insulinpump blir antalet medicintekniska pro- dukter ännu fler. Det är viktigt att patienter får information om vilka medicintekniska produkter de ska använda, samt om när och hur de ska användas.
SOU 2025:71 |
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
Medicintekniska produkter som inte används tillsammans med läkemedel
Vissa patienter har behov av medicintekniska produkter, utan tydlig koppling till en läkemedelsbehandling. Det gäller t.ex. patienter med inkontinens eller stomi för vilka inkontinensskydd60 och stomimate- rial utgör medicintekniska produkter. Det finns många olika pro- dukter som också behöver utprovas noga för att passa varje patient. Information om vilken produkt som passar är därför viktig för pati- enten. Produkterna är också betydligt mer skrymmande än förbruk- ningsartiklarna för diabetiker.
Utöver vad som angetts ovan, där det handlar om behandling mot kroniska sjukdomar över längre tid, förekommer att patienter efter olika kirurgiska ingrepp behöver använda sårvårdsprodukter i form av plåster och bandage. Ofta appliceras dessa produkter i vården men de behöver bytas tills såret läkt. Ibland sker sådana byten på en vårdinrättning, t.ex. en distriktssköterskemottagning men kan också genomförs av patienten själv. Om informationen anses ut- göra väsentlig uppgift om vidtagna och planerade åtgärder ska den journalföras61, men om det görs sker sannolikt inte i en enhetlig och strukturerad form. I de fall patienten ska ansvara för att byta olika former av förband finns vad utredningen känner till i dag inget eta- blerat, strukturerat och enhetligt sätt att överföra information om vilka produkter som använts i vården till patienten. Det kan antas att produktnamnet noteras på en lapp eller så fotograferar patien- ten en kartong med sin mobiltelefon. Ibland kanske patienten får med sig viss materiel hem. När såret ska läggas om och materialet är slut kan patienten i dessa fall ha ett behov av att veta vilken pro- dukt som använts. Det kan tilläggas att sårvårds- och förbandsom- rådet är ett mycket omfattande område med en ständig produktut- veckling som för den oinvigde är svårt att navigera i och bedöma vilka produkter som är likvärdiga.
60Inkontinensskydd klassificeras som medicintekniska produkter i riskklass I enligt Guidance on classification of medical devices, MDCG 2021- 24.
61Se 3 kap. 6 § patientdatalagen (2008:355).
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
SOU 2025:71 |
Implantat
Den medicinska utvecklingen går tillsammans med den tekniska utvecklingen mycket fort framåt. Det möjliggör ständigt nya be- handlingar. Med den tekniska utvecklingen utvecklas också olika former av implantat. Inom ortopedin har man länge opererat in plattor, skruvar och spikar vid benbrott eller ersatt leder med pro- teser. Inom hjärtvården har man också under lång tid opererat in pacemakers för att påverka hjärtats egen rytm.
Även inom den estetiska kirurgin förekommer olika former av implantat. Implantat är sällan något som patienten kan eller behöver göra något åt själv, de sitter så att säga där de sitter. Det finns i dag däremot ingen samlad informationskälla över vilka implantat en patient har fått insatta och som riktar sig till patienten. Viss infor- mation för ett begränsat antal implantat finns i de s.k. uppmärksam- hetsinformationen i journalen (se vidare 8.7.3) vilken kan göras till- gänglig via e-tjänsten Journalen på 1177. Viss information förs också in i olika kvalitetsregister, men dessa är inte avsedda som informa- tionskälla för patientens vård och behandling.62 I artikel 18 i förord- ningen (EU) 2017/745 om medicintekniska produkter förutsätts att tillverkare tillsammans med implantat ska tillhandahålla implan- tatkort som gör det möjligt att identifiera produkten och som gör det möjligt för patienten att använda produkten på ett säkert sätt. När en medicinteknisk produkt har implanterats i en patient, ska en hälso- och sjukvårdsinstitution lämna information och implan- tatkortet försett med patientens identitet.63 Dessutom ska hälso- och sjukvårdsinstitutionen se till att patienten har tillgång till den information om implantatet som tillverkaren har tillhandahållit. Sådan information är t.ex. information om produktens förväntade livslängd och nödvändig uppföljning, bruksanvisningar och försik- tighetsåtgärder som ska vidtas vid interferens med yttre påverkan, medicinska undersökningar eller miljöförhållanden. Kortet är bra för patienten i situationer då det är viktigt att kunna förmedla infor- mation om sina implantat, t.ex. i samband med säkerhetskontroll vid resor, vid planerad utlandsvård eller om behov av hälso- och sjukvård uppstår i samband med t.ex. en inrikes eller utrikes resa.
62Se 7 kap. 4–6 §§ patientdatalagen (2008:355).
636 kap. 1 § Socialstyrelsens föreskrifter (HSLF-FS 2021:52) om användning av medicin- tekniska produkter i hälso- och sjukvården.
SOU 2025:71 |
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
Patientens behov av information om medicintekniska produkter
Eftersom förskrivningar av medicintekniska produkter generellt saknar användaranvisningar och fokuserar på valet av produkt och mängd har utredningen i den enkätundersökning som genomförts riktad till patienter ställt frågor kopplat till information för beställ- ning och distribution snarare än användningen av dessa produkter.
När det gäller medicintekniska förbrukningsartiklar kan utred- ningen konstatera att uppfattningarna om för- och nackdelar med olika beställnings och distributionssystem varierar. Patienter som använder förbrukningsartiklar som har nära samband med en läke- medelsbehandling verkar generellt sett se fler fördelar med distri- bution via apotek. För dessa patienter underlättar det om beställ- ning och distribution av förbrukningsartiklar och läkemedel kan ske samlat genom en och samma tjänst, även om undantag finns. Ur ett informationsperspektiv behöver då informationen finnas att tillgå via registret nationell läkemedelslista. Så är fallet när produk- terna förskrivs på hjälpmedelskort.
Patienter som använder stomi- eller inkontinensartiklar ser i stället fördelar med distanslösningar som innebär att de kan få en smidig leverans direkt hem eftersom dessa produkter är skrymmande. De är mer generellt negativa till att hämta produkterna fysiskt på apotek då de, förutom att vara skrymmande och svåra att få med från butik, ändå oftast inte finns i lager. Vilken aktör som de beställer genom och vem som sköter distributionen blir därmed av underordnat in- tresse. En smidig distributionslösning är viktigast. Generellt sett verkar dessa patienter mindre nöjda med distribution via apoteks- aktörerna. För beställning och distribution genom regionernas sy- stem behövs ingen information i registret nationell läkemedelslista. Däremot är det viktigt att patienterna vet var de får tillgång till in- formation om sina produkter. Några patienter menar att de inte har tillgång till sina ”förskrivningar” och därmed t.ex. saknar vetskap om hur mycket de har kvar att hämta ut innan de behöver ta kon- takt med vården för en ny bedömning och eventuellt ny förskriv- ning. Situationen kan variera mellan regionerna då de etablerat olika lösningar. Även om patienter med behov av förbrukningsartiklar för stomi och inkontinens generellt är nöjda med distributionen via regionerna uttrycker flera patienter problem med att regionerna
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
SOU 2025:71 |
upphandlar för snäva sortiment som inte kan anpassas till den en- skilde.
Patienterna ser också ett värde i att ha tillgång till information om sina implantat. I den enkätundersökning utredningen genom- fört lyfts både ett allmänt informationsbehov fram likväl som spe- cifika behov kopplade till säkerhetskontroller vid resor, akut vård i de fall man inte är kontaktbar, vid kognitiv svikt eller i anhörigvård. Även produktsäkerhetsrelaterade frågor som indragningar av spe- cifika tillverkningssatser nämns. Man uttrycker också ett behov av att informationen kan göras tillgänglig för andra vårdgivare i de fall dessa inte har tillgång till journalinformationen. Frågan om implantat besvarades också av förhållandevis många personer som inte har ett implantat men som lyfte fram önskan av att ha tillgång till sådan samlad information om de i framtiden skulle få ett implantat.
6.4Hälso- och sjukvårdspersonalens behov av information
I alla möten mellan patient och hälso- och sjukvårdspersonal krävs tillgång till information om t.ex. symtom, labresultat och effekter av tidigare behandlingsåtgärder för att göra rätt bedömningar vid utvärdering av tidigare insatser och inför nya beslut. Sådan informa- tion kan bl.a. fås genom samtal med och undersökning av patienten, men även genom patientjournalen och andra informationskällor t.ex. den nationella läkemedelslistan. Det är viktig för patientsäker- heten att informationsöverföringen fungerar och att man förstår vilken information man har tillgång till respektive inte har tillgång till. Betydelsen av att förstå informationslandskapet ökar när vi delar större mängder information. I de följande avsnitten beskrivs hälso- och sjukvårdspersonalens behov av information om en pati- ents läkemedelsbehandlingar och användning av medicintekniska produkter.
6.4.1Behovet av information om läkemedelsbehandlingar
Som konstaterats i avsnitt 5.2 ska det innan ett beslut tas om en ny eller ändrad läkemedelsbehandling alltid göras en lämplighetsbedöm- ning utifrån patientens behov. För att en sådan bedömning ska kunna
SOU 2025:71 |
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
göras krävs tillgång till information om bl.a. patientens hälsotill- stånd, sjukhistoria och resultat av laboratorieprover t.ex. för lever- och njurfunktion. Information om tidigare eller annan pågående läkemedelsbehandling, även sådan som administreras av sjukvårds- personal, är också viktig.
När en ny läkemedelsbehandling ska påbörjas är det viktigt att kunna bedöma om det föreligger kliniskt relevanta interaktioner mellan det påtänkta läkemedlet och redan pågående behandling. En sådan interaktion kan uppstå med ett annat förskrivet läkemedel eller ett läkemedel som administreras av vårdpersonal. Läkemedel som ordinerats för att administreras av vårdpersonal kan vara rele- vanta vid bedömning av risk för interaktioner, både utifrån att det administrerade läkemedlet har effekt under lång tid, och därmed kan interagera med det nyinsatta läkemedlet, eller att det är ordi- nerat sedan tidigare men är planerat att administreras längre fram och då kommer att kunna interagera.
Vid uppföljning och utvärdering av en behandling är det också viktigt att kunna ta del av vilka läkemedel en patient ordinerats så att uppföljningen görs utifrån rätt förutsättningar. En effekt eller bieffekt som patienten nämner kan t.ex. komma från ett helt annat läkemedel än det som är aktuellt för den nu aktuella åkomman. Listan av nu aktuella läkemedel behöver inte vara densamma som vid in- sättningstillfället då patienten kan ha fått annan vård och behand- ling insatt. Information om vilka läkemedel en patient ordinerats och använder är också en viktig del i läkemedelsgenomgångar.64 För hälso- och sjukvårdspersonalen är det ur ett informationsperspek- tiv inte lika relevant att dela upp behovet utifrån läkemedel patien- ten använder själv och läkemedel som administreras av hälso- och sjukvårdspersonal. Det är information om pågående läkemedelsbe- handlingar som står i centrum.
Olika behov av information i olika situationer
Som framgår av avsnitt 5.2 och 6.3 ovan ges läkemedel i många olika situationer. Det handlar om många olika typer av läkemedel, alltifrån sådana som verkar i endast ett fåtal minuter till dem som
6411 kap. Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordination och hantering av läkemedel i hälso- och sjukvården.
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
SOU 2025:71 |
har effekt under månader eller, kanske i framtiden vad gäller gen- terapier, under hela patientens återstående livstid. I vilket tidsper- spektiv ett läkemedel har effekt har naturligtvis stor betydelse för när det är relevant att ha information om detta vid framtida behand- lingsbeslut. Det är sannolikt av mindre vikt att vid t.ex. ett besök på reumatologen i dag ha information om vilken narkosgas patienten fick vid en operation förra månaden, eller hur mycket noradrenalin en patient tidigare fått för att hålla blodtrycket uppe under ett inten- sivvårdstillfälle. Däremot kan det omvänt vara av stor vikt att veta vilka läkemedel mot hypertoni en patient kontinuerligt använder65 när patienten ska opereras eller läggas in för intensivvård. Det som skiljer situationerna åt är tidsaspekten där kunskap om ett tidigare administrerat läkemedel med kort effekt kan vara mindre relevant vid ett senare vårdtillfälle, åtminstone vad gäller frågan om inter- aktioner.
Information om läkemedel med kortare effekt kan dock vara relevant i andra situationer t.ex. i samband med att en svårt sjuk patient flyttas mellan olika sjukhus. Information om en cancer- behandling som påbörjas vid t.ex. ett universitetssjukhus och ska fortsätta vid sjukhuset i patientens hemregion är också viktig att känna till. Vid dessa tillfällen är dock inte enbart information om läkemedelsbehandling viktig att ha kännedom om, men den utgör en viktig del.
I dag finns information om ordinationer i flera system
Inte ens i en enskild region eller hos en enskild vårdgivare är det säkert att alla läkemedelsordinationer samlas i en gemensam lista
i ett system. Detta gäller särskilt sådana läkemedel som administreras av hälso- och sjukvårdspersonal där det förekommer dokumenta- tion om ordinationer och administrerade läkemedel i olika specia- liserade system. Till exempel dokumenteras behandling med kon- trastmedel, och ibland även andra, t.ex. sederande, läkemedel inför radiologiska undersökningar i separata system. Det är inte med självklarhet som detta också förs in i en samlad lista i regionen. Mot- svarande gäller för t.ex. anestesi och onkologi där dokumentation
65Det räcker inte med att veta vad som är ordinerat. Om patienten inte använder ett ordi- nerat läkemedel riskerar en uppföljning av blodtrycket leda till en oavsiktlig justering till en högre dos när orsaken till problemet var att patienten inte använde läkemedlet som tänkt.
SOU 2025:71 |
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
av läkemedel ofta sker i separata system. Ett exempel är när patien- ter, som en del av en hematologisk cancerbehandling, behandlas med höga doser kortison. Det är då inte givet att denna information finns tillgänglig för all hälso- och sjukvårdspersonal som har behov av den, t.ex. när patienten söker vård för andra symtom som skulle kunna vara relaterade till kortisonbehandlingen. Cancerbehand- lingar består ofta av flera olika läkemedel där vissa administreras i hälso- och sjukvården medan andra förskrivs på recept. Dock gör regionerna här olika. Cancerbehandlingar har effekt över längre tid och information om pågående sådana är därför viktig att känna till när andra behandlingar sätts in eller ändras.
Läkemedelsbehandling vid inskrivning för vård
När en patient skrivs in för vård tar vårdgivaren över hela ansvaret för att patientens sedan tidigare ordinerade läkemedelsbehandlingar kan fortgå, utvärderas eller vid behov pausas eller avslutas. Det är då viktigt att kunna klarlägga vilka läkemedel en patient ordinerats och faktiskt använder. Om detta inte görs kan det få oönskade kon- sekvenser. Det kan exempelvis vara lika illa att under vårdtillfället ge ett läkemedel som patienten av någon anledning valt att inte använda som att helt missa att ge ett läkemedel. En sådan invente- ring måste omfatta både förskrivna läkemedel och sådana som admi- nistreras av sjukvårdspersonal. Även receptfria läkemedel, inklusive naturläkemedel, kan vara relevanta att ha kännedom om. Eftersom patienten kan ha fått vård hos andra vårdgivare är det inte säkert att heltäckande information finns i den egna vårdgivarens journal, sär- skilt inte om patienten skrivs in för regionalt specialiserad eller natio- nellt högspecialiserad vård vid ett universitetssjukhus utanför patien- tens hemregion. Dokumenterade läkemedelsordinationer ska hållas samlade i patientjournalen.66 Eftersom patienten kan ha journal- uppgifter dokumenterade hos olika vårdgivare, även inom en region, och alla vårdgivare inte delar sina journaler med andra vårdgivare, kommer det i dag inte alltid att finnas en samlad lista ens i en region.
666 kap. 12 § Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordi- nation och hantering av läkemedel i hälso- och sjukvården.
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
SOU 2025:71 |
Däremot finns de flesta ordinationer i vårdgivarens huvudsakliga67 journalsystem.
Registret nationell läkemedelslista är, trots att det i dag inte inne- håller uppgifter från ordinationer, en viktig informationskälla vid inskrivning för vård. Hur bra stöd som listan utgör är dock bero- ende av hur väl uppdaterad informationen i registret är. En dansk studie genomförd efter införandet av Fælles medicinkort visar att nio av tio patienter med polyfarmaci hade en eller flera avvikelser mellan informationen i läkemedelslistan och hur patienten faktiskt använde sina läkemedel.68 Drygt hälften, 53 procent, av avvikelserna orsakades av hälso- och sjukvården där bristande uppdateringar i listan bland allmänpraktiserande läkare var vanligast (65 procent). Samtidigt orsakades en tredjedel av avvikelserna av patienterna själva där 70 procent utgjordes av avsiktliga avsteg från ordinerad användning. Det senare visar betydelsen av att inte enbart använda listan utan också föra dialog med patienten. Risken är annars att man vid ett vårdtillfälle administrerar läkemedel i en avvikande dos eller ett läkemedel som inte använts alls. Av redovisningen av studien framgår också att antalet avvikelser mellan listan och hur en patient använder sina läkemedel ökar ju längre tid det gått sedan listan senast uppdaterades.69
Som angetts ovan är det inte enbart information om förskrivningar som är betydelsefulla vid inskrivning för vård. Även andra läkemedel som ordinerats för regelbunden eller framtida administration av sjuk- vårdspersonal kan behöva administreras under det aktuella vårdtillfället.
Information om vaccinationer
Även vårdpersonal har ett behov av information om genomförda vaccinationer. Enligt den rapport som E-hälsomyndigheten och Folkhälsomyndigheten tog fram år 2018 är hälso- och sjukvårds-
67Med huvudsakliga system avses här det system som ofta täcker merparten av verksam- heterna t.ex. Cambio Cosmic NCS Cross eller Millennium.
68Bülow C., Noergaard J.D.S.V., Faerch K.U., Pontoppidan C., Unkerskov J., Johansson K.S., Kornholt J., Christensen M.B., Causes of discrepancies between medications listed in the national electronic prescribing system and patients' actual use of medications. Basic Clin Pharmacol Toxicol. 2021 Sep;129(3):221-231. doi: 10.1111/bcpt.13626. Epub 2021 Jun 28. PMID: 34137181.
69A.a.
SOU 2025:71 |
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
verksamheterna eniga om behovet av ett digitalt vaccinationskort.70 Utredningen berör frågor om vaccinationer närmare i kapitel 9. Här nedan redogörs kortfattat för behoven.
När en patient uppsöker en vårdgivare för att bli vaccinerad är det, precis som vid ordination av andra läkemedel, viktigt att kunna ta ställning till tidigare givna vaccinationer. För att kunna göra detta behöver vårdpersonalen ha tillgång till information om vad som tidi- gare administrerats och när. En vaccination består ofta av en grund- immunisering och efterföljande påfyllnadsdoser. Tillgång till infor- mation om när grundvaccinationen, eller senaste påfyllnadsdos, genomfördes är av betydelse för om och i så fall när en ny dos ska ges. Det är inte givet att patienten inför en påfyllnadsdos uppsöker samma vårdgivare som för grundvaccinationen. Det är inte heller givet att patienten minns när senaste dos gavs eller har med sig ett utskrivet vaccinationskort. Information från andra vårdgivares pati- entjournaler är därför av betydelse. Både att ge ett vaccin för ofta eller för sällan kan innebära patientsäkerhetsrisker.
Läkemedel i kliniska prövningar
Innan läkemedel kan släppas ut på marknaden måste de godkännas. För ett sådant godkännande krävs underlag för bedömning av läke- medlets säkerhet och effekt. Sådan information fås bl.a. genom kli- niska läkemedelsprövningar.
Kraven på dokumentation under kliniska läkemedelsprövningar är omfattande. Sådan dokumentation behövs både för patientens vård, men även för själva prövningen som senare ska kunna ligga till grund för ansökan om ett godkännande. Så vitt utredningen erfar saknas undantag från kraven på dokumentation av ordinationer av läkemedel under klinisk prövning i Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordination och hantering av läkemedel i hälso- och sjukvården. Vad utredningen erfar är det dock olika hur dokumentation av läkemedel under klinisk prövning sker i patientjournalen, om det sker på samma strukturerade sätt som för andra läkemedel. Läkemedlen blir inte med säkerhet tillgängliga i den samlade läkemedelslista som finns i patientjournalen.
70E-hälsomyndigheten, 2018, Förstudie digitalt vaccinationskort – Återrapportering enligt regeringsbeslut S2019/03409/FS (delvis), s. 67.
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
SOU 2025:71 |
Informationen delas i så fall inte heller som läkemedelsordinationer mellan vårdgivare med stöd av sammanhållen vård- och omsorgsdoku- mentation. Detta är en patientsäkerhetsrisk. Ordination av läke- medel i kliniska prövningar berörs t.ex. inte i några fall av de rutiner eller riktlinjer som utredningen tagit del av om ordination av läke- medel.71,72 Information från en region gör dock gällande att man har särskilda mallar i läkemedelsmodulen för kliniska prövningar.73
En av de svårigheter som uppstår kring dokumentation av läke- medel i en klinisk prövning är att själva läkemedlet ofta ännu inte är godkänt och därmed saknas i de produktdatabaser som ligger till grund för den strukturerade dokumentationen. Därtill finns av natur- liga orsaker vissa utmaningar att applicera olika former av besluts- stöd på dessa produkter då den information beslutsstöden bygger på många gånger inte heller finns. Det finns sannolikt undantag från ovanstående då nya studier på ett sedan tidigare godkänt läkemedel genomförs. I det fall ett läkemedel inte finns i produktlistan kan i vilket fall den aktuella substansen dokumenteras.
Att i en sammanställning över patientens pågående läkemedels- behandling även kunna ta del av information om att patienten ingår i en klinisk läkemedelsprövning är av betydelse för patientsäkerhe- ten om patienten söker vård hos en annan vårdgivare. Eftersom in- formationen om läkemedlet, eller om patienten får placebo, är begrän- sad skulle t.ex. information om den aktuella studiens EudraCT/CTIS eller EU-nummer kunna dokumenteras. Transparensen kring läke- medelsprövningar är i dag stor och reglerad.74 Viss information om själva prövningen är tillgänglig genom publika databaser t.ex. EU Clinical Trials75 eller svenska Hitta Kliniska Studier76.
71Journalföring av läkemedelsinformation i Region Östergötland, dokumentnummer 18153, version 14.
72Ordination och hantering av läkemedel, riktlinjer och rutiner, Region Örebro län, doku- mentnummer 688488 R3.
73Samtal med Yvonne Pantzar, Region Jönköpings län, 2024-11-01.
74Se Europaparlamentets och rådets förordning (EU) nr 536/2014 av den 16 april 2014 om kliniska prövningar av humanläkemedel och om upphävande av direktiv 2001/20/EG.
75https://euclinicaltrials.eu/search-for-clinical-trials/, besökt 2024-10-31.
76https://www.hiks.se/, besökt 2024-10-31.
SOU 2025:71 |
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
Farmaceutsortiment
I avsnitt 4.4.8 beskrivs möjligheterna till ett framtida farmaceut- sortiment. Ett sådant sortiment skulle vara receptfritt men endast få säljas efter särskild rådgivning av farmaceut. Införande av ett så- dant sortiment skulle innebära att vissa i dag receptfria eller recept- belagda läkemedel i framtiden skulle få en ny klassning. Det är i dags- läget inte känt vilka läkemedel det skulle kunna handla om, dock finns sedan våren 2024 en nässpray för behandling av känd eller miss- tänkt opioidöverdosering hos vuxna, som är receptfri och endast får säljas efter särskild rådgivning från farmaceut. Eftersom dessa läkemedel, om systemet införs, kommer klassas som receptfria kommer de, i likhet med övriga receptfria läkemedel som inte för- skrivs, inte att registreras i den nationella läkemedelslistan. Läke- medelsverket har föreslagit tre kriterier för att kategorisering i far- maceutsortimentet; säkerhet, folk- eller djurhälsa samt miljö. Precis som för övriga receptfria läkemedel kan det finnas behov för vård- personal att känna till om patienten använder sådana läkemedel. Särskilt utmanande kan det vara om patienten är medvetslös eller av andra orsaker har svårt att förmedla vilka läkemedel den använder.
Läkemedel vid tandvård
Även tandläkare och tandhygienister har behov av information om en patients övriga sjukdomar vilket även inkluderar behov av infor- mation om pågående läkemedelsbehandling. Inför ett större ingrepp är det t.ex. relevant att ha kännedom om patienten använder blod- förtunnande läkemedel. Dessa är ofta, men inte alltid, receptför- skrivna. Det finns även andra fall där information om pågående läke- medelsbehandling är relevant att känna till, t.ex. behandling med läkemedel som ger biverkningar i munhålan77 eller läkemedel mot benskörhet som i vissa sällsynta fall kan leda till käkbensnekros. Läkemedel för behandling av benskörhet är ett exempel på en läke- medelsgrupp där vissa läkemedel förskrivs på recept och ges veckovis och andra administreras parenteralt mer sällan av vårdpersonal.
Tandläkare och tandhygienister har i dag, under samma förut- sättningar som övrig hälso- och sjukvårdspersonal med förskriv-
77Tricykliska antidepressiva läkemedel, som ibland även används för behandling av nerv- smärtor, ger t.ex. upphov till muntorrhet som kan påverka mun- och tandhälsan.
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
SOU 2025:71 |
ningsrätt, tillgång till informationen i registret nationell läkemedels- lista genom t.ex. tjänsten Förskrivningskollen. För information om läkemedelsbehandlingar som inte förskrivs är tandvårdspersonal
i dag hänvisade till att föra en dialog med patienterna, vilket fungerar bra så länge patienten har en god uppfattning om sin läkemedelsbe- handling, eller att kontakta berörda vårdgivare. Det är inte alltid pati- enten kan redogöra för aktuell läkemedelsbehandling och det kan vara svårt att veta vilken vårdgivare som ska kontaktas, inte minst i akuta fall. Det skulle därför vara av betydelse för patientsäkerheten om tandvårdspersonal kunde ta del av information ur en samlad lista.
Behov av information om läkemedelsbehandlingar i blodverksamhet
Inför blodtappning ska uppgifter hämtas in om blodgivarens hälsa och relevanta medicinska förhållanden samt om eventuella risk- händelser och riskbeteenden. Som en del i sådan hälsodeklaration efterfrågas bl.a. uppgifter om vilka läkemedel en patient använder. Uppgifterna ska hämtas in av hälso- och sjukvårdspersonal som har utbildning för och är bedömd som kompetent för uppgiften.78 Syf- tet med att inhämta uppgifterna är att säkerställa att blodgivningen kan ske säkert, både för blodgivaren och så att produkten är säker för mottagaren. Uppgifter om de läkemedel som blodgivaren använ- der, både receptbelagda och receptfria, måste uppges. Hälso- och sjukvårdspersonalen gör därefter en bedömning om det är säkert att lämna blod.
Personal på blodcentralerna, ofta biomedicinska analytiker eller sjuksköterskor, har i dag inte alltid tillgång till registret nationell läkemedelslista. Kvaliteten på de uppgifter som patienten lämnar är därför helt beroende av hur väl patienten själv kan redogöra för sin pågående läkemedelsbehandling. Det gäller såväl avseende receptfria läkemedel som patienten själv fattat beslut om att använda, förskrivna läkemedel och sådana läkemedel som ordineras och administreras av hälso- och sjukvårdspersonal. Vid oklarheter finns särskild utsedd personal med behörighet att ta del av uppgifter ur patientjournalen men precis som vad gäller övrig tillgång till uppgifter om läkemedels- ordinationer är detta avhängigt tillgången till alla de olika patient-
78Se 6 kap. 3 § Socialstyrelsens föreskrifter (SOSFS 2009:28) om blodverksamhet.
SOU 2025:71 |
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
journaler och journalhandlingar hos olika vårdgivare där uppgifter om ordinerade läkemedel kan förekomma. Enligt uppgifter till utred- ningen är de vanligaste avvikande svaren när blodgivare besvarar den obligatoriska hälsodeklarationen gällande läkemedel och utlands- resor.79 I dag saknas information i FASS och bipacksedlar om ett läkemedel är lämpligt eller inte i samband med blodgivning. Det gör att patienten inte själv kan avgöra om denne ska komma till blodgivning eller avstå. Blodcentralerna använder för sin bedöm- ning ett kunskapsstöd framtaget av en expertgrupp och som till- handahålls via Svenska blodalliansen.80
Det skulle enligt uppgifter till utredningen underlätta för per- sonalen på blodcentralen om de kunde få tillgång till uppgifter om en blodgivares samlade läkemedelsbehandling.81 Det skulle t.ex. kunna ske genom att personalen medges direktåtkomst till en natio- nell källa eller om patienten själv enkelt kan föra över eller koppla information från den nationella källan till sin hälsodeklaration. Efter- som det är frivilligt att lämna blod men att det i samband med detta finns krav på att uppge vissa hälsouppgifter torde sådan åtkomst kunna inrättas med en integritetshöjande åtgärd som samtycke.
6.4.2Olika yrkesgrupper har olika behov
Som beskrevs i avsnitt 6.2 har utredningen genomfört en enkätunder- sökning riktad till vårdpersonal. Nedan belyses några olika yrkes- gruppers olika synpunkter kring behoven av tillgång till information.
Läkare
Läkare uppger att de har ett stort behov av en samlad bild av en patients läkemedelsbehandlingar för att kunna ta ett helhetsansvar för patientens behandling.82 Om uppgifterna inte finns att lätt tillgå får de förlita sig på vad patienten kommer ihåg och kan redogöra för, vilket ibland ger en bristfällig bild, eller inhämta informationen på andra sätt. Ifall patienten sökt vård hos andra vårdgivare som
79Korrespondens med Beatrice Aspevall Diedrich, ordförande Svenska blodalliansen.
80https://transfusion.se/blodgivning/lakemedelslista/, besökt 2024-11-04.
81Korrespondens med Svenska Blodalliansen, Komm2023/00650/ S 2023:09-71.
82Sammanställning av enkät till vårdpersonal – läkare, Komm2023/00649/ S 2023:09-20.
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
SOU 2025:71 |
inte dokumenterar i samma instans83 av vårdinformationssystem beskrivs insamlandet som tidskrävande. Detta är en uppfattning som man delar med andra verksamheter t.ex. Kriminalvården och Statens institutionsstyrelse (se 5.4.2 och 5.4.3). Information om aktuell och pågående läkemedelsbehandling behövs framför allt för att undvika interaktioner, dubbelmedicinering och för att kunna bedöma biverkningar. Ibland är patienten i ett tillstånd som gör att det inte går att kommunicera. Ett exempel som lyfts fram är att det vid t.ex. en hjärnblödning är viktigt att känna till om patienten sedan tidigare är ordinerad blodförtunnande läkemedel. Andra exempel som tas upp är när patienten får parenteral behandling mot ben- skörhet på sjukhus och informationen inte finns tillgänglig i pri- märvården som då riskerar att sätta in och förskriva oral behandling. Ytterligare ett exempel är när immunmodulerande behandling ges inom onkologin och det inte är känt i primärvården men kan ha stor påverkan på patientens fortsatta vård och behandling. Även behandlingar med antibiotika som kan ges både parenteralt av sjuk- vårdspersonal eller hanteras oralt av patienten själv via förskrivning lyfts fram som centrala att ha kännedom om. Andra pekar på att det finns regionala skillnader för vissa läkemedel huruvida de för- skrivs eller tillhandahålls av vårdgivaren på andra sätt, där valet på- verkar huruvida informationen tillgängliggörs genom registret natio- nell läkemedelslista eller inte. Det finns även de som, när patienten flyttas mellan olika vårdgivare, ser ett tydligt behov av att få till- gång till information om aktuella behandlingar inom t.ex. högspecia- liserad vård.
Svårigheterna att få tillgång till information beskrivs som störst när patienten rör sig över vårdgivargränser, mellan t.ex. regioner, men även i de fall man inte använder samma vårdinformationssystem i primärvård som för sjukhusvård inom samma region. Även om regionerna genom kommande byten av journalsystem sannolikt överbryggar flera av dessa utmaningar kommer situationen att vissa specialiserade verksamheter arbetar i separata informationssystem likväl som svårigheter att utbyta information mellan vårdgivare i olika regioner att kvarstå.
Alla är dock inte odelat positiva över tillgång till mer informa- tion. Det finns de som uttrycker svårigheter med att dela för mycket information och ifrågasätter relevansen i att dela information om
83För en närmare förklaring av olika instanser av samma vårdinformationsystem, se 7.2.1.
SOU 2025:71 |
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
sådana behandlingar som sker i samband med t.ex. intensivvård och operation då dessa ofta saknar relevans utanför det aktuella vårdtill- fället. Vissa anser också att det är den samlade journalinformationen som är viktigast.
Sjuksköterskor
Även sjuksköterskor har behov av att ha tillgång till en samlad bild av patientens läkemedelsbehandling. Vissa sjuksköterskor har för- skrivningsrätt och behöver kunna bedöma sina ordinationer i relation till annan behandling och avgöra när de behöver involvera en läkare. Sjuksköterskor upplever i dag utmaningar i att utföra sitt arbete på ett patientsäkert sätt när tillgången till information kring olika be- handlingar varierar om patienter rör sig mellan olika vårdgivare med olika informationssystem.
Sjuksköterskan är ofta den som har till uppgift att, i hälso- och sjukvården, administrera ett läkemedel till patienten och är därmed direkt beroende av tillgången till korrekta läkemedelsordinationer. Sådana ordinationer kan ibland ha utförts av en annan vårdgivare.
Särskilt utmanande är situationen när patienterna rör sig mellan regio- nal och kommunal vård och informationen inte följer med, t.ex. när inte aktuella doser av insulin anges tydligt. Sjuksköterskor justerar även doser av vissa läkemedel vid t.ex. diabetes och hjärtsvikt. Då de inte har förskrivningsrätt kan denna information inte hängas upp på förskrivningar. Justeringarna görs i ordinationen vilket skapar ett behov av att kunna dela även denna information. Även bland sjuksköterskor finns uppfattningen att alla läkemedel inte är lika relevanta att ha information om t.ex. sådana läkemedel som ges under en begränsad tid under ett avgränsat vårdtillfälle av mindre betydelse att senare ha kännedom om.
Många vaccinationer både ordineras och administreras av sjuk- sköterskor, inte minst inom barnhälsovård och elevhälsa, varför tillgång till samlad information om tidigare givna vaccinationer är viktig, särskilt när barn flyttar mellan regioner. Sjuksköterskors rätt att ordinera vaccinationer framgår av 9 § Socialstyrelsens föreskrifter (HSLF-FS 2018:43) om behörighet för sjuksköterskor att förskriva och ordinera läkemedel.
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
SOU 2025:71 |
Kliniska farmaceuter
Kliniska farmaceuter deltar ofta i läkemedelsgenomgångar (se av- snitt 5.2.8) och behöver därmed en samlad bild av en patients läke- medelsbehandlingar oavsett om de förskrivs eller administreras i sjukvården. Även de kliniska farmaceuterna beskriver svårigheter att få en samlad bild över läkemedelsbehandlingen när patienten rör sig över vårdgivargränser eller när informationen dokumenteras i olika system hos samma vårdgivare och som inte direkt är samman- kopplade, t.ex. för cytostatika eller läkemedel för behandling av ben- skörhet. Om informationen är samlad på ett ställe blir det också enklare att använda olika former av besluts- eller analysstöd för att bedöma interaktioner etc.
De kliniska farmaceuterna ser också ett behov av att kunna in- hämta information om en patients faktiska läkemedelsanvändning då inte alla ordinerade läkemedel används eller inte används som ordinerat. Därutöver ser de ett behov av information om eventuella receptfria läkemedel som patienten använder.
6.4.3Behovet av information om medicintekniska produkter
Det finns bland vårdpersonal olika uppfattning om vilka medicin- tekniska produkter det finns behov av att ha kännedom om i patient- mötet. Av den enkätundersökning utredningen genomfört framgår att det framför allt finns ett behov av att få tillgång till information om vilka medicintekniska produkter en patient använder under lång tid. Respondenterna menar att informationen bidrar till en bild av patientens helhetssituation och ger en överblick av vårdbehov, utgör ett stöd när patientens minne sviktar, och är viktiga att ta hänsyn till när man bedömer vårdbehov och nya behandlingar. Respon- denterna exemplifierat med att om man får information om att pati- enten har en stomi säger det något om patientens situation. Informa- tionen om den medicintekniska produkten utgör därmed enligt utredningens bedömning en form av proxyvariabel. Det är enligt utredningen viktigt att komma ihåg att dessa proxyvariabler inte ger en helhetsbild, utan endast bidrar till den samlade bilden, och att det fortfarande kan finnas annan information som behövs när patientens vårdbehov ska bedömas.
SOU 2025:71 |
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
Det framkommer också ett behov av att ha kännedom om för- skrivna produkter när patienter akut behöver hjälp med att, efter bedömning, få nya förskrivningar utfärdade. Flera beskriver att patienterna ofta inte har den detaljkunskap som krävs kring exakt vilken produkt de använt tidigare för att kunna utfärda en ny för- skrivning. Det beskrivs också ett behov av att kunna bedöma vilka produkter som vid förskrivning passar med redan befintliga, en form av kompatibilitetsbedömning. Inte minst beskrivs behoven kring information om förskrivna produkter vara viktig för allmän- specialister och sjuksköterskor.
Bland de produktområden som bedöms viktiga att ha kännedom om förekommer andningsrelaterade hjälpmedel där dessa bl.a. måste passa till vissa specifika läkemedel t.ex. en specifik inhalator. Även produkter kopplat till syrgasbehandling i t.ex. hemmet tas upp. I sam- band med läkemedelsadministrering nämns produkter som behövs för att tillföra olika läkemedel samt olika former av läkemedels- pumpar. Information om att patienten matas via sond uppges också vara relevant att känna till för t.ex. valet av läkemedelsbehandling. Även stomimaterial och storlek på katetrar är sådant som efterfrågas, framför allt inför förskrivning eller utbyte. En produktkategori som många berör är implantat, se vidare särskilt avsnitt nedan.
Olika yrkeskategorier kan ha olika behov av information
Det är tydligt att behoven av information ibland är direkt relaterade till produkter men i andra fall handlar behovet av information om patientens tillstånd eller funktion. Vilket stomimaterial patienten använder är viktigt för sjuksköterskan som ska hjälpa patienten att prova ut och förskriva dessa produkter. För en läkare kan det i stället räcka med att veta att patienten har en stomi för att kunna göra vissa bedömningar kring patientens vård och behandling. Någon närmare information om produkterna behövs då inte. Precis som för läke- medel är det primärt informationen i journalen som är av intresse men att annan information från t.ex. förskrivningar är av värde, som komplement, när direktåtkomst till patientjournalen saknas.
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
SOU 2025:71 |
Alla ser inte ett tydligt behov
Det är precis som vad avser läkemedel inte alla som ser ett behov av tillgång till information om medicintekniska produkter. Vissa gör bedömningen att information om medicintekniska produkter utgör journalinformation och inte ska presenteras i en nationell läkeme- delslista över huvud taget. Andra uttrycker att om medicintekniska produkter ska inkluderas behöver det göras på ett pedagogiskt sätt så att man åstadkommer en tydlig och effektiv presentation av infor- mationen. Man framför också att tillägg av andra produktgrupper inte får försena införandet av information om läkemedelsbehand- lingar.
Implantat
I samband med vård förekommer det att medicintekniskt material eller produkter sätts in i kroppen. Information om att en patient har implantat är viktig för vårdpersonal att känna till. Det har bl.a. betydelse inför radiologiska undersökningar, operationer, bedöm- ning av infektioner och vid konstaterande av dödsfall och inför eventuell kremering.84 Sedan ett antal år tillbaka finns information om vissa implantat tillgänglig genom s.k. uppmärksamhetsinforma- tion i journalen och i den nationella patientöversikten, se vidare avsnitt 8.7.3.
I kodverkslistorna för uppmärksamhetsinformation finns tydliga motiveringar till varför information om de implantat som specifi- ceras är viktig.85 Flera av de patientsäkerhetsrisker som specificeras är vävnadsskador kopplade till magnetisk metall och magnetkamera- undersökningar. Detta gäller för flera av de specificerade implanta- ten. Patienter med en implanterbar defibrillator eller pacemaker har eller kan ha ökad risk för arytmier vilket är viktigt att känna till. Patient med mekanisk hjärtklaffprotes har ökad trombosbenägenhet. Det är därför viktigt med adekvat antikoagulantiaterapi, som i sin tur kan ge ökad blödningsbenägenhet. Patienter med dränage av cerebrospinalvätska kan få problem med avflödeshinder och förhöjt
84Sammanställning av enkät till vårdpersonal – läkare (Komm2023/00649/ S 2023:09-20).
85Kodverkslista – uppmärksamhetsinformation version 5.1, https://www.socialstyrelsen.se/globalassets/sharepoint- dokument/artikelkatalog/klassifikationer-och-koder/2022-6-8059-kodverkslista.xlsx, besökt 2024-04-08.
SOU 2025:71 |
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
intrakraniellt tryck. Patienter med trakealstent har ökad risk för infektioner och risk för skada vid intubation. Patienter med insulin- pump har en risk för såväl sänkt som förhöjt blodsocker.
De är långt ifrån alla implantat som tas upp i uppmärksamhets- informationen i dag. Socialstyrelsen listar ett tiotal olika typer av implantat. En slagning i Eudamed86 ger drygt 84 000 träffar på olika unika implantat.87 Socialstyrelsen har en process med tillhörande referensgrupp för uppdateringen. I den enkätundersökning som utredningen genomfört framkommer dock att uppdateringscykeln för uppmärksamhetsinformationen är för långsam och att det kon- tinuerligt lanseras nya produkter.88 Det finns exempel på andra im- plantat, som i dag inte inkluderas i uppmärksamhetsinformationen, där det är viktigt att känna till deras förekomst. Ett sådant exempel är användningen av konstgjord sfinkter vid urininkontinens. Det är på dessa patienter kontraindicerat att använda vanlig urinkateter varför det i akuta situationer är viktigt att känna till förekomst av den implanterade sfinktern.89
En annan orsak till att känna till förekomsten av implantat är att det när patienten söker vård för ospecifik feber är viktigt att veta om det finns ett implantat som kan vara infekterat med s.k. bio- film90,91 Det är också viktigt att vid konstaterande av dödsfall veta huruvida en patient har vissa typer av implantat, t.ex. pacemaker eller defibrillator. Dessa måste föras upp på dödsbeviset då de kan explodera vid kremering. Enligt enkätsvaren utgör sökandet efter information om pacemaker ett tidsödande jobb då det ofta rör pati- enter man inte känner, det kan ske under tidspress och det är inte alltid möjligt att leta i alla olika journalhandlingar. Informationen är lätt att missa, även om man vid en noggrannare undersökning kan palpera implantatet. Om denna information vore mer lättill- gänglig anses det kunna underlätta arbetet och göra det mer säkert.
Information om implantat är också viktig vid radiologiska under- sökningar. Vissa implantat är ferromagnetiska och kan därmed inne-
86För en närmare beskrivning av Eudamed, se avsnitt 8.7.2.
87https://ec.europa.eu/tools/eudamed/#/screen/search-device, sökkriterie produkttyp = implantat, sökning genomförd 2024-08-23.
88Sammanställning av enkät till vårdpersonal – läkare (Komm2023/00649/ S 2023:09-20).
89Västra Götalandsregionen, Vårdrutin AMS 800, SU9803-2137832294-78, version 6.0.
90Med biofilm avses tunna skikt av bakterier eller andra mikroorganismer på ytor i vatten eller andra våta miljöer där organismerna kan leva, t ex på medicinska implantat, på tandytor eller på båtbottnar i sjövatten, https://mesh.kib.ki.se/term/D018441/biofilms, besökt 2024-11-01.
91Sammanställning av enkät till vårdpersonal – läkare (Komm2023/00649/ S 2023:09-20).
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
SOU 2025:71 |
bära risker i samband med vissa radiologiska undersökningar då det skulle kunna leda till vävnadsskada. Även implantat som innehåller känslig elektronik kan vara av betydelse att känna till i dessa samman- hang då det kan få negativa konsekvenser och äventyra patientsäker- heten om dessa går sönder vid undersökningen. Det förekommer också situationer då implantatet i sig inte har betydelse för själva röntgenundersökningen men där valet och användningen av kon- trastmedel skiljer sig åt beroende på om man t.ex. har en höftprotes inopererad eller inte. Eftersom radiologiska undersökningar bl.a. utförs akut finns det risk att information som behövs inte finns i tillgängliga journaler.
Tillgång till information om implantat kan dock vara känslig, och i felaktiga händer användas för att skada. Den tidigare amerikanske vicepresidenten Dick Cheney valde t.ex. ett implantat som inte gick att koppla upp trådlöst för att undvika möjligheten att någon hackade implantatet och därigenom påverkade hans hälsa.92 När information samlas i ett register behöver även dessa säkerhetsrela- terade frågor beaktas.
6.5Apotekspersonalens behov av information
I öppenvårdsapotekens grunduppdrag ingår att verka för en god och säker läkemedelsanvändning genom att säkerställa att konsu- menten så snart det kan ske får tillgång till förordnade läkemedel och varor, ge sakkunnig och individuellt anpassad information och rådgivning, samt genomföra och upplysa om utbyte av läkemedel.93 Apoteken finns till för patienten och patientsäkerheten. Vid expe- diering av läkemedel ska en farmaceut göra en bedömning av om expedieringen är lämplig med hänsyn till den som receptet avser och dennes behov. Vid expediering av ett recept till människa ska vid bedömningen även patientens samtliga recept i elektronisk form samt information om expedierade läkemedel beaktas.94 Därutöver säljer apotek receptfria läkemedel och andra vårdrelaterade produk- ter, t.ex. medicintekniska produkter, för egenvård. Även vid sådan
92https://www.theguardian.com/world/2013/oct/19/dick-cheney-heart-assassination-fear, besökt 2024-06-25.
932 kap. 3 a § lagen (2009:366) om handel med läkemedel.
948 kap. 11 § Läkemedelsverkets föreskrifter (HSLF-FS 2021:75) om förordnande och utlämnande av läkemedel och teknisk sprit.
SOU 2025:71 |
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
försäljning ska apoteken ge råd enligt vad som framgår av 2 kap. 6 § 11 lagen (2009:366) om handel med läkemedel. Apotekens uppgifter utgår ifrån patientens behov och utgör en viktig del i patientsäker- heten. En farmaceut ska genomföra en helhetskontroll innan ett förskrivet läkemedel eller teknisk sprit konstateras vara färdigt för utlämnande och bekräfta detta med sitt signum på förpackningen.95 Med helhetskontroll avses en kontroll i slutskedet av en expediering som ska säkerställa att det läkemedel eller den tekniska sprit som ska utlämnas motsvarar det som förordnats samt att alla övriga upp- gifter som ska ingå i en expediering, fram till utlämnandet, har ut- förts på rätt sätt.96 Att en helhetskontroll har utförts ska dokumen- teras och bekräftas med signum.97 Om det i möte med patienten framkommer information om användningen av receptfria läkemedel som inte förskrivits men som har betydelse för den övriga behand- lingen får det förutsättas att apotekspersonalen även väger in detta i bedömningen.
I öppenvårdsapotekens grunduppdrag ingår bland annat att hjälpa patienten till korrekt läkemedelsanvändning. Bortsett från att apote- ken ska tillhandahålla patienten dennes förskrivna läkemedel och andra varor är farmaceuten på apotek, utifrån sitt ansvar och sin kompetens, en viktig länk mellan vården och patienten och för att stödja patienten i dennes läkemedelsanvändning. Farmaceuten ska vid expediering av ett läkemedel göra en lämplighetsbedömning en- ligt vad som angetts ovan, men även säkerställa att patienten kan använda sitt läkemedel på ett korrekt sätt. Farmaceuter träffar också ofta patienter med kroniska sjukdomar flera gånger mellan besöken i vården i samband med att patienten behöver hämta ut mer läke- medel. Därmed har farmaceuten stora möjligheter att fånga upp frågor och problem kring patientens läkemedelsanvändning som annars kanske inte kommer till vårdens kännedom. En utmaning för farmaceuterna kan dock vara att de saknar möjlighet att skrift- ligt överföra information från tillfälle till tillfälle då de inte för pati- entjournal. Ibland kan farmaceuten lösa frågorna och problemen tillsammans med patienten. Vid andra tillfällen behöver farmaceuten ta kontakt med vården (se även avsnitt 15.3.6) eller hänvisa patien- ten till ansvarig förskrivare. Att kunna svara på patientens frågor
95Se 8 kap. 31 § Läkemedelsverkets föreskrifter (HSLF-FS 2021:75) om förordnande och utlämnande av läkemedel och teknisk sprit.
961 kap. 7 § ovan nämnda föreskrift.
97Se 8 kap. 31 § ovan nämnda föreskrift.
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
SOU 2025:71 |
och att bidra till att lösa patientens läkemedelsrelaterade problem bidrar både till en bättre läkemedelsanvändning och till patientsäker- heten samt avlastar övrig hälso- och sjukvård.
Farmaceuten har också en viktig roll vid expediering av för patien- ten nya läkemedel. Dels behöver farmaceuten försäkra sig om att patienten har förstått hur denne ska använda sitt läkemedel, dels göra en bedömning av att förskrivningen är lämplig för den enskilda patienten. Detta görs både utifrån vad farmaceuten känner till om patienten och utifrån information om tidigare förskrivningar och uthämtade läkemedel. Farmaceutens roll är inte att ersätta förskri- varen i dennes ansvar för patientens behandling utan kompletterar denne utifrån sina ansvars- och kompetensområden i samband med expedieringen av en förskrivning. Farmaceutens kompetens utgör ett ytterligare stöd till patienten i dennes läkemedelsanvändning. Detta bidrar till att öka patientsäkerheten. Farmaceuten är ibland
i sitt arbete begränsad genom att denne inte har tillgång till all vård- dokumentation, men farmaceuten har tillgång till alla elektroniska förskrivningar och information om uthämtade läkemedel. Patienten är också, när denne själv hämtar ut sitt läkemedel, en viktig källa till information.
Som ett led i att utveckla apotekens roll ytterligare har Tandvårds- och läkemedelsförmånsverket haft i uppdrag att utreda möjligheten till ytterligare farmaceutiska tjänster.98 Två nationella försöksverk- samheter har genomförts, inhalationsvägledning och läkemedels- samtal.99 Myndigheten ska slutredovisa uppdraget i december 2024.100
6.5.1Farmaceuternas behov av information om patientens läkemedel
Tillgång till korrekt information om förskrivna och expedierade läkemedel i kombination med möjligheten att ställa frågor till pati- enten är avgörande för att farmaceuten ska kunna genomföra den lämplighets- och helhetsbedömning som ingår i dennes ansvar och för att kunna hjälpa patienten att använda sitt läkemedel på rätt sätt.
98Regleringsbrev för budgetåret 2021 avseende Tandvårds- och läkemedelsförmånsverket (S2021/00824).
99Tandvårds- och läkemedelsförmånsverket, 2022–2024, Försöksverksamhet med farma- ceutisk tjänst, tre delrapporter (dnr 782/2021).
100Regleringsbrev för budgetåret 2024 avseende Tandvårds- och läkemedelsförmånsverket (S2023/03257[delvis]).
SOU 2025:71 |
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
Farmaceuten har dock inte tillgång till patientjournaler och har där- med inte tillgång till information om ordinerade eller administre- rade läkemedel som ges av vårdpersonal i samband med en vård- kontakt. Som framgått inledningsvis i detta kapitel (se avsnitt 6.1) ges patienten läkemedel av vårdpersonal i många olika situationer.
Förskrivna läkemedel
En av öppenvårdsapotekens huvudsakliga uppgifter är att till- handahålla förskrivna läkemedel. För att kunna genomföra en säker receptexpediering, och bistå patienten med information kring läke- medelsanvändningen, är det viktigt att den information som öppen- vårdsapoteken har tillgång till är uppdaterad och korrekt.
Det kan inte nog understrykas att det är viktigt för nyttohemtag- ningen, både avseende patientsäkerhetsvinster och samhällsekono- miska effekter, att få den nationella läkemedelslistan att fungera så som det beskrivs i departementspromemorian Nationell läkemedels- lista.101 Det finns problem och risker kopplat till läkemedelspro- cessen så som den ser ut i dag. Många av dessa kan undanröjas om informationen i en förskrivning är uppdaterad och samstämmig med ordinationen och om antalet dubblerade och inaktuella förskrivningar i registret nationell läkemedelslista kan minimeras. Häri ligger sanno- likt de största vinsterna med nationella läkemedelslistan för alla in- volverade aktörer, dvs. patienter, förskrivare och farmaceuter. Ett exempel på när det finns många inaktuella recept uppges vara vid behandling av glaukom. Det är inte helt ovanligt att flera olika ögon- droppar prövas efter varandra innan rätt läkemedel identifieras för en enskild patient. Vid varje nyinsättning skapas ett nytt recept och vid expediering på öppenvårdsapotek behöver det senast utfärdade receptet identifieras eftersom gamla recept sällan makuleras. Apoteks- personal vittnar också om att de läkemedelslistor som tillhandahålls i vårdmötet har stora avvikelser mot de listor på recept som finns att tillgå vid expediering. Svenska vetenskapliga studier visar också på diskrepanser mellan information i patientjournalens läkemedels- listor och förskrivningar eller faktisk läkemedelsanvändning. I en studie genomfördes läkemedelsgenomgångar av en klinisk farmaceut för 405 patienter två veckor efter vårdbesök. Risken för läkemedels-
101Ds 2016:44 Nationell läkemedelslista, s. 186 samt s. 270 f.
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
SOU 2025:71 |
relaterad skada bedömdes därefter av läkare. I 72 procent av fallen fanns mer än en avvikelse i läkemedelslistan och patienter som genom- fört besök i specialiserad öppenvård hade i medeltal 4,5 avvikelser per patient. Av alla avvikelser bedömdes 18 procent respektive 2,5 pro- cent utgöra moderat eller hög risk för skada.102 I en annan studie där strukturerade intervjuer genomfördes på öppenvårdsapotek med 327 patienter över 18 år med fler än tre läkemedel analyserades infor- mationen i patientens lista över aktuella recept. Två tredjedelar av patienterna hade minst en avvikelse bland recepten.103 I en annan nyligen publicerad studie hösten 2024 har en patients uttag av läke- medel innehållande samma aktiva substans under en trettiodagars- period undersökts i en registerstudie. Andelen dubbla uttag har enligt studien ökat mellan år 2006 och 2021 och är nu 11 procent i åldersgruppen 65 till 79 år. Författarna menar att detta indikerar en stor risk för pågående dubbelanvändning.104
Enligt en studie från år 2014 som genomförts av Sveriges Apoteks- förening korrigerar öppenvårdsapotek varje år omkring 850 000 fel- aktigt förskrivna recept. Även om den siffran är en extrapolering från ett mindre urval visar den på att problemet är reellt, utgör en patientsäkerhetsrisk och att om recepten förskrevs korrekt från början skulle det spara tid både i vården och på öppenvårdsapotek.105
I den enkätundersökning utredningen genomfört framkommer generellt att apotekspersonal ser stora utmaningar kopplat till dubbel- förskrivning, att inaktuella recept inte makuleras när nya utfärdas, att ordinationsändringar inte speglas i patientens recept m.m.106 Eftersom apoteken inte har tillgång till läkemedelsordinationerna i journalen är det viktigt att informationen i förskrivningen och bakomliggande ordination stämmer överens. Om så inte är fallet har apotekspersonalen svårt att utföra sitt uppdrag och det finns risk att patienten därigenom också får felaktig information. Att
102Modig S., Caleres V., Milos Nymberg V., Petersson F., Lundstedt L., Lenander C., Assess- ment of medication discrepancies with point prevalence measurement: how accurate are the medication lists for Swedish patients? Drugs & Therapy Perspectives (2022) 38:185-193.
103Hammar T., Mzil L., Eiermann B., Discrepancies in patients' medication lists from pharmacies in Sweden: an interview study before the implementation of the Swedish National Medication List. Int J of Clin Pharm (2023) 45:88-96.
104Erhan T., Wastesson J.W., Fastbom J., Trends in Drug Duplications in Swedish Older Adults: A Nationwide Register Study from 2006 to 2021. Drugs Aging. 2024 Sep;41(9):775-
781.doi: 10.1007/s40266-024-01145-6. Epub 2024 Sep 13. PMID: 39269595; PMCID: PMC11408397.
105Ge apoteken större inflytande över läkemedelsrecepten, publicerad på Dagens Nyheter Debatt, 5 augusti 2014.
106Sammanställning av enkät till apotekspersonal (Komm2023/00649/ S 2023:09-19).
SOU 2025:71 |
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
kontrollera motsägelsefulla uppgifter är något som tar mycket tid i anspråk för apotekspersonal. Det saknas också i dag säkra digitala kommunikationsverktyg mellan apotek och vården vilket inte under- lättar kontrollerna. Frågan om säker och effektiv kommunikation mellan apotekspersonal och förskrivare har tidigare uppmärksam- mats i bl.a. den nationella läkemedelsstrategin år 2018. Frågan läm- nades till Läkemedelsverket att utreda vidare inom ett uppdrag att förebygga och hantera rest- och bristsituationer avseende läkemedel. Myndigheten bedömde nyligen i sin delrapport att former för hur kommunikation mellan farmaceut och förskrivare ska ske behöver diskuteras vidare mellan aktörerna och att den nationella läkemedels- strategin kan utgöra ett forum för sådan dialog. Utredningen kan därmed konstatera att frågan inte heller denna gång kommer att få sin lösning inom överskådlig tid (se även 15.3.6).107,108 Apoteksperso- nalen måste i stället lägga tid på att via telefon försöka nå aktuell förskrivare vilket inte alltid är möjligt. Patienten tvingas vänta, eller återkomma vid ett senare tillfälle vilket kan vara besvärligt för pati- enten och kan innebära långa resor och produktionsbortfall. Även vårdpersonal drabbas av detta genom att de får göra avbrott i sitt arbete med att ta hand om andra patienter för att tillsammans med apotekspersonal försöka reda ut oklarheter i förskrivningen. Det är inte heller lämpligt ur ett dataskyddsperspektiv att i register samla stora mängder inaktuella uppgifter. En välfungerande informations- process har stora vinster både på samhällsnivå och för individen.
De följande avsnitten ska läsas med utgångspunkt att den natio- nella läkemedelslistan i sin redan beslutade form kommer att imple- menteras och medföra de förväntade nyttorna.
Läkemedel som administreras eller överlämnas i samband med vårdtillfällen
Läkemedel administreras eller överlämnas av hälso- och sjukvårds- personal i många olika situationer. Som framgått i bl.a. avsnitt 6.3.2 ovan kan det vara i samband med ett akut, oplanerat eller planerat vårdtillfälle. Många akut- eller intensivvårdsläkemedel utövar sin
107Apotekarsocieteten, 2019, Slutrapport Nationell läkemedelsstrategi aktivitet 1.15 – Struk- turerad läkemedelsinformation från apotek till ordinatör.
108Läkemedelsverket, 2024, Uppdrag att förebygga och hantera rest och bristsituationer avse- ende läkemedel – Delredovisning, dnr 1.1.8-2023-040343, s. 40.
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
SOU 2025:71 |
effekt direkt efter administrering och elimineras ur kroppen inom minuter eller inom de närmaste timmarna efter administreringen. Detsamma gäller t.ex. narkosmedel. Sådana läkemedel bör enligt utredningens bedömning i princip sakna relevans för farmaceutens bedömning på öppenvårdsapotek eftersom de i de flesta fall inte riskerar att interagera med andra förskrivna läkemedel. Dessa läke- medel påverkar sannolikt inte heller patientens övriga läkemedels- användning. Detta bekräftas också av svaren i den av utredningen genomförda enkätundersökningen. I den mån patienten har frågor kring sin under vårdtillfället genomförda behandling är den bästa källan till information patientjournalen eller hälso- och sjukvårds- personalen på aktuell vårdenhet. Apotekspersonal kan också sakna aktuell kunskap om dessa läkemedel eftersom läkemedlen normalt inte förskrivs och expedieras på öppenvårdsapotek (se vidare 8.11.3).
Läkemedelsbehandling med längre effekt eller som ska fortgå efter ett vårdtillfälle
Alla läkemedel som administreras i samband med vårdtillfällen har inte en kort effekt och snabb elimination. Ibland kan patienten ordi- neras en eller flera behandlingar under vårdtillfället där denne, efter överlämnande, själv är delaktig i administreringen, t.ex. en tablett- behandling. Det förekommer även att sådana behandlingar ska fort- sätta efter utskrivning (se fig. 6.1). Om läkemedel administreras eller överlämnas vid ett vårdtillfälle och patienten sedan tidigare har flera läkemedel mot samma eller andra åkommor kan situationen snabbt bli komplex, och det kan uppstå många frågor i efterhand. Vilken tablett var det egentligen som jag fick på avdelningen? Varför fick jag den? Vilket läkemedel var bara tillfälligt? Ska jag fortsätta använda den här kapseln nu när jag också fick en injektion?
Den som ordinerat en läkemedelsbehandling har huvudansvaret för att informera patienten om behandlingen. Ofta sker det samtidigt med att patienten får en lista utskriven ur patientjournalen i sam- band med utskrivningen. En välinformerad, medveten patient kan i många fall göra rätt utifrån denna lista. Att det i vissa situationer ändå ofta uppstår oklarheter framgår av den enkätundersökning som utredningen genomfört. Det är inte heller konstigt eller ovan- ligt att frågorna uppstår på apoteket. Det kan vara mycket informa-
SOU 2025:71 |
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
tion som förmedlas vid själva vårdtillfället och det som just då verkar självklart kan ha fallit i glömska när läkemedlen ska hämtas ut.
Det kan också uppstå frågor i samband med att ett läkemedel ska hämtas ut på öppenvårdsapotek. När den nya informationen möter informationen från de gamla förskrivningarna kan oklarheter uppstå för patienten eller för expedierande personal på öppenvårds- apoteket. Frågor kan också uppstå i förhållande till informationen som påförts de läkemedelsförpackningar som patienten sedan tidi- gare har hemma. Öppenvårdsapotek har också en annan tillgäng- lighet än hälso- och sjukvården vilket kan bidra till att patienter ibland väljer att ställa frågorna där.
Farmaceuter saknar tillgång till information om läkemedel som administrerats i hälso- och sjukvården
I dag har farmaceuter på öppenvårdsapotek inte tillgång till infor- mation om vilka läkemedel som administrerats eller överlämnats till en patient i sjukvården i samband med ett vårdtillfälle. Om det upp- står frågor i samband med receptexpediering som relaterar till läke- medelsbehandlingen vid själva vårdtillfället kan farmaceuten inte svara på dessa om inte patienten också har med, och delar med sig av, en separat läkemedelsberättelse eller en utskriven version av den läkemedelslista som finns i patientjournalen.
Efter operation ordineras ofta patienter trombosprofylax som kan vara i injektionsform. Under vårdtillfället får patienten lära sig hantera läkemedlet så att patienten sedan själv kan administrera det. Vid hemgång har patienten påbörjat behandlingen, kanske fått med sig ett par sprutor som jourdos,109 och samtidigt fått ett recept för att hämta ut läkemedlet på öppenvårdsapotek. För en farmaceut på ett öppenvårdsapotek syns i dag endast information om förskriv- ningen. För att få en helhetsbild av behandlingen och dess längd måste farmaceuten förlita sig på dialogen med patienten eller dennes ombud. Det har t.ex. hänt att patienter vid hemgång fått ett recept förskrivet på en förpackning om 100 sprutor när patienten var ordi- nerad totalt 28 dagars behandling, varav ett antal doser redan hade administrerats under vårdtillfället. I ett sådant fall kan farmaceuten inte vid expedieringstillfället utifrån tillgänglig information säker-
109Se 3 kap. 1 § Läkemedelsverkets föreskrifter (HSLF-FS 2021:75) om förordnande och utlämnande av läkemedel och teknisk sprit.
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
SOU 2025:71 |
ställa att rätt mängd lämnas ut. Situationen blir helt avhängig hur tydligt receptet är formulerat och hur klar patienten eller dennes ombud är över situationen och kan tolka den av vården utlämnade läkemedelslistan. Farmaceutens möjlighet att bidra till en korrekt läkemedelsanvändning begränsas. Situationer som den ovanstående, och motsvarande för antibiotikabehandlingar, lyfts särskilt fram i de enkätsvar som utredningen fått.
Med korrekt information kan farmaceuten många gånger för-
klara sambandet mellan de faktiskt använda läkemedlen under vård- tillfället och de läkemedel som är aktuella för expediering eller som patienten haft tidigare. I fall som det som beskrivs ovan skulle till- gång till information om i vilket fall behandlingsstart och behand- lingens längd bidra till att genomföra en i förhållande till patientens behov korrekt expediering. I avsaknad av information måste farma- ceuten hänvisa patienten tillbaka till sjukvården. Möjligheter för farmaceuter att ta del av utökad information skulle kunna bidra till att öka patientsäkerheten och avlasta övrig hälso- och sjukvård. Det handlar inte om att ta över de uppgifter eller det ansvar som ankommer på förskrivaren eller annan hälso- och sjukvårdspersonal utan att, precis som vad avser förskrivna läkemedel, utgöra ett komplement och att kunna bidra till en bättre helhetsbild och ge större möjlig- het att stötta patienten i linje med det ansvar som redan åligger farma- ceuter på öppenvårdsapotek för att öka patientsäkerheten. Ett sådant stöd behöver inte alltid vara att besvara en fråga, utan kan också vara att bidra till att förtydliga frågeställningen och påtala vikten av och motivera patienten att ta kontakt med vården för att lösa frågan.
Läkemedel som administreras i öppenvård
Det är inte enbart i samband med vårdtillfällen när patienten är in- lagd på sjukhus som läkemedel administreras av sjukvårdspersonal. Patienter ordineras också läkemedel där de behöver få hjälp med administreringen, men där det inte krävs att patienten är intagen för vård i samband med detta. Ofta handlar det om läkemedel som inte kan tillverkas i en beredningsform som patienten kan hantera själv. Det kan också bero på att just den enskilda patienten inte be- dömts klara av att administrera det aktuella läkemedlet själv eller med hjälp av anhöriga. Sådana läkemedel som beskrivs ovan kan ges
SOU 2025:71 |
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
med varierande frekvens men har ibland effekt över längre tid, s.k. depotberedningar, och skiljer sig därmed från de akut- eller intensiv- vårdsläkemedel som beskrevs tidigare. Det förekommer också att t.ex. antibiotika ges parenteralt i öppenvård på infektionsmottag- ning när lämpliga beredningsformer saknas eller att cytostatika ges med viss regelbundenhet på onkologimottagning.
Läkemedel som administreras vid ovanstående vårdkontakter förskrivs oftast inte på recept utan tillhandahålls av vården i samband med administreringen, ofta vid ett besök på en mottagning på sjuk- huset, en vårdcentral eller i hemsjukvård. Det kan inte uteslutas att sådana läkemedel är av relevans vid den lämplighetsbedömning som farmaceuter på öppenvårdsapotek ska göra i samband med recept- expediering. Detta gäller särskilt läkemedel som finns kvar i kroppen och har effekt över lång tid. Enligt Läkemedelsverkets föreskrifter ska farmaceuten i sin bedömning av om en expediering är lämplig för patienten beakta bland annat elektroniska recept och uthämtade läkemedel, dvs. i praktiken det som finns registrerat i nationella läke- medelslistan.110 Den aktuella bestämmelsen grundar sig i att den in- formationen dels är lämplig att ta del av i samband med bedömningen, dels är information som finns tillgänglig för närvarande, inte att det skulle vara den enda och kanske mest optimala informationen att genomföra kontrollen utifrån. Utredningen känner inte till någon analys över förekomsten, eller konsekvenserna, av potentiella inter- aktioner mellan förskrivna läkemedel och läkemedel som ges av vård- personal.
Farmaceutsortiment
Läkemedelsverket har fått i uppdrag att utreda ett möjligt farma- ceutsortiment (se avsnitt 4.4.8 samt 6.4.1). I korthet innebär ett farmaceutsortiment att vissa läkemedel, som i dag måste förskrivas, ska kunna säljas på apotek utan att det krävs ett recept.111 Genom att i stället ställa krav på att rådgivning ges av farmaceut i samband med kundens köp skulle flera läkemedel på detta sätt eventuellt kunna göras tillgängliga som receptfria.
1108 kap. 11 § Läkemedelsverkets föreskrifter (HSLF-FS 2021:75) om förordnande och utlämnande av läkemedel och teknisk sprit.
111Läkemedelsverket, 2024, Uppdrag om farmaceutsortiment Slutredovisning från Läkemedels- verket, dnr 1.1.8-2023-041314.
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
SOU 2025:71 |
Ett utökat receptfritt sortiment, som innefattar läkemedel som tidigare krävt förskrivning av behörig förskrivare, innebär nya förut- sättningar på flera sätt. Det innebär bl.a. att den bedömning som tidigare gjorts av förskrivaren inför beslutet om förskrivning inte kommer att ha gjorts i samma utsträckning. Därmed kommer inte heller den bedömning av lämpligheten i förhållande till annan läke- medelsbehandling som framkommer av journalen att genomföras eftersom läkemedelsinköpet inte behöver ha föregåtts av att läke- medelsbehandlingen ordinerats av en förskrivare. Precis som vid annan försäljning av receptfria läkemedel kan det, vid försäljning av ett farmaceutsortiment, finnas ett behov för farmaceuter på öppen- vårdsapotek att ställa frågor om vilka andra läkemedel en kund an- vänder. Även användningen av sådana läkemedel som administreras av hälso- och sjukvårdspersonal kan påverka rådgivningen kring receptfria läkemedel. Det kan därför finnas skäl för farmaceuter på öppenvårdsapotek att, i samband med rådgivning kring ett särskilt farmaceutsortiment, ta del av information om andra läkemedel som ges till patienten regelbundet av sjukvårdspersonal.
Kommunikation mellan öppenvårdsapotek och vårdgivare
Ett område som återkommande tas upp, så även i den enkätunder- sökning utredningen genomfört, är möjligheten för apotekspersonal i de fall oklarheter uppstår effektivt kunna kommunicera med för- skrivaren, eller om förskrivaren inte är tillgänglig inom rimlig tid, någon annan behörig representant hos vårdgivaren112. Receptpro- cessen, så som datoriseringen av pappersblanketten är genomförd, erbjuder enbart envägskommunikation från förskrivaren till apoteket (se vidare avsnitt 15.3.6). Receptet förutsätts vara korrekt utfärdat. När oklarheter uppstår är aktörerna hänvisade till telefon, telefax eller brev. Öppen e-post uppfyller inte de krav på sekretess som föreligger. Det är ibland svårt att hitta ett korrekt telefonnummer och att få tag på den person som står bakom förskrivningen. Samma problem föreligger för förskrivare i kontakt med öppenvårdsapoteken. Ibland saknas särskilda telefonnummer för yrkesmässig kontakt och öppenvårdsapotek och förskrivare hänvisas till samma telefonnummer
112Om en förskrivare endast tillfälligt var verksam hos vårdgivaren eller om förskrivaren t.ex. har semester behöver vårdgivaren säkerställa att någon annan kan ta ansvar för den aktuella förskrivningen, se t.ex. 3 kap. 1–2 §§ patientsäkerhetslagen (2010:659).
SOU 2025:71 |
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
och telefonkö som patienter. Såsom beskrivits ovan leder svårig- heterna att kommunicera mellan apotekspersonal och förskrivare både till ineffektivitet och onödiga risker.
Även om en effektivare kommunikationslösning mellan öppen- vårdsapotek och förskrivare behövs, av flera skäl, så är det mest effektiva om alla parter kan göra rätt från början. För att underlätta är det också viktigt att man har tillgång till information och mandat att åtgärda så många problem som möjligt i varje möte med patienten.
6.5.2Farmaceuternas behov av information om medicintekniska produkter
Även om öppenvårdsapotek mest är förknippade med läkemedel hanterar de också en stor mängd medicintekniska produkter. Medi- cintekniska produkter ska vara CE-märkta men kräver inte förhands- godkännande för att släppas ut på marknaden, är inte receptbelagda som många läkemedel och kräver inte heller någon annan särskild beställning för att få utlämnas. De kan dock ibland förskrivas för vissa ändamål, ofta handlar det då om att kunna tillföra kroppen läkemedel eller för egenkontroll av behandling (se avsnitt 5.3.4). Förskrivning av medicintekniska produkter för utlämnande via öppenvårdsapotek syftar både till att patienten ska få den produkt förskrivaren avsåg och att patienten ska kunna erhålla kostnadsreducering i enlighet med vad som framgår av lagen (2002:160) om läkemedelsförmåner
m.m.Förskrivningen utgör dock inte någon förutsättning för att apoteket ska kunna sälja produkten.
På öppenvårdsapotek säljs också en mängd andra medicintekniska produkter, som inte kan förskrivas. Det handlar om alltifrån plåster till elektroniska blodtrycksmätare och självtester. Många av dessa pro- dukter är avsedda för egenvård för enklare åkommor men det före- kommer också mer avancerad sårvårdsmateriel som används efter kirurgiska ingrepp och ofta på sjukvårdens rekommendation.
Det krävs inte något tillstånd för att en handlare ska få sälja medi- cintekniska produkter113 vilket gör att de också kan säljas på andra försäljningsställen än öppenvårdsapotek. Däremot finns en praktisk begränsning i vilka medicintekniska produkter en patient kan hantera
113Undantag finns för sprutor och kanyler där handel ska anmälas till Läkemedelsverket och det finns restriktioner för hur man som konsument får köpa dessa produkter. Se bl.a. lagen (2012:595) om införsel av och handel med sprutor och kanyler.
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
SOU 2025:71 |
själv och därmed rimligen har ett intresse av att köpa. Även om det teoretiskt går att köpa implantat eller EKG-apparater så är möjlig- heten till användning för enskilda konsumenter kraftigt begränsad. Öppenvårdsapoteken har heller ingen skyldighet att tillhandahålla andra medicintekniska produkter än sådana förordnade varor som omfattas av lagen (2002:160) om läkemedelsförmåner m.m.
Av den enkät som utredningen genomfört framkommer att öppenvårdsapotekens behov av information om medicintekniska produkter i första hand avser sådana produkter som används till- sammans med en läkemedelsbehandling.
Förskrivna förbrukningsartiklar
Som redan konstaterats finns information om vissa medicintekniska produkter i den nationella läkemedelslistan. Det handlar om sådana förbrukningsartiklar som omfattas av förmånslagstiftningen och som förskrivs på hjälpmedelskort för utlämnande via öppenvårds- apotek. Öppenvårdsapotek behöver tillgång till uppgifter om dessa produkter för att kunna genomföra en expediering.
Som beskrevs i avsnitt 5.3.4 har flera regioner valt att helt eller delvis sluta förskriva förbrukningsartiklar för att i stället distribuera dessa genom egna kanaler. Av den enkätundersökning som utred- ningen genomfört framkommer att omständigheten att regionerna på detta sätt frångått den nationella infrastruktur som hjälpmedels- kort och förmånssystem utgjort på detta område, ibland orsakar problem för patienter och apotek.114
Ett problemområde som lyfts fram särskilt är att det i vissa fall är svårt att bedöma om patienten kan använda sina läkemedel som avsett när det saknas information om sådana förbrukningsartiklar som behövs för att tillföra kroppen läkemedlen, t.ex. injektions- sprutor, kanyler och masker till inhalatorer. Problemet beskrivs som särskilt stort i samband med e-handel eftersom patienten inte direkt kan tillfrågas vid en sådan beställning.
Problem uppstår också när patienter rör sig över gränser mellan kommuner och regioner som hanterar detta på olika sätt. Sådana situa- tioner uppstår t.ex. när patienten är på tillfälligt besök i en annan region än där patienten bor och akut får slut på en ordinerad, men
114Sammanställning av enkät till apotekspersonal (Komm2023/00649/ S 2023:09-19).
SOU 2025:71 |
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
inte förskriven, medicinteknisk produkt. Det finns då en risk att patienten inte kan besöka ett vanligt apotek och få hjälp, oavsett om patienten kan tänka sig att betala hela kostnaden själv. Persona- len på apoteket har inte tillgång till information om vilken produkt patienten har behov av om inte patienten själv kan redogöra för detta. Problemet gäller också omvänt då en patient med förskrivna för- brukningsartiklar besöker en annan region än hemregionen där den besökta regionen valt andra distributionslösningar. Öppenvårds- apotekens lager ska anpassas utifrån konsumenternas behov på den marknad som öppenvårdsapoteken verkar i syfte att så många kon- sumenter som möjligt ska kunna expedieras direkt.115 Apotek i dessa regioner har ofta anpassat sina lager efter befolkningens behov och lagerför inte varor som inte efterfrågas. Därmed kan det vara svårt att direkt få tillgång till den förskrivna varan. Regionens distribu- tionslösning innefattar vad utredningen erfar sällan möjlighet att handla i annan fysisk butik utan utgörs av olika distanslösningar. Om det fanns fysiska butiker, som inte är öppenvårdsapotek, skulle de i vilket fall inte kunna expediera förskrivna förbrukningsartiklar inom förmånen.
Utredningen kan konstatera att det faktum att alla inte använder den nationella infrastrukturen och därmed möjligheten till samman- hängande och lättillgänglig information på området försvårar för apotekspersonalen att hjälpa patienterna i dessa situationer.
Avancerad sårvård
Som beskrivs under avsnitt 6.3.4 kan det finnas situationer när pati- enter själva behöver köpa mer avancerade sårvårdsprodukter på öppenvårdsapotek efter kirurgiska ingrepp. I dessa fall har omlägg- ningen av såret sannolikt från första början skett av sjukvårdsper- sonal men det saknas ofta information om vilka produkter som använts. Apotekens rådgivning och förmåga att hjälpa patienten skulle sannolikt kunna förbättras om de hade tillgång till bättre information om vilka sådana produkter som rekommenderats och använts.
Som beskrivs närmare i avsnitt 8.7.2 saknas i dag en nationell pro- duktkatalog över eller klassificeringssystem för medicintekniska
1152 kap. 3 a § lagen (2009:366) om handel med läkemedel.
Betydelsen av en samlad bild av patientens läkemedelsbehandling ... |
SOU 2025:71 |
produkter vilket också försvårar för apotekspersonalen att hjälpa patienten att hitta rätt produkt.
6.6Statliga vårdgivares behov av information om läkemedelsbehandlingar
Även statliga myndigheter har behov av att ta del av information om behandlingar med läkemedel och medicintekniska produkter. Myndigheter som är vårdgivare och som har behov av uppgifter i primäranvändningsyfte har exemplifierats i avsnitt 5.4.
7Möjligheter att elektroniskt dela information om fler läkemedelsbehandlingar och användningen av medicintekniska produkter
Som framgår av avsnitt 4.2.7 framfördes år 2017 kritik mot att lagen om nationell läkemedelslista begränsades till förskrivna och på apo- tek uthämtade läkemedel samt att den helhetsbild som i princip alla aktörer är överens om behövs inte kunde infrias. Den information aktörerna ansåg saknades och som också efterfrågades var informa- tion om behandling med läkemedel som administreras av hälso- och sjukvårdspersonal eller på annat sätt ges i en hälso- och sjukvårds- situation.
Regeringen pekar också i utredningens direktiv särskilt på beho- vet av att utreda tillgången till information om medicintekniska pro- dukter, t.ex. inopererade implantat. Uppgift om dessa produkter kan med dagens reglering inte tas in i nationell läkemedelslista. Produk- terna kan påverka kroppen under lång tid och förorsaka skada eller risk för skada. Utifrån ett patientsäkerhetsperspektiv är behovet av samlade uppgifter i dessa fall likartat med det behov som finns i fråga om läkemedel, men det finns även behov av sådana uppgifter för upp- följning och statistik.1
Som konstaterats i kapitel 6 har patienter, hälso- och sjukvårds- personal samt apotekspersonal i olika sammanhang behov av till- gång till fler uppgifter om behandling med läkemedel och medicin- tekniska produkter. I detta kapitel diskuteras hur sådana uppgifter
1Dir. 2023:133, Fortsatt utveckling av registret nationell läkemedelslista, s. 5.
369
Möjligheter att elektroniskt dela information om fler läkemedelsbehandlingar ... |
SOU 2025:71 |
skulle kunna tillgängliggöras. Utredningens bedömning av hur infor- mationsdelningen bör lösas presenteras sedan i kapitel 8.
7.1Rättsligt stöd för och krav på att samla och dela information om läkemedelsbehandlingar och behandling med medicintekniska produkter
För att kunna dela information elektroniskt mellan olika aktörer krävs dels att informationen finns dokumenterad, dels att det finns rättsligt stöd för att kunna dela uppgifterna. Nedan redogör utred- ningen kort för detta. En längre redogörelse för personuppgiftsbe- handlingen i samband med läkemedelsprocessen finns i avsnitt 5.2.10.
Hälso- och sjukvårdsverksamheters tillgång till information
En förutsättning för att kunna dela information elektroniskt är att uppgifter dokumenteras. Skyldigheten att föra patientjournal be- skrivs i avsnitt 5.1.1. Som framgår av avsnitt 5.2.2 finns särskilda författningsbestämmelser om läkemedelsordinationer och om att uppgifter hänförliga till ordinationerna ska dokumenteras struktu- rerat och hållas samlade i en patientjournal. Dokumentation av ordi- nerade medicintekniska produkter ska också ske men det är inte lika tydligt eller detaljerat reglerat, se vidare avsnitt 5.3.3. Dokumenta- tion av medicintekniska produkter sker vad utredningen erfar dock inte alltid strukturerat utan kan många gånger ske i fritext.
Det finns för dem som bedriver hälso- och sjukvård enligt hälso- och sjukvårdslagen (2017:309), i det följande förkortat HSL, i hu- vudsak två juridiska möjligheter att få elektronisk tillgång till samt elektroniskt dela information om en patients läkemedelsbehandling eller behandling med medicintekniska produkter. Något förenklat kan sägas att tillgång till uppgifter i en patientjournal inom en vård- givares verksamhet regleras i patientdatalagen (2014:821), i det föl- jande förkortad PDL. Andra vårdgivares tillgång till informationen i en patientjournal regleras i lagen (2022:913) om sammanhållen vård- och omsorgsdokumentation, i det följande förkortad SVOD. SVOD medger möjligheten att under vissa förutsättningar, genom direktåtkomst eller annat elektroniskt utlämnande, dela personupp- gifter mellan dem som är vård- och omsorgsgivare.
SOU 2025:71 |
Möjligheter att elektroniskt dela information om fler läkemedelsbehandlingar ... |
När SVOD trädde i kraft den 1 januari 2023 upphävdes samtidigt 6 kap. i patientdatalagen.2 Där fanns motsvarande regler för vårdgi- vare som i dag finns i SVOD men då användes begreppet samman- hållen journalföring. Det begreppet används fortfarande i skrift av vissa. Utredningen använder i det följande begreppet sammanhållen vård- och omsorgsdokumentation utom i de fall andra verk citeras.
Tillgång till information om förskrivna och expedierade läkeme- del samt vissa andra varor, bl.a. medicintekniska produkter som för- skrivs på hjälpmedelskort, regleras i lagen (2018:1212) om nationell läkemedelslista. Den regleringen omfattar förutom hälso- och sjuk- vården även öppenvårdsapotek.
Patientens tillgång till information
Även patienter kan få tillgång till information om sina läkemedels- behandlingar och behandling med medicintekniska produkter uti- från olika regelverk (se avsnitt 4.2.1–4.2.3). Patienter kan ges till- gång till informationen elektroniskt genom den frivilliga möjlighet som finns för vårdgivare att enligt PDL elektroniskt dela informa- tion ur patientjournalen.3 Det är bl.a. dessa bestämmelser som ligger till grund för e-tjänsten 1177 Journal som regionerna tillhandahåller via Inera AB. Patienter kan också begära ut hela eller delar av sin patientjournal som en handling. I dessa fall finns en skyldighet för vårdgivaren att, efter en prövning enligt offentlighets- och sekre- tesslagen (2009:400) eller 6 kap. 12 och 13 §§ patientsäkerhetslagen (2010:659), lämna ut begärd handling i de delar som enligt prövningen kan lämnas ut.4 Patienter kan också, bl.a. genom e-tjänsten Läkeme- delskollen hos E-hälsomyndigheten ta del av uppgifter om förskriv- ningar och uthämtade läkemedel och andra varor genom registret nationell läkemedelslista.5
2Lagen om ändring i patientdatalagen (2008:355), SFS 2022:915.
35 kap. 5 § patientdatalagen (2008:355).
4Se 8 kap. 1–2 §§ patientdatalagen (2008:355).
55 kap. 6 § lagen (2018:1212) om nationell läkemedelslista.
Möjligheter att elektroniskt dela information om fler läkemedelsbehandlingar ... |
SOU 2025:71 |
Öppenvårdsapotekens tillgång till information
Den som bedriver verksamhet inom detaljhandel med läkemedel enligt lagen (2009:366) om handel med läkemedel, dvs. öppenvårds- apotek, är vårdgivare enligt patientsäkerhetslagen men inte enligt HSL. Öppenvårdsapotek omfattas inte heller av PDL och är där- med inte skyldiga att föra patientjournal och kan inte heller ta del av andra vårdgivares patientjournaler enligt SVOD.6 Farmaceuter på öppenvårdsapotek kan därmed endast få tillgång till den begrän- sade information om läkemedelsbehandlingar och behandling med medicintekniska produkter som delas genom lagen om nationell läke- medelslista.7 Expedierande apotekspersonals tillgång till patientin- formation är därigenom begränsad till uppgifter om förskrivna och på öppenvårdsapotek expedierade läkemedel och andra varor. Person- uppgiftsbehandlingen på öppenvårdsapotek regleras i apoteksdata- lagen (2009:367).
I de följande avsnitten diskuteras de olika möjligheterna att dela information om läkemedel som administreras av hälso- och sjukvårds- personal eller annat sätt ges i en hälso- och sjukvårdssituation mer ingående. När begreppet vårdgivare används nedan syftar det på andra vårdgivare än öppenvårdsapotek.
7.2Att dela information mellan vårdgivare genom sammanhållen vård- och omsorgsdokumentation
Lagen (2022:913) om sammanhållen vård- och omsorgsdokumen- tation, nedan SVOD, ger juridiska möjligheter att, med patientens samtycke och om inga spärrar införts, dela information ur patient- journaler mellan olika vårdgivare genom direktåtkomst eller annat elektroniskt utlämnande. Utredningens uppdrag är begränsat till att se över hur man kan samla och dela uppgifter inom hälso- och sjuk- vården varför lagens möjlighet att även dela omsorgsdokumentation inte kommer att beaktas i betänkandet. Lagen lägger en juridisk grund för att skapa en sammanhållen information om en patients vård, inklusive uppgifter om behandlingar med läkemedel och medi- cintekniska produkter. Sammanhållen vård- och omsorgsdokumen-
6Se definitionerna av hälso- och sjukvård samt vårdgivare i 1 kap. 3 § patientdatalagen (2008:355) samt i 1 kap. 1 § lagen (2022:913) om sammanhållen vård- och omsorgsdokumentation.
75 kap. 1–2 §§ lagen (2018:1212) om nationell läkemedelslista.
SOU 2025:71 |
Möjligheter att elektroniskt dela information om fler läkemedelsbehandlingar ... |
tation används i dag på olika sätt av vårdgivare och Inera AB för att dela information. En schematisk illustration som exemplifierar hur information ur patientjournaler kan delas inom och mellan vårdinfor- mationssystem finns i figur 7.1 a–d. I det följande beskrivs några av dessa mer ingående.
7.2.1Användningen av sammanhållen vård och omsorgsdokumentation inom ett och samma vårdinformationssystem
Sammanhållen vård- och omsorgsdokumentation möjliggör för flera vårdgivare som använder ett och samma vårdinformationssystem att elektroniskt dela information ur de olika vårdgivarnas patient- journaler (se fig. 7.1 c). Informationen blir, utan avgränsning till informationsmängd eller -område, tillgänglig genom att den ingår i en enhetlig informationsstruktur. Det är viktigt att notera att det i detta fall egentligen handlar om att vårdgivarna arbetar med samma informationskälla. Inga extra tjänstegränssnitt, interoperabilitets- lösningar eller överföring av information mellan olika system krävs i sådana fall. Informationen hanteras i ett gemensamt system. Detta måste skiljas från den situation då en annan region använder ett vård- informationssystem från samma leverantör (se fig. 7.1 d). Då kan ofta inte information delas mellan regionerna eftersom man har olika in- stanser8 av programvara, och olika informationskällor där informa- tionen lagras.9
Flera regioner satsar på gemensamma regionala vårdinformationsystem
Möjligheten att genom SVOD dela information mellan vårdgivare inom ett och samma vårdinformationssystem används i dag av flera regioner. Vid upphandling av nästa generations primära vårdinfor- mationssystem har flera av regionerna tagit höjd för att inkludera fler vårdgivare inom den offentligt finansierade vården. Det finns i fjorton regioner krav på att privata vårdgivare som omfattas av lagen
8Inom it avser ”instanser” separata och oberoende kopior av en mjukvaruapplikation eller tjänst som körs på samma fysiska eller virtuella infrastruktur.
9E-hälsomyndigheten, 2021, Ökat nyttjande av sammanhållen journalföring – Möjligheter, ut- maningar och behovet av digital informationsförsörjning idag och i framtiden, dnr 2021/01681, s. 36.
Möjligheter att elektroniskt dela information om fler läkemedelsbehandlingar ... |
SOU 2025:71 |
(2008:962) om valfrihetssystem, i det följande förkortat LOV, ska använda den aktuella regionens vårdinformationssystem. I ytterligare fyra regioner ställs inte detta krav, men man erbjuder de privata vård- givarna att på frivillig väg använda regionens vårdinformationssystem. Det antal regioner som ställer krav på att privata vårdgivare med vilka man har avtal ska använda samma system har ökat sedan LOV infördes. En effekt av detta är att de privata vårdgivarna ofta också kan ta del av regionens tekniska koppling till Inera AB:s tjänst Natio- nell patientöversikt, se vidare nedan, men det ökar också komplexi- teten för privata aktörer som finns etablerade i fler än en region.10
Ovanstående innebär alltså att när patienten rör sig inom regio- nen, mellan de olika vårdgivare som regionen har avtal med och de kommuner i länet som valt att nyttja optionen, kommer det finnas en till stora delar sammanhängande vårdinformation kring patienten. I de fall olika vårdinformationssystem, från olika leverantörer, an- vänds i olika verksamheter hos en enskild vårdgivare eller av olika vårdgivare ställs dock helt andra krav på interoperabilitet för att informationen ska kunna utbytas. Sammanhållen vård- och omsorgs- dokumentation möjliggör därmed att vårdgivarna, om patienten läm- nat sitt samtycke och inte spärrat uppgifter, genom direktåtkomst eller annat elektroniskt utlämnande kan ta del av till exempel den i vårdinformationssystemet samlade läkemedelslistan. Att flera regi- oner nu knyter vårdgivare som bedriver vård enligt LOV och länets kommuner till samma vårdinformationssystem innebär än större möj- ligheter att dela information. Runt 95 procent av patienterna som får offentligt finansierad vård vid sjukhus får det i dag i den region där patienten är folkbokförd (se avsnitt 6.1.1). Därmed kommer offentliga och privata vårdgivare knutna till den aktuella regionen att få goda möjligheter till en bättre bild av patientens vård.
10A.a., s. 40–41.
SOU 2025:71 |
Möjligheter att elektroniskt dela information om fler läkemedelsbehandlingar ... |
Figur 7.1 Exempel på hur information kan delas mellan olika informationssystem
VIS – Vårdinformationssystem
a) |
|
b) |
|
|
c) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Vårdgivare A |
|
|
Vårdgivare A |
|
|
|
VIS A |
|
VIS A |
|
|
|
VIS A |
|
|
VIS B |
|
|
Vårdgivare A |
|
Vårdgivare B |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
PatientdatalagenPatientdatalagen Patientdatalagen
Sammanhållen vård- och omsorgsdokumentation
d)
VIS A1 |
VIS A2 |
Vårdgivare A |
|
Vårdgivare B |
|
Vårdgivare C |
|
Vårdgivare D |
|
|
|
|
|
|
|
PatientdatalagenPatientdatalagen
Sammanhållen vård- och omsorgsdokumentation
a)En vårdgivare använder ett vårdinforationssystem. Uppgifter delas mellan vårdenheter genom pati - entdatalagen, PDL.
b)En vårdgivare använder två olika vårdinformationsystem. Information kan utbytas mellan vården - heter som använder de olika systemen genom PDL.
c)Två vårdgivare använder en gemensam installation av ett vårdinformationssystem. Information kan utbytas mellan vårdenheter hos de olika vårdgivarna genom lagen om sammanhållen vård- och omsorgs- dokumentation, SVOD.
d)Två installationer av samma vårdinformationssystem, A1 och A2. Genom att installationerna skiljer sig åt går det inte att tekniskt utbyta information mellan t.ex. vårdgivare B och C även om det juridiskt skulle vara möjligt.
Möjligheter att elektroniskt dela information om fler läkemedelsbehandlingar ... |
SOU 2025:71 |
Alla vårdgivare kommer inte använda samma vårdinformationssystem
Införande av ett gemensamt vårdinformationssystem för en region, länets kommuner och vårdgivare enligt LOV är inte tillräckligt för att utgöra grunden för en nationell infrastruktur för delning av pati- entuppgifter. För det första ställer inte alla regioner samma krav på obligatorisk anslutning, för det andra kan informationen inte utbytas mellan regioner och för det tredje finns det fler vårdgivare än de som bedriver offentligt finansierad vård. Inom den offentligt finansierade vården finns även statliga vårdgivare som t.ex. Kriminalvården, Statens institutionsstyrelse och Försvarsmakten (se avsnitt 5.4) som behöver vara en integrerad del i infrastrukturen på hälso- och sjukvårdens område.
En nationell infrastruktur som bygger på sammanhållen vård- och omsorgsdokumentation behöver ge samma möjligheter till överblick i den mån en patient också besöker privata vårdgivare utan vårdavtal med regionen, tandvården, om patienten t.ex. får specialiserad vård i en annan region eller om patienten omhändertas i Kriminalvården.
Även om regionerna oftast har ett primärt vårdinformations- system som hanterar huvuddelen av journalinformationen finns i de flesta regioner också flera specialiserade informationssystem för t.ex. cancervård, intensivvård, bilddiagnostisk verksamhet osv. Upp- gifter om vård som dokumenteras i dessa separata system kan vara svårtillgängliga då teknisk integration saknas och informatiken skil- jer sig åt. Även om möjlighet att förskriva läkemedel ofta saknas i de separata systemen kan flera av dem fortfarande hantera ordina- tioner av läkemedel som administreras av sjukvårdspersonal. För de, företrädesvis mindre vårdgivare eller pensionerade förskrivare, som inte har tillgång till ett vårdinformationssystem finns även möj- ligheten att förskriva genom E-hälsomyndighetens e-tjänst Förskriv- ningskollen eller privata webbapplikationer.
I den kommunala hälso- och sjukvården och omsorgen används också flera olika system där vissa av dessa är mer inriktade på om- sorgsprocessen och saknar effektivt stöd för att i annan form än fri- text dokumentera läkemedelsbehandlingar (se även avsnitt 17.4.3)
SOU 2025:71 |
Möjligheter att elektroniskt dela information om fler läkemedelsbehandlingar ... |
7.2.2Tillgång till information om läkemedelsbehandlingar genom tjänsten Nationell patientöversikt
Nationell patientöversikt, i det följande förkortat NPÖ, är en tjänst som Inera AB erbjuder offentligt finansierade vårdgivare. Tjänsten gör det möjligt för vårdgivarna att på frivillig basis elektroniskt dela och ta del av viss journalinformation. Frivilligheten omfattar också urvalet av information, dvs. olika anslutna vårdgivare kan välja att dela med sig av olika information på olika områden t.ex. vårdkon- takter, anteckningar, diagnoser, läkemedel, provsvar eller remisser. Delningen sker genom direktåtkomst med stöd av bestämmelserna i SVOD. Hälso- och sjukvårdpersonal, t.ex. läkare, sjuksköterskor och kliniska farmaceuter, kan genom tjänsten ta del av viss journal- information som finns hos andra vårdgivare, om patienten har gett sitt samtycke till det, oavsett vilket journalsystem som används av de olika vårdgivarna. I dag är NPÖ viktigt för utbyte av journalin- formation mellan vårdgivare eftersom många olika vårdinformations- system används och vilket system som används varierar mellan olika vårdgivare. Delning av information inom ett vårdinformationssystem räcker därmed inte till.
Anslutning till NPÖ och underliggande tjänster och funktioner görs genom avtal med Inera AB. Anslutning kan göras som produ- cent och/eller konsument av information dvs. genom att man delar eller kan ta del av information. I NPÖ-gränssnittet lagras ingen in- formation när den läses av användaren. Lösningen är federerad, det vill säga att all information som visas i NPÖ visas upp från de lokala vårdinformationssystem där den finns lagrad.11 Däremot finns hos Inera en viss registerfunktionalitet, ett engagemangsindex, som an- ger vilka vårdgivare som har information av vilket slag gällande en viss patient.12 Det finns också en stödfunktion som kallas tillgänglig patient och som tekniskt begränsar vilka patienter vårdpersonalen kan söka information om hos en annan vårdgivare.13 Stödfunktionen är en följd av de begränsningar avseende vilken patientinformation som hälso- och sjukvårdspersonal har rätt att ta del av enligt pati- entdatalagen (2008:355) och gör så att vårdpersonalen endast kan
11E-hälsomyndigheten, 2021, Ökat nyttjande av sammanhållen journalföring – Möjligheter, ut- maningar och behovet av digital informationsförsörjning idag och i framtiden, dnr 2021/01681, s. 60.
12I nu liggande utredningsuppdrag för t.ex. S2024:A går motsvarande funktionalitet under benämningen patientdataindex.
13https://inera.atlassian.net/wiki/spaces/OINPN/pages/442336878/Tillg+nglig+patient+TGP, besökt 2024-10-17.
Möjligheter att elektroniskt dela information om fler läkemedelsbehandlingar ... |
SOU 2025:71 |
se uppgifter i NPÖ om de patienter som också finns i det egna vårdinformationssystemet.
Möjlighet att läsa men inte skriva
NPÖ möjliggör utbyte av information mellan regionala, kommu- nala och offentligt finansierade privata vårdgivare. NPÖ erbjuder dock enbart möjligheten att läsa egen och andra vårdgivares infor- mation. Av patientdatalagen framgår att varje vårdgivare är skyldig att föra patientjournal. Tillgång till andra vårdgivares patientjour- naler medges enligt SVOD genom direktåtkomst eller annat elek- troniskt utlämnande. Med direktåtkomst avses en viss form av elek- troniskt utlämnande av personuppgifter till en mottagare utanför en vårdgivares organisation.14 Det går därmed inte att med nuvarande regelverk skriva eller registrera uppgifter i någon annan vårdgivares journal. NPÖ utgör inte heller någon form av nationell patientjournal.
Större möjligheter till samarbete i ett gemensamt vårdinformationsystem
Eftersom NPÖ varken möjliggör tillägg eller ändringar av informa- tion i olika vårdgivares patientjournaler upplever vårdpersonal ofta att översikten inte är tillräcklig för att kunna samarbeta effektivt kring patienten och dennes vård.15 Regionerna arbetar därför, som tidigare nämnts, med t.ex. krav i upphandlingar enligt lagen (2008:962) om valfrihetssystem, förkortat LOV, för att använda ett gemensamt journalsystem för de offentliga och privata vårdgivare som deltar i den vård regionen ansvarar för.16 Värt att notera är dock att en sådan ordning utgår från samma reglering som NPÖ och därmed inte heller torde medge tillägg eller ändring i någon annan vårdgivares informa- tion. Däremot innebär det att informationshanteringen sker i ett samlat system per region och att man kan dokumentera direkt i den egna vårdgivarens journal i systemet. En konsekvens av regioners krav på att använda ett för regionen gemensamt journalsystem är att vårdgivare som verkar på nationell nivå, t.ex. olika privata bolag
14Prop. 2007/08:126 Patientdatalag m.m., s. 70.
15Nätverket för Sveriges it-direktörer, 2023, IT och digitalisering i hälso- och sjukvården 2023, s. 15.
16A.a.
SOU 2025:71 |
Möjligheter att elektroniskt dela information om fler läkemedelsbehandlingar ... |
som utför vård i flera regioner, kan behöva använda flera olika vård- informationsystem i sin verksamhet.
För kommunala vårdgivare möjliggörs anslutningen till regionens vårdinformationssystem i stället genom frivilliga optioner och det är oklart hur många kommuner som i nuläget antagit dessa optioner. Eftersom alla patienter trots regionernas ambitioner aldrig kommer kunna omfattas av ett och samma journalsystem kommer NPÖ, eller liknande lösningar, fortsatt ha betydelse för utbyte av informa- tion mellan vårdgivare som inte använder samma journalsystem; i praktiken för utbyte av information mellan olika regioner, utbyte med privata vårdgivare utan LOV-avtal och utbyte av information med andra vårdgivare inom EU/EES.
Det är värt att notera att det endast är offentligt finansierade vårdgivare som har möjlighet att ansluta till Inera AB:s nationella tjänsteplattform och NPÖ. Detta innebär att NPÖ i nuläget inte har förutsättningar att kunna bli heltäckande, eftersom exempelvis företagshälsovård, försäkringsfinansierad vård och vård som utförs av privata vårdgivare, till exempel vaccinatörer, inte kan vare sig pro- ducera eller konsumera information i systemet.17
Läkemedel och vissa andra varor i den nationella patientöversikten
NPÖ kan i dag, för de regioner som valt att dela information genom tjänsten, bland annat visa information om ordinerade, förskrivna och/eller administrerade läkemedel och vissa andra varor för en pati- ent.18 I NPÖ presenteras också uppgifter om uthämtade läkemedel genom att data hämtas från registret nationell läkemedelslista, se vidare nedan.
För information om ordinerade läkemedel använder NPÖ ett tjänstekontrakt från Inera, baserat på Green CDA19, som heter GetMedicationHistory. Informationen utgår ifrån ordinationer men kan även innehålla information om förskrivning eller administreringar. Vilka ordinationer som omfattas styrs helt av vilka informations- system och informationsmängder vårdgivaren valt att ansluta. Till
17E-hälsomyndigheten, 2021, Ökat nyttjande av sammanhållen journalföring – Möjligheter, ut- maningar och behovet av digital informationsförsörjning idag och i framtiden, dnr 2021/01681, s. 59.
18Inera AB, 2023, Tjänstekontraktsbeskrivning Version 2.1.7, s. 63.
19Green CDA skiljer sig från FHIR men kommer från samma organisation, HL7.
Möjligheter att elektroniskt dela information om fler läkemedelsbehandlingar ... |
SOU 2025:71 |
exempel kan en vårdgivare ha valt att ansluta sitt primära vårdinfor- mationssystem som hanterar ordinationer och förskrivningar i många av slutenvårds- och de flesta öppenvårdsverksamheterna, men valt att inte ansluta det system som hanterar flertalet ordinationer inom cancervården. Som framgår av Läkemedelsverkets rapport Rekvisi- tionsläkemedel i epidemiologiska studier dokumenteras information om läkemedelsordinationer i regionerna i ett flertal separata system bland annat för cytostatika, röntgenkontrastmedel och narkos, det vill säga för läkemedel som ges i vården.20 Vilka ordinationer som om- fattas av NPÖ är också helt upp till de olika vårdgivarna att avgöra. Tjänstekontraktet stödjer delning av information om alla ordinatio- ner som dokumenteras strukturerat i t.ex. vårdinformationsystemets läkemedelsmodul, dvs. både för sådana läkemedel som förskrivs och sådana som administreras av hälso- och sjukvårdspersonal. Även av patienten uppgivna läkemedelsbehandlingar kan delas via kontraktet om de dokumenteras i läkemedelsmodulen och vårdgivaren så önskar. Information om handelsvaror21 kan delas via kontraktet om de doku- menteras i läkemedelsmodulen och vårdgivaren så önskar. Det inne- bär att det i vissa fall kan delas uppgifter även om medicintekniska produkter förskrivna på hjälpmedelskort.
Information om läkemedel som administrerats under slutenvårds- episoder kan också finnas sammanfattad och tillgängliggjord under andra rubriker i NPÖ genom olika anteckningar, t.ex. epikriser.
Om denna information delas sker det genom andra tjänstekontrakt och visas under andra rubriker i NPÖ. I de fall patienten får dosdis- penserade läkemedel förskrivs dessa dessutom i Inera AB:s verktyg Pascal. I vissa regioner dokumenteras inte dessa ordinationer i pati- entjournalen och visas därmed inte regelmässigt i NPÖ.22 Det är sam- mantaget svårt att se att NPÖ, så som det är i dag, ger en samlad bild av en patients läkemedelsbehandling då det finns väldigt stora friheter för vårdgivarna själva att avgöra om, och i så fall vilken, in- formation som ska delas.
Anslutningsgraden och vilken information som finns tillgänglig i NPÖ utvecklas över tid. Alla regioner är anslutna men alla visar
20Läkemedelsverket, 2022, Rekvisitionsläkemedel i epidemiologiska studier – Individdata på läkemedel administrerade utan receptförskrivning, baserat på rutinregistrering i sjukvårdens it-system, dnr 4.3.1-2019-096455, s. 13.
21Det Inera benämner handelsvaror utgörs sannolikt till största delen av förbruknings- artiklar som också i de flesta fall utgörs av medicintekniska produkter.
22Se Region Östergötland, Journalföring av läkemedelsinformation i Region Östergötland, dokumentnummer 18153, version 14.
SOU 2025:71 |
Möjligheter att elektroniskt dela information om fler läkemedelsbehandlingar ... |
inte samma information. Till exempel visar inte Gotland, Gävleborg, Stockholm, Västra Götaland eller Skåne information om läkemedel alls (dessa län omfattar cirka 56 procent av befolkningen).23 Av de som visar information om läkemedel framgår det inte om det är från samtliga i regionen använda vårdinformationssystem.
Även bland kommuner varierar anslutningsgraden där 54 av
290 kommuner är anslutna och endast en visar information om läke- medel. 144 privata vårdgivare är anslutna varav 95 visar information om läkemedel.24 När det gäller privata vårdgivare är det oklart hur stor anslutningsgraden är eftersom det inte finns någon uppgift om hur stort det totala antalet är. Den digitala infrastruktur och de tjäns- ter som Inera AB tillhandhåller har karaktären av en interregional infrastruktur, snarare än en nationell.25
Som konstaterades ovan presenteras i NPÖ också uppgifter om uthämtade läkemedel. Detta sker genom att data hämtas och presen- teras från registret nationell läkemedelslista. Uppgifterna delas där- med inte med stöd av sammanhållen vård- och omsorgsdokumenta- tion. Uppgifterna visas under en egen ”flik” och inte under samma menyval som övrig läkemedelsinformation vilket enligt utredning- ens bedömning bidrar till att läkemedelsinformationen i NPÖ blir fragmenterad.26
Vacciner i den nationella patientöversikten
Vacciner är läkemedel men hanteras, när de administreras av sjuk- vårdspersonal, som en särskild informationsmängd i NPÖ och pre- senteras under en egen rubrik. Orsaken till detta är att bl.a. att det för vaccinationer behövs viss annan information som inte ingår i en läkemedelsordination (se även avsnitt 9.5). Det är också logiskt för användaren att skilja information om vaccinationer från information om övriga läkemedelsbehandlingar. Vaccinationer visas därmed som regel inte i listan över ordinerade läkemedel.27 I händelse av att ett
23https://www.inera.se/tjanster/alla-tjanster-a-o/npo---nationell-patientoversikt/#section- 14510, besökt 24-02-15.
24A.a.
25SOU 2024:33 Delad hälsodata – dubbel nytta, s. 201.
26Inera AB, 2024, Nationell patientöversikt 4.8 Manual, s. 80.
27Det är enligt Inera möjligt att skicka information om administrerade vacciner via tjänste- kontraktet GetMedicationHistory. Vilket tjänstekontrakt som används avgör om informa- tionen visas under rubriken läkemedel eller vaccinationer.
Möjligheter att elektroniskt dela information om fler läkemedelsbehandlingar ... |
SOU 2025:71 |
vaccin förskrivs på recept gäller i allt väsentligt samma förutsätt- ningar som för övriga förskrivna läkemedel.
Information om vaccinationer tillgängliggörs genom ett eget tjänstekontrakt, GetVaccinationHistory, som hämtar information både om själva ordinationen och vaccinationstillfället. Information om vaccinationer behöver omfatta uppgifter som normalt inte om- fattas av en läkemedelsordination t.ex. vad vaccinationen skyddar mot, huruvida vaccinationen ingår i ett program och vilken dos i ett schema den aktuella vaccinationen utgör.
Möjligheten att tillhandahålla information om vaccinationer via NPÖ är på samma sätt som för andra läkemedel begränsad till offent- ligt finansierade vårdgivare och de system de valt att ansluta. I dag visar nitton regioner, åtta kommuner och fyra privata vårdgivare in- formation om vaccinationer via NPÖ. Även om täckningen bland regioner är hög sker många vaccinationer, framför allt mot TBE och vaccinationer inför resor, hos privata aktörer som inte är anslutna till NPÖ.
7.2.3Fördelar med att dela information genom sammanhållen vård- och omsorgsdokumentation
Det finns fördelar med att dela information mellan vårdgivare med stöd av sammanhållen vård- och omsorgsdokumentation, t.ex. genom NPÖ eller när flera vårdgivare använder ett gemensamt vårdinforma- tionssystem. En av de största fördelarna är att NPÖ och motsvarande tjänster utgår ifrån patientjournalen. Journalen innehåller all den dok- umentation28 om en patient som en vårdgivare behöver ha tillgång till för en effektiv och säker vård, dvs. inte enbart om läkemedelsbe- handlingar. Det innebär också att den information om behandling med läkemedel och medicintekniska produkter som visas är vad som faktiskt ordinerats. Därmed kommer justeringar som dokumenteras i ordinationer över tid alltid att redovisas och informationen kan sättas i relation till annan relevant klinisk dokumentation. Det inne- bär också att man slipper de utmaningar som finns med synkroni- sering av information t.ex. mellan förskrivningar och ordinationer som uppstår om man utgår från det nuvarande registret nationell läkemedelslista som nationell sammanställning. Möjligheten att visa
28Även om journalen ska innehålla all relevant dokumentation är det inte säkert att all infor- mation med nödvändighet finns att tillgå i NPÖ i dag.
SOU 2025:71 |
Möjligheter att elektroniskt dela information om fler läkemedelsbehandlingar ... |
uppgifter för andra vårdgivare genom tjänster som NPÖ möjliggör också att tillgängliggöra information för patienten genom till exem- pel e-tjänsten 1177 Journal, se vidare avsnitt 7.2.4 nedan.
NPÖ möjliggörs genom SVOD vilken, till skillnad från lagen (2018:1212) om nationell läkemedelslista, inte är en registerlag. Exakt vilken information som får visas behöver därmed inte regleras. SVOD reglerar delningen av alla personuppgifter i en patientjournal. Samti- digt innehåller SVOD och PDL de mekanismer som bedömts be- hövas för att skydda den personliga integriteten. Sammantaget ger detta större möjligheter till flexibilitet i t.ex. utvecklingen av tjänster och gränssnitt.
Det krävs patientens medgivande för att vårdgivare ska få ge andra vårdgivare tillgång till information genom SVOD, ett så kallat tyst samtycke. Det innebär att patienten ska informeras om vad samman- hållen vård- och omsorgsdokumentation innebär och om sin möj- lighet att motsätta sig att uppgifterna görs tillgängliga. Om patien- ten inte motsätter sig tillgängliggörandet (tyst samtycke) så kan uppgifterna delas i enlighet med SVOD.29
En annan fördel med att tillgängliggöra information om ordine- rade läkemedel genom SVOD är att till exempel kommunala vård- och omsorgsgivare får använda informationen som underlag för att iordningställa, ofta kallat att dela, eller administrera läkemedel till patienterna. Sjuksköterskor i kommunal vård behöver tillgång till samlad information om alla patientens pågående läkemedelsbehand- lingar för att kunna iordningställa och administrera såväl tablettbe- handlingar som injektioner. Detta förutsätter dock att informations- täckningen är god, både vad avser vårdgivare och informationssystem. Som redogjordes för ovan saknas i dag information om läkemedel i NPÖ från vårdgivare motsvarande cirka 56 procent av befolkningen. Även i de fall patienten får dosdispenserade läkemedel förskrivs dessa i Inera AB:s verktyg Pascal och visas inte regelmässigt i NPÖ. Informationen i registret nationell läkemedelslista är inte lämplig att användas som delningsunderlag i hälso- och sjukvård, dels efter- som det inte är syftet med informationen, dels eftersom informatio- nen än så länge bl.a. riskerar att inte vara uppdaterad utifrån senaste ordinationsändring. Den nationella läkemedelslistan innehåller inte heller information om sådana läkemedelsbehandlingar som inte för- skrivs på recept och t.ex. ska injiceras av vårdpersonal.
292 kap. 2 § lagen (2022:913) om sammanhållen vård- och omsorgsdokumentation.
Möjligheter att elektroniskt dela information om fler läkemedelsbehandlingar ... |
SOU 2025:71 |
Att information inte är uppdaterad är naturligtvis även ett pro- blem för patienten som därför i dag måste hålla ordning på om en ordinationsändring meddelats på annat sätt. Hälso- och sjukvårds- personal måste dock förlita sig på sådan dokumentation som i första hand är avsedd för dem och inte en sekundär källa som receptet faktiskt utgör. För hälso- och sjukvårdspersonalen är därför infor- mationen från läkemedelsordinationen central.
7.2.4Nackdelar med att dela information genom sammanhållen vård och omsorgsdokumentation och NPÖ
Informationen i NPÖ är i dag inte heltäckande eftersom det inte är tvingande att dela information enligt lagen (2022:913) om samman- hållen vård- och omsorgsdokumentation, nedan SVOD. De som delar information delar inte heller information från alla de system de använder och som innehåller patientuppgifter. Detta har uppmärk- sammats av både E-hälsomyndigheten och Utredningen om e-recept och patientöversikter inom EES.30,31 Även om NPÖ hämtar uppgif- ter ur patientjournalen, och i teorin kan visa alla ospärrade uppgifter, är det inte heller ett lika bra alternativ som att ha direkt tillgång till all information i patientjournalen.
Anteckningar, vilket i praktiken är ostrukturerad text och noter- ingar, är den informationsmängd som är mest använd och delad i NPÖ.32 Täckningen avseende information om läkemedelsbehand- lingar i NPÖ motsvarar, som konstaterats ovan, i dag inte ens hälf- ten av befolkningen, och då inte med säkerhet avseende alla relevanta och aktuella läkemedelsordinationer. Så länge lagkrav saknas är den framtida utvecklingen helt beroende av vad regioner och övriga vård- givare har för avsikter och vad som slutligen också genomförs. Att skapa lösningar som hanterar sammanhållen vård- och omsorgsdoku- mentation över vårdgivargränserna på ett säkert och effektivt sätt kräver enligt regionerna betydande resurser hos såväl regionen som medverkande privata vårdgivare och kommuner.33 Även E-hälsomyn-
30E-hälsomyndigheten, 2021, Ökat nyttjande av sammanhållen journalföring – Möjligheter, ut- maningar och behovet av digital informationsförsörjning i dag och i framtiden, dnr 2021/01681.
31SOU 2023:13 Patientöversikter inom EES och Sverige.
32E-hälsomyndigheten, 2021, Ökat nyttjande av sammanhållen journalföring – Möjligheter, ut- maningar och behovet av digital informationsförsörjning i dag och i framtiden, dnr 2021/01681, s. 59.
33Nätverket för Sveriges it-direktörer, 2023, IT och digitalisering i hälso- och sjukvården 2023, s. 16.
SOU 2025:71 |
Möjligheter att elektroniskt dela information om fler läkemedelsbehandlingar ... |
digheten lyfter kostnader och finansieringsmodellen för NPÖ som en utmaning framför allt för mindre vårdgivare.34 Utvecklingen är därmed i nuläget beroende av sjukvårdshuvudmännens prioriteringar och vårdgivarnas möjlighet till finansiering.
Privata vårdgivare medges inte åtkomst till NPÖ
Privata vårdgivare utan avtal med en region, dvs. utförare av sådan vård som inte är offentligt finansierad, omfattas inte heller av pati- entöversikterna eftersom de inte har möjlighet att ansluta till tjäns- ten NPÖ.35 En nationell sammanställning över en patients aktuella läkemedelsbehandlingar tillgänglig för hälso- och sjukvårdspersonal behöver omfatta alla vårdgivare för att vara heltäckande och garan- tera patientsäkerheten. Det ska också noteras att apotekspersonal, även om de utgör hälso- och sjukvårdspersonal, inte kan ta del av uppgifter i en nationell lösning som bygger på SVOD vare sig det är NPÖ eller en annan tjänst. Vilken information apotekspersonal har behov av att få tillgång till för att lösa sina uppgifter behöver därför beaktas vid val av en framtida lösning.
Federerade lösningar kräver kontinuerlig möjlighet att ansluta till informationskällan
Federerade lösningar som t.ex. NPÖ innebär också generellt risker vid bristande kontinuitet i de informationsbärande systemen, till exempel om en verksamhet avslutas och informationen inte kan över- föras elektroniskt till en annan vårdgivare eller till Inspektionen för vård och omsorg.36 Ett sådant exempel gäller konkursen av Vård- centralen i Pålsboda år 2023 där den närliggande vårdcentralen fick begära alla journaler på papper eftersom verksamheterna hade olika system.37 Vidare finns det enligt E-hälsomyndigheten i dag en be-
34E-hälsomyndigheten, 2021, Ökat nyttjande av sammanhållen journalföring – Möjligheter, ut- maningar och behovet av digital informationsförsörjning i dag och i framtiden, dnr 2021/01681, s. 59.
35Det är inte fullt klargjort vad som är bakgrunden till att vissa privata aktörer inte får ansluta till Ineras tjänster (se SOU 2023:13 s. 237) men då tjänsterna tillhandahålls offentliga vård- givare genom det s.k. Teckal-undantaget (se 3 kap. 12–16 §§ LOU) finns viss risk att ett för stort inslag av privata aktörer skulle påverka kommuners och regioners möjligheter att nyttja tjänsterna utan offentlig upphandling. Se även Inera AB, Anslutning av tredjepartsprodukter
– Huvudrapport (2021).
36Se 9 kap. 1 § patientdatalagen (2008:355).
37Vårdcentral fick 2 500 nya patienter, publicerad på Lakartidningen.se 2023-08-10.
Möjligheter att elektroniskt dela information om fler läkemedelsbehandlingar ... |
SOU 2025:71 |
gränsning i hur långt tillbaka i tiden som information visas upp i NPÖ, trots att den finns kvar hos vårdgivaren.38 Tjänsten fungerar i stället som ett ”titthål” in i dokumenterad information som en annan vårdgivare gjort tillgänglig. När läsning och tjänsten avslutas stängs ”titthålet”.39 Om informationen som tillgängliggjorts ligger till grund för en medicinsk bedömning ska den dock dokumenteras i den vårdgivares journalsystem där bedömningen görs. Det görs
i dag genom att man refererar till innehållet hos andra vårdgivares system i det egna systemet. Eftersom signerade journaluppgifter inte får ändras ger detta en fullgod spårbarhet, även om det kan vara om- ständligt vid en utredning.
NPÖ är statiskt och många system är inte anslutna
Regionernas it-direktörer beskriver i den årliga SLIT-rapporten att dagens NPÖ-lösning är för statisk eftersom tjänsten varken möjlig- gör tillägg eller ändringar av journalinformation.40 Vårdpersonalen anser därmed inte att tjänsten är tillräckligt effektiv för informations- delning och samarbete kring patienten och dennes vård. Detta menar it-direktörerna bidrar till att regionerna nu inför en sammanhållen journal mellan de olika vårdgivarna i regionen.41 Även om delningen av uppgifter mellan vårdgivare i detta fall bygger på SVOD begrän- sas den organisatoriskt och geografiskt. I den årliga rapporten för år 2022 anges att 15 regioner har en egen gemensam läkemedelslista i sina respektive vårdinformationssystem. Läkemedelslistan är en del av patientjournalen, med information om vilka läkemedel som har ordinerats patienten inom den egna regionen och ger vården en samlad bild över läkemedelsbehandlingen, så länge patienten inte har fått läkemedel förskrivet utanför regionen och detta inte fram- kommit på annat sätt.42 Vad som avses i rapporten är dock inte helt tydligt. Givet vad som tidigare anförts angående Läkemedelsverkets insamling av uppgifter om läkemedel som administrerats i hälso- och sjukvården synes det osannolikt att listan skulle vara komplett inom regionen. Då listan inte heller omfattar ordinationer, vare sig
38E-hälsomyndigheten, 2021, Ökat nyttjande av sammanhållen journalföring – Möjligheter, ut- maningar och behovet av digital informationsförsörjning i dag och i framtiden, dnr 2021/01681, s. 60.
39A.a., s. 37.
40Nätverket för Sveriges it-direktörer, 2023, IT och digitalisering i hälso- och sjukvården 2023, s. 15.
41A.a.
42Nätverket för Sveriges it-direktörer, 2022, IT och digitalisering i hälso- och sjukvården 2022, s. 15.
SOU 2025:71 |
Möjligheter att elektroniskt dela information om fler läkemedelsbehandlingar ... |
sådana som administrerats eller förskrivits, hos andra vårdgivare än regionen kan den knappast heller utgöra en nationellt samlad bild. Det kan också noteras att det faktum att endast 15 regioner uppger att de har en samlad läkemedelslista väcker frågan om huruvida vissa regioner lever upp till det krav på samlade läkemedelsordinationer som Socialstyrelsen beslutade redan år 2017 (se avsnitt 5.2.8).
7.2.5Finns möjligheter till utvidgad sammanhållen vård- och omsorgsdokumentation?
En del av de ovan identifierade nackdelarna med NPÖ som federe- rad lösning för att dela information mellan vårdgivare skulle kunna överbryggas genom ny lagstiftning. Det finns förslag i betänkandet Patientöversikter inom EES och Sverige (SOU 2023:13) att göra pati- entöversikter inom Sverige obligatoriska genom krav på att tillgänglig- göra uppgifter (se vidare 4.4.5 samt 8.13). Motsvarande tankar re- dovisades också år 2021 i E-hälsomyndighetens rapport om NPÖ som föregick den utredningen.43 I rapporten föreslog E-hälsomyndig- heten att en vårdgivare ska vara skyldig att lämna ut vissa prioriterade uppgifter till en patientöversikt som är tillgänglig i hela landet och för alla vårdgivare och som även kan nyttjas för överföring av uppgif- ter i samband med utlandsvård.44 De prioriteringar som E-hälsomyn- digheten föreslog var uppgifter om allergi/överkänslighet, ordinerade läkemedel, medicintekniska produkter/implantat och laboratorieresul- tat, dvs. till stor del uppgifter denna utredning har att analysera.45 Förslagen i SOU 2023:13 innehåller också överväganden om att sta- ten ska ta över delar av Inera AB vilket skulle öka möjligheterna för andra aktörer än offentligt finansierade vårdgivare att lämna uppgif- ter. Infrastrukturen skulle bli statlig, nationell. Även i det senare betänkandet Delad hälsodata – dubbel nytta (SOU 2024:33) finns förslag om skyldigheter för vårdgivare att ge andra vårdgivare tillgång till vissa uppgifter genom direktåtkomst (se vidare 4.4.2 samt 8.13).
En skyldighet i t.ex. SVOD för vårdgivare att lämna uppgifter till patientöversikter eller på annat sätt dela dessa genom direktåt- komst eller annat elektroniskt utlämnande skulle medföra att vissa
43E-hälsomyndigheten, 2021, Ökat nyttjande av sammanhållen journalföring – Möjligheter,
utmaningar och behovet av digital informationsförsörjning i dag och i framtiden, dnr 2021/01681.
44A.a., s. 63.
45A.a., s. 48–49.
Möjligheter att elektroniskt dela information om fler läkemedelsbehandlingar ... |
SOU 2025:71 |
av de nackdelar som i dag finns med NPÖ överbryggas. Det som talar emot en sådan utveckling är om betydelsen av NPÖ minskar framöver i takt med att annat nyttjande av sammanhållen vårddoku- mentation ökar i och med införandet av nya vårdinformationssystem. I så fall, om nyttorna anses begränsade, kan vårdgivarnas incitament att investera i sådan funktionalitet minska. Det som å andra sidan starkt talar för en fortsatt utveckling av patientöversikter är kom- mande krav inom det europeiska hälsodataområdet på att dela infor- mation i form av patientöversikter inom EU/EES (se vidare 4.4.7 samt 8.13). Som framgår av tidigare avsnitt är det inte realistiskt att sammanhållen vård- och omsorgsdokumentation genom ett gemen- samt vårdinformationssystem löser frågan om delning av patientin- formation över läns-, region eller landsgränser. Samtidigt omfattar patientöversikter en begränsad mängd uppgifter vilket talar för ett fortsatt stort behov av att kunna dela information mellan flera vård- givare direkt inom ett mellan flera vårdgivare gemensamt vårdinfor- mationssystem. Sannolikt behövs därför under en överskådlig tid båda lösningarna, som komplement till varandra.
Även om det skulle införas krav på att alla vårdgivare ska ansluta sig till NPÖ kvarstår utifrån vad som redovisats ovan en hel del ut- veckling av NPÖ för att på ett entydigt och ändamålsenligt sätt dela uppgifter om läkemedelsbehandlingar och behandling med medicin- tekniska produkter. Det faktum att inte alla läkemedelsordinationer visas i nuläget och att det inte kopplas till vad som expedierats på apotek utgör en brist. För att alla läkemedel ska visas krävs, precis som vid en lösning som omfattar den nationella läkemedelslistan, ett visst utvecklingsarbete.
Regeringens tidigare bedömningar
Möjligheterna att dela information genom sammanhållen journal- föring (eller som det nu benämns sammanhållen vård- och om- sorgsdokumentation) har behandlats i propositionen som föregick patientdatalagen och i propositionen om sammanhållen vård- och omsorgsdokumentation.46,47
46Prop. 2007/08:126 Patientdatalag m.m.
47Prop. 2021/22:177 Sammanhållen vård- och omsorgsdokumentation.
SOU 2025:71 |
Möjligheter att elektroniskt dela information om fler läkemedelsbehandlingar ... |
Förarbeten till patientdatalagen
Regeringen anförde i propositionen Patientdatalag m.m. (prop. 2007/08:126) att obligatoriska krav på sammanhållen journal i hel- het eller i mer begränsade slag krävde sådana tekniska, organisato- riska och andra förutsättningar som då inte fanns inom hälso- och sjukvården. Regeringen anförde vidare att en tvingande lagstiftning riskerade att låsa fast utvecklingen i lösningar som inte skulle vara hållbara på sikt. Regeringen ansåg att regler som uttryckligen tillåter att journalföring sker sammanhållet över vårdgivargränser skulle stödja utvecklingen och därmed förbättra förutsättningarna till en säker och effektiv hälso- och sjukvård.48
Förarbeten till lagen om sammanhållen vård och omsorgsdokumentation
I samband med propositionen om en sammanhållen vård och om- sorgsdokumentation återaktualiserades frågan om obligatoriska krav. Flera remissinstanser, däribland SKR, ansåg att det borde vara krav på huvudmännen att upprätta system för sammanhållen vård- och omsorgsdokumentation, med syfte att säkerställa en god, effektiv och likvärdig vård och omsorg över landet.49 Regeringen anförde då i huvudsak samma argument som år 2007. Regeringen angav vidare att sjukvårdshuvudmännen i dag tillämpar bestämmelserna om sam- manhållen journalföring genom olika tekniska lösningar. Även om de flesta av sjukvårdshuvudmännen på något sätt har anslutit sig till system som möjliggör sammanhållen journalföring, så använder de möjligheten på olika sätt och i olika utsträckning. Regeringen anger att E-hälsomyndigheten visserligen lyfte fram i delredovisningen av uppdraget att föreslå hur sammanhållen journalföring kan nyttjas i större utsträckning, att frivilligheten att ansluta sig till sammanhållen journalföring är ett av hindren för dess funktionalitet. E-hälsomyn- digheten lyfte dock även fram andra hinder, såsom kostnaden för att ansluta sig som kan uppfattas som för hög för mindre vården- heter, eller att de tekniska förutsättningarna saknas och att kostna- derna för tekniska anpassningar är för höga visavi förväntad nytta med sammanhållen journalföring. E-hälsomyndigheten föreslår i
48Prop. 2007/08:126 Patientdatalag m.m., s. 87–88.
49Prop. 2021/22:177 Sammanhållen vård- och omsorgsdokumentation, s. 44.
Möjligheter att elektroniskt dela information om fler läkemedelsbehandlingar ... |
SOU 2025:71 |
slutrapporten av samma uppdrag, Sammanhållen journalföring, möj- ligheter till digital informationsförsörjning på hälsodataområdet ett visst mått av obligatorium för vissa prioriterade informationsmängder inom sammanhållen journalföring.50
Regeringen angav vidare att möjligheten till att upprätta system för sammanhållen vård- och omsorgsdokumentation är en del av ett långsiktigt utvecklingsarbete inom både region och kommun för att en säker och god vård och omsorg ska kunna tillhandahållas, samtidigt som enskildas integritetskänsliga uppgifter behandlas på ett sätt som tillgodoser fysiska personers skydd avseende behand- lingen av personuppgifter. Kommunerna och regionerna har också att ta ställning till i vilken utsträckning sammanhållen vård- och omsorgsdokumentation ska användas i deras verksamheter. Lagför- slaget möjliggör nationella, regionala eller lokala system.51 Reger- ingen landade därför i allt väsentligt i samma ställningstagande som tidigare. Sammanhållen journalföring ska vara frivillig.
I departementspromemorian om den nationella läkemedelslistan (Ds 2016:44) konstaterades bl.a. att sammanhållen journalföring skulle lösa många av de horisontella utmaningarna med delning av information om läkemedel mellan vårdgivare, men inte de vertikala mellan vård och apotek.52
En viktig faktor när det gäller sammanhållen journalföring, och som också saknas i Inera AB:s implementering, är att det inte räcker med att se viss information. Om man dessutom saknar information om vilken information som saknas finns stora risker att man tolkar uppgifterna fel och därigenom fattar fel beslut och att patientsäker- hetsrisker uppstår. En frivillig lösning måste därför alltid komplet- teras med en karta över vad som visas och vad som faktiskt inte visas. Detta gäller inte enbart för uppgifter om läkemedelsbehandling. Det har nu gått 16 år sedan propositionen om patientdatalagen lades fram för riksdagen. Trots detta har man inte på frivillig väg kunnat åstad- komma en delning av information som kan liknas vid en nationell infrastruktur.53
50A.a., s. 45.
51A.a., s. 46.
52Ds 20016:44 Nationell läkemedelslista, s. 155.
53Se även SOU 2024:33 Delad hälsodata – dubbel nytta, s. 199 ff.
SOU 2025:71 |
Möjligheter att elektroniskt dela information om fler läkemedelsbehandlingar ... |
7.3Att dela information mellan vårdgivare genom registret nationell läkemedelslista
Ett alternativ till att dela information om patienters läkemedelsbe- handling via sammanhållen vård- och omsorgsdokumentation är den nationella läkemedelslistan. Lagen (2018:1212) om nationell läkemedelslista innebär redan i dag skyldigheter att dela informa- tion om förskrivna och expedierade läkemedel och andra varor på öppenvårdsapotek. Lagen möjliggör för patienter, hälso- och sjuk- vårdspersonal och expedierande personal på öppenvårdsapotek att i vissa situationer och under i lagen angivna förutsättningar få direkt- åtkomst till uppgifter i registret. Lagen medger inte att information om läkemedel eller medicintekniska produkter som inte förskrivs delas genom registret. Inte heller medicintekniska produkter som förskrivs på annat sätt än via hjälpmedelskort är tillgängliga via den nationella läkemedelslistan (se avsnitt 5.3.4) I de följande avsnitten resonerar utredningen om för- och nackdelar om sådana möjligheter infördes.
7.3.1Fördelar med att dela information genom registret nationell läkemedelslista
Det finns vissa fördelar med att dela information om patienters be- handling med läkemedel eller medicintekniska produkter genom ett register som den nationella läkemedelslistan. Lagen är, till skillnad från när uppgifter delas genom SVOD, tvingande vilket innebär att samtliga vårdgivare måste kunna registrera förskrivningar, dvs. upp- gifter i bl.a. recept och hjälpmedelskort, och ta del av information
i registret. Genom skyldigheten att lämna dessa uppgifter uppstår inte de oklarheter med att frivilligt dela information som finns vid sammanhållen vård- och omsorgsdokumentation. Även om förskriv- ningar hänförliga till en patient hos en enskild vårdgivare alltid åter- finns i den vårdgivarens patientjournal så finns där, enligt vad som beskrivits tidigare, inte alltid uppgift om patientens samtliga förskriv- ningar och inte heller någon information om på öppenvårdsapotek uthämtade läkemedel eller medicintekniska produkter. Därmed blir konstruktionen med registret nationell läkemedelslista i nuläget över- lägsen sammanhållen journalföring vad gäller förskrivningar samt uthämtade läkemedel och andra varor. Registret har också fördelen
Möjligheter att elektroniskt dela information om fler läkemedelsbehandlingar ... |
SOU 2025:71 |
att det är tillgängligt för alla de aktörer som är berörda av förskriv- ningarna, det vill säga vårdgivare, öppenvårdsapotek och patienten själv. I den mån expedierande personal vid öppenvårdsapotek har behov av tillgång till uppgifter om sådan övrig läkemedelsbehandling eller behandling med medicintekniska produkter, där t.ex. läkeme- dlet administreras av hälso- och sjukvårdspersonal eller de medicin- tekniska produkterna inte förskrivs på hjälpmedelskort, är därmed registret en möjlig väg att utforska.
7.3.2Nackdelar med att dela information genom den nationella läkemedelslistan
En uppenbar nackdel med en registerlösning som nationell läkeme- delslista är att registret endast kan omfatta de specifika informations- mängder som regleras i lagen. I dag omfattar registret bara informa- tion om förskrivna och expedierade läkemedel och andra varor. För att kunna dela annan information genom registret behöver lagen ändras.
När det gäller hälso- och sjukvårdspersonalens behov av informa- tion om en patients behandling med läkemedel eller medicintekniska produkter krävs normalt tillgång till mer information än bara upp- gifter från själva ordinationen eller vad som framkommer av en för- skrivning (se avsnitt 5.2.2). Även om ett register som den nationella läkemedelslistan skulle utvidgas till att omfatta information om ordi- nationer av läkemedel och vissa medicintekniska produkter skulle det inte vara fullt tillräckligt för hälso- och sjukvårdspersonalens behov. Däremot skulle det ge tillgång till information som inte finns tillgänglig på andra sätt än genom att fråga patienten eller att ta direkt- kontakt med andra vårdgivare.
En annan nackdel med att dela uppgifter genom ett register som den nationella läkemedelslistan är att informationen om ordinatio- ner och förskrivningar lagras på olika platser (i journalen och i regist- ret) och riskerar att uppdateras asynkront. Därigenom finns en risk att ordinationerna i journalen och förskrivningarna i registret inte ger samma eller lika information. Problemet har diskuterats i flera år och än i dag är det otydligt och oklart vilken funktionalitet som faktiskt kommer att utvecklas på detta område, när det kommer att ske och vem som bär ansvar för att det sker. Samtidigt är just möjlig- heten till att åstadkomma samstämmiga uppgifter mellan journalens ordinationer och registrets förskrivningar det kanske största värdet
SOU 2025:71 |
Möjligheter att elektroniskt dela information om fler läkemedelsbehandlingar ... |
som den nationella läkemedelslistan i dess nuvarande utformning kan skapa när det kommer till förbättrad patientsäkerhet avseende förskrivna läkemedel. Det är inte självklart att samma vinster kan uppstå om man även genom registret skulle förmedla information om ordinationer av läkemedel eller medicintekniska produkter genom att upprätta en parallell dokumentation till patientjournalen. I dag är osäkerheten i den information som finns registrerad i förskriv- ningarna i den nationella läkemedelslistan om hur en patient ska använda sitt läkemedel så stor att flera aktörer, framför allt företrä- dare för hälso- och sjukvården, anser att den inte kan användas som underlag för vilka läkemedel en patient ska ta och hur. Detta är ett problem för både patienter, öppenvårdsapotek och vårdgivare som inte alltid har tillgång till samlad och komplett information direkt ur journalen (se avsnitt 7.2.2. avseende t.ex. brister i NPÖ). Öppenvårds- apotek baserar hela sitt arbete, och därmed sitt bidrag till patient- säkerheten, på den information som finns i förskrivningen. Öppen- vårdsapotek får inte ta del av information i patientjournalen. Att inte kunna lita på informationen i förskrivningen utgör därmed ett stort problem.
Samtidigt som den nationella läkemedelslistan vinner över sam- manhållen vård- och omsorgsdokumentation i täckningsgrad (den är obligatorisk) riskerar den att förlora i informationens korrekthet (när informationen i en förskrivning inte speglar senaste ordinations- ändring). Dessa brister ligger enligt vad utredningen erfar inte i hu- vudsak i de juridiska delarna utan i teknisk utveckling där de invol- verade aktörerna ännu inte kommit överens om vem som ska lösa vad och hur. Det är också i möjligheten till uppdaterad information som stora delar av den ekonomiska effekthemtagningen som redo- visades i departementspromemorian Nationell läkemedelslista ligger.54 Till dags dato har en mycket liten del av den effekthemtagningen realiserats.
54Ds 2016:44 Nationell läkemedelslista, s. 270 ff.
Möjligheter att elektroniskt dela information om fler läkemedelsbehandlingar ... |
SOU 2025:71 |
7.3.3Finns möjligheter till utveckling av registret nationell läkemedelslista?
För att kunna inkludera information om läkemedelsbehandlingar som inte förskrivs och som administreras av hälso- och sjukvårds- personal (inklusive vacciner), samt information om vissa andra medicintekniska produkter, skulle lagen behöva ändras. En sådan översyn kan bara vara aktuell om det kan anses ändamålsenligt att samla och tillgängliggöra uppgifterna på detta sätt. I propositionen om nationell läkemedelslista gjorde regeringen bedömningen att uppgifter om det som där benämndes rekvisitionsläkemedel i stället borde delas genom sammanhållen journalföring.55 När det gäller sådana förskrivningar av medicintekniska produkter som inte för- skrivs på hjälpmedelskort saknas däremot i dag en nationell infra- struktur. Sådan information delas inte heller vad utredningen erfar genom NPÖ, däremot finns regionspecifika tjänster att tillgå för beställning via 1177.se, t.ex. för region Stockholm.56 Ett arbete pågår vid Inera för en skapa en nationell tjänst för beställning. Tjäns- ten hämtar information från ordinationen i regionens källsystem.57 Utredningen har inte kunnat klarlägga hur den aktuella tjänsten eller informationsinnehållet förhåller sig till förbrukningsartiklar förskrivna på hjälpmedelskort och som registreras i den nationella läkemedelslistan.
En ändring av lagen om nationell läkemedelslista, för att åstad- komma insamling och delning även av uppgifter om läkemedelsor- dinationer och om medicintekniska produkter i större omfattning, skulle innebära bl.a. att ändamål med personuppgiftsbehandling och de uppgifter som får registreras behöver ses över. Därutöver behöver en integritetsavvägning göras huruvida det är proportionerligt att registrera och dela uppgifterna med de olika aktörerna.
Det finns utmaningar med implementeringen av den nationella läkemedelslistan i sin gällande lydelse. Det har nu gått sex år sedan lagen beslutades och det är tveksamt om utvecklingen de närmaste åren kommer leda till att visionen om en uppdaterad och gemensam bild mellan vård, apotek och patient helt infrias. Det finns därför
55Prop. 2017/18:223 Nationell läkemedelslista, s. 58 samt s. 216.
56https://www.1177.se/Stockholm/om-1177/nar-du-loggar-in-pa-1177.se/det-har-kan-du- gora-nar-du-loggat-in/bestall-forbrukningshjalpmedel-via-natet/, besökt 2024-10-21.
57Övertagande och vidareutveckling av regional tjänst inom hjälpmedelsområdet – Inera, besökt 2024-10-21.
SOU 2025:71 |
Möjligheter att elektroniskt dela information om fler läkemedelsbehandlingar ... |
skäl att noga överväga om registret nationell läkemedelslista är rätt sätt att dela information om alla ordinationer. Den nationella läke- medelslistan erbjuder däremot en unik möjlighet att dela informa- tion mellan hälso- och sjukvård och öppenvårdsapotek. Det är själv- klart att öppenvårdsapotek behöver tillgång till förskrivningar för att kunna expediera läkemedel, det är däremot enligt utredningens bedömning inte lika uppenbart att de nyttor som uppstår om apote- ken får tillgång till information om läkemedel som administrerats i vården är proportionerliga. I vilket fall inte i förhållande till vårdens egna behov av motsvarande information.
7.4Aspekter på patientens tillgång till information
All vård är till för patienten och det är helt centralt att en patient ges förutsättningar att använda sina läkemedel och medicintekniska produkter på rätt sätt. Därför är det rimligt att patienten som huvud- regel kan få tillgång till information om alla sina aktuella och pågå- ende läkemedelsbehandlingar, även de läkemedel patienten inte admi- nistrerar själv. Det är även rimligt att patienten kan ta del av en nationell sammanställning av förskrivna medicintekniska produkter inklusive förbrukningsartiklar, samt information om andra medicin- tekniska produkter som patienten är beroende av. Detta kan ske på olika sätt.
Patienter får som regel58 ta del av information både via den natio- nella läkemedelslistan och via patientjournalen. Vilka praktiska möj- ligheter som i dag finns för patienten att ta del av information om läkemedelsbehandlingar och medicintekniska produkter framgår bl.a. av avsnitt 4.2 och 5.3.6. De begränsningar i informationstäck- ning som redovisas för hälso- och sjukvårdspersonal via tjänsten nationell patientöversikt i avsnitt 7.2.2 gäller i allt väsentligt även när patienten ska ta del av informationen via e-tjänsten 1177 Journal.
58Information kan spärras gentemot patienten själv om det finns sekretesskäl för detta.
Möjligheter att elektroniskt dela information om fler läkemedelsbehandlingar ... |
SOU 2025:71 |
7.4.1Information om läkemedelsbehandlingar är en av flera viktiga informationsmängder för patienten
I avsnitt 5.1.3 beskrevs att hälso- och sjukvårdpersonal behöver till- gång till betydligt mer information än vad som framkommer i en läkemedelslista för att kunna ge god och patientsäker vård. För att patienten ska få ökad förståelse för sin samlade behandling behöver även patienten många gånger tillgång till mer information än enbart en läkemedelslista. Att enbart ha tillgång till den nationella läkeme- delslistan blir därför även för patienter med t.ex. flera diagnoser eller en komplex sjukdomssituation alltför begränsat. Att ha tillgång till en korrekt och komplett lista på aktuella läkemedelsbehandlingar är dock en viktig del i den samlade vårdinformationen. Som framgick i avsnitt 6.3 inkluderar det sådana läkemedel som administreras av hälso- och sjukvårdspersonal.
Genom e-tjänsten 1177 Journal kan patienten ta del av uppgifter inom flera olika informationsområden som diagnoser, anteckningar, labsvar, remisser, anteckningar och läkemedelsbehandlingar. Inera och E-hälsomyndigheten har i dag möjliggjort en koppling som gör att man som inloggad i endera tjänsten sömlöst kan byta mellan 1177 Journal och Läkemedelskollen. Informationen från Läkemedels- kollen är dock ännu inte integrerad eller kopplad till annan informa- tion i 1177 Journal utan läkemedelsinformation från journalen och den nationella läkemedelslistan presenteras som olika tjänster eller listor. Såvitt utredningen erfar är det på samma vis med Ineras kom- mande e-tjänst för förskrivningar av förbrukningsartiklar. Som pati- ent måste man då lägga pussel på samma sätt som hälso- och sjuk- vårdspersonalen.
Både SVOD och nationella läkemedelslistan fungerar
För att patienten ska få tillgång till samlad information om fler läke- medelsbehandlingar och behandling med medicintekniska produk- ter än i dag skulle det vara möjligt att överväga att tillgängliggöra uppgifterna genom registret nationell läkemedelista eller via en natio- nell e-tjänst med stöd av SVOD. För att kunna tillgängliggöra in- formationen i enlighet med SVOD behövs utifrån vad som beskri- vits ovan ingen ändring av befintlig lagstiftning. Däremot påverkas patienten av samma utmaning som hälso- och sjukvårdspersonalen
SOU 2025:71 |
Möjligheter att elektroniskt dela information om fler läkemedelsbehandlingar ... |
genom att det i dag är frivilligt för vårdgivarna att ansluta sig till Inera AB:s tjänster och dela information. Information från privata vårdgivare utan t.ex. vårdavtal med en region eller kommun kan inte heller delas via NPÖ. Därmed går det inte för patienten att veta om det som tillgängliggörs är en komplett bild av läkemedelsbehand- lingen. Detta gäller både ordinationer för förskrivna läkemedel och sådana läkemedel som administreras av hälso- och sjukvårdspersonal.
För att kunna samla och tillgängliggöra även andra uppgifter än de som finns i förskrivningar och som i övrigt omfattas av lagen om nationell läkemedelslista krävs en lagändring. I dag är alla vårdgivare skyldiga att registrera uppgifter om förskrivningar i registret natio- nell läkemedelslista. I den mån registret skulle omfatta fler informa- tionsmängder skulle det därmed sannolikt också medföra en skyl- dighet att registrera dessa.
Patienten behöver information från både ordinationen och förskrivningen
Patienten behöver information från både ordinationen och förskriv- ningen eftersom dessa till viss del innehåller olika uppgifter (se av- snitt 5.2.2 och 5.2.3). Ordinationen utgör information som kommer direkt från patientjournalen och ska därmed alltid vara uppdaterad. Ordinationen innehåller också t.ex. information om när behandlingen ska påbörjas och avslutas som inte alltid lika tydligt framgår av en förskrivning. Receptet speglar mycket, men inte all den information som ingår i ordinationen vid tidpunkten för utfärdandet. Receptet innehåller också annan information som krävs för expediering på apotek men som inte är en del av en ordination, t.ex. uppgifter som behövs för kostnadsreducering. När lagen (2018:1212) om nationell läkemedelslista träder i kraft i sin helhet kommer patienten i anslut- ning till uppgifter om förskrivningen även ha tillgång till uppgift om ordinationsorsak samt senaste datum för när läkemedelsbehand- lingen ska följas upp eller avslutas. För patienten är det viktigt att, utöver information om varför och hur denne ska använda sitt läke- medel och när behandlingen ska följas upp, veta vilka giltiga recept de har och hur många uttag som finns kvar på dessa.
När det gäller läkemedel som administreras i vården finns inga förskrivningar. För sådan information måste informationen hämtas direkt från ordinationen.
Möjligheter att elektroniskt dela information om fler läkemedelsbehandlingar ... |
SOU 2025:71 |
7.5Aspekter på utveckling och kostnader för att dela information
Det är viktigt att även beakta utvecklingsbehov och de ekonomiska konsekvenser som kommer av de alternativa lösningar för elektro- nisk informationsdelning som beskrivs ovan. För att kunna utbyta information mellan olika system och aktörer, oavsett lösning, krävs i grunden en interoperabilitet. I betänkandet Delad hälsodata – dubbel nytta beskrivs begreppet interoperabilitetslösning för hälso- och sjuk- vården som en återanvändbar resurs som beskriver rättsliga, orga- nisatoriska, semantiska eller tekniska förutsättningar, såsom kon- ceptuella ramverk, riktlinjer, referensarkitekturer, specifikationer, standarder, vissa tjänster och applikationer, samt dokumenterade tekniska komponenter, såsom källkod, som syftar till förmågan att ge eller få tillgång till personuppgifter hos andra vårdgivare genom ett elektroniskt system.59 Interoperabilitetslösningar krävs oavsett om informationen delas mellan olika aktörer genom SVOD eller genom registret nationell läkemedelslista. I dag finns tekniska lös- ningar på plats hos vissa aktörer och i vissa it-system för att utbyta information om ordinationer inom ramen för Inera AB:s e-tjänster NPÖ och 1177 Journal. Tekniska lösningar för att fullt ut utbyta information med registret nationell läkemedelslista är under utveck- ling. De lösningar som Inera implementerat är något äldre än lös- ningarna för den nationella läkemedelslistan och de bygger på andra standarder.
Enligt E-hälsomyndigheten tillåter ofta de tjänstekontrakt som används för att försörja NPÖ med information att informationen har olika struktur och innehåll. Vidare uppges tolkningen vara olika av vilken information som faktiskt avses inom vissa informations- mängder. Detta spelar mindre roll när informationen ska läsas av en människa via NPÖ, men försvårar enligt myndigheten påtagligt fram- tida datadrivna tjänster. Denna utmaning beror endast delvis på hur Nationella tjänsteplattformen är konstruerad. Bristen på enhetligt strukturerad information uppstår även i verksamheternas informa- tionssystem och i de sätt som vårdens medarbetare dokumenterar.60 E-hälsomyndigheten föreslår i sin rapport kring utvecklingen av
59SOU 2024:33 Delad hälsodata – dubbel nytta, s. 379.
60E-hälsomyndigheten, 2021, Ökat nyttjande av sammanhållen journalföring Möjligheter, ut- maningar och behovet av digital informationsförsörjning i dag och i framtiden, dnr 2021/01681, s. 59.
SOU 2025:71 |
Möjligheter att elektroniskt dela information om fler läkemedelsbehandlingar ... |
NPÖ att staten ska stimulera förändring på området genom över- enskommelser med SKR och regeringsuppdrag till myndigheter.61 Myndigheten avstår dock från att skatta kostnaderna.
Genom kommande krav på att även dela viss information om läkemedelsbehandlingar genom patientöversikter inom EU/EES kommer sannolikt ytterligare krav ställas på interoperabilitet som kanske går utöver vad som redan är implementerat (se avsnitt 4.4.7). Det är utredningens bedömning att både lösningar som innebär att information delas genom e-tjänster som bygger på SVOD och lös- ningar som innebär informationsdelning genom registret nationell läkemedelslista kommer kräva utveckling, såväl verksamhetsmässigt som av it-system. Det kan dock konstateras att kostnaderna för att anpassa separata journalsystem som hanterar ett mer avgränsat om- råde av läkemedelsbehandlingar, som i t.ex. tandvården eller nuklear- medicin, kan framstå som mer svårmotiverade än för ett separat sy- stem som hanterar läkemedel för behandling av till exempel cancer. Detta måste beaktas vid genomförande av förslag som syftar till att skapa en komplett översikt. Som tidigare framgått är det dock vik- tigt att eventuella avgränsningar i vilken information som inte visas också tydligt framgår av källorna.
61E-hälsomyndigheten, 2021, Sammanhållen journalföring – Möjligheter till digital informa- tionsförsörjning på hälsodataområdet, dnr 2021/01681, s. 55 ff.
8En ny nationell infrastruktur för information om en patients läkemedelsbehandling och användning av vissa medicintekniska produkter
Utredningen ska enligt direktiven analysera och ta ställning till om och hur uppgifter om ordination och administrering av sådana läke- medel som patienter får vid behandling inom hälso- och sjukvården, inklusive vacciner, kan läggas till i nationell läkemedelslista samt ana- lysera och ta ställning till om uppgifter om medicintekniska pro- dukter kan läggas till, och i så fall vilka produkter. Utredningen ska också analysera och ta ställning till vilka som bör kunna ta del av uppgifterna och på vilket sätt tillgång ska ges.
Utredningen har i kapitel 6 beskrivit behovet av en samlad bild av en patients behandling som inkluderar information om läkemedel en patient får administrerade i vården samt vissa medicintekniska produkter. I kapitel 7 beskrivs möjligheterna att dela ytterligare in- formation om läkemedel och vissa medicintekniska produkter genom sammanhållen vård- och omsorgsdokumentation eller genom regi- stret nationell läkemedelslista. I detta kapitel beskrivs utredningens bedömningar och resonemang om en utökad nationell läkemedelslista och hur detta kan realiseras. Behovet av, och hur information om vaccinationer kan delas, behandlas särskilt i kapitel 9.
I avsnitt 8.1 beskrivs relationen mellan en nationell läkemedelslista och patientjournalen. I avsnitt 8.2 till och med 8.4 behandlas upp- gifter om en patients läkemedelsbehandlingar och i avsnitt 8.5 till och med 8.8 behandlas uppgifter om patientens behandling med, eller användning av, medicintekniska produkter. Därefter avhandlas för produktkategorierna gemensamma frågeställningar om informa-
401
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
tionsdelning och åtkomst i avsnitt 8.9 till och med 8.11. Kapitlet avslutas med ett resonemang om hur utredningens bedömningar förhåller sig till bl.a. tidigare utredningars förslag och EU-förord- ningen om det europeiska hälsodataområdet.
I detta kapitel avses med hälso- och sjukvårdspersonal sådan perso- nal som arbetar i hälso- och sjukvårdsverksamhet, utom apoteksper- sonal. När apotekspersonal avses framgår det uttryckligen i texterna.
8.1En nationell sammanställning över ordinerade och förskrivna produkter är ett viktigt komplement till patientjournalen
Utredningens bedömning: En nationell sammanställning över en patients läkemedelsbehandling och behandling med eller an- vändning av vissa medicintekniska produkter som är tillgänglig för patienten och berörd hälso- och sjukvårdspersonal är av pati- entsäkerhetsskäl ett viktigt komplement till den dokumentation som finns i vårdgivarens patientjournal.
Som framgått av tidigare kapitel räcker det sällan att ha tillgång till enbart information om vilka läkemedel eller medicintekniska pro- dukter som tidigare förskrivits eller ordinerats patienten, för att fatta ett nytt beslut om en patients vård.1 Det krävs tillgång även till annan information, såsom patientens sjukdomshistoria, allmän- tillstånd, symtom, laboratorieresultat m.m. (se även avsnitt 5.1.3 samt 6.4.1). Om en patient sökt vård tidigare finns sådan informa- tion i patientjournalen. En sammanställning över läkemedelsbehand- lingar och användningen av medicintekniska produkter är dock ett viktigt komplement som kan ge vägledning när information ur t.ex. en enskild patientjournal inte är tillgänglig eller informationen är fragmenterad och spridd över flera olika system eller journalhand- lingar. Med ledning av en sådan lista kan kompletterande informa- tion inhämtas direkt från patienten, närstående eller, vid behov, på annat sätt från en annan vårdgivare än genom elektronisk åtkomst till dennes patientjournaler. Tillgång till sådan information minskar
1Se t.ex. 6 kap. 2 § Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordination och hantering av läkemedel i hälso- och sjukvården.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
risken för överlappande eller konkurrerande ordinationer vilka med- för patientsäkerhetsrisker.
Dagens informationsdelning är inte tillräcklig
Patientjournalen består av en samling journalhandlingar, avgränsas till en enskild patient och förs separat hos varje vårdgivare. Ibland kan journalhandlingar hos samma vårdgivare förvaras i flera olika it-system som inte alltid kan utbyta information (se även avsnitt
5.1samt 8.4.4). Även om flera regioner tagit initiativ till att införa gemensamma journalsystem för flera vårdgivare, med möjlighet att dela information över vissa vårdgivargränser, så finns det inget som tyder på att vi i framtiden kommer ha en samlad nationell patient- journal. Inera AB:s e-tjänst nationell patientöversikt, förkortad NPÖ, ger för närvarande inte en komplett bild. Dels för att all journalin- formation inte inkluderas i NPÖ, dels för att inte alla vårdgivare är anslutna. Det är också upp till den som ansluter sig till tjänsten att bestämma vilka system man vill ansluta och vilka uppgifter man vill dela. Vilka uppgifter som varje ansluten vårdgivare delar skiljer sig därför åt. Även om information om ordinerade och förskrivna läke- medel redan i dag tekniskt kan delas via NPÖ är det således inte säkert att det sker. I de fall det i NPÖ anges att en region delar informa- tion om läkemedelsordinationer och/eller förskrivna läkemedel innebär det inte heller alltid att alla ordinationer och/eller förskriv- ningar från alla regionens olika it-system delas. Det förekommer sällan information i tjänsten om vad som gäller i detta avseende.
Utifrån ovanstående kan utredningen konstatera att det finns situationer när hälso- och sjukvårdspersonal riskerar att stå utan tillgång till, eller med endast fragmentarisk information om ordi- nerade och förskrivna läkemedel och medicintekniska produkter.
Detta försvårar arbetet och innebär, om informationen inte inhäm- tas på annat sätt, en patientsäkerhetsrisk t.ex. om patienten får två läkemedel mot samma åkomma eller två läkemedel som interagerar på ett olyckligt sätt. I värsta fall leder dubbelmedicinering, överdo- sering eller interaktioner till att patienten behöver akut vård. Upp- gifterna i de olika patientjournalerna behöver vara åtkomliga för andra vårdgivare för att täcka deras behov av information. Utred- ningen bedömer att de i dag inte är det i tillräckligt stor utsträckning.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
Det faktum att patientens journal hos varje vårdgivare utgör de mest välgrundade källorna till patientens vårdhistoria innebär dock inte att andra informationskällor är oviktiga.
Det har under lång tid, av patientsäkerhetsskäl, pekats på behovet av en nationell samlad bild över en patients läkemedelsbehandling. Tydliga tecken på detta är de brister i läkemedelsbehandlingen som framkommer i vetenskapliga studier (se bl.a. 8.2.1 nedan) och de arbeten som pågått under drygt 20 års tid för att skapa en gemen- sam nationell läkemedelslista. Även riksdagens uttalande från år 2017 bekräftar behovet.2 Det finns, av patientsäkerhetsskäl, krav i föreskrifter på att hälso- och sjukvårdspersonal ska inhämta infor- mation bl.a. om vilka läkemedel en patient använder inför nya beslut om läkemedelsanvändning.3 Utredningens bedömning är att en nationell källa till sådan information bör underlätta arbetet och att uppfylla kraven och därmed bidra till patientsäkerheten. En ibland förekommande invändning mot en nationell sammanställning är att det kan bli oöverskådligt och svårarbetat för hälso- och sjukvårds- personal om informationen presenteras separat utan tillräckligt tek- niskt stöd för att analysera och använda informationen.4 Utredningen instämmer i att den risken finns och frågan behandlas bl.a. i avsnitt
8.10nedan samt i kapitel 15. Samtidigt är det viktigt att sätta lösningen med en nationell sammanställning av information i relation till hur situationen är i dag. Kravet att inhämta information om annan på- gående behandling, och dokumentera denna, gäller även om det inte finns någon nationell sammanställning. Denna informationsinsam- ling torde vara en än större utmaning för hälso- och sjukvårdsperso- nalen. Målsättningen måste dock fortsatt vara att hitta tekniska lös- ningar som förenklar arbetet och presenterar den sammanställda informationen på ett användarvänligt sätt.
I takt med att den nationella infrastrukturen på hälsodataområdet utvecklas bedömer utredningen att fler informationsmängder succe- sivt kan tillgängliggöras genom olika nationella och europeiska e-tjäns- ter. En nationell läkemedels- och medicintekniklista måste ses i detta perspektiv. Utredningen bedömer därför att en nationell samman- ställning över en patients läkemedelsbehandling och behandling
2Vissa frågor om läkemedelsregistret, 2017/18:SoU2.
3Se bl.a. 6 kap. 2 § Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordination och hantering av läkemedel i hälso- och sjukvården.
4Se bl.a. Den nationella läkemedelslistan riskerar att bli en administrativ fälla, Läkartidningen.se publicerad 2024-03-28.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
med eller användning av vissa medicintekniska produkter som är tillgänglig för patienten och berörd hälso- och sjukvårdspersonal av patientsäkerhetsskäl är ett viktigt komplement till den dokumen- tation som finns i vårdgivarens patientjournal.
8.2Det behövs samlad information om en patients läkemedelsbehandlingar
Utredningens bedömning: Det behov av en nationell samman- ställning över patienters läkemedelsbehandling som konstate- rades av riksdagen år 2017 är alltjämt aktuellt. Dagens nationella läkemedelslista uppfyller inte detta behov, varken avseende om- fattning eller tekniska lösningar. Det behövs av patientsäkerhets- skäl en nationell sammanställning av uppgifter om patienters läkemedelsbehandlingar, som innehåller mer än bara förskrivna och expedierade läkemedel.
En nationell läkemedelslista där flera aktörer kan få en samlad bild av en patients läkemedelsanvändning5 har länge varit en vision inom e-hälsoarbetet. Arbetet har pågått i drygt 20 år. Det omfattar bl.a. arbeten som Patientens läkemedelslista6, Nationell ordinationsdata- bas, Rätt information på rätt plats i rätt tid (SOU 2014:23), Nästa fas i e-hälsoarbetet (SOU 2015:32), och departementspromemorian Nationell läkemedelslista (Ds 2016:44).7
Riksdagens socialutskott betonade i samband med att lagen om nationell läkemedelslista beslutades år 2018 vikten av ett nationellt helhetsgrepp när det gäller patientsäkerhet och läkemedelsanvänd- ning. Utskottet framhöll de nyttor som den nationella läkemedels- listan behövde skapa, i form av förbättring av patientsäkerheten och en överblick av läkemedelsanvändningen.
5Läkemedelsanvändning ska här tolkas som ett brett begrepp och avser de läkemedel en patient är ordinerad eller själv valt att använda och inte begränsas till vilka läkemedel en patient faktiskt använder.
6CareLink, 2005, Patientens Läkemedelslista, PALL.
7Se bl.a SOU 2015:32 Nästa fas i e-hälsoarbetet, s. 281 samt Ds 2016:44 Nationell läkemedels- lista, s. 142 ff.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
Utskottet noterar det pågående arbetet med anledning av förslagen i promemorian Nationell läkemedelslista (Ds 2016:44) och påminner om att man i det arbetet bör beakta behovet av ett nationellt helhets- grepp när det gäller patientsäkerhet och läkemedelsanvändning. Läke- medelsbehandlingar är förenade med stora risker för komplikationer, och för den enskilda patienten kan fel ordination av läkemedel eller en olämplig kombination av läkemedel leda till allvarliga konsekvenser för liv och hälsa. Enligt utskottet behövs en tydlig nationell styrning för att säkra hanteringen av information vid läkemedelsbehandlingar. För att uppnå en verklig förbättring av patientsäkerheten och överblicken över läkemedelsanvändningen bör regeringen därför snarast fullfölja arbetet med att ta fram en nationell läkemedelslista och återkomma till riksdagen med förslag. Riksdagen bör ställa sig bakom det som utskottet anför och tillkännage detta för regeringen.8
Det övergripande målet med en nationell läkemedelslista i den depar- tementspromemoria som föregick regeringens proposition uppgavs vara att skapa en samlad bild av en patients läkemedelsbehandling, oavsett var i landet patienten har ordinerats eller hämtat ut sina läke- medel. Förslaget avgränsades dock till att omfatta endast förskrivna läkemedel och andra varor.9,10 I promemorian konstaterades dock att det föreligger ett tydligt behov för hälso- och sjukvårdspersonal att ha tillgång till information om alla pågående läkemedelsordina- tioner, för att bl.a. förhindra interaktioner och ge möjlighet att be- döma effekter och bieffekter.11 Vidare angavs att det för vissa sjuk- domstillstånd, såsom t.ex. cancer, multipel skleros eller reumatoid artrit, är förhållandevis vanligt att receptförskrivna läkemedel och läkemedel som administreras patienten i samband med hälso- och sjukvård, ingår i en och samma läkemedelsbehandling.12 Av en analys som Myndigheten för vårdanalys presenterade år 2014 framgår att dessa patienter ofta har olika vårdgivare och att patienterna i regel behöver konsumera vård på flera olika vårdnivåer. Dessa omständig- heter minskar enligt myndigheten sannolikheten för att hälso- och sjukvårdspersonal kan få en komplett bild av patientens pågående behandlingar i patientjournalen.13 Sedan rapporten skrevs har fram-
8Vissa frågor om läkemedelsregistret, 2017/18:SoU2.
9Andra varor avser förbrukningsartiklar som förskrivs på hjälpmedelskort, dvs. medicin- tekniska produkter, och livsmedel för särskilda medicinska ändamål som förskrivs på livs- medelsanvisning för expediering på öppenvårdsapotek.
10Ds 2016:44 Nationell läkemedelslista, s. 164–165 samt s. 254.
11A.a., s. 67 ff.
12A.a., s. 253.
13Myndigheten för vårdanalys, 2014, VIP i vården? – Om utmaningar i vården av personer med kronisk sjukdom.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
för allt regionerna arbetat med att utveckla sammanhållen vård- och omsorgsdokumentation för att på så sätt möjliggöra delning av upp- gifter mellan olika vårdgivare inom regionens huvudmannaansvar.
Samtidigt har specialiseringen av vården, vilket leder till att patienter rör sig över region- och vårdgivargränser, ökat. Det är svårt att vär- dera hur slutsatserna från år 2014 står sig i dag men klart är att alla vårdgivare än så länge inte sömlöst kan dela vårdinformation även om situationen sannolikt, genom utökad användning av möjligheterna till sammanhållen vård- och omsorgsdokumentation, är bättre än för tio år sedan. I ett av skälen till EU-förordningen om det europeiska hälsodataområdet anges bl.a. att hälso- och sjukvårdspersonal på grund av bristande interoperabilitet i många fall inte kan få tillgång till sina patienters fullständiga patientjournaler och därmed inte kan fatta optimala medicinska beslut om diagnos och behandling.14
Av departementspromemorian framgår vidare att det framför allt är information om två subgrupper bland de läkemedel som överläm- nas eller administreras i hälso- och sjukvården som det är angeläget att skapa åtkomst till. Det rör dels läkemedel som administreras patienten i öppenvård och som har effekt över lång tid och därmed innebär en utdragen interaktionsrisk, dels läkemedel som admini- streras patienten i öppenvården och som ingår i samma substans- grupp som motsvarande receptförskrivna läkemedel men där det kan bero på lokala terapitraditioner eller – om läkemedlen är medi- cinsk likvärdiga – upphandlingsrelaterade skäl vilket läkemedel som patienten får ordinerat.15 Skälet till att dessa läkemedel inte omfatta- des av det slutliga förslaget till nationell läkemedelslista var att upp- gifterna bedömdes betydligt svårare att aggregera och föra över i ett fast och strukturerat format än uppgifter om receptförskrivna läke- medel.16 I den efterföljande propositionen angavs att ett övergri- pande mål med registret är att skapa en samlad källa av en patients förskrivna läkemedel och andra varor samtidigt som patientens behov av integritetsskydd tillgodoses. Den nationella läkemedelslistan för- väntas bidra till ökad patientsäkerhet och en effektivisering av arbets- momenten vid ordination och förskrivning av läkemedel.17 Helhets- perspektivet gick därmed förlorat.
14Skäl 19 till förordningen (EU) 2025/327 om det europeiska hälsodataområdet.
15Ds 2016:44 Nationell läkemedelslista, s. 253.
16A.a., s. 254.
17Prop. 2017/18:223 Nationell läkemedelslista, s. 1.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
I flera remissvar på promemorian påtalades som en brist att det föreslagna registret nationell läkemedelslista inte utgör en helhets- bild om det inte omfattar en patients alla läkemedelsbehandlingar.
Remissinstanserna pekade framför allt på att listan i det första steget inte skulle omfatta sådana läkemedel som administreras av hälso- och sjukvårdspersonal eller på annat sätt ges i en hälso- och sjukvårds- situation.18
Ikraftträdandet har skjutits fram flera gånger
Lagen (2018:1212) om nationell läkemedelslista har vid tidpunkten för denna utredning ännu inte trätt i kraft i sin helhet. Tidpunkten för ikraftträdande av bl.a. 9 kap. 1 §, där det anges att den som be- driver verksamhet inom hälso- och sjukvården ska ha direktåtkomst till registret nationell läkemedelslista och i samband med elektronisk förskrivning kunna lämna vissa i lagen angivna uppgifter till registret, har skjutits fram vid två tillfällen.19 Sveriges kommuner och regio- ner inkom återigen under hösten 2024 med en hemställan om att skjuta delar av det återstående ikraftträdandet på framtiden då de anser att tidplanen varit orimlig.20 En lagrådsremiss som behandlar framskjutandet behandlas under våren 2025 (se även avsnitt 4.1).21 Berörda aktörer, både vårdgivare och öppenvårdsapotek, har så här långt investerat betydande resurser i systemutveckling för att kunna ansluta till registret. Det återstår dock ytterligare teknisk utveckling, implementering och eventuell förändring av arbetsprocesser för att de av riksdagen och andra aktörer utpekade nyttorna ska kunna rea- liseras. Framför allt förmågan att koppla ihop ordinationer och för- skrivningar beskrivs från vårdgivarehåll vara central för att kunna nå en förbättrad patientsäkerhet (se bl.a. avsnitt 4.2.6 samt 15.3.3).
18Se t.ex. remissvar från Sveriges kommuner och landsting, Läkarförbundet, Apotekarsocieteten, Nätverket Sveriges Läkemedelskommittéer, Region Örebro län, Region Östergötland och Region Skåne (Socialdepartementets dnr S2017/00117/FS).
19Prop. 2019/20:158 Senarelagt införande av nationell läkemedelslista och bastjänstgöring för läkare samt prop. 2022/23:57 Senarelagd anslutning till nationell läkemedelslista.
20Sveriges kommuner och regioner, 2024, Hemställan om åtgärder för att uppnå en effektiv anslutning till Nationella Läkemedelslistan, dnr SKR2024/01292.
21Lagrådsremiss, Åtgärder för en effektiv och patientsäker anslutning till den nationella läkemedelslistan.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
De uttalade behoven kvarstår
Utredningen konstaterar att de i departementspromemorian och av Socialutskottet utpekade behoven och nyttorna med en nationell sammanställning över en patients läkemedelsbehandling kvarstår.
I utredningens direktiv uttrycker regeringen en tydlig ambition att fortsatt stärka patientsäkerheten och ta steg mot en nationell data- infrastruktur.
Nedan beskrivs kortfattat behovet av en samlad bild av en patients läkemedelsbehandling med läkemedel utifrån patientens, hälso- och sjukvårdens och apotekens perspektiv. En djupare analys av de olika aktörernas behov finns i kapitel 6.
När utredningen fortsättningsvis använder begreppet ”en samlad bild av en patients läkemedelsbehandling” avses det ovanstående ut- pekade övergripande målet med en nationell sammanställning. När utredningen avser den läkemedelslista innehållande förskrivna och expedierade läkemedel och varor som beslutats och nu implemen- teras används begreppen ”registret nationell läkemedelslista” eller ”lagen om nationell läkemedelslista”.
8.2.1Patientperspektivet
Patienternas behov av information om läkemedel som administreras i vården beskrivs närmare i avsnitt 6.2. För att en patient ska kunna vara delaktig i sin vård och klara delar av, eller hela behandlingen på egen hand behöver patienten ha tillgång till aktuell och uppdaterad information om sina pågående behandlingar. I en holländsk studie från år 2016, bland äldre patienter som behandlades med mer än fem samtidiga läkemedel, visade det sig att endast 15 procent av patient- erna korrekt kunde minnas indikationen för samtliga förskrivna läkemedel.22
Patienten behöver förstå vad det övergripande målet med och förväntade resultatet av läkemedelsbehandlingen är. Det inkluderar sådan behandling som patienten får administrerad eller överlämnad av hälso- och sjukvårdspersonal. Mer specifikt behöver patienten information som omfattar bland annat hur mycket av ett läkemedel
22Bosch-Lenders D., Maessen D.W., Stoffers H.E., Knottnerus J.A., Winkens B., van den Akker M., Factors associated with appropriate knowledge of the indications for prescribed drugs among community-dwelling older patients with polypharmacy. Age Ageing. 2016 May;45(3):402-8. doi: 10.1093/ageing/afw045. Epub 2016 Mar 24. PMID: 27013501.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
som ska tas, hur ofta och länge det ska tas, hur och varför läkemedlet ska tas och om det är något annat patienten ska tänka på vid använd- ningen. Det sista kan exempelvis vara att inta läkemedlet i samband med måltid eller att inte ta läkemedlet samtidigt som ett annat läke- medel intas för att undvika oönskad interaktion. Det är också viktigt att patienten känner till tecken på att läkemedlet har avsedd effekt eller, om sådana kan noteras, tecken på att behandlingen inte fun- gerar och att förnyad kontakt ska tas med vården. Patienten behöver också veta vem den ska kontakta vid eventuella frågor om sin be- handling. För enkelhet och överskådlighet behöver denna informa- tion om läkemedelsbehandlingen presenteras samlad. En påläst och välinformerad patient har sannolikt lättare att följa instruktioner och råd som vård- och apotekspersonal ger och får därigenom ett bättre vårdresultat. Detta stöds bl.a. av en systematisk översikt från år 2011 som visar att låg hälsolitteracitet förknippas med sämre hälsoresultat och sämre användning av hälso- och sjukvårdstjänster.23 I en amerikansk studie från år 2005 kunde man också visa att nöjd- heten, kunskapen och självförtroendet kring behandling korrelerade med ökad kunskap om läkemedelsbehandlingen.24 Det synes därmed finnas stöd för betydelsen av patientens tillgång till information och kunskap om sin behandling. För patientsäkerheten är det också av vikt eftersom patientens kunskap om och förståelse för behandlingen bidrar till minskad risk för felanvändning av förskrivna läkemedel.
Användningen av e-tjänster i Sverige är hög
Undersökningar visar att majoriteten av den svenska befolkningen använder internet och e-tjänster. Det är endast 4 procent av befolk- ningen som är 16 år eller äldre som inte använder internet.25 E-tjäns- ter inom hälso- och sjukvårdsområdet kommer högt upp på listan över de mest använda tjänsterna, näst efter Skatteverkets e-tjänster.26 Åtta av tio i befolkningen uppger att de använder e-tjänster för sjuk-
23Berkman N.D., Sheridan S.L., Donahue K.E., Halpern D.J., Crotty K., Low health literacy and health outcomes: an updated systematic review. Ann Intern Med. 2011 Jul 19;155(2):97-107. doi: 10.7326/0003-4819-155-2-201107190-00005. PMID: 21768583.
24Burge S., White D., Bajorek E., Bazaldua O., Trevino J., Albright T., Wright F., Cigarroa L., Correlates of medication knowledge and adherence: findings from the residency research network of South Texas. Fam Med. 2005 Nov–Dec;37(10):712-8. PMID: 16273450.
25Internetstiftelsen, Svenskarna och internet 2023, s. 7.
26Internetstiftelsen, Svenskarna och internet 2021, s. 41.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
vården.27 Även om användningen varierar något mellan ålders- grupperna är användningen närmare 80 procent för alla födda efter 1950 och i åldersgruppen födda 1920–1940 är användningen över 55 procent.28 Fram till pensionsåldern är det fler kvinnor än män som nyttjar e-vårdtjänster men efter pensionering är det i stället fler män än kvinnor som gör det.29 Samtidigt som användningen av e-tjänster är hög uttrycker många pensionärer en önskan att kon- takten med myndigheter och sjukvård var enklare på nätet.30 Lik- nande slutsatser har dragits av t.ex. utredningen om digital post.31
Det är sannolikt att i takt med att dagens yngre blir äldre kom- mer användningen av e-tjänster i de äldre åldersgrupperna öka ytter- ligare. Det är dock enligt utredningens bedömning viktigt att tidigt involvera personer från olika åldersgrupper och med olika funktions- variationer vid utveckling av e-tjänster och introduktion av ny tek- nik så att så många som möjligt kan använda och ta hjälp av tjäns- terna. Detta gäller i synnerhet på hälso- och sjukvårdsområdet där de som är svagast också kan ha det största behovet av sjukvård.
För att patienten ska kunna ta del av uppgifter om sin behandling behövs en e-hälsotjänst. I dag finns som tidigare beskrivits 1177 Journal och Läkemedelskollen med de begräsningar i informations- innehåll som dessa tjänster medför. Utredningen resonerar vidare kring en patientportal i avsnitt 8.13.6.
Patienten rör sig mellan regioner, vårdgivare och vårdnivåer
Patienter rör sig i dag i större utsträckning mellan vårdenheter, vård- givare och vårdnivåer vilket innebär att dokumentation om patien- tens behandlingar kan finnas hos olika vårdgivare eller inom olika organisatoriska enheter eller vårdprocesser hos en och samma vård- givare (se även avsnitt 6.1.1). Viss journalinformation tillgänglig- görs i dag genom e-tjänsten 1177 Journal, men den informationen är inte heltäckande (se bl.a. 7.2.2 samt 7.4). Många vårdgivare är t.ex. inte anslutna till tjänsten eller har valt att inte dela viss infor- mation där. Så som tjänsten i dag är utformad är det inte helt enkelt
27Internetstiftelsen, Svenskarna och internet 2023, s. 32.
28A.a., s. 32.
29A.a., s. 33.
30A.a., s. 17.
31SOU 2024:47 Digital myndighetspost, s. 99 ff.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
att som patient få en helhetsuppfattning av vilken information som visas och inte visas, även om det för varje informationsområde med viss möda går att utreda. Vissa vårdgivare, t.ex. de som utför företags- hälsovård och försäkringsvård, tillåts i dag inte heller dela information via tjänsterna då de inte utför offentligt finansierad vård.32 För pati- enten innebär ovanstående att det är svårt att få en överblick över informationen och att veta om den information som presenteras är komplett. Om denna tjänst ska kunna utgöra underlag för att för- enkla, förbättra och göra patientens vård mer säker behöver infor- mationstäckningen öka. Företrädare för flera patientorganisationer som utredningen haft dialog med lyfter att för närvarande måste patienten själv eller anhöriga agera budbärare av information mellan vårdgivare och att det ansvaret utgör en börda.33
Patienter får läkemedel på recept och genom hälso- och sjukvården
Patientens medicinska behandling avgränsas inte till enbart läke- medel och andra varor som förskrivs och expedieras från öppen- vårdsapotek. Patienten kan få läkemedel och medicintekniska pro- dukter både genom att de förskrivs eller genom åtgärder som t.ex. administrering eller att de tillförs patienten i hälso- och sjukvården. Det förekommer att patienter får läkemedelsbehandlingar som inne- fattar både receptförskrivna läkemedel och läkemedel som behöver administreras i, eller som överlämnas i samband med, hälso- och sjukvård. Som framgick redan i departementspromemorian Nationell läkemedelslista, år 2016, finns det läkemedelsbehandlingar som, om de kunnat formuleras så att patienten kunnat använda dem själv, sannolikt hade förskrivits.34 Som angetts tidigare finns det också sjukdomsområden där det är vanligt förekommande med en kom- bination av läkemedel som administreras i hälso- och sjukvården och läkemedel som förskrivs, t.ex. vid MS, reumatisk sjukdom eller
32Det är inte fullt klargjort vad som är bakgrunden till att vissa privata aktörer inte får ansluta till Ineras tjänster (se SOU 2023:13 s. 237) men då tjänsterna tillhandahålls offentliga vård- givare genom det s.k. Teckal-undantaget (se 3 kap. 12–16 §§ LOU) finns viss risk att ett för stort inslag av privata aktörer skulle påverka kommuners och regioners möjligheter att nyttja tjänsterna utan offentlig upphandling. Se även Inera AB, Anslutning av tredjepartsprodukter
– Huvudrapport (2021).
33Protokoll från dialog om utveckling av den nationella läkemedelslistan, Komm2023/00650/S 2023:09-16.
34Ds 2016:44 Nationell läkemedelslista, s. 253.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
cancer. Det förekommer också att vissa regioner vid onkologisk be- handling och samtidig avancerad sjukvård i hemmet inom ramen för den vården delar ut läkemedel som hade kunnat förskrivas direkt till patienten, samtidigt som andra läkemedel förskrivs till patienten från den lokala vårdcentralen.
Läkemedel som administreras eller delas ut av hälso- och sjuk- vårdspersonal finns i dag inte med i registret nationell läkemedels- lista. Det finns därför flera orsaker till att patientens bild av pågå- ende behandling kan vara fragmenterad. För att ge patienterna en bättre helhetsbild av sin medicinska behandling behövs därför en nationell sammanställning som omfattar mer än bara förskrivna och expedierade läkemedel. Att detta presenteras för patienten på ett peda- gogiskt sätt är dock av stor betydelse och berörs närmare längre fram.
Integritetsskyddet ska upprätthållas
Samtidigt som patienten behöver kunna få tillgång till mer omfattande information om sin behandling behöver insamling och delning av sådana uppgifter ske på ett sätt som säkerställer att patientens rätt till integritet upprätthålls. All hälso- och sjukvårdspersonal behöver inte, och får inte, alltid veta allt om patienten. Till exempel behöver inte en undersköterska som hjälper en patient med stomi i hemsjuk- vård få del av information om patientens läkemedelsbehandling mot cancer för att kunna genomföra åtgärden, se vidare nedan. Patienten behöver kunna påverka andra personers tillgång till sin information, samtidigt som det är viktigt av patientsäkerhetsskäl att behörig vård- personal inte begränsas i tillgången till nödvändig information.
Tillgång till journalinformation regleras bl.a. i patientdatalagen (2008:355). Där anges att den som arbetar hos en vårdgivare får ta del av dokumenterade uppgifter om en patient endast om han eller hon deltar i vården av patienten eller av annat skäl behöver upp- gifterna för sitt arbete inom hälso- och sjukvården.35 En vårdgivare ska dessutom bestämma villkor för tilldelning av behörighet för åtkomst till sådana uppgifter om patienter som förs helt eller delvis automatiserat. Sådan behörighet ska begränsas till vad som behövs för att den enskilde ska kunna fullgöra sina arbetsuppgifter inom
354 kap. 1 § patientdatalagen (2008:355).
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
hälso- och sjukvården.36 När information samlas in till registret nationell läkemedelslista regleras tillgången till uppgifterna i lagen (2018:1212) om nationell läkemedelslista. För hälso- och sjukvård- personals direktåtkomst till uppgifter i registret krävs patientens samtycke. Samtycket utgör där en integritetshöjande åtgärd.
Vid en vidareutveckling som möjliggör samlad tillgång till fler uppgifter om behandlingar med läkemedel och medicintekniska produkter har integritetsfrågorna fortsatt en central roll.
8.2.2Vårdperspektivet
För att hälso- och sjukvårdspersonal ska kunna ge individuellt an- passad, god och säker vård utgör tillgång till uppdaterad och korrekt information om en patients pågående och ibland tidigare och plane- rad behandling en viktig faktor (se avsnitt 6.4). Hälso- och sjuk- vårdspersonalen står dock för närvarande inför samma utmaningar som patienten vid eftersökande av denna information med ibland fragmenterad vård som utförs av flera olika vårdgivare och på flera vårdnivåer. Ett tydligt sådant exempel är när Kriminalvården och Statens institutionsstyrelse inom ramen för sin verksamhet får an- svar för nya patienter då dessa kommer från olika geografiska om- råden i Sverige (se avsnitt 5.4.2 och 5.4.3). Komplexiteten i hur hälso- och sjukvården organiserats och vilket utbud av alternativa vårdgivare som finns samt hur detta påverkar dokumentationen i patientjournalen varierar dock mellan olika regioner. Situationen påverkas också av vilken typ av vård patienten har behov av då t.ex. vårdval eller försäkringsvård är vanligare inom vissa sjukdomsom- råden än andra. Den information som hälso- och sjukvårdspersonal kan inhämta via e-tjänster, såsom Inera AB:s tjänst nationell patient- översikt, är inte fullständig (se även avsnitt 7.2).
Flertalet regioner kan i dag elektroniskt dela information mellan många av regionens egna vårdverksamheter. Flera regioner har också ambitionen att samma vårdinformationssystem ska delas mellan flera vårdgivare inom regionen och att vårdgivarna därigenom lättare ska kunna dela patientuppgifter mellan sig (se även avsnitt 7.2.1).37 Fak- tum kvarstår dock att ovanstående inte utgör en lösning för hur
364 kap. 2 § ovan nämnda författning.
37Nätverket för Sveriges it-direktörer, 2023, it och digitalisering i hälso- och sjukvården 2023, s. 15–16.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
uppgifter ska kunna delas mellan vårdgivare i olika regioner, natio- nellt eller inom EU genom t.ex. det europeiska hälsodataområdet (se även avsnitt 4.4.7). Det finns inte förutsättningar för ett natio- nellt eller internationellt gemensamt vårdinformationssystem. Möj- ligheterna att dela information måste därför även bygga på andra principer.
I avsnitt 6.1.1 redogör utredningen för vad som är känt kring patientrörligheten mellan olika vårdgivare. Även om rörligheten inte är omfattande sett till den procentuella andelen av all vård som utförs förväntas den i framtiden att öka genom t.ex. ökade krav på vårdgaranti, vårdförmedling och ytterligare specialisering och kon- centrering av vård. Det finns inte vad utredningen känner till några rapporter som värderar informationsbehovet kring de patienter som får vård inom en och samma vårdgivare och de som rör sig mellan olika vårdgivare med olika vårdinformationssystem. I det enskilda fallet kan det dock vara nog så viktigt att av patientsäkerhetsskäl känna till samtlig läkemedelsbehandling.
Det finns enligt utredningens bedömning således för närvarande ett behov för hälso- och sjukvårdpersonal hos vårdgivare i såväl regional, kommunal, statlig och privat regi att i större omfattning kunna ta del av och att dela information om patienters läkemedels- behandlingar (se t.ex. 5.4 angående statliga vårdgivares behov). Detta framgår också bland annat av vad Sveriges Läkemedelskommittéer, LOK, angav i sitt remissvar när departementspromemorian Nationell läkemedelslista, remitterades. Där framfördes att en sammanhållen läkemedelslista är ett av vårdens mest angelägna behov och är grund- läggande för en säker läkemedelsanvändning.38
8.2.3Apoteksperspektivet
Personal på öppenvårdsapotek har behov av information om en pati- ents pågående läkemedelsbehandlingar för att på ett patientsäkert sätt kunna expediera läkemedel och ge råd om läkemedelsanvänd- ning (se även avsnitt 6.5). Det är grundläggande för apoteksperso- nalens utförande av dessa uppgifter att de kan inhämta information om patientens förskrivna läkemedel och om till patienten tidigare
38Nätverket Sveriges Läkemedelskommittéer, Nationell läkemedelslista – synpunkter från LOK, (dnr Komm2023/00650/S 2023:09-30.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
expedierade förskrivna läkemedel.39 Genom bestämmelser i lagen (2018:1212) om nationell läkemedelslista kommer expedierande personal på öppenvårdsapotek, när vårdgivarna fullt ut är anslutna till registret, i samband med expediering av ett recept med patien- tens samtycke även kunna ta del av uppgift om ordinationsorsak. Detta kommer att ge apotekspersonalen bättre förutsättningar att bidra till en säkrare läkemedelsanvändning för patienten genom att de t.ex. kan kontrollera doseringen.40 När farmaceuten bedömer om doseringen är rimlig behövs ofta information om vilket eller vilka sjukdomstillstånd som motiverar insättningen av läkemedlet. I dag saknas uppgift om behandlingsändamål ofta på förskrivningen och tillgång till den mer precisa uppgiften ordinationsorsak möjliggör för apotekspersonalen att bättre förstå syftet med behandlingen, vilket annars inte alltid är självklart.
Det är tydligt att det som i första hand underlättar arbetet för expedierande personal på öppenvårdsapotek, och ökar patientsäker- heten, är tillgång till aktuella och uppdaterade uppgifter om patien- tens förskrivningar och i vissa fall tillgång till information från den bakomliggande ordinationen. Som framgår av avsnitt 6.5.1 finns också situationer då personal vid öppenvårdsapotek skulle ha nytta av ytterligare information om vad som hänt vid ett vårdtillfälle eller vilka läkemedel en patient regelbundet får administrerade av hälso- och sjukvårdspersonal.
8.2.4Utredningens bedömning
Sammantaget gör utredningen bedömningen att det sedan tidigare identifierade behovet av en samlad bild över en patients läkemedels- behandling kvarstår och ännu inte är uppfyllt. Det finns därför behov av en nationell sammanställning över en patients läkemedelsbehand- ling som omfattar mer än bara förskrivna och expedierade läkemedel och vissa andra varor. Utredningen lägger denna bedömning till grund för det fortsatta utvecklandet av förslag i syfte att stärka förutsätt- ningarna för en ny, utökad, nationell läkemedelslista som medför förbättringar av patientsäkerheten genom minskad risk för felaktig
39Se 8 kap. 11 § andra stycket Läkemedelsverkets föreskrifter (HSLF-FS 2021:75) om förordnande och utlämnande av läkemedel och teknisk sprit.
40Se prop. 2017/18:223 Nationell läkemedelslista, s. 109.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
läkemedelsanvändning. Vilka aktörer som bör ha tillgång till upp- gifterna behandlas närmare i avsnitt 8.11.
8.3Vad behöver en nationell sammanställning av en patients läkemedelsbehandling innehålla?
Bedömning: En nationell sammanställning av en patients läke- medelsbehandling bör innehålla uppgifter om ordinerade läke- medel som förskrivits, överlämnats på annat sätt eller admini- strerats i hälso- och sjukvården. Den bör också omfatta uppgifter om förskrivna läkemedel som expedierats på öppenvårdsapotek.
Det övergripande målet med en nationell läkemedelslista var enligt departementspromemorian Nationell läkemedelslista att skapa en samlad bild av en patients läkemedelsbehandling, oavsett var i landet patienten har ordinerats eller hämtat ut sina läkemedel.41
En samlad bild av en patients läkemedelsbehandling omfattar mer än enbart de läkemedel som förskrivs på recept och som expe- dieras på öppenvårdsapotek, som i dag ingår i registret nationell läke- medelslista. Detta beskrevs också i departementspromemorian (se avsnitt 8.2 ovan). Många patienter behandlas parallellt med förskrivna läkemedel också kontinuerligt med andra läkemedel som administre- ras eller överlämnas av sjukvårdspersonal. Läkemedel administreras eller överlämnas också i samband med att patienten är inskriven för vård (se avsnitt 5.2.7). Behovet av information om åtminstone vissa av de läkemedel som administreras eller överlämnas av sjukvårds- personal uppmärksammades redan i den nämnda departementspro- memorian. Där beskrevs att förutsättningarna för patientsäkerheten
iläkemedelsprocessen kan bli ännu bättre om hälso- och sjukvårds- personal och patienten också får åtkomst till andra informations- mängder om patientens läkemedelsanvändning, t.ex. uppgifter om rekvisitionsläkemedel som ordineras i öppenvården.42 Som framgår av avsnitt 8.2 ovan och kapitel 6 finns det för flera aktörer behov av samlad information om fler läkemedelsbehandlingar än om bara de läkemedel som förskrivs på recept. I avsnitt 8.2 konstaterar utred- ningen att det alltjämt behövs en samlad bild av en patients läke-
41Ds 2016:44 Nationell läkemedelslista, s. 1.
42A.a., s. 247.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
medelsbehandling. I det följande analyserar utredningen omfatt- ningen av detta närmare.
När en patient ordineras läkemedel dokumenteras detta i patien- tens journal. Information i en patientjournal kan hos en vårdgivare vara spridd över flera olika vårdinformationssystem, det gäller även information om ordinerade läkemedel. För att möjliggöra en samlad bild av en patients läkemedelsbehandling behöver därför information om ordinationer hämtas från de olika delarna av patientjournalen, både i Sverige och på sikt även ur patientjournaler i andra EU-länder.
Som konstaterades i avsnitt 8.1 innehåller patientjournalen fler uppgifter som är av betydelse för patientens vård. I framtiden kan insamlingen av information om ordinerade läkemedel kompletteras med inhämtande och tillgängliggörande av annan information om patientens vård som är av betydelse för utredning och behandling, och som tillhandahålls genom nationella eller internationella tjänster, t.ex. obligatoriska patientöversikter. Sådana krav kommer med in- förandet av EU-förordningen om det europeiska hälsodataområdet.43
8.3.1Information om ordination av förskrivna läkemedel
Som framgår av kapitel 5.2 är uppgifter som anges vid ordinationen och annan information i journalen central för all läkemedelsbehand- ling. I departementspromemorian Nationell läkemedelslista redogörs för behovet och nyttan av att ha samstämmiga uppgifter i en ordi- nation och i det recept som utfärdas med anledning av ordinatio- nen.44 Det nuvarande registret nationell läkemedelslista innehåller information om förskrivna och expedierade läkemedel. På grund av att det för närvarande saknas systemstöd, måste en förskrivning i registret nationell läkemedelslista i dag uppdateras manuellt när den bakomliggande ordinationen ändras på ett sätt som också påverkar förskrivningen. Ett sådant manuellt arbete är förenat med utma- ningar då ett samlat ordinationsunderlag saknas. Det tar dessutom tid från annat patientrelaterat arbete, vilket får till konsekvens att annan vård trängs undan. Ingen myndighet, systemleverantör eller vårdgivare har i nuläget visat på en lösning där ordinationer och förskrivningar med teknikens hjälp, på ett patientsäkert sätt och
43Förordningen (EU) 2025/327 om det europeiska hälsodataområdet.
44Nationell läkemedelslista, Ds 2016:44, s. 183.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
med beaktande av gällande ansvarsförhållanden, både hålls uppda- terade och bidrar till att åtgärda eventuella skillnader.
Informationen i läkemedelsordinationen är central för hälso- och sjukvårdspersonal
Om alla uppgifter från ordinationen av ett förskrivet läkemedel tillgängliggörs i en nationell sammanställning, åstadkommer man ett bättre informationsunderlag för både patienten och för hälso- och sjukvårdpersonalen. Detta gäller framför allt när patienter rör sig över vårdgivargränser och när det inte finns möjlighet till elek- tronisk åtkomst inom t.ex. ett och samma vårdinformationssystem genom sammanhållen vård- och omsorgsdokumentation.
Även om det innebär ett arbetsmoment för hälso- och sjukvårds- personalen att ta del av och analysera information från ordinationerna, innebär det att man får del av information direkt från patientjourna- len, och att uppgifterna därmed är uppdaterade och aktuella. Vård- personal har en skyldighet att inhämta information om bl.a. pågående läkemedelsbehandling inför t.ex. inskrivning och nya behandlings- beslut. Ordinationsinformation för förskrivna läkemedel inkluderar även t.ex. dosjusteringar av insulinbehandlingar, också då det utförts av sjuksköterskor45 (se avsnitt 5.2.2). Sådan information är viktig att ha tillgång till bl.a. i samband med kommunal hälso- och sjukvård och hemsjukvård. När hälso- och sjukvårdspersonal i fler fall får tillgång till information om tidigare ordinationer innebär det också att patienten slipper vara bärare av informationen. Ambitionen måste vara att åstadkomma en effektiv informationshantering där uppgif- terna så långt möjligt med tekniskt stöd kan hanteras direkt i patient- journalen.
Patienten bör på samma sätt som hälso- och sjukvårdspersona- len beredas möjlighet att ta del av samlad, uppdaterad och korrekt information om sin läkemedelsbehandling. Företrädare för flera patientorganisationer som utredningen haft dialog med lyfter just att patienten själv eller anhöriga i dag får agera budbärare av medi- cinsk information och att det upplevs som en börda.46
45Sjuksköterskor är behöriga att i vissa fall justera en ordination inom givna ramar men saknar behörighet att förskriva många läkemedel vilket gör att de aldrig har möjlighet att uppdatera t.ex. doseringsinformationen på ett recept.
46Protokoll från dialog om utveckling av den nationella läkemedelslistan, Komm2023/00650/S 2023:09-16.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
Inrättandet av det europeiska hälsodataområdet
De patientöversikter som utgör en prioriterad kategori för elektro- niska hälsodata med personuppgifter för primäranvändning enligt EU-förordningen om det europeiska hälsodataområdet innefattar bl.a. uppgifter om patientens aktuella och relevanta tidigare läke- medelsbehandlingar.47 Vad exakt som avses med detta är ännu inte helt klart men kommer att framgå av genomförandeakter som kom- missionen ska anta senast den 26 mars 2027.48 Utredningens bedöm- ning är dock att det kan antas omfatta sådana läkemedel som en patient behandlas med och som kan vara relevanta att känna till vid beslut om ny eller annan behandling. Detta stöds av t.ex. de beskriv- ningar av patientöversikter som tidigare tagits fram av det europeiska e-hälsonätverket i samband med patientrörlighetsdirektivet. Där framgår att det rör sig om relevanta förskrivna läkemedel där behand- lingens längd utifrån ordinationen fortfarande är aktuell eller läke- medel som påverkar nuvarande hälsostatus eller är av betydelse för ett kliniskt beslut.49 Sådan information bör enligt utredningens be- dömning inte vara avgränsad till enbart receptförskrivna läkemedel. Det bör därmed även kunna omfatta sådana läkemedelsgrupper som administreras regelbundet i hälso- och sjukvården, i samband med t.ex. cancerbehandling, multipel skleros, reumatisk sjukdom, vissa psykiatriska behandlingar etc. och som berörs av vår utrednings arbete. Vilka läkemedel som förskrivs varierar också mellan olika EU-länder. Vissa läkemedel som förskrivs i Sverige hanteras t.ex.
i våra grannländer Danmark och Norge som sjukhusläkemedel och distribueras inte via öppenvårdsapotek. Information från ordinatio- nen behövs även för förskrivna läkemedel eftersom behandlingen kan fortgå även efter det att ett recept är slutexpedierat. Det finns alltså även ur dessa perspektiv behov av att skapa möjligheter att tillgängliggöra information om ordinerade förskrivna läkemedel likväl som vissa läkemedel som administreras av hälso- och sjuk-
47Artikel 14 och bilaga I till förordningen (EU) 2025/327 om det europeiska hälsodata- området.
48Artikel 15.1 förordningen (EU) 2025/327 om det europeiska hälsodataområdet.
49”Relevant prescribed medicines whose period of time indicated for the treatment has not yet expired whether it has been dispensed or not, or medicines that influence current health status or are relevant to a clinical decision”, se eHealth Network Guideline on the electronic exchange of health data under Cross-Border Directive 2011/24/EU, Patient Summary, Release 3.3, June 2023.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
vårdspersonal t.ex. vid cancerbehandling, behandling av MS eller reumatologiska sjukdomar.
Nuvarande tjänster fyller inte behovet
Information från vissa läkemedelsordinationer tillgängliggörs för närvarande via andra e-tjänster i den nationella patientöversikten, förkortat NPÖ, och i 1177 Journal. Läkemedelsinformationen i NPÖ eller 1177 Journal så som den ser ut i dag utgör inte en natio- nell sammanställning av en patients läkemedelsbehandlingar då allt- för få vårdgivare presenterar information samt att vissa vårdgivare inte tillåts ansluta till tjänsten (se vidare 7.2.2). I de fall vårdgivare anges vara anslutna till NPÖ eller 1177 Journal innebär det inte heller att ordinationer från alla olika vårdinformationssystem hos vårdgiva- ren visas. E-tjänsterna har även andra begränsningar genom att t.ex. privata vårdgivare utan offentlig finansiering inte kan ansluta och att NPÖ i dag enbart visar upp en läsbar bild med information vilket till del försvårar arbetet för hälso- och sjukvårdspersonalen.
Information om läkemedelsordinationer bör läggas till i en nationell sammanställning
Information om läkemedelsordinationer bör i en nationell samman- ställning komplettera de redan befintliga uppgifterna om förskrivna och uthämtade läkemedel som finns i registret nationell läkemedels- lista. Ordinationen utgör grunden till förskrivningen och utgör vik- tig information om behandlingen som kan fortgå även efter att ett recept är slutexpedierat. Tillsammans ger dessa informationsmängder en mer fullständig bild av en patients läkemedelsbehandling.
Att dessa ordinationer och förskrivningar görs tillgängliga gemen- samt är viktigt, men det behöver inte innebära att det förenklar vår- dens eller öppenvårdsapotekens arbetsprocesser. Utan en teknisk koppling mellan ordination och förskrivning, som möjliggör att informationen kan konsumeras på ett effektivt sätt, finns risk både för att arbetet blir onödigt tidskrävande och för att det introduce- rar nya patientsäkerhetsrisker (se även avsnitt 15.3.3). Detta ställer krav på it-lösningar som stödjer både hälso- och sjukvårdpersona- lens, apotekspersonalens och patientens möjligheter att konsumera
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
informationen. För apotekspersonalen och patienten räcker det inte att lägga till ordinationsinformation och fortsatt låta informa- tionen i förskrivningarna vara felaktiga (se även om apoteksperso- nalens tillgång till ordinationsinformation i 8.11).
Sammanfattningsvis bedömer utredningen att en nationell sam- manställning behöver innehålla såväl information om förskrivna och expedierade läkemedel som information om de ordinationer förskrivningarna grundar sig på.
Det finns ett fortsatt behov av ökad överensstämmelse mellan ordinationer och förskrivningar
En mer omfattande sammanställning av en patients läkemedels- behandling, som inkluderar uppgifter från ordinationer av förskrivna läkemedel, innebär inte att behovet av att uppgifterna i en förskriv- ning överensstämmer med uppgifterna i den bakomliggande ordina- tionen upphör. Tvärtom är det fortfarande angeläget att detta löses på ett tillfredställande sätt. Det var också en bärande idé i det ur- sprungliga förslaget till en nationell läkemedelslista.50
Patientperspektivet
Patienten har tillgång till skriftlig information om sin läkemedels- behandling från förskrivningen, de listor över läkemedelsordina- tioner som patienten får utskrivna i vården, apoteksetiketten och ibland även genom sin direktåtkomst till information i journalen via 1177 Journal. Det medför en onödig patientsäkerhetsrisk om patienten får olika uppgifter om samma behandling beroende på var patienten hämtar informationen. Att, såsom görs på vissa informa- tionsplattformar i dag, enbart informera patienten om att den in- formation som tillgängliggörs möjligen inte är komplett, är i läng- den inte trovärdigt för hälso- och sjukvårdssystemet som helhet. Patienten kan genom en sådan tillämpning inte på ett enkelt sätt förstå vilka uppgifter som har samlats och tillgängliggjorts, och vilka som eventuellt har utelämnats. Strävan måste vara att uppnå överensstämmelse i de uppgifter som tillgängliggörs på olika ställen.
50Se Ds 2016:44 Nationell läkemedelslista, s. 144 samt prop. 2017/18:223 Nationell läke- medelslista, s. 184.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
Öppenvårdsapotek använder receptuppgifter som utgångspunkt för expediering av läkemedel. Uppgifterna där ligger därför till grund för såväl den farmaceutiska bedömning som görs i samband med en expediering, som för patientens rättigheter till förmån. Om exempel- vis den ordinerade doseringen av ett läkemedel ökas utan att ett ite- rerat recept ändras leder det dels till att den expedierade mängden läkemedel inte kommer att räcka så länge som det var avsett, dels till att patienten därigenom kan få svårt att hämta ut mer av sina läke- medel inom förmån. Den farmaceutiska bedömningen riskerar också att bli fel vid en sådan ändring eftersom apotekspersonalen kom- mer att utgå från en för låg dos vid sin bedömning. Även om apo- tekspersonal ofta kan lösa diskrepanserna i informationen i dialog med patienten är det en diskussion som egentligen inte är värde- skapande och skulle kunna undvikas i en sammanhängande vårdkedja. Dessutom är det information från receptet som påförs den apoteks- etikett som klistras på läkemedelsförpackningen. Avsikten med infor- mationen på etiketten är att patienten ska kunna använda den som stöd för sin läkemedelsanvändning. Det är av bl.a. dessa skäl viktigt att informationen i ordinationen och förskrivningen stämmer överens.
Det behöver dock poängteras att en fullständig överensstämmelse enligt ovan sannolikt inte går att nå så länge informationen inte hämtas från en enda källa, t.ex. genom att patienten har en QR-kod eller motsvarande på sin läkemedelsförpackning som länkar till upp- gifterna i en ordination. Detta är i dag inte möjligt, men är en intres- sant utveckling att undersöka i den fortsatta digitaliseringen. Det skulle dock kräva omställningar i regelverk och processer. Så som systemet med förskrivningar fungerar i dag, med eller utan en natio- nell läkemedelslista, finns alltid en risk att en ordinationsändring sker och ska effektueras under den tid som förflyter mellan att för- skrivningen utfärdas och att patienten hämtar ut läkemedlet på ett apotek. Den information som då finns på utskrivna papperslistor eller på den etikett som är fäst på läkemedelsförpackningen kommer i sådana fall fortsatt att vara inaktuell. Det finns därför fortsatt ett stort behov av personliga möten och mänsklig kommunikation för att patienten ska vara väl förtrogen med vad som är en avsedd och korrekt behandling. Detta utgör enligt utredningens bedömning inte ett argument emot att sträva efter att informationen i olika källor stämmer överens i så stor utsträckning som möjligt.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
Patientsäkerhetsarbete handlar om att ständigt minimera risker, även om riskerna ändå kan finnas kvar i viss omfattning.
Den fortsatta utvecklingen av tekniska lösningar och hur infor- mationen presenteras måste göras i nära samråd med dem som ska använda informationen så att de tekniska lösningarna stödjer arbets- processerna och på bästa sätt bidrar till patientens möjlighet till en ändamålsenlig och säker läkemedelsanvändning. Utredningen utveck- lar detta närmare i kapitel 15.
Vårdperspektivet
Hälso- och sjukvårdspersonal med behörighet att förskriva läke- medel beskriver utmaningar med att informationen i ordinationer och recept inte överensstämmer (se vidare bl.a. 15.3.3). Personalen ser dock även andra utmaningar som t.ex. ansvarsfrågan när en ordi- nation ändras, utan att motsvarande ändring genomförs i en redan utfärdad förskrivning. Vem har då ansvar för vad när något går fel? En annan utmaning uppstår när en ordination avslutas och avsikten är att patienten omedelbart ska avsluta medicineringen, men en giltig förskrivning fortfarande finns tillgänglig för patienten, eller om pati- enten helt enkelt har kvar av det expedierade läkemedlet hemma. Av bl.a. dessa anledningar är det ur vårdperspektivet viktigt att vad som framgår av en läkemedelsordination och en förskrivning stämmer överens i så stor grad som möjligt.
Ovanstående utmaningar kanske inte helt kan lösas genom att nationellt tillgängliggöra information om både ordinationer och för- skrivningar. Till viss del skulle sannolikt en bättre koppling mellan recept och ordination kunna förenkla samordning av recept och ordi- nationer. I dag kräver all ändring och makulering av recept manuellt arbete vilket upplevs tidskrävande. En heltäckande lösning på proble- met kommer kanske inte finnas förrän förskrivningen helt kan av- skaffas och att expediering av läkemedel till patient på öppenvårds- apotek kan ske med ordinationen som grund. Utredningens arbete och förslag når här inte ända fram, men genom en stegvis utveckling med fokus på tillgängliggörande av information ökar möjligheten till en framtida lösning där ordinationsinformation för samtliga för- skrivna läkemedel, från alla vårdgivare, tillgängliggörs nationellt.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
Apoteksperspektivet
Apotekspersonal framför i den enkätundersökning utredningen genomfört att ett problem med registret nationell läkemedelslista är att det där i, för samma patient, är vanligt att det ligger flera ”parallella” recept avseende samma läkemedel men med olika styr- kor och dosering. Problemet finns även beskrivet i den vetenskap- liga litteraturen. I en svensk artikel från år 2022, baserad på struk- turerade intervjuer med 327 patienter, konstaterades t.ex. att nio procent av förskrivningarna var dubbletter och tre procent hade felaktig dosering.51 Även undersökningar genomförda av Sveriges apoteksförening indikerar att problemet är omfattande. Under en vecka år 2021 fokuserade öppenvårdsapotek på signalen dubbel- medicinering i det elektroniska expertstödet som apoteken använ- der vid expediering och som hittar fall där det finns recept på läke- medel med samma verkan. Det genererades 400 000 sådana signaler under veckan varav en tredjedel bedömdes utgöra recept som inte skulle användas.52
Problemet med dubbletter kan uppstå t.ex. genom att doseringen för ett förskrivet läkemedel ändras varpå ett nytt recept utfärdas, utan att tidigare recept makuleras53 av förskrivaren (se även avsnitt 15.3.5). Det förekommer också att nya recept utfärdas för samtliga aktuella förskrivningar, ofta kallat receptförnyelse, fastän bara något av receptens giltighetstid gått ut, eller samtliga läkemedel på ett recept är uttagna. Ett sådant beteende stimuleras sannolikt av att det är mer effektivt både för förskrivare och patient att förnya alla recept samtidigt i samband med en medicinsk bedömning än att göra det när varje enskilt recept tar slut. Detta kan också drivas av patienten eftersom de ofta får betala en egenavgift per förnyelse-
51Hammar T., Mzil L., Eiermann B., Discrepancies in patients’ medication lists from phar- macies in Sweden: an interview study before the implementation of the Swedish National Medication List. Int J Clin Pharm. 2023 Feb;45(1):88-96. doi: 10.1007/s11096-022-01480-x. Epub 2022 Oct 28. PMID: 36307661; PMCID: PMC9938824.
52https://sverigesapoteksforening.se/finn-fem-fel-hur-manga-felaktiga-recept-finns-det/, besökt 2024-08-15.
53Recept utgör ett underlag för expediering på öppenvårdsapotek. Att makulera, eller ta bort ett recept, är inte författningsmässigt reglerat men får till konsekvens att en patient inte längre kan hämta ut läkemedlet med det aktuella receptet på apotek. Att makulera ett recept påver- kar inte läkemedelsordinationen. Ett recept kan makuleras både av en förskrivare och perso- nal på öppenvårdsapotek, se vidare https://www.ehalsomyndigheten.se/yrkesverksam/makulering- av-e-recept/, besökt 2024-11-06.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
tillfälle, inte per förnyad förskrivning.54 Flera parallellt giltiga recept avseende samma läkemedel men med olika dosering utgör ett reellt patientsäkerhetsproblem. Flera identiska dubbletter utgör snarare en administrativ börda då det i varje enskilt fall krävs en utredning av om det föreligger skillnader som behöver beaktas. Att slentrian- mässigt expediera det äldsta receptet först kan också utgöra en pati- entsäkerhetsrisk t.ex. då det receptet har störst sannolikhet att ha en avvikande dosering.
Apotekspersonalen uppger i den av utredningen genomförda enkätundersökningen att omständigheten att apotekspersonal sak- nar tillgång till den bakomliggande ordinationen, för att med hjälp av uppgifterna där kunna bedöma vad som är korrekt information, utgör ett problem. Ordinationen utgör dock journalinformation. Enligt gällande lagstiftning är sådan dokumentation inte åtkomlig för apotekspersonal (se vidare avsnitt 8.11.3).55 Ett annat, och mer ändamålsenligt sätt, att lösa detta problem är att åstadkomma att informationen i ordinationen och förskrivningen så långt möjligt stämmer överens. Vid förskrivning till människa ska förskrivaren ange samtliga uppgifter så tydligt att risk för feltolkning undviks och att patienten kan använda läkemedlet på rätt sätt (se 5.2.3). Här kan effektiva tekniska lösningar förenkla förskrivarens arbete.
8.3.2Det räcker inte med information om förskrivna läkemedel
Det främsta syftet med tillgång till mer komplett information om patientens läkemedelsbehandlingar som administreras eller över- lämnas i hälso- och sjukvården är att den som ska ta ställning till patientens fortsatta behandling har kännedom om läkemedelsbehand- lingar som vid det aktuella vårdtillfället påverkar, eller kan komma att påverka, patientens hälsotillstånd. Detta är viktigt bl.a. för att kunna bedöma risken för läkemedelsinteraktioner. Som tidigare konstaterats (se avsnitt 6.3, 6.4 samt 8.2 ovan) räcker det då inte med information om enbart förskrivna och expedierade läkemedel för att skapa en, för framför allt patienten och hälso- och sjukvården,
54Se t.ex. https://regionsormland.se/contentassets/ab6bed21f8fa41d3b5bbedd26f120b75/avgifter_202 4.pdf, besökt 2024-11-20.
55Se patientdatalagen (2008:355) och lagen (2023:913) om sammanhållen vård- och omsorgs- dokumentation.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
relevant och samlad bild av en patients läkemedelsbehandling som bidrar till ökad patientsäkerhet. För att åstadkomma en sådan samlad bild behöver även information om läkemedel som administreras av hälso- och sjukvårdspersonal eller på annat sätt ges i en hälso- och sjukvårdssituation läggas till. Vissa sådana läkemedel används och utövar sin effekt under en mycket begränsad period och är förmod- ligen av mindre betydelse att ha information om i en samlad bild. Andra läkemedel ges återkommande eller kan ha effekt som sitter i över tid och påverkar eller kan påverka annan utredning eller be- handling, t.ex. med andra läkemedel (se avsnitt 6.3.2 samt 6.4.1). Det är utredningens bedömning att i första hand läkemedel med ihållande effekt som har betydelse för pågående och kommande behandling bör framgå av en samlad bild över en patients läkemedels- behandling. Det stämmer också överens med den beskrivning som det europeiska e-hälsonätverket gör av aktuella och relevanta tidigare använda läkemedel i europeiska patientöversikter.56 Där framgår att en patientöversikt ska innehålla uppgifter om relevanta förskrivna läkemedel där behandlingens längd utifrån ordinationen fortfarande är aktuell eller läkemedel som påverkar nuvarande hälsostatus eller är av betydelse för ett kliniskt beslut.57 De närmare detaljerna för vad som kommer att gälla enligt EU-förordningen om det europeiska hälsodataområdet kommer anges i framtida genomförandeakter. Ur ett juridiskt perspektiv är det viktigt att den reglering utredningen föreslår är förenlig med EU-förordningen eftersom möjligheterna till nationell särreglering i och med denna är begränsad. I den fram- tida utvecklingen av lösningar är det också ur ett resurs- och effek- tivitetsperspektiv viktigt att försöka hitta och ta till vara så många synergier som möjligt mellan de förslag som bl.a. denna utredning lämnar och de krav som kommer av EU-förordningen om det europeiska hälsodataområdet (se även avsnitt 8.13.1 samt 8.13.4).
Utredningen bedömer att på sikt även information om andra, mer kortverkande, läkemedelsbehandlingar bör tillgängliggöras. Även patienter inskrivna för vård flyttas mellan olika vårdgivare och det finns situationer när det är av relevans att ta del även av information om mer kortverkande läkemedelsbehandlingar som ges t.ex. när pati-
56Se Artikel 14 och bilaga I förordningen (EU) 2025/327 om det europeiska hälsodata- området samt eHealth Network Guideline on the electronic exchange of health data under Cross-Border Directive 2011/24/EU, Patient Summary, Release 3.3, June 2023.
57eHealth Network Guideline on the electronic exchange of health data under Cross-Border Directive 2011/24/EU, Patient Summary, Release 3.3, June 2023, s. 24.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
enten är inskriven för vård, även om det också kan finnas andra pro- cesser för att överföra mer omfattande patientinformation mellan vårdgivare i dessa sammanhang.
Information om vissa ordinationer är av mindre relevans för en nationell sammanställning
Läkemedel som administreras av hälso- och sjukvårdspersonal före- gås som huvudregel inte av en förskrivning. För sådana läkemedel utgör ordinationen, så som den dokumenteras i patientjournalen, alltid underlag för det som administreras. De uppgifter som doku- menteras vid en läkemedelsordination utgör därmed den informa- tionsmängd som en samlad lista över läkemedel som administrerats i hälso- och sjukvården måste bygga på. Det finns dock undantag från detta, när läkemedel som administreras av hälso- och sjukvårds- personal har förskrivits och lämnats ut från apotek före administre- ringen. Det gäller framför allt läkemedel som administreras i patientens hem av sjukvårdspersonal i olika sammanhang, t.ex. vid hemsjuk- vård58, men även i undantagsfall läkemedel som patienten hämtat ut på öppenvårdsapotek och tar med till en vårdgivare för administre- ring. I dessa avseenden gör regionerna olika i huruvida dessa läke- medel förskrivs eller rekvireras och delas ut kostnadsfritt för patien- ten. I de fall läkemedel som administreras av sjukvårdspersonal förskrivs kommer informationen omfattas av en nationell samman- ställning men hanteras enligt vad som anges för övriga förskrivna läkemedel enligt avsnitt 8.3.1 ovan.
I sluten vård förekommer att patienter ordineras fler läkemedel än vad som faktiskt administreras. Dels handlar det om att ordina- tioner som beslutats i förväg behöver ändras när patientens tillstånd ändras, dels handlar det om ordinationer som görs förebyggande för att skapa handlingsfrihet för sjuksköterskor under vårdtiden. Dessa ordinationer är av mindre betydelse att samla i en nationell läkemedelslista om de ordinerade läkemedlen aldrig har, eller kommer att, administreras patienten.
58All sjukvård som ges i hemmet är inte hemsjukvård. Både öppen och sluten vård kan bedrivas i patientens hem. Hemsjukvård är enligt hälso- och sjukvårdslagen en del av den öppna vården.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
Informationen behöver avgränsas
Av alla de läkemedel som patienter ordineras är det endast en mindre del som ordineras för administrering i hälso- och sjukvården. De flesta läkemedel förskrivs.59 Trots att läkemedel som administreras av hälso- och sjukvårdspersonal totalt sett utgör en mindre andel av de läke- medel som används behöver det sannolikt göras en avgränsning av vilka av dessa läkemedel som bör omfattas av förslaget att informa- tionen ska delas med alla vårdgivare. Avgränsningen bör göras både utifrån vilken medicinsk relevans som är förenad med att dela infor- mation om det administrerade läkemedlet och utifrån vad som är tekniskt, ekonomiskt och tidsmässigt rimligt att dela uppgifter om.
När avgränsningar genomförs är det viktigt att information om avgränsningarna finns tydligt angivna i anslutning till informatio- nen så att den som använder informationen som en del i sitt besluts- fattande har en tydlig bild av underlagets omfattning och eventuella brister. Det kan vara lika viktigt att veta vad man genom olika avgräns- ningar inte får information om, som att få information om vad som faktiskt ordinerats eller administrerats.
Det som enligt utredningens bedömning bör vara av intresse vid ett vårdbeslut gällande en patient är vilka läkemedel som används kontinuerligt eller har en kvarvarande effekt och därmed påverkar denne, eller som är planerade att administreras enligt t.ex. ett be- handlingsschema. Utredningen menar därför att en nationell sam- manställning i denna del bör innehålla information om sådana läke- medel som administrerats, överlämnats eller där det t.ex. finns ett behandlingsschema som anger att de i framtiden kommer att admi- nistreras.
8.3.3Gemensamma vårdinformationssystem löser inte hela problemet
Som beskrivits tidigare planerar flera regioner att nyttja samma vård- informationssystem för såväl stora delar av den egna verksamheten som den verksamhet som utförs av andra vårdgivare enligt lagen
59Uppgifter ur E-hälsomyndighetens statistikdatabas avseende försäljningen av humanläke- medel för år 2023 gör gällande att det under året såldes 114 miljoner förskrivna förpackningar medan det såldes 15 miljoner förpackningar på rekvisition. Försäljning av antal förpackningar är en surrogatvariabel för vad som faktiskt ordineras och administreras men visar ändå på relatio- nen mellan de olika distributionssätten. Se https://statistik.ehalsomyndigheten.se/pxweb/sv/.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
(2008:962) om valfrihetssystem, nedan LOV, eller av kommunala vård- och omsorgsgivare. Att på detta sätt nyttja gemensamma system kommer inte att täcka all vård och kommer därmed inte heller kunna utgöra eller betraktas som en nationell infrastruktur. Det är oklart i vilken grad privata vårdgivare enligt LOV eller kommunala vård- givare faktiskt kommer nyttja optionen att använda samma vårdinfor- mationssystem som sjukvårdshuvudmännen och därigenom ha bättre förutsättningar att tekniskt kunna dela data i enlighet med bestäm- melserna i lagen (2022:913) om sammanhållen vård- och omsorgs- dokumentation.60 Vissa privata vårdgivare har t.ex. avtal med flera sjukvårdshuvudmän som använder olika vårdinformationssystem. För en sådan vårdgivare kan det vara svårt att tvingas använda flera olika system.
Det räcker dock inte att det primära vårdinformationssystemet är gemensamt mellan flera vårdgivare för att delning av information ska fungera fullt ut. Faktum kvarstår att en och samma vårdgivare även i framtiden kan förväntas använda flera olika vårdinformations- system för olika specialändamål i den egna verksamheten.61 I dag dokumenteras t.ex. ofta vård inom radiologi, förlossning, anestesi och onkologi, vilka alla innefattar läkemedelsbehandling, i separata system. I vissa fall kan även förskrivning ske från något av dessa separata system.62 Regionerna har inte implementerat en region- gemensam läkemedelslista63 som omfattar läkemedelsordinationer från alla dessa system. Någon komplett regional gemensam läke- medelslista som omfattar pågående läkemedelsbehandling finns därför inte om inte den behandlande hälso- och sjukvårdspersona- len manuellt uppdaterar läkemedelslistan i det vårdinformations- system som vårdgivaren anser är det primära.
Gemensamma vårdinformationssystem mellan flera vårdgivare i en region kommer inte att lösa utmaningarna med att dela informa-
60Ett exempel är Region Skåne och Västra Götalandsregionen som båda upphandlat vård- informationssystemet Millennium. I Västra Götalandsregionen är avsikten att samtliga kom- muner ska använda regionens Millennium-instans medan det i Skåne är tvärtom, samtliga kommuner har ställt sig utanför.
61Ett sådant exempel är Västra Götalandsregionen som valt att inte använda det nya vård- informationssystemet Millennium för anestesi och intensvivvård.
62Till exempel använder Region Skåne Obstetrix i förlossningsvården även för förskrivningar.
63Här används begreppet läkemedelslista i den betydelse som följer av Socialstyrelsens före- skrifter och allmänna råd (HSLF-FS 2017:37) om ordination och hantering av läkemedel i hälso- och sjukvården. Dels anges i 6 kap. 12 § i föreskrifterna att dokumenterade läkemedels- ordinationer ska hållas samlade i patientjournalen, dels anges i 11 kap. att läkemedelslistan ska uppdateras, användas och lämnas till patienten vid utskrivning.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
tion om läkemedelsbehandlingar, eller andra uppgifter, mellan regio- ner och mellan vårdgivare inom EU/EES i enlighet med EU-förord- ningen om det europeiska hälsodataområdet.64 En anledning till detta är att de installeras som olika instanser (se avsnitt 7.2.1). Det finns därför, trots de planerade åtgärderna för att i viss utsträckning använda gemensamma vårdinformationssystem, fortfarande enligt utred- ningens bedömning behov av att arbeta vidare med olika former av interoperabilitetslösningar för att kunna utbyta patientinformation som också innefattar uppgifter om läkemedelsbehandlingar. För- mågan till interoperabilitet och en skyldighet att tillgängliggöra upp- gifter var t.ex. bärande i de förslag om gränsöverskridande utbyte av patientuppgifter som lämnades av Utredningen om e-recept och patientöversikter inom EES.65 Krav på interoperabilitet kommer nu genom det europeiska format för utbyte av elektronisk hälsodoku- mentation som ska användas för de prioriterade kategorier av elek- troniska hälsodata med personuppgifter för primäranvändning som ska delas enligt EU-förordningen om det europeiska hälsodata- området.66 De krav som anges i EU-förordningen är fullt ut har- moniserade avseende interoperabilitet för dessa hälsodata.
Att fler delar data genom ett gemensamt vårdinformationssystem är positivt
De är positivt att flera vårdgivare väljer att använda samma vårdinfor- mationssystem och att nyttja möjligheten att dela patientuppgifter inom regelverket för sammanhållen vård- och omsorgsdokumen- tation. Det innebär sannolikt att man för närvarande kan dela större mängder information än vad som är möjligt att göra genom olika former av nu befintliga interoperabilitetslösningar eller register. Informationen är på detta sätt även bearbetningsbar på ett annat sätt än när den delas genom de olika tjänster som finns i dag. Läke- medelsbehandlingar är komplexa och utgör oftast bara en del av patientens behandling. Behovet av tillgång även till annan informa- tion från journalen är därför ofta avgörande för hälso- och sjukvårds- personalen. En stor del av patienterna får också sin vård i hemregionen (se avsnitt 6.1)
64Förordningen (EU) 2025/327 om det europeiska hälsodataområdet.
65SOU 2023:12 Patientöversikter inom EES och Sverige.
66Se artikel 15 förordningen (EU) 2025/327 om det europeiska hälsodataområdet.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
Dessa regionala lösningar står inte i ett motsatsförhållande till att också dela information genom nationella lösningar som möjliggör informationsdelning även i de fall aktörerna inte använder samma system. Den nationella, eller för den delen internationella, infrastruk- turen kan sägas ta vid där den regionala eller lokala upphör och utgör också en möjlighet att dela information över landsgränser, t.ex. för att tillgodose de krav som följer av det europeiska hälsodataområdet.
8.3.4Information om patientens faktiska användning av läkemedel och om egenvård med receptfria läkemedel är också viktig
Även om utredningen hittills har resonerat mycket kring betydelsen av dokumentationen i patientjournalen och läkemedelsordinationen i synnerhet är det i alla sammanhang då en läkemedelsbehandling diskuteras, justeras eller beslutas viktigt att beakta patienten fak- tiska användning av läkemedel. Det är inte självklart att patienten använder läkemedel som det är avsett, och i det fall patienten fått en variabel dosering, t.ex. 1–2 tabletter 3–4 gånger dagligen, eller en vid behovsdosering, går det inte att utifrån ordinationen säga något om den faktiska användningen. Det finns därmed även behov av att kunna samla uppgifter av relevans om patientens faktiska läkemedels- användning inför en vårdkontakt, t.ex. en uppföljning efter insatt behandling. Det är en skyldighet för den som ordinerar ett läkemedel att som en del i lämplighetsbedömningen inhämta information om patientens läkemedelsanvändning.67 Det är också en skyldighet för den som ordinerat ett läkemedel att följa upp åtgärden.68 Utredningen kan därmed konstatera att det finns behov av att i anslutning till en samlad information om en patients läkemedelsbehandlingar som bygger på ordinationer och förskrivningar även kunna samla infor- mation om den faktiska användningen, t.ex. genom samtal med patienten eller dennes egna noteringar. Som framgår längre fram kan sådana möjligheter öppnas genom EU-förordningen om det europeiska hälsodataområdet. Det är därmed inget denna utredning kommer utreda vidare.69
676 kap. 2 § Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordina- tion och hantering av läkemedel i hälso- och sjukvården.
686 kap. 17 § ovan nämnda föreskrift.
69Förordningen (EU) 2025/327 om det europeiska hälsodataområdet.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
Egenvård med receptfria läkemedel
Det är inte ovanligt att patienter, på eget initiativ, genom egenvård70 behandlar sig med receptfria läkemedel. Försäljningen av receptfria läkemedel till människa genom öppenvårdsapotek och annan detalj- handel uppgick år 2024 till 5,8 miljarder kronor eller 100 miljoner förpackningar.71 Kännedom om sådan behandling är av vikt när ut- redning eller beslut om behandling görs i hälso- och sjukvården.
I nuläget är hälso- och sjukvårdspersonal hänvisad till att inhämta information om användning av receptfria läkemedel genom att fråga patienten. Informationen dokumenteras därefter i patientens journal. Även om patienten i många fall muntligt kan redogöra för sin an- vändning av receptfria läkemedel vid ett vårdbesök förekommer det att patienter inte minns vilka sådana läkemedel de använder, särskilt då det även receptfritt förekommer många olika generiska alternativ med olika handelsnamn. Patienten kan också vara medvetslös när denne kommer i kontakt med vården. I dessa situationer skulle infor- mation även om detta i en nationell sammanställning vara till hjälp för vårdpersonalen. Även vid förberedelse inför olika vårdkontakter eller moment när patienten inte själv är närvarande, t.ex. inför en läkemedelsgenomgång, skulle tillgång till information om patientens användning av receptfria läkemedel vara till nytta för den samlade bedömningen. Även som underlag för de hälsodeklarationer som upprättas i samband med t.ex. blodgivning är användning av recept- fria läkemedel relevant att känna till (se även avsnitt 6.4.1).
Flera företrädare för hälso- och sjukvården har till utredningen framfört önskemål om att det i en framtida utveckling vore önskvärt att en nationell sammanställning av en patients läkemedelsbehand- lingar även kan stödja dokumentation av sådan användning som pati- enten själv fattar beslut om. Även om inte alla patienter har förmågan, och att vissa patienter inte kommer att registrera alla uppgifter om detta, bedömer utredningen att det fyller ett syfte och att det skulle skapa möjligheter till en mer patientsäker bedömning i samband med att patienten söker vård. Med dagens teknik bör sådan dokumenta- tion enligt utredningens bedömning kunna göras enkel genom att patienten t.ex. via sin mobilkamera kan fotografera och genom bild-
70Här avses sådan egenvård som är förknippad med verksamhet på öppenvårdsapotek och framgår av bl.a. lagen (2009:366) om handel med läkemedel.
71Uppgifter ur E-hälsomyndighetens statistikdatabas avseende försäljningen av human- läkemedel för egenvård på öppenvårdsapotek eller annat försäljningsställe.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
tolkning, streck- eller QR-kod kan knyta förpackningen till ett regi- ster över receptfria läkemedel. Om registreringen görs av patienten själv skulle det kunna vara en frivillig möjlighet för den som vill under- lätta för sig själv och för dem som är delaktiga i patientens vård. Det skulle sannolikt vara svårt, och inte heller ändamålsenligt, att införa krav på att alla receptfria läkemedel ska registreras. Det skulle för- modligen även vara svårt att få sådan information heltäckande och aktuell. Om möjligheten till dokumentering infördes skulle den utgöra ett för patienten frivilligt komplement till övrigt innehåll
i läkemedelslistan. Sådan information måste inte heller nödvändigt- vis registreras i ett nationellt register utan skulle kunna registreras via andra typer av plattformar så länge patienten kan göra informa- tionen tillgänglig via nationella specifikationer för utbyte av infor- mation. Uppgifterna behöver därför inte heller vara en del av patient- journalen förrän informationen efterfrågas i samband med hälso- och sjukvård.
En patient kan även behandlas med läkemedel som kan köpas receptfritt genom att dessa förskrivs på recept eller ordineras och administreras av hälso- och sjukvårdspersonal. I dessa fall kommer information om läkemedelsbehandlingen att hanteras i enlighet med vad som tidigare beskrivits i avsnitt 8.3.1 och 8.3.2.
Det europeiska hälsodataområdet ställer krav på möjlighet att föra in egna uppgifter
I EU-förordningen om det europeiska hälsodataområdet anges att fysiska personer och deras företrädare ska ha rätt att föra in infor- mation i sin egen elektroniska hälsodokumentation genom tjänster för tillgång till elektroniska hälsodata eller applikationer kopplade till dessa tjänster. Enligt EU-förordningen ska det tydligt framgå att informationen har förts in av den fysiska personen eller av dennes företrädare. Fysiska personer, eller deras företrädare, ska inte ha möj- lighet att direkt ändra elektroniska hälsodata och tillhörande informa- tion som förts in av hälso- och sjukvårdspersonal.72 För den första gruppen prioriterade kategorier av elektroniska hälsodata med per- sonuppgifter enligt artikel 14.1 i EU-förordningen ska detta vara genomfört senast den 26 mars 2029.73 Till den första kategorin prio-
72Artikel 5 förordningen (EU) 2025/327 om det europeiska hälsodataområdet.
73Artikel 105 förordningen (EU) 2025/327 om det europeiska hälsodataområdet.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
riterade hälsodata hör bl.a. receptuppgifter och uppgifter i patient- översikter där t.ex. uppgifter om aktuella och relevanta tidigare läkemedel ingår.74
8.3.5Utredningens bedömning
Utredningens bedömning är att en nationell sammanställning om en patients läkemedelsbehandling bör innehålla uppgifter om ordi- nerade läkemedel som förskrivits eller administrerats i hälso- och sjukvården. Sammanställningen bör även innehålla uppgifter om förskrivna läkemedel som expedierats på öppenvårdsapotek. Utred- ningen konstaterar också att det i EU-förordningen om det europeiska hälsodataområdet anges att patienten ska kunna föra in information i sin elektroniska hälsodokumentation. Det bör innebära att det blir möjligt för patienten att, på frivillig grund, lägga till information relaterat till användning av förskrivna läkemedel, och kanske även om receptfria läkemedel som patienten själv beslutat att använda, när bestämmelsen börjar tillämpas den 26 mars 2029.
8.4Hur ska uppgifterna tillgängliggöras
Utredningens bedömning: Uppgifter om läkemedelsordinationer och administrerade läkemedel bör som huvudregel delas genom en federerad teknisk lösning. Vissa uppgifter om behandlingar av betydelse under lång tid kan dock behöva samlas in och delas genom ett register.
Uppgifter om förskrivningar och expedierade förskrivna läke- medel bör även fortsatt samlas i och delas genom ett register. Fede- rerad information och uppgifter ur registret bör kunna presenteras samlat för dem som är behöriga att ta del av informationen.
74Artikel 14.1 och bilaga I till förordningen (EU) 2025/327 om det europeiska hälsodata- området.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
Utredningen konstaterar att en lösning av uppdraget som innebär att fler uppgifter om läkemedelsbehandlingar kan delas mellan olika vårdaktörer75 men där patientinformationen i så stor utsträckning som möjligt stannar hos den vårdgivare som ursprungligen doku- menterat uppgifterna har flera fördelar (se avsnitt 7.2). En sådan lösning innebär bl.a. att informationen kan användas som underlag för administrering av läkemedel i t.ex. kommunal vård eftersom det är journalinformation som delas. Journalinformationen utgör också den mest aktuella informationen och är inte en kopia eller avskrift som behöver synkroniseras med uppgifterna i den källa där de ur- sprungligen hämtades, och där ändringar i uppgifterna kan ske fort- löpande. En sådan lösning kan bli möjlig om man utgår ifrån lagen (2022:913) om sammanhållen vård- och omsorgsdokumentation, nedan förkortad SVOD (se även avsnitt 7.2.1). Att dela information med stöd av SVOD var också den lösning som regeringen i första hand såg framför sig för utökad delning av information om s.k. rekvisitionsläkemedel i propositionen om en nationell läkemedels- lista.76 Regeringen var dock öppen för att i en eventuell framtid överväga att kopiera in uppgifterna även i registret nationell läke- medelslista för att kunna dela dessa med patienter och öppenvårds- apotek.77 Som utredningen konstaterat ovan och beskrivit närmare i kapitel 7 finns det ett antal utmaningar med att skapa flera kopior av samma information. Dessutom behövs en registerlösning inte för att kunna dela journaluppgifter med patienten. Om den möjlighet som SVOD ger, att på frivillig väg bl.a. dela patientinformation mellan vårdgivare, i stället görs tvingande i den delen, öppnas en möjlighet för vårdgivare att elektroniskt ta del av andra vårdgivares uppgifter om patientens behandling. En sådan lösning förutsätter interopera- bilitet och innebär att vårdgivare tvingas att dela information om ordinerade och administrerade läkemedel genom en nationell struk- tur, som skulle utgöra en del av den nationella infrastrukturen på hälso- och sjukvårdens område. Krav på att dela information, och att hälso- och sjukvårdspersonalen ska ha tillgång till denna genom olika tillgångstjänster, kommer även av EU-förordningen om det europeiska hälsodataområdet. EU-förordningen begränsar dock
75Med vårdaktör avses här brett de olika aktörer inom hälso- och sjukvårdssektorn som skulle kunna ha nytta av information, utan ett juridiskt raster av vem som i dag har möjlighet att ta del av informationen.
76Prop. 2017/18:223 Nationell läkemedelslista, s. 218 f.
77A.a., s. 220.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
detta till de i artikel 14.1 prioriterade kategorierna av elektroniska hälsodata.78 SVOD möjliggör delning av alla uppgifter i en patient- journal, inte enbart de prioriterade kategorierna i artikel 14.1 i EU- förordningen. Krav på att dela uppgifter enligt SVOD skulle därmed ur ett nationellt perspektiv skapa större möjligheter. Som angetts tidigare pågår en utredning av hur nationell rätt ska anpassas till EU-förordningen.79 Det återstår därför att se hur patientdatalagen (2008:355) och SVOD kommer anpassas till den nya EU-förord- ningen i dessa delar. Informationen bör enligt utredningens bedöm- ning i vilket fall i första hand hämtas från andra vårdgivares system vid den tidpunkt då behovet av information uppstår och presenteras på lämpligt sätt för den som gör anropet. En sådan lösning innebär sannolikt även att vårdgivare, via samma lösningar för interopera- bilitet, kan utbyta information om läkemedelsordinationer mellan andra system inom vårdgivarens egen verksamhet i delar som i dag inte är interoperabla, och även avseende sådana uppgifter som inte omfattas av EU-förordningen om det europeiska hälsodataområdet. En ytterligare fördel med att använda sig av möjligheten att dela in- formation som ges i SVOD är att också rätten för hälso- och sjuk- vårdspersonal och patienten att ta del av även sådan patientinforma- tion som inte omfattas av EU-förordningen då kommer att följa den befintliga regleringen för detta i SVOD och patientdatalagen (2008:355) (se vidare avsnitt 8.12).
Systemet med sammanhållen vård- och omsorgsdokumentation har många fördelar och är en bra lösning för att dela information mellan vårdgivare. Utredningen bedömer dock att de praktiska imple- menteringar som finns i dag för utnyttjande av möjligheten att dela uppgifter i enlighet med SVOD inte är fullt ut ändamålsenliga. Det är t.ex. svårt att se att NPÖ i dag kan betraktas som en nationell infrastruktur för en samlad bild över en patients läkemedelsanvänd- ning. Regeringen har också vidtagit ett antal åtgärder för att skapa en statlig nationell digital infrastruktur för hälso- och sjukvården bl.a. genom ett flertal uppdrag till E-hälsomyndigheten och uppdraget till en särskild utredare att möjliggöra en nationell digital infrastruk- tur för hälsodata (S 2024:A).
78Se artikel 11, 12 samt 14 i förordningen (EU) 2025/327 om det europeiska hälsodata- området.
79Se S 2024:A, Uppdrag att möjliggöra en nationell digital infrastruktur för hälsodata.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
Registret nationell läkemedelslista är viktigt
Utredningen anser att registret nationell läkemedelslista såsom det regleras i lagen (2018:1212) om nationell läkemedelslista även fort- satt har en viktig funktion att fylla. I registret samlas information som samtliga öppenvårdsapotek har behov av för att kunna upp- fylla sitt uppdrag att se till att patienter får tillgång till förskrivna läkemedel och varor. Registret är också det enda ställe där uppgif- ter om vilka förskrivna läkemedel en patient faktiskt också hämtar ut från ett öppenvårdsapotek samlas. Uppgifter om förskrivna och expedierade läkemedel bör därför enligt utredningen även fortsatt samlas i registret nationell läkemedelslista (se vidare avsnitt 8.4.8). När hälso- och sjukvårdspersonal gör anrop för att få del av en pati- ents läkemedelsbehandlingar ur andra vårdgivares journaler enligt vad som beskrivs ovan, bör samtidigt uppgifter hämtas även från registret nationell läkemedelslista för uppgifter om till patienten förskrivna och expedierade läkemedel. Den samlade information som den anropande hälso- och sjukvårdpersonalen får del av utgör då en än mer fullständig bild av patientens läkemedelsbehandling. För att en sådan lösning ska fungera väl i praktiken krävs dock att det är möjligt att koppla förskrivningsinformation i registret till motsvarande ordination i vårdgivarens journal (se vidare avsnitt 15.3.3). Att lagra information om en sådan koppling är juridiskt möjligt i registret nationell läkemedelslista.80
Ett europeiskt hälsodataområde
När EU-förordningen om det europeiska hälsodataområdet börjar tillämpas kommer det, som tidigare angetts, att finnas krav på att dela viss information inom och mellan medlemsländer, t.ex. patient- översikter, elektroniska förskrivningar och elektroniska uppgifter om expedierade läkemedel.81
I den mån en svensk patient fått vård i ett annat EU-land, finns det behov av att för svenska vårdgivare även få tillgång till information om den i utlandet genomförda vården likväl som det är viktigt att kunna dela patientuppgifter hänförliga till vård som ges i Sverige
803 kap. 8 § 8 lagen (2018:1212) om nationell läkemedelslista, se också prop. 2017/18:223 Nationell läkemedelslista, s. 115.
81Artikel 14 förordningen (EU) 2025/327 om det europeiska hälsodataområdet.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
med andra länder. Sådant utbyte av information ska enligt förord- ningen ske genom interoperabilitetsplattformen för digital hälsa, MinHälsa@EU, och förmedlas genom den nationella kontaktpunkten för digital hälsa.82 Den information som berörs av denna utrednings uppdrag bör enligt utredningens bedömning till stor del kunna göras tillgänglig i de strukturer som följer av EU-förordningen om det europeiska hälsodataområdet. Ordinationer avseende läkemedel som det är relevant att dela information om enligt EU-förordningen bör kunna presenteras som en del i en federerad lösning. Informa- tion om förskrivningar som utfärdats i andra EU- och EES-länder bör kunna visas i registret nationell läkemedelslista. Motsvarande lösningar för delning av patientuppgifter bör enligt utredningen kunna övervägas avseende uppgifter om medicintekniska produkter och vacciner, vilka också omfattas av patientöversikter enligt EU- förordningen om det europeiska hälsodataområdet. Utredningens bedömningar om medicintekniska produkter respektive vacciner behandlas närmare i avsnitt 8.5 och kapitel 9.
8.4.1Federerade lösningar är ofta förstahandsvalet för nya tjänster
Begreppet federering avser att samordna eller sammanföra. Exem- pelvis är federerade databaser flera databaser som hanteras som en enhet.83 Federerade analyser avser metoder som gör det möjligt att åstadkomma analyser baserat på flera olika datakällor utan att behöva lagra känsliga personuppgifter utanför källsystemen och de skydds- mekanismer som omger dessa. Exponeringen av data kan därför reduceras.84
Vid nyutveckling av olika tjänster för att dela data används i dag ofta federerade lösningar som förstahandsval både nationellt och inom EU. Den svenska lösningen med nationella patientöversikter som tidigare beskrivits utgör ett exempel på en federerad lösning. Utredningen om sekundäranvändning av hälsodata beskriver i sitt betänkande Vidareanvändning av hälsodata för vård och klinisk forsk- ning fördelar med federerade lösningar för delning av bl.a. genomik-
82Se artikel 23 förordningen (EU) 2025/327 om det europeiska hälsodataområdet.
83https://it-ord.idg.se/ord/federate/, besökt 24-03-20.
84Läkemedelsverket (2021): Federerade analyser – IT-arkitektur, (dnr 4.3.1-2020-017988).
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
data.85 Den utredningen prioriterade dock vad de ansåg vara snabbt genomförbara förslag med sju regionalt och en centralt inrättad databas för precisionsmedicin. I betänkandet pekas dock på för- delarna med just federerade lösningar sett ur ett längre perspektiv.86
Ett konkret exempel på utveckling av en federerad lösning som pågår är det europeiska initiativet för canceravbildning där Umeå universitet är en av 79 partners från 14 EU-medlemsstater. Målet är en infrastruktur för medicinska cancerbilder med över 60 miljoner anonymiserade röntgenundersökningar och kliniska data från can- cerpatienter, tillgängliga för kliniker, forskare och innovatörer över hela EU.87,88 Ett annat exempel är bioinformatikplattformen vid SciLifeLab89 som vid Uppsala universitet utvecklat den svenska noden av tekniklösningen och som första pilotprojekt samlat data om barntumörer.90 Lösningen bygger på att rådata deponeras i en svensk nationell nod medan metadata, även kallat data om data, läggs in i en central funktion91 via vars webbplats forskare kan söka efter metadata och efter godkännande få säker tillgång till rådata. Den ovan nämnda lösningen är inte federerad i en svensk kontext efter- som data samlas nationellt, men är federerad vad avser datadelning mellan länder i EU. De förslag kring interoperabilitet som lämnas i betänkandet Delad hälsodata – dubbel nytta stödjer också federe- rade lösningar.92
Utredningen konstaterar att federerade lösningar i dag ofta över- vägs vid delning av data, inte minst hälsodata.
8.4.2Federerade lösningar har patientsäkerhetsfördelar
En styrka med federerade lösningar ligger i att uppgifter lagras decen- traliserat, på endast ett ställe, i anslutning till där informationen ska- pas. Inom hälso- och sjukvården innebär det att den finns hos enbart en vårdgivare, den vårdgivare där uppgifterna först
85SOU 2023:76 Vidareanvändning av hälsodata för vård och klinisk forskning, s. 38.
86A.a., s. 872.
87Europeiska initiativet för canceravbildning, https://digital- strategy.ec.europa.eu/sv/policies/cancer-imaging, besökt 24-04-11.
88Onkologi i Sverige, nr 1 2024, s. 24.
89National Bioinformatics Infrastructure Sweden, förkortat NBIS.
90Enklare att dela genomikdata mellan olika länder, Pressmeddelande från Uppsala universitet, 2024-02-26.
91Funktionen kallas European Genome-phenome Archive, förkortat EGA.
92SOU 2024:33 Delad hälsodata – dubbel nytta.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
dokumenterades. Om man delar patientuppgifter med en sådan lösning i hälso- och sjukvården innebär det att de uppgifter som hälso- och sjukvårdspersonalen arbetar med i vardagen är samma patientuppgifter som genom en federerad lösning kommer att delas över vårdgivargränser, oavsett om delning sker i Sverige eller inom EU. Detta borgar för att det är den mest korrekta och uppdaterade informationen som delas vilket är av stor betydelse för patient- säkerheten.
Att samla information i centrala register, utöver i patientjour- nalen, innebär att integritetskänslig information lagras på mer än en plats. Att lagringen sker på fler platser medför att informationen måste hållas uppdaterad och synkroniserad över tid. I teorin kan detta vara en fördel eftersom fler kopior av information innebär viss redundans och kan ha vissa informationssäkerhetsmässiga för- delar. Samtidigt innebär en registerlösning att när information lag- ras på flera platser, centralt och lokalt, kan information komma att ändras enbart på det ena lagringsstället. När det inträffar är infor- mationen inte längre överensstämmande i de olika källorna vilket medför en reell risk för att vårdbeslut fattas med felaktiga eller ofullständiga uppgifter som grund. Sådana fel kan leda till patient- säkerhetsrisker och efterföljande vårdskador. Den nuvarande lös- ningen med registret nationell läkemedelslista är ett tydligt exem- pel på att det, på olika sätt, visat sig vara svårt att få informationen i ordinationer och förskrivningar att vara uppdaterade och samstäm- miga över tid trots att detta är en av de stora patientsäkerhetsvinster som eftersträvats. Ordinationsuppgifterna i journalen och förskriv- ningen i registret nationell läkemedelslista är endast samstämmiga fram till det ögonblick som informationen uppdateras i någon av källorna.
Eftersom patientuppgifter utgör känsliga personuppgifter medför också att lagra sådana personuppgifter på fler ställen en ökad risk för att uppgifterna hanteras av obehöriga och andra integritetsintrång.
Patientjournalen är decentraliserad och till del federerad
Det finns bestämmelser om patientjournaler bland annat i patient- datalagen (2008:355). En patientjournal är decentraliserad genom att den omfattar en patient och knyts till varje vårdgivare (se av-
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
snitt 5.1). Det finns ingen nationellt sammanhållen patientjournal. Varje vårdgivare ansvarar och är personuppgiftsansvarig för den pati- entdokumentation, de journalhandlingar, som upprättas hos vård- givaren. Lagen möjliggör inte att en vårdgivare kan dokumentera patientuppgifter i en annan vårdgivares journaler. Lagen (2022:913) om sammanhållen vård- och omsorgsdokumentation, nedan SVOD, möjliggör direktåtkomst eller annat elektroniskt utlämnande till andra vårdgivares journaler. Tar hälso- och sjukvårdspersonal del av information genom den möjlighet som regleringen i lagen om sam- manhållen vård- och omsorgsdokumentation ger, kan beslut och åtgärder som vidtas för patienten grundas på vad som framkommer av även andra vårdgivares dokumentation. De uppgifter som an- vänts som beslutsunderlag ska då dokumenteras även i den egna journalen, eller så ska det på annat sätt synliggöras vilken informa- tion som legat till grund för beslutet.
När en region väljer att erbjuda ett upphandlat journalsystem till flera vårdgivare innebär det att vårdgivarna kommer att kunna använda samma tekniska plattform, att data lagras på ett enhetligt sätt och att förutsättningarna för att kunna utbyta information tekniskt och semantiskt inom systemet ökar. Eftersom det i de fallen ändå är olika vårdgivare som använder samma system, innebär det att journalinfor- mationen fortfarande finns i flera olika journalhandlingar hos olika vårdgivarna. Möjligheten till åtkomst regleras även i dessa fall i lagen om sammanhållen vård- och omsorgsdokumentation. Inhämtande av information kan i ett sådant fall ses som en federerad lösning.
Information om ordinationer och i hälso- och sjukvården admi- nistrerade läkemedel utgör patientinformation som dokumenteras i patientjournalen. Det är också information som, för att kunna ligga till grund för nya medicinska beslut rörande patienten, bäst ses i en helhet kopplad till övrig information i patientjournalen.
En samlad bild av en enskild behandling utifrån flera lokala listor
Det finns utmaningar med federerade lösningar när flera vårdgivare gemensamt ska ansvara för att information om en enskild patients behandling är uppdaterad. Ansvaret för åtgärder i hälso- och sjuk- vården är generellt sett inte gemensamt för flera vårdgivare, utan ansvaret åvilar varje vårdgivare och varje anställd hos vårdgivaren,
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
utifrån deras kompetens och behörighet. I detta betänkande är upp- draget avgränsat till att se över uppgifter om bland annat en patients läkemedelsbehandlingar och behandling med eller användning av vissa medicintekniska produkter. Utmaningarna med en federerad lösning uppstår i dessa sammanhang främst för behandlingar som pågår under längre tid och där flera olika vårdgivare kan möta patien- ten och behöva utföra justeringar i läkemedelsbehandlingen över tid.
Detta kan exemplifieras genom en behandling av högt blodtryck med ACE-hämmare och diuretika som oftast förskrivs på recept och beräknas pågå under överskådlig tid, sannolikt livslångt. En ordina- tion utförd av ordinatör A hos vårdgivare A registreras i patientens journal A. Patienten flyttar till grannkommunen som ligger i en annan region. Den nya ordinatör B hos vårdgivare B kan genom regleringen i lagen om sammanhållen vård- och omsorgsdokumen- tation, via t.ex. NPÖ, ta del av information från vårdgivare A. Detta förutsätter att vårdgivare A valt att dela aktuell information på detta sätt, att det föreligger en patientrelation och att patienten samtycker till behandlingen samt inte spärrat informationen.93 Om ordinatör B i någon del vill ändra ordinationen som ursprungligen utförts av ordinatör A kommer en ny ordination att registreras hos vårdgivare B, i journal B. Ordinatör B har ansvar för sitt handlande och infor- mationen ska dokumenteras hos vårdgivare B. Ordinatör B har ingen legal eller teknisk möjlighet att på egen hand ändra patientdoku- mentationen hos vårdgivare A. Resultatet blir två dokumenterade ordinationer för egentligen samma läkemedelsbehandling, för samma läkemedel men med t.ex. olika styrka eller dosering. Så länge inte ordinatör A aktivt beslutar att sätta ut94 läkemedlet och dokumen- terar detta som en utsättningsordination95, och så länge inte ordina- tör B kan utföra en åtgärd som får effekt hos vårdgivare A, kommer båda ordinationerna att kvarstå, även om de förvisso är daterade med två olika datum. I dokumentationen över de båda ordinationerna ska också anges ett datum för uppföljning eller avslut av behandlingen,
93Se 3 kap. 1 § samt 2 kap. 3 § lagen (2022:913) om sammanhållen vård- och omsorgsdoku- mentation.
94Utsättning av läkemedel definieras i Socialstyrelsens termbank som avslutande av behand- ling med ett visst läkemedel, som beslutats av behörig hälso- och sjukvårdspersonal. https://termbank.socialstyrelsen.se/article.php?tid=365, beslutad år 2013.
95Begreppet utsättningsordination förekommer med betydelsen ändringsordination som avser att avsluta behandling med ett visst läkemedel. Sveriges kommuner och regioner, 2023, Rapport gemensamma begrepp inom läkemedelsområdet att i en begreppsrapport från Sveriges kommuner och regioner, dnr SKR2023/02148.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
och med tiden kommer ordination A att spela ut sin roll, men under en tid kommer ordinationerna att ”överlappa” varandra. I en federe- rad lösning där patientens samlade läkemedelsbehandling presenteras kommer båda dessa ordinationer att visas. Det kan som exemplet visar leda till att inaktuell information presenteras. Med utgångs- punkt i att de olika ordinationerna är daterade, och att det av journal- anteckningen i anslutning till den ändrade ordinationen bör gå att utläsa att den just innebär en justering av den ursprungliga ordina- tionen, bör informationen ändå bidra till att ge en mer fullständig bild av patientens behandlingssituation och behandlingshistorik. För att skapa möjligheter att uppdatera information även i andra vård- givares journaler, om det är en lämplig lösning på detta problem, krävs en översyn av patientdatalagen och SVOD. Det ligger dock utanför utredningens uppdrag.
En fråga att ställa sig med anledning av det ovanstående exemp- let är hur man, efter att ordinatör B ändrat ordinationen, ska se på ordination A. Den finns, är inte avslutad, men utgör samtidigt inte den mest aktuella ordinationen. Den dokumenterade ordination A kan inte ändras på annat sätt än genom en att en aktiv åtgärd vidtas hos vårdgivare A. Vårdgivare A kommer inte få en automatisk signal när ordinatör B hos vårdgivare B ändrar ordinationen. En sådan signal, utan att patienten har sökt vård på nytt, skulle leda till behov av administrativa åtgärder hos vårdgivare A om informationen i sig- nalen också ska hanteras. Om patienten senare skulle återkomma till vårdgivare A skulle ordinatören ha tillgång till den samlade bil- den och därmed kunna identifiera ordination B. Det blir då, utifrån dagens regelverk, ordinatör A:s ansvar att avgöra hur dokumenta- tionen av ordination A ska hanteras vidare. Många av de frågor som rör själva informationshanteringen och presentationen av denna måste hanteras i samverkan mellan aktörerna i utvecklingen av arbets- processer och system (se vidare kapitel 15).
Om i stället två skilda ordinationer hos två olika vårdgivare, t.ex. olika läkemedel mot olika hälsotillstånd, dokumenteras i olika journa- ler fungerar informationen om ordinationerna mer direkt som kom- plement till varandra. Det kan t.ex. gälla en hypertonibehandling som följs upp hos den lokala vårdcentralen när patienten samtidigt står under behandling för sin reumatism hos en privat reumatolog. Antalet olika situationer som kan uppstå är sannolikt svårt att över-
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
blicka och kan möjligen klarläggas genom en djupare forsknings- studie eller genom uppföljning och utvärdering över tid.
Av de ovanstående exemplifierande situationerna kan man kon- statera att en federerad lösning, förutom de angivna fördelarna, även medför vissa utmaningar. Dessa kan enligt utredningens bedöm- ning sannolikt till viss del överbryggas genom utvecklade arbets- processer och användargränssnitt, kompletterat med visst före- skriftsarbete. Detta diskuteras vidare i kapitel 15.
Om man i stället väljer en fullständigt synkroniserad och ständigt uppdaterad lösning skulle denna kräva en central masterdatabas som sedan i relevanta delar replikeras eller visualiseras för de decentra- liserade användarna. Alla åtgärder måste då vidtas i den centrala data- basen eller registret, inklusive dokumentation av patientuppgifter hos vårdgivarna. En sådan ordning är dock helt motsatt vad patient- datalagen föreskriver om att en patients journal är knuten till, och ligger under, en enskild vårdgivares ansvar. En sådan ordning skulle kräva att patientens journal åtminstone i någon bemärkelse var natio- nell och gemensam för samtliga vårdgivare. Sådana lösningar har tidi- gare avfärdats av regeringen.96 Att enbart hantera läkemedelsinfor- mation centraliserat skulle inte heller innebära att en enskild ordinatör kan känna sig trygg med att ändra i någon annans ordination enbart utifrån informationen i det centrala registret, eftersom det fortfarande skulle saknas samtidig tillgång till övrig bakgrundsinformation som finns i de lokala journalerna (se avsnitt 8.1).
Sammanfattningsvis konstaterar utredningen att federerade lös- ningar har patientsäkerhetsmässiga fördelar jämfört med register- lösningar genom att det är den ursprungliga, uppdaterade, informa- tionen som delas mellan aktörerna. Det finns dock utmaningar med federerade lösningar när vårdgivare inte kan dela all nödvändig infor- mation om en patient och när det innebär praktiska utmaningar i hur informationen kan hanteras, så som är fallet med dagens nationella patientöversikt. EU-förordningen om det europeiska hälsodataom- rådet ställer också krav på förmåga till informationsdelning genom en europeisk programvarukomponent för interoperabilitet för elek- troniska hälsodokumentationssystem men denna begränsas för pri- märanvändning till prioriterade kategorier av elektroniska hälsodata och framstår därmed vara mer begränsad än vad som är möjligt att
96Prop. 2007/08:126 Patientdatalag m.m., s. 82 ff.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
dela med stöd av dagens SVOD.97 Detta visar på varför det fort- farande finns vinster med att flera vårdgivare arbetar i ett gemen- samt journalsystem där all nödvändig information kan utbytas söm- löst, samt varför det fullt ut är svårt att ersätta detta med andra lösningar. Andra lösningar utgör dock viktiga komplement.
Utredningen bedömer att den ena lösningen inte utesluter den andra, och gör sammantaget bedömningen att en federerad lösning för att dela information om ordinationer, kompletterad med tillgång till övrig information i patientjournaler, ändå är det mest ändamåls- enliga att bygga vidare på. Som angetts ovan ställer detta samtidigt krav på hur information presenteras, se vidare om detta i avsnitt 8.10.
8.4.3Federerade lösningar kan innebära mindre integritetsintrång
Federerade lösningar har också fördelar då de kan uppfattas som mindre integritetskränkande än registerlösningar. Den främsta skill- naden i detta avseende är att med en registerlösning på hälso- och sjukvårdsområdet samlas stora mängder känsliga personuppgifter i ett register, ofta hos en tredje part. Registret utgör ofta en kopia av information samtidigt som det leder till en koncentration av upp- gifter, detta innebär integritetsrisker. Det nuvarande registret natio- nell läkemedelslista samlar förskrivningar, inte kopior av förskriv- ningar. Därför skiljer sig det nuvarande registret från ett möjligt framtida register som i stället skulle samla kopior av information om ordinerade och administrerade läkemedel. En federerad lösning innebär att de känsliga uppgifterna inte flyttas eller lagras på någon ny plats per automatik, utan de lagras även fortsättningsvis enbart, decentraliserat, hos de ursprungliga informationshållarna och med stöd av patientdatalagens (2008:355) bestämmelser.
En federerad lösning kräver olika stödfunktioner eller kompo- nenter för att kunna hitta informationen i de federerade patientjourna- lerna. Komponenten tjänsteadressering behövs förenklat för att kunna hitta de olika system där informationen finns lagrad. En sådan kom- ponent innehåller inga personuppgifter. Komponenten patientdata- index behövs för att veta i vilka olika vårdinformationssystem som det finns information om en viss patient. Ett patientdataindex är ett
97Se bl.a. artikel 2.2 n, artikel 14 samt artikel 25 förordningen (EU) 2025/327 om det europeiska hälsodataområdet.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
register över personuppgifter och behöver som sådant övervägas ur integritetssynpunkt. Indexet innehåller dock uppgifter som är betyd- ligt mindre känsliga, t.ex. att en viss person fått vård hos en viss vård- givare, än de mer specifika uppgifterna om vårdens närmare innehåll som finns i en patientjournal.
Personuppgiftsansvar
En registerlösning med en tredje part som registerhållare innebär att en annan aktör än vårdgivaren ska förvalta registret och bli per- sonuppgiftsansvarig, eller utgöra personuppgiftsbiträde, för den personuppgiftsbehandling som denne och dennes behöriga perso- nal behöver utföra med patientens personuppgifter med anledning av att de förvaltar och hanterar registret. En federerad lösning påver- kar inte omständigheten att vårdgivaren är personuppgiftsansvarig för patientens personuppgifter som finns i vårdgivarens journaler.
En registerlösning, såsom registret nationell läkemedelslista, kan innebära att det blir utmanande för den som är personuppgifts- ansvarig för registret att säkerställa att uppgifterna i registret är korrekta och uppdaterade.98 Detta eftersom uppgifterna levereras in i registret av hälso- och sjukvården i samband med förskrivning och av öppenvårdsapoteken i samband med expediering. Det inne- bär att E-hälsomyndigheten är beroende av att dessa aktörer upp- fyller sina skyldigheter vid behandling av uppgifter i samband med registreringen. Den personuppgiftsansvarige för registret saknar i detta fall direkt kontroll över vilka uppgifter som registreras i regi- stret även om det i viss utsträckning går att styra genom regler för registrering.
Enligt båda lösningarna är den som behandlar personuppgifter, antingen i registret eller genom en federerad lösning, personuppgifts- ansvarig för sin behandling.99 En federerad lösning innebär dock att det inte behöver upprättas något ytterligare register som innehåller känsliga personuppgifter som någon aktör måste hantera, utöver vad som sägs om patientdataindex ovan. Eftersom personuppgifts- ansvaret bl.a. syftar till att skydda den enskildes integritet bedömer
98Artikel 5.1 d dataskyddsförordningen.
99Se 3 kap. 1 § lagen (2018:1212) om nationell läkemedelslista, 2 kap. 6 § patientdatalagen (2008:355), 4 kap. 1 § lagen (2022:913) om sammanhållen vård- och omsorgsdokumentation och 7 § apoteksdatalagen (2009:367).
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
utredningen att också denna skillnad bidrar till att en federerad lösning bör uppfattas som att den medför ett mindre integritets- intrång.
Behörighetsstyrning är möjlig i båda fallen
I både en registerlösning och en federerad lösning kan tillgången till uppgifter behörighetsstyras. I fallet med registret nationell läke- medelslista sker detta exempelvis genom säkerställande av enskilda användares identitet genom krav på användning av e-legitimation på tillitsnivå 3, krav på vårdgivarens hantering av behörighetsgrun- dande information, inhämtande och registrering av samtycke samt loggning. Vårdgivare försöker så långt det är möjlig lösa detta genom att behörighetsstyrningen i vårdinformationsystemet når den nivå av tillit som krävs för att kunna ta del av informationen i den natio- nella läkemedelslistan utan att en separat e-legitimation krävs. Där- emot kan fler aktörer vara involverade i behörighetsstyrningen och även registerhållarens, eller den personuppgiftsansvariges åtkomst behöver regleras och kontrolleras.
Vid den federerade lösningen och e-tjänsten nationell patient- översikt sker behörighetsstyrningen genom vårdgivarens försorg genom tilldelning av medarbetaruppdraget vård och behandling, inloggning med SITHS-kort samt genom kontrolltjänsten tillgänglig patient.100 Tillgänglig patient kontrollerar att det finns en vårdrela- tion registrerad för den patient information efterfrågas om.101 I båda lösningsalternativen krävs att vårdpersonalen har ett verksamhets- knutet och patientrelaterat behov av den information som eftersöks. Detta kan dock inte på ett enkelt sätt kontrolleras i detalj i förväg utan behöver vara en del av ett kontinuerligt informationssäker- hetsarbete, regleras i rutiner och följas upp av den personuppgifts- ansvarige genom t.ex. revision av informationshanteringen i efter- hand. Den ovan nämnda tjänsten tillgänglig patient utgör dock ett hjälpmedel som till del begränsar möjligheten till felaktig behand-
100https://www.inera.se/tjanster/alla-tjanster-a-o/npo---nationell-patientoversikt/ samt https://inera.atlassian.net/wiki/spaces/OINPN/pages/2354385877/Checklista+F+rberedel ser+konfigurering+i+HSA, besökt 2024-12-30.
101https://inera.atlassian.net/wiki/spaces/OINPN/pages/442336878/Tillg+nglig+patient+TGP, besökt 2024-08-19.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
ling. I en registerlösning ankommer dessa kontroller och uppfölj- ning på registerhållaren.
Även EU-förordningen om det europeiska hälsodataområdet102 ställer krav på behörighetsstyrning av åtkomst, loggning och trans- parens gentemot patienten kring vem som tagit del av informatio- nen.103 Hur svensk rätt ska anpassas till EU-förordningen utreds för närvarande.104
Skillnader i spärrhantering
En registerlösning kan innebära att möjligheter att spärra uppgifter i registret behöver införas för att patienten så långt möjligt ska kunna bestämma över åtkomsten till uppgifter, utan att syftet med regi- stret förfelas. Möjligheterna att spärra uppgifter i registret nationell läkemedelslista och enligt patientdatalagen (2008:355) innebär ut- maningar vad gäller att göra spärrhanteringen lättöverskådlig och pedagogisk för såväl patienter som vårdpersonal. Detta beskrivs ut- förligare i avsnitt 10.6. Om fler sådana möjligheter behöver införas i samband med en utökning av innehållet i registret genom denna utrednings förslag kommer sannolikt komplexiteten också att öka vilket riskerar göra det svårare både för patienten att förstå och hälso- och sjukvårdspersonalen att förklara spärrarnas innebörd och effekter.
Vid en federerad lösning, där åtkomstbestämmelserna och möj- ligheten för patienten att spärra uppgifter styrs av befintlig reglering
ilagen (2022:913) om sammanhållen vård- och omsorgsdokumen- tation, ökar inte komplexiteten ytterligare genom fler bestämmelser.
Även EU-förordningen om det europeiska hälsodataområdet möjliggör för patienten att spärra information.105 Hur den nationella regleringen av spärrar kan samordnas med regleringen av detta i EU-förordningen utreds särskilt.106 Utifrån vår utrednings uppdrag att försöka ensa spärrhanteringen i registret nationell läkemedels- lista och enligt patientdatalagen kan utredningen konstatera att en så likformad spärrhantering som möjligt är av betydelse för att pati-
102Förordningen (EU) 2025/327 om det europeiska hälsodataområdet.
103Se bl.a. artikel 9, 12 och 13 förordningen (EU) 2025/327 om det europeiska hälsodata- området.
104Se utredning S 2024:A.
105Se artikel 8 förordningen (EU) 2025/327 om det europeiska hälsodataområdet.
106Se utredning S 2024:A.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
enten och hälso- och sjukvårdspersonalen ska kunna förstå och an- vända möjligheten att spärra uppgifter på ett ändamålsenligt sätt.
Informationssäkerhet, cyberkriminalitet m.m.
Att samlat lagra stora mängder integritetskänsliga uppgifter innebär risker för integritetsintrång. Konsekvenserna av att en obehörig person får åtkomst till uppgifter, eller att en behörig person bereder sig tillgång till uppgifter i ett obehörigt syfte, kan bli större om in- formationen lagras sammanställd än om den lagras federerat. Den obehöriga åtkomsten kan åstadkommas t.ex. genom att olika former av sårbarheter i it-systemen utnyttjas, eller genom att personer med laglig åtkomst till informationen på olika sätt gör denna tillgänglig även för andra i ett syfte som inte är avsett.
Ett aktuellt exempel på att information i ett nationellt hälsodata- register stulits och missbrukats är det som drabbat vaccinations- registret.107 Folkhälsomyndigheten blev den 8 juli 2022 uppmärk- sammad på att uppgifter om barns vaccinationer mot covid-19 var publicerade på en webbplats. Efter att ha tagit del av utredningar av händelseförloppet bedömde myndigheten att det fanns en risk att hela det nationella vaccinationsregistret kan ha röjts. Röjande inne- bär ur ett dataskyddsperspektiv att det finns en risk att uppgifterna har kopierats och flyttats till en plats där de är utom myndighetens kontroll.108
Det finns förvisso alltid risker med att samla information i digi- tala system. Därför behöver alltid nyttorna vägas mot riskerna innan ytterligare uppgifter samlas. Obehörig åtkomst och obehörigt nytt- jande av information ska alltid förhindras eller försvåras genom ett aktivt informationssäkerhetsarbete som omfattar både verksamhets- mässigt skydd och it-skydd.
Omständigheten att uppgifter vid en registerlösning samlas in och lagras på ytterligare ett ställe än där uppgifterna ursprungligen dokumenterades, innebär dels att uppgifterna dupliceras, dels att det därefter finns ytterligare en källa med känsliga personuppgifter
107Folkhälsomyndigheten (2024): Åtal sedan uppgifter från det nationella vaccinations- registret röjdes 2022, pressmeddelande 7 mars 2024.
108https://www.folkhalsomyndigheten.se/smittskydd-beredskap/vaccinationer/nationella- vaccinationsregistret/information-om-en-personuppgiftsincident-i-det-nationella- vaccinationsregistret/, besökt 2024-03-26.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
med risk för intrång. Vid ett intrång i ett register är risken också att integritetsintrånget blir mer omfattande eftersom mängden sam- lade känsliga personuppgifter i registret blir stort. Det kan jämföras med en federerad lösning där uppgifterna inte hålls samlade utan även fortsatt lagras åtskilt i de olika vårdsystem där de ursprung- ligen dokumenterats. Ett obehörigt intrång i en vårdgivares patient- journal kommer i de flesta fall inte att innehålla samma mängd infor- mation om varje enskild patient som ett nationellt register. Mängden patienter som drabbas av ett dataintrång hos en vårdgivare kommer också att vara betydligt mindre än om ett nationellt register utsätts för detta. Tanken att sprida data och nyttja molnlösningar är också något som Ukraina tillämpade för att minska sårbarheterna och risken att få datacenter utslagna i kriget mot Ryssland.109
Vid beaktande av detta gör utredningen bedömningen att en federerad lösning bör ha en informationssäkerhetsmässig fördel även ur detta avseende.
8.4.4Krav på tillgänglighet och robusthet
System som innehåller vårdinformation behöver vara tillgängliga och robusta. Detta gäller även en nationell sammanställning av information om en patients läkemedelsbehandlingar oavsett om informationen lagras i ett register eller delas genom en federerad lösning. Utmaningarna det medför kan dock vara olika.
Registerlösning
För att ett centralt register, som samlar och delar information från patientjournaler, ska kunna användas för att stödja hälso- och sjuk- vårdspersonalens beslutsfattande eller användas som stöd för pati- entens fortsatta behandling behöver det vara tillgängligt110 samt innehålla korrekt och uppdaterad information.
I händelse av att ett nationellt register blir otillgängligt tvingas patienter och vårdpersonal att använda alternativa källor eller att avstå från informationen. Det medför en risk att beslut måste fattas
109Totalförsvarets forskningsinstitut, 2023, Unravelling the Myth of Cyberwar – Five Hypotheses on Cyberwarfare in the Russo-Ukrainian War (2014–2023), FOI-R--5513--SE, s. 56.
110Med tillgängligt avses här att kunna svara på anrop kontinuerligt över tid, 24 timmar om dygnet, sju dagar i veckan, 365 dagar om året.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
utifrån en mindre komplett bild av patientens hälsosituation eller att tid och resurser behöver användas till att söka efter informatio- nen via andra källor. När ett register som varit otillgängligt åter blir tillgängligt behöver mekanismer finnas på plats för att säkerställa att uppdateringar eller synkroniseringar sker mellan register och källsystem, för att inte riskera att diskrepans i informationsinne- hållet uppstår. Detta ökar komplexiteten i lösningen. Det är också en risk om registret är tillgängligt men att kopplingen till källsyste- men inte fungerar. Det kan då hända att uppdatering av informa- tion i registret inte sker och att beslut fattas på felaktig informa- tion. Sammantaget ställer en registerlösning höga krav på den som ansvarar för driften och dem som ska leverera informationen.
Registret nationell läkemedelslista
Registret nationell läkemedelslista innehåller uppgifter om förskriv- ningar och expedierade läkemedel och utgör inte en samling av in- formation främst från patientjournaler. Registret utgör en original- källa. Att registret är tillgängligt är därmed helt avgörande för att expediering av förskrivna läkemedel ska kunna ske från öppenvårds- apotek och att patienten därmed kan genomföra sin avsedda läke- medelsbehandling. Därför ställs också höga krav på registrets till- gänglighet. Ett tecken på betydelsen av robusthet i processerna kring förskrivning och expediering av läkemedel är att E-hälsomyndig- heten nyligen fick i uppdrag av regeringen att analysera och lämna kostnadseffektiva förslag på hur robustheten i det digitala flödet kan stärkas i fråga om förskrivning och expediering av läkemedel.111
Federerade lösningar
Federerade lösningar bygger på att data hämtas momentant från den som ansvarar för och producerar informationen. För att kunna göra detta utan att vid varje tillfälle för informationsinhämtning behöva anropa samtliga ingående system som kan innehålla infor- mation om en patient används ofta en indexfunktion, benämnt patientdataindex. Ett patientdataindex innehåller information om
111Uppdrag att stärka robustheten i det digitala flödet i fråga om förskrivning och expediering av läkemedel (S2024/01057).
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
vilka system som har information om en viss patient och behöver alltid vara uppdaterat och tillgängligt. Kraven som behöver ställas på ett patientdataindex motsvarar till stor del de krav som gäller för ett nationellt register. Skillnaden är att indexet inte innehåller lika många uppgifter, utan kan sägas innehålla information om var upp- gifter om en viss patient finns.
Eftersom uppgifter som inhämtas med en federerad lösning
kommer att visas från vårdens källsystem krävs att även dessa käll- system är tillgängliga i den stund uppgifter om en viss patient ska hämtas. Till skillnad från ett nationellt register där uppgifterna lagras samlat ställer federerade lösningar krav på tillgänglighet hos alla de distribuerande system som innehåller information om patienten. Sådan information kan vara spridd över flera olika system och vård- givare. Federerade lösningar behöver därför beakta vad som karak- täriserar dessa aktörer och deras system.
Tillgång till, och möjlighet att dokumentera i, en patientjournal är avgörande för att kunna bedriva god och patientsäker vård. Viss vård, t.ex. vid sjukhus112, bedrivs dygnet runt och journalsystemen behöver ständigt vara tillgängliga för att den verksamheten ska kunna bedrivas. Med tillgängliga avses här att systemen är möjliga att läsa från och skriva i. Kraven på leverantörerna av vårdinformationsystem ämnade för sådana verksamheter, och deras beredskap att hantera avbrott, är sannolikt höga. Vid avbrott finns reservrutiner på plats. För dessa vårdgivare blir det också relevant att säkerställa att möjlig- heten till delning av information i en federerad lösning blir robust. Tillgängligheten bygger på verksamhetens grundläggande krav att bedriva verksamhet dygnet runt. För att information från alla vård- givare ska vara tillgänglig genom en nationell tjänst krävs att informa- tionsproducenterna har en skyldighet att dela information. Vidare kan det bli aktuellt att ställa tillgänglighetskrav på dessa vårdgivare för att säkerställa att information alltid finns tillgänglig när den be- höver läsas.
Mindre vårdgivare, t.ex. enstaka praktiker och tandläkarmottag- ningar, karaktäriseras av att verksamheten mycket sällan bedrivs dygnet runt. Verksamhetens krav på tillgänglighet till journalsystemen kan därmed vara lägre för tid när verksamhet inte bedrivs. Det kan inte uteslutas att det bland dessa verksamheter finns vårdgivare som
112Ett sjukhus definieras av att det finns inskrivna patienter vilket i sig betyder att vården sker dygnet runt, se 7 kap. 4 § hälso- och sjukvårdslagen (2017:30).
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
har enklare digitala journalsystem men som i dag inte är uppkopp- lade 24 timmar om dygnet 365 dagar om året. Den allmänna trenden av digitalisering och uppkoppling, tillsammans med de allt högre krav som ställs på dessa system som medicintekniska produkter, och inte minst av kraven på förmåga till datadelning i EU-förord- ningen om det europeiska hälsodataområdet, gör att utredningen bedömer att detta bör vara ett övergående problem.113 Utredningen har dock inte kunnat finna sammanställd information eller haft möj- lighet att göra en närmare kartläggning av vilka system som används av vilka vårdgivare eller vilka förmågor dessa system har (se även avsnitt 17.4). Utredningen bedömer att samhällets digitalisering på sikt kommer göra att merparten av digitala journalsystem kommer vara uppkopplade.
De utmaningar som beskrivs ovan behöver en tillfredställande lösning och behöver vara en central del i ett utvecklings- och infö- randeprojekt. Det har framförts till utredningen att informations- cachning för relevanta uppgifter skulle kunna vara en lösning för att hantera att vissa system inte alltid är on-line. Sådana lösningar innebär dock att information mellanlagras och det behöver i så fall noga utredas hur detta förhåller sig till reglerna om behandling av personuppgifter.
En federerad lösning är också robust så till vida att den bygger på information från många olika källor. Om en vårdgivares system faller ifrån så är information från övriga vårdgivare fortfarande till- gänglig. Det gör att mycket, men inte all information fortfarande kan vara tillgänglig. I det fall det sker ett bortfall av en vårdgivares system och det av patientdataindex framgår att det finns information om den aktuella patienten och att vissa uppgifter om en patient där- med inte finns tillgängliga är det viktigt att användaren får information om vilka vårdgivare som inte tillhandahåller information vid det aktu- ella tillfället. Detta är helt centralt för patientsäkerheten.
113Förordningen (EU) 2025/327 om det europeiska hälsodataområdet.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
8.4.5Federerade lösningar kan innebära utmaningar för tillgång till historiska data
Det går inte att dra några generella slutsatser om hur gammal infor- mation som är av värde i utredning och behandling av en patient. Det varierar mellan olika behandlingar och patientens situation. Upp- gifter om ett vårdtillfälle, där patienten blivit färdigbehandlad, frisk- förklarad och det inte uppstått några komplikationer av betydelse för framtida vård, kan ofta vara av mindre relevans vid ett senare vårdtillfälle. Samtidigt kan det vara väldigt värdefullt att kunna ta del av uppgifter om att en patient sökt vård för samma åkomma vid ett flertal tillfällen under en viss tidsperiod och att då också kunna ta del av de undersökningsresultat som framkommit vid dessa tidi- gare tillfällen. Det kan ge värdefull vägledning i den fortsatta utred- ningen och vid valet av behandling.
En federerad insamling av uppgifter från lång tid tillbaka kan inne- bära utmaningar att, i den samlade informationsmängden, hitta det som är väsentligt i den aktuella situationen. Det finns också kost- nadsmässiga aspekter på att alltid tillgängliggöra all information och att i takt med framtida teknik- och systemutveckling migrera information så att den är direkt tillgänglig via nya system och platt- formar. Nyttorna behöver vägas mot kostnaderna och det behöver beaktas vad som är samhällsekonomiskt försvarbart.
Behovet av information om tidigare genomförda läkemedelsbehandlingar
I de arbeten som föregick den nationella läkemedelslistan114 låg fokus på att hälso- och sjukvårdsvårdpersonal skulle kunna ta del av en samlad bild som visar en patients pågående läkemedelsbehandling. När det gäller behandlingar som inkluderar läkemedel och medicin- tekniska produkter finns dock ibland behov av tillgång till äldre upp- gifter, bl.a. om sådan behandling där effekten sitter i länge, exempel- vis vacciner, genterapier eller implantat. Vissa läkemedel som ges som regelbundna parenterala engångsdoser kan ha effekt som sitter i länge och som kan påverka annan behandling eller hantering av ett nytillkommet sjukdomstillstånd. Om exempelvis någon söker vård med symtom på infektion kan det vara av värde att veta att patienten
114T.ex. PALL och NOD.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
behandlas med t.ex. det immunförsvarssänkande läkemedlet innehåll- ande rituximab var 6:e eller var 12:e månad. Ett annat exempel är när patienter, som en del av en hematologisk cancerbehandling, behand- las med höga doser kortison. I vissa regioner dokumenteras i dag ordi- nationen av höga doser kortison inom cancervården i ett separat it-system och det är därmed inte givet att denna information är till- gänglig för all hälso- och sjukvårdspersonal som har behov av den.
Det finns exempel där det också är viktigt med historisk infor- mation, t.ex. vid val av läkemedel inför nya behandlingar av åter- kommande urinvägsinfektioner. Det kan i dessa situationer vara relevant att ta del av vilka läkemedel som tidigare använts, och med vilket resultat, för att undvika framtida terapisvikt och resistens- utveckling. Vissa läkemedel har också en maximal livstidsdos där det är viktigt att känna till hur mycket patienten tidigare fått admi- nistrerat. Det gäller t.ex. behandling av olika maligna tillstånd med substansen doxorubicin där risken att utveckla hjärtsvikt ökar med dosen. Den kumulativa livstidsdosen för vuxna ska i fallet doxorubicin inte överskrida 550 mg/m2 kroppsyta.115
Olika lösningar har olika fördelar
Tillgång till äldre eller historiska data är enligt utredningens bedöm- ning sannolikt enklare att lösa genom en registerlösning än genom en federerad lösning. Ett register byggs succesivt på med informa- tion och om inget gallras kommer registret med tiden att innehålla all information av den typ som samlas in om en patient. Ett register med känsliga personuppgifter som inte gallras utgör dock en utma- ning ur integritetssynpunkt. I registret nationell läkemedelslista får i dag uppgifter finnas registrerade som längst i fem år, vilket inte skulle vara tillräckligt för vissa av de behandlingar som nämnts ovan och som kan tänkas omfattas av utredningens förslag.
En federerad lösning innebär att man är beroende av vilka histo- riska data och vilken mängd data som källsystemen kan tillgängliggöra. Det finns bestämmelser om bevarandetider i 3 kap. 17 § patient- datalagen (2008:355), förkortad PDL. Där framgår att en journal- handling ska bevaras minst tio år efter det att den sista uppgiften fördes in i handlingen. Av 4 § patientdataförordningen (2008:360)
115Se t.ex. produktresumén för läkemedlet Doxorubicin Accord 2024-01-04.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
framgår att Socialstyrelsen får meddela föreskrifter om att vissa slags journalhandlingar ska bevaras under längre tid. Föreskrifter om längre bevarandetider finns framför allt för verksamheter som omfattar hantering av blod, vävnader och celler (se avsnitt 5.1). Att en journalhandling bevaras innebär dock inte nödvändigtvis att den för all framtid är tillgänglig genom elektronisk åtkomst. Detta kan bli särskilt märkbart då vårdgivare upphör med sin verksamhet. Ett sådant exempel var när den privata vårdcentralen i Pålsboda år 2023 upphörde med sin verksamhet och patientjournalerna, som inte var kompatibla med regionens elektroniska journalsystem, riskerade att bli oåtkomliga.116 Även om det finns bestämmelser om hur informa- tionen i dylika situationer ska tas om hand, se 9 kap. PDL, garante- rar det inte möjlighet till elektronisk åtkomst. Situationen i Pålsboda fick till slut sin lösning genom att Inspektionen för vård och om- sorg, i enlighet med vad som anges i 9 kap. PDL, möjliggjorde att journalhandlingarna överfördes till Region Örebro län. Dock får patientjournalerna vid behov skrivas ut och finns vad utredningen uppfattar fortfarande inte tillgängliga via elektronisk åtkomst.
Det kan även i andra situationer uppstå utmaningar med tillgång till äldre eller historiska uppgifter, t.ex. vid byte av elektroniska jour- nalsystem. Även om de äldre systemen skulle vara uppkopplade med läsmöjlighet kvarstår problematiken med att äldre system har en informatik och semantik som kan vara svår att hantera, åtminstone genom interoperabilitet i sammanställda nationella lösningar. Detta kommer dock sannolikt förändras framöver i takt med att interope- rabiliteten ökar och system byts ut. Krav på interoperabilitet avseende vissa hälsodatauppgifter följer som angetts ovan även av EU-för- ordningen om det europeiska hälsodataområdet.117
Förslaget med en federerad lösning för att samla uppgifter om en patients läkemedelsbehandling är dock ingen heltäckande lösning ens när alla elektroniska system är tillgängliga. Den möjliggör endast insamling av de uppgifter som lagras elektroniskt. Fortfarande förs vissa journaluppgifter på papper och det saknas än så länge tving- ande krav på att journaler ska föras elektroniskt. För att minska riskerna med att information ”försvinner” ur, eller saknas i, elek- troniskt sökbara system kan det vid framtagandet av en interopera-
116https://www.sydnarkenytt.se/hallsberg/artikel/nu-finns-palsbodabornas-vardjournaler- tillgaengliga-igen, besökt 2024-08-20.
117Förordningen (EU) 2025/327 om det europeiska hälsodataområdet.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
bilitetslösning övervägas att information om att vissa uppgifter eller kategorier av uppgifter saknas presenteras för den som söker infor- mationen. De uppgifterna får då eftersökas på annat sätt. Inte heller EU-förordningen om det europeiska hälsodataområdet ställer krav på att alla uppgifter ska registreras elektroniskt, kraven i förord- ningen gäller enbart när uppgifterna faktiskt hanteras elektroniskt. Kraven i EU-förordningen hänförliga till primäranvändning gäller sådana uppgifter som utgör prioriterade kategorier av elektroniska hälsodata med personuppgifter.118 Utifrån den beskrivning som finns i europeiska e-hälsonätverkets riktlinjer för patientöversikter fram- tagna utifrån patientrörlighetsdirektivet är det inte givet att egen- skapen aktuella och relevanta tidigare läkemedel i kategorin patient- översikt inkluderar läkemedel med väldigt kort effekt och som ges t.ex. i samband med narkos eller intensivvård.119 Just anestesijour- nalen är en av de journalhandlingar som fortfarande förs på papper hos flera vårdgivare i Sverige.
Eftersom det i dag inte finns något uttryckligt krav på att jour- naler ska föras elektroniskt är det även fortsatt möjligt för vårdgivare att föra journal på andra sätt. Inte heller sådana journaler kommer att träffas av tillkommande krav på tillgängliggörande av elektroniska journaluppgifter i en federerad lösning. Utredningen gör dock be- dömningen att tillgängliggörandet av nödvändig information kommer att förbättras i så stor utsträckning att det ändå bör övervägas. Av t.ex. det förslag till ny 2 kap. 1 a § i SVOD som presenteras av Utred- ningen om infrastruktur för hälsodata som nationellt intresse ska en vårdgivare ge andra vårdgivare tillgång, genom direktåtkomst eller annat elektroniskt utlämnande, till vissa uppgifter om en patient som behövs för en effektiv och säker vård.120
Registerlösningen kan vara relevant för vissa administrerade läkemedel
Även om utredningen ser många fördelar med federerade lösningar för att dela information om ordinerade och administrerade läkemedel finns det produktområden där en registerlösning, utifrån vad som
118Artikel 14 förordningen (EU) 2025/327 om det europeiska hälsodataområdet.
119Se bilaga 1 till förordningen (EU) 2025/327 om det europeiska hälsodataområdet samt eHealth Network Guideline on the electronic exchange of health data under Cross-Border Directive 2011/24/EU, Patient Summary, Release 3.3, June 2023, s. 24.
120SOU 2024:33 Delad hälsodata – dubbel nytta, s. 276 ff.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
ovan sagts, fortfarande bedöms som mer fördelaktig. Det rör fram- för allt läkemedel som administreras och har effekt under mycket lång tid. Exempel på sådana läkemedel är vacciner (se vidare kapitel 9) och läkemedel för genterapi, men skulle även kunna omfatta andra läkemedel där effekten sitter i så länge att en federerad lösning be- döms mindre lämplig. Utredningen väljer att fortsatt benämnda denna grupp av läkemedel för läkemedel med långvarig effekt. Utredningen bedömer att det för sådana läkemedel kan finnas utmaningar med fede- rerade lösningar och att data i källsystemen skulle behöva vara tillgäng- liga under så lång tid att det kan finnas skäl att i stället lagra dessa uppgifter i registret nationell läkemedelslista (se vidare kapitel 11).
8.4.6Federerade lösningar spar lagringsutrymme
Federerade lösningar kan innebära att man sparar lagringsutrymme. Lagringsutrymme är generellt en utmaning i hälso- och sjukvården. Särskilt multimedia och bildinformation är utrymmeskrävande, men även genetisk information som blir allt vanligare diagnostiskt kan framöver komma att ta alltmer utrymme. Även om de tekniska möj- ligheterna att lagra stora mängder information också hela tiden ökar blir hantering av information på sikt en utmaning. Ur hälso- och sjukvårdens perspektiv blir det därför viktigt dels att överväga vilken information som lagras och hur det sker, dels att hushålla med lag- ringsresurserna. Federerade lösningar innebär till skillnad från regi- sterlösningar att informationen inte behöver dubbleras och är där- med ur ett lagringsperspektiv mer effektiv.
8.4.7Betydelsen av federerade lösningar för insamlande av uppgifter till andra hälsodataregister
Uppgifter om vilka läkemedel patienter får administrerade i hälso- och sjukvården är av stor betydelse som underlag för uppföljning och forskning, dvs. sekundäranvändning av hälsodata (se även kapi- tel 17 avseende utredningens tilläggsuppdrag avseende sekundär- användning). Socialstyrelsen lyfter i sin slutrapport Kartläggning av datamängder av nationellt intresse på hälsodataområdet att behovet av en heltäckande bild av läkemedelsanvändningen i Sverige är mycket
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
stort.121 Myndigheten bedömer vidare att uppgifter om rekvisitions- läkemedel122 insamlade på nationell nivå behövs för bl.a. studier om läkemedelssäkerhet samt för att skapa underlag kopplade till beslut om införande av nya terapiläkemedel och cancerbehandlingar inom hälso- och sjukvården. Det är i dag en stor utmaning att samla alla uppgifter om vilka läkemedel som används av patienter inom sluten- vården och det är svårt att få en tillräckligt hög grad av tillförlitlighet. Läkemedelsregistret är ett register som förvaltas av Socialstyrelsen och som används för forskning och uppföljning. Det innehåller upp- gifter om patienters på öppenvårdsapotek uthämtade läkemedel där uppgifterna framför allt kommer från registret nationell läkemedels- lista.
På motsvarande sätt finns det för Folkhälsomyndighetens behov av uppgifter för bl.a. statistik, uppföljning och forskning, ett register över nationella vaccinationsprogram.123 Vaccinationsprogramsutred- ningen (S 2022:13) har föreslagit vissa ändringar i den lagstiftning som reglerar registret (se vidare avsnitt 9.3).
Utredningen om hälsodataregister (S 2023:02) har bl.a. haft i upp- drag att analysera regelverket för hälsodataregister och att föreslå regler för behandling av personuppgifter som avser rekvisitionsläke- medel och särskilt bedöma om uppgifterna kan samlas in via registret nationell läkemedelslista.124 Utredningen föreslår i sitt betänkande Ett nytt regelverk för hälsodataregister, SOU 2024:57, bl.a. inrättan- det av ett nytt register för uppgifter om administrerade läkemedel.125 Registret föreslås innehålla uppgifter om administrerade läkemedel i slutenvård och specialiserad öppenvård, inklusive vacciner.126 I be- tänkandet framgår vidare att uppgifterna ska samlas in direkt till Socialstyrelsen och inte via registret nationell läkemedelslista och att uppgifter om ordinationer inte bör samlas in.127,128 Vår utredning och Utredningen om hälsodataregister har under utredningstiden haft en nära och regelbunden dialog.
121Socialstyrelsen, 2022, Kartläggning av datamängder av nationellt intresse på hälsodata- området – slutrapport, art.nr 2022-10-8136.
122Vår utredning använder inte begreppet rekvisitionsläkemedel då detta i huvudsak knyts till en distributionsform. Vi använder i stället begreppet läkemedel som administreras eller över- lämnas av hälso- och sjukvårdspersonal. Begreppen avser dock ungefär samma läkemedel.
123Se lagen (2012:453) om register över nationella vaccinationsprogram.
124Bättre förutsättningar för uppföljning av hälso- och sjukvården (dir. 2023:48).
125SOU 2024:57 Ett nytt regelverk för hälsodataregister, s. 265 samt s. 295.
126A.a., s. 265.
127A.a., s. 281.
128A.a., s. 268.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
Som framgår av redovisningen ovan gör utredningen bedöm- ningen att det sammantaget för primäranvändning av patientupp- gifter finns fördelar med att dela uppgifter om ordinerade och admini- strerade läkemedel genom federerade lösningar, jämfört med en registerlösning. Utredningen finner dock att det finns skäl att fort- satt samla uppgifter om förskrivningar och expedierade läkemedel i registret nationell läkemedelslista, se vidare om detta i avsnitt 8.4.8. Registret nationell läkemedelslista finns och utgör en nationell källa för uppgifter. Det är också i dag den enda källa där uppgifter om expedierade läkemedel samlas. Det finns därmed rationella skäl för att fortsatt hämta uppgifter om förskrivna läkemedel till läkemedels- registret129 hos Socialstyrelsen via den nationella läkemedelslistan. Om utredningen hade funnit att uppgifter om ordinationer och administrerade läkemedel skulle samlas i ett nationellt register hade det också varit rationellt att överväga att ha det registret som källa för andra hälsodataregister som har behov av de i registret lagrade uppgifterna.
Att samla uppgifter i registret nationell läkemedelslista och dela dessa med andra hälsodataregister utgör dock inte den enda rationella lösningen för insamling eller delning av uppgifter där synergier upp- nås. Utredningen konstaterar att krav på gemensamma nationella specifikationer för interoperabilitet, dvs. hur data utbyts mellan aktörer, utgör en god och nödvändig grund för att det ska gå att dela information mellan olika aktörer och i olika syften (se även avsnitt 8.13.4). Detta gäller oavsett om en registerlösning eller en federerad lösning används. Att statens satsningar på en digital infra- struktur för hälso- och sjukvården ska grundas på interoperabili- tetslösningar föreslås också av Utredningen om infrastruktur för hälsodata som nationellt intresse (S 2022:10) i betänkandet Delad hälsodata – dubbel nytta. Regler för ökad interoperabilitet i hälso- och sjukvården. Enligt betänkandet ska dessa interoperabilitetslösningar i möjligaste mån vara baserade på standarder som är öppna, inter- nationella och implementationsnära.130 Som angetts ovan innebär också EU-förordningen om det europeiska hälsodataområdet bl.a. krav på delning av vissa hälsodata för primäranvändning med den interoperabilitetslösning som följer av förordningen.
129Utredningen om hälsodataregister föreslår att läkemedelsregistret som en del i hela för- slaget om en ny hälsodataregisterlag ska byta namn till registret över expedierade läkemedel.
130SOU 2024:33 Delad hälsodata – dubbel nytta, Regler för ökad interoperabilitet i hälso- och sjukvården, s. 226.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
En interoperabilitetslösning innebär att det semantiskt, juridiskt och tekniskt finns förutsättningar att utbyta information. Om ovan nämnda standarder har tagits fram och implementerats av hälso- och sjukvårdsaktörer kommer det därför att möjliggöra delande av data i väsentligt större utsträckning än vad som för närvarande är möjligt. När samtliga ovan nämnda förutsättningar är uppfyllda kommer det att krävas en enklare teknisk åtgärd för att utbyta in- formation, även om utbytet ska ske med fler aktörer och i olika syften. Utredningen återkommer till hur förslagen i vårt betänkande förhåller sig till det ovan nämnda och andra nyligen lagda förslag om bl.a. interoperabilitetslösningar i avsnitt 8.13.
Vilka uppgifter som ska dokumenteras om ordinerade och admi- nistrerade läkemedel är väldefinierade informationsmängder som anges i föreskrifter. Det finns därför ett begränsat antal parametrar att komma överens om hur de ska utbytas. Detta utgör en god grund för att det ska gå att ta fram gemensamma specifikationer för dessa. Vid beaktande av detta finner utredningen att en federerad lösning, som bygger på datadelning genom gemensamma specifikationer, kan utgöra en lämplig grund för insamling av data för såväl primär- som sekundäranvändning när det gäller uppgifter om läkemedel som ordineras och administreras i hälso- och sjukvården. Det blir genom detta en lämpligare, och för aktörerna en inte mer betung- ande åtgärd, att uppgifterna delas direkt med respektive mottagare av uppgifterna jämfört med att uppgifterna först ska lagras i ett sär- skilt register. Den föreslagna lösningen kan därför enligt utredningens bedömning utgöra en lämpligare grund för såväl insamling av upp- gifter till ett hälsodataregister som för momentan delning av upp- gifter mellan vårdgivare, än att först samla uppgifterna i nationella läkemedelslistan för att sedan lämna dem vidare till Socialstyrelsens register. Utredningen drar därför samma slutsats avseende detta som gjordes i betänkandet Delad hälsodata – dubbel nytta.
8.4.8Ett register är fortfarande lämpligt för förskrivningar
Som utredningen konstaterar ovan finns det flera argument för att dela information om ordinationer genom federerade lösningar. Det finns dock fortfarande starkt vägande skäl för att information om förskrivningar och expedierade förskrivna läkemedel och varor även
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
fortsatt bör finnas i ett nationellt register. Som beskrivits i avsnitt
5.2.3är ett recept i första hand ett meddelande mellan förskrivaren och öppenvårdsapoteket som ska säkerställa att en patient får rätt läkemedel och kan använda detta på avsett sätt. Därutöver används receptet för att förmedla viss information till patienten och för in- formation som ligger till grund för betalning. Så länge öppenvårds- apotek inte kan ta del av ordinationsinformation direkt ur en pati- ents journal och utifrån denna genomföra en expediering behöver receptuppgifterna även fortsatt förmedlas till öppenvårdsapoteken på annat sätt. En förändring av nuvarande ordning skulle behöva föregås av en noggrann analys och skulle medföra omfattande för- ändringar av gällande regelverk. Expedierande personal på apotek kan inte få åtkomst till uppgifter i journalen enligt patientdatalagen i dess gällande lydelse. Förändringen skulle dessutom sannolikt få stora konsekvenser för både vårdens och apoteksaktörernas it-sys- tem. Om expediering av läkemedel skulle bygga på ordinations- information direkt ur journalen krävs också att tillgången till dessa uppgifter är tillräckligt robust.
Om uppgifter om ordinationen i ett första skede tillgängliggörs nationellt, kan delas mellan vårdgivare och blir tillgängliga för patien- ten framstår det därför som ett viktigt första steg. När detta är genom- fört kan ytterligare förändringar övervägas om det finns behov av det. Mot bakgrund av detta och för att förskrivningar ska kunna till- gängliggöras för alla apoteksaktörer i Sverige, och inom det Europeiska ekonomiska samarbetsområdet, bedömer utredningen att ett register där förskrivningar samlas därför även fortsatt är en ändamålsenlig lösning.
Registret nationell läkemedelslista är också den enda källa som samlar uppgifter om samtliga expedierade förskrivna läkemedel och andra varor. För att fortsatt kunna följa upp vilka förskrivna läke- medel och varor en patient faktiskt också hämtat ut från ett öppen- vårdsapotek behöver expedieringen kunna kopplas till det recept som ligger till grund för denna. Det finns dock utmaningar med den nu- varande lösningen vilka bl.a. beskrivits i avsnitt 8.2.2. Om man i en framtid ser möjligheter att bygga vidare på expediering direkt utifrån ordinationen så kommer ändå informationen om vad som expedie- rats behöva samlas in, sannolikt i ett register. Det aktuella läget och de investeringar och framsteg som gjorts utifrån den nu gällande lagen
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
om nationell läkemedelslista motiverar inte heller enligt utredningen att det i nuläget bör väljas en annan lösning i dessa delar.
8.4.9Utredningens samlade bedömning
Det finns för- och nackdelar både med federerade lösningar för datadelning och med en registerlösning. Utredningens bedömning är att fördelarna med att tillgängliggöra uppgifter genom en fede- rerad lösning överväger när det gäller att dela information om ordi- nationer och vilka läkemedel som administrerats avseende de flesta läkemedelsbehandlingar. De huvudsakliga skälen för bedömningen är att en federerad lösning möjliggör tillgång till information direkt från den vårdgivare som ursprungligen dokumenterat uppgiften, innebär mindre risk för integritetsintrång och att någon ytterligare aktör inte behöver lagra eller hantera känsliga personuppgifter. Ut- redningen bedömer därför att uppgifter om läkemedelsordinationer och administrerade läkemedel för primäranvändning i första hand bör samlas in och delas genom en federerad teknisk lösning. Vissa uppgifter om behandlingar av betydelse under lång tid kan dock behöva samlas in och delas genom ett register.
Uppgifter om förskrivningar och expedierade förskrivna läke- medel bör även fortsatt samlas i och delas genom ett register efter- som det är den enda samlade källan för dessa uppgifter och uppgif- terna behövs för att bl.a. möjliggöra expediering av recept nationellt och i andra EU- och EES-länder. Federerad information liksom uppgifter ur registret behöver kunna presenteras samlat för dem som är behöriga att ta del av informationen.
8.5Det behövs samlad information även om vissa medicintekniska produkter
Utredningens bedömning: Det behövs en nationell sammanställ- ning över en patients behandling med eller användning av vissa medicintekniska produkter. Registret nationell läkemedelslista bör kompletteras med sådana uppgifter.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
Medicintekniska produkter utgör ett omfattande och heterogent produktområde och har beskrivits bl.a. i avsnitt 5.3.1. Patienternas, vårdpersonalens och öppenvårdsapotekens behov av information om medicintekniska produkter finns beskrivna i kapitel 6. I avsnitt
8.2redogjorde utredningen för behoven av en samlad bild av en patients läkemedelsbehandling och att arbetet med detta har pågått i snart 20 år. Motsvarande aktiviteter saknas på en övergripande nivå på medicinteknikområdet även om det finns exempel kring information om vissa begränsade grupper av implantat (se vidare 8.7.1 nedan). Det saknas t.ex. i allmänhet motsvarande uttalanden kring betydelsen för patientsäkerheten av tillgång till information om medicintekniska produkter. Det finns vad utredningen känner till inte heller något uttalande från riksdagen på samma sätt som för läkemedel. Utredningen känner inte heller till att information om och patientens användning av medicintekniska produkter i allmän- het beforskas i någon större utsträckning. Det är därmed svårare att hitta tydligt vetenskapligt stöd för hur utredningen ska se på be- hovet av information om en patients användning av medicintek- niska produkter.
Vissa medicintekniska produkter finns redan i registret nationell läkemedelslista
Vissa medicintekniska produkter är redan, genom elektroniska för- skrivningar på hjälpmedelskort, en del av registret nationell läke- medelslista (se avsnitt 5.3.6). Detta är en konsekvens av att elek- tronisk förskrivning av förbrukningsartiklar har hanterats genom samma infrastruktur som recept för läkemedel. Förskrivningarna har därmed även inkluderats först i receptregistret och senare i registret nationell läkemedelslista. Som framgår av avsnitt 5.3.4 är friheten att utforma system för förskrivning och tillhandahållande av medicintekniska produkter mycket större än för läkemedel. Även om registret nationell läkemedelslista kan betraktas som en natio- nell infrastruktur för förskrivning på hjälpmedelskort kan man inte på samma sätt som för läkemedel hävda att registret bidrar till en nationell sammanställning av information om dessa förskrivningar. Dessutom finns inga begränsningar i att förskriva dessa produkter på andra sätt än elektroniskt.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
Vissa av de medicintekniska produkter som kan förskrivas på hjälpmedelskort har en tydlig koppling till läkemedelsbehandling genom att de är avsedda för att tillföra kroppen läkemedel eller för egenkontroll av behandling. Information om dessa produkter är ibland av betydelse för att apotekspersonalen ska kunna bedöma att patienten kan hantera sina läkemedel på ett korrekt sätt.131 I de fall produkterna förskrivs på hjälpmedelskort finns informationen ofta tillgänglig i registret nationell läkemedelslista.132 I de fall regionerna distribuerar förbrukningsartiklar genom andra system än öppenvårds- apotek kan det dock innebära utmaningar för öppenvårdsapoteken (se avsnitt 6.5.2.). I dessa fall har expedierande personal på öppen- vårdsapotek inte tillgång till den aktuella informationen eftersom det då saknas en förskrivning som registrerats i registret nationell läkemedelslista. Detsamma gäller om ett hjälpmedelskort utfärdas på papper.
Information om många andra medicintekniska produkter omfattas i dag inte av någon nationell sammanställning
Medicintekniska produkter omfattar betydligt fler produkter eller produktkategorier än de som i dag kan hanteras genom registret nationell läkemedelslista. Analysen av behovet av information kan därför inte begränsas till de produktkategorier som i dag kan om- fattas av registret. I kapitel 6 har utredningen redogjort för vad som framkommit om patientens, vård- och apotekspersonalens behov av information.
De infrastrukturella förutsättningarna att tillgängliggöra infor- mation om användningen av medicintekniska produkter är också annorlunda än för läkemedel. Utredningen beskriver t.ex. i avsnitt
8.7.2de allmänna utmaningarna avseende avsaknaden av grundlägg- ande information för medicintekniska produkter såsom t.ex en nationell produktkatalog och ett system för kategorisering. Det saknas också i stora delar en gemensam informatik för ordination och förskrivning av medicintekniska produkter.
131Se 2 kap. 9 a § lagen (2009:366) om handel med läkemedel samt 8 kap. 32 § Läkemedels- verkets föreskrifter (HSLF-FS 2021:75) om förordnande och utlämnande av läkemedel och teknisk sprit.
132Notera att till skillnad för vad som gäller för förskrivningar av läkemedel finns inget krav på att förskriva varor på hjälpmedelskort elektroniskt. Däremot registreras alla expedieringar i den nationella läkemedelslistan.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
Förutsättningarna för patienten
Förutsättningarna för patienten att i dag ta del av information om sina medicintekniska produkter är i allt väsentligt desamma som beskrivits avseende läkemedel i avsnitt 8.2.1. Sammanfattningsvis innebär det att det finns en patientrörlighet som medför att i den mån information finns kan den vara utspridd över flera olika vård- givare och i flera olika informationssystem. Till skillnad från läke- medel kan dock förskrivningar finnas i flera olika system eftersom regionerna kan ha inrättat flera olika parallella försörjningsmodeller för olika medicintekniska produkter som förbrukningsartiklar, hjälp- medel, stomi- och inkontinensprodukter. Därutöver finns informa- tion om vissa andra medicintekniska produkter som använts i sam- band med vård i vårdinformationssystemen. I vilken grad det går att ta del av detta via e-tjänster som 1177 Journal beror dels på hur informationen dokumenteras i patientjournalen, om det sker i en informationsdomän som delas genom ett tjänstekontrakt och om den aktuella vårdgivaren valt att dela denna informationsdomän. Någon tydlig rubrik i 1177 Journal som hanterar just medicintek- niska produkter finns inte. I den mån förskrivningar på hjälpmedels- kort visas sker det under rubriken läkemedel via tjänstekontraktet GetMedicationHistory (se avsnitt 7.2.2).
Vad som framgår av 8.2.1 om en hög digital mognad att ta del av information via elektroniska tjänster är naturligtvis även tillämpligt på detta område.
Förutsättningar för vårdpersonal att ta del av information
Förutsättningarna för vårdpersonal att ta del av information om användningen av medicintekniska produkter påverkas precis som för patienten av i vilken mån informationen är utspridd hos flera olika vårdgivare och i olika system. Det saknas i grunden en enhetlig informatik kring ordination och förskrivning av medicintekniska produkter vilket gör att information t.ex. får sökas bland annan jour- nalinformation som tillgängliggörs genom e-tjänsten Nationell patientöversikt. Information om förskrivningar av medicintekniska produkter som genomförs elektroniskt på hjälpmedelskort finns åtkomliga via den nationella läkemedelslistan eller under rubriken läkemedel i den nationella patientöversikten, om vårdgivaren valt
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
att dela informationen. Viss information om implantat tillgänglig- görs också via uppmärksamhetsinformationen (se avsnitt 8.7.3 nedan). Utredningen kan konstatera att det inte finns någon sam- lad nationell infrastruktur genom vilken information om använd- ningen av eller behandlingen med medicintekniska produkter kan delas för hälso- och sjukvårdspersonalens behov.
Det finns ett behov av nationell infrastruktur för att hantera internationella utmaningar
Trots vad som ovan sagts är det utredningens uppfattning att det finns ett behov av att börja utveckla nationell infrastruktur för att möjliggöra delning av information om användningen av åtminstone vissa medicintekniska produkter. Ett sådant skäl är inrättandet av det europeiska hälsodataområdet som ställer direkta krav på att vissa uppgifter ska kunna delas mellan vårdgivare nationellt och till vård- givare i andra länder inom EU. Patientöversikterna, som ingår i de prioriterade kategorierna av elektroniska hälsodata med personupp- gifter för primäranvändning enligt EU-förordningen, ska bl.a. om- fatta uppgifter om medicintekniska produkter och implantat133.
Ieuropeiska e-hälsonätverkets riktlinjer för patientöversikter fram- tagna utifrån patientrörlighetsdirektivet beskrivs kategorin omfatta en patients implanterade och externa medicintekniska produkter och utrustning av vilka deras hälsostatus är beroende. Det inklu- derar produkter som pacemakers, implanterade fibrillatorer, pro- teser, ferromagnetsiska benimplantat etc. som hälso- och sjukvårds- personalen behöver ha kännedom om.134 Utifrån den beskrivningen omfattas i vilket fall inte alla de omkring 800 000 olika medicintek- niska produkter som kan finnas på den svenska marknaden, utan antalet produkter avgränsas väsentligt.
Enligt EU-förordningen om det europeiska hälsodataområdet utgör bl.a. elektroniska förskrivningar sådana prioriterade elektro- niska hälsodata med personuppgifter som ska delas för primär- användning. De genomförandeakter som kommissionen enligt
133Se artikel 14.1 och bilaga I till förordningen (EU) 2025/327 om det europeiska hälsodata- området. Skrivningen kan framstå som märklig då implantat är att betrakta som medicin- tekniska produkter om de inte klassificeras som läkemedel. I det senare fallet utgör de i så fall en beredningsform.
134eHealth Network Guideline on the electronic exchange of health data under Cross- Border Directive 2011/24/EU, Patient Summary, Release 3.3, June 2023, s. 23.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
förordningen ska fastställa senast den 26 mars 2027 får klargöra om även förskrivningar avseende förbrukningsartiklar ska omfattas av kraven på att dela uppgifter.135
Många av de produkter som förskrivs på hjälpmedelskort i Sverige har ett nära samband med läkemedelsanvändningen och det kan därmed finnas ett stort behov av att ha kännedom även om dessa. Det är t.ex. svårt för en diabetiker att injicera sitt insulin utan en kanyl. Det är också svårt att följa sin behandling utan tillgång till teststickor. Små barn som är astmatiker behöver även ha tillgång till en andningsbehållare för att kunna använda sin inhalator. Även om det ännu inte finns ett gemensamt europeiskt system för för- skrivningar av medicintekniska produkter är det produkter där det vid behandling i andra länder kan finnas skäl att åtminstone kunna dela information om vilka produkter patienten använder eller har använt.
Sammantaget gör utredningen bedömningen att det finns ett nationellt behov av en sammanställning av information om vissa medicintekniska produkter och att det utan en sådan infrastruktur är svårt att dela motsvarande uppgifter över landsgränser. Även om kravet på att dela uppgifter om medicintekniska produkter i patient- översikter enligt EU-förordningen om det europeiska hälsodata- området synes vara begränsat utifrån vad som anges om detta i europeiska e-hälsonätverkets riktlinjer, kan det inte uteslutas att det kommer utökas framöver. Kommissionen har t.ex. befogenhet att anta delegerade akter som ändrar innehållet, och därmed vilka uppgifter som ska delas, i bilaga 1 till EU-förordningen.136
135Se artikel 14.1 och 15.1 förordningen (EU) 2025/327 om det europeiska hälsodataområdet. Det är inte helt tydligt om även elektroniska förskrivningar avseende förbrukningsartiklar omfattas av vad som ska delas enligt EU-förordningen, jfr. artikel 2.1 b samt annex I, punk- ten 2 Elektroniskt recept, i EU-förordningen samt definitionerna av recept och medicinskt hjälpmedel i direktiv 2011/24/EU.
136Se artikel 14.2 förordningen (EU) 2025/327 om det europeiska hälsodataområdet.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
8.6Vilka medicintekniska produkter bör omfattas av en nationell sammanställning
Utredningens bedömning: En nationell sammanställning över en patients behandling med eller användning av medicintekniska produkter bör som ett första steg omfatta alla produkter som kan förskrivas samt vissa medicintekniska produkter med avsedd långvarig användning, t.ex. vissa implantat och invasiva produk- ter. Utvecklingen av en sådan sammanställning bör ske succesivt och i nära dialog med berörda aktörer.
Utredningen har i uppdrag bl.a. att analysera och ta ställning till om uppgifter om medicintekniska produkter kan läggas till i den natio- nella läkemedelslistan, och i så fall vilka produkter. I föregående av- snitt konstaterade utredningen att det behövs en utökad nationell sammanställning av patientens behandling med eller användning av vissa medicintekniska produkter. I detta avsnitt analyserar utred- ningen närmare behovet av information om behandling med eller användning av vilka medicintekniska produkter.
8.6.1Vilka produkter som ska omfattas måste bygga på ett behov av information
En bedömning av vilka medicintekniska produkter som ska omfattas av en nationell sammanställning över en patients behandling med eller användning av medicintekniska produkter måste bygga på patientens, hälso- och sjukvårdens och apotekens behov av infor- mation och ta sin utgångspunkt i deras författningsreglerade upp- gifter. En utgångspunkt måste vara att informationen ska bidra till ökad patientsäkerhet eller andra tydliga nyttor för de olika aktörerna. I det följande sammanfattas patientens, vårdpersonalens och apote- kens behov i detta avseende. De utmaningar som finns med att till- gängliggöra patientuppgifter över vårdgivargränser, mellan olika vård- informationssystem och med beaktande av patientens valmöjligheter av vårdgivare som tidigare beskrivits är i stor utsträckning desamma för läkemedel och medicintekniska produkter.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
Patientens behov av information om sina medicintekniska produkter
Patientens behov av tillgång till uppgifter om medicintekniska pro- dukter som ingår i dennes behandling finns närmare beskrivet i av- snitt 6.3.4. Där framgår bl.a. att patienter har behov av information om sådana produkter som de ordineras att själva ansvara för att an- vända. Förskrivningar av medicintekniska produkter omfattar ofta inte på samma sätt som för läkemedel någon särskild anvisning om dosering eller hur produkten i övrigt ska användas. Det finns t.ex. inte någon författningsreglering kring att uppgift om användning ska anges på ett hjälpmedelskort. Vad gäller regionernas egna utfor- made underlag för förskrivning är utformningen av dessa helt upp till regionen att besluta om. Det finns dock bestämmelser som anger att en patient ska få sådan information att de kan använda produk- terna.137 Denna information förmedlas normalt sett inte via förskriv- ningar utan på andra sätt. Patienterna har därför framför allt behov av information om sina förskrivningar av medicintekniska produkter på hjälpmedelskort för att kunna beställa dessa produkter. Patienten kan också ha behov av information om vilka medicintekniska pro- dukter som utgör hjälpmedel och som patienten lånar eller hyr av en vårdgivare.
Som framgår av avsnitt 5.3.4 kan distributionen av förbruknings- artiklar ske på olika sätt, antingen via utlämnande från öppenvårds- apotek eller via någon annan av regionerna upphandlad logistiklös- ning. Det är endast när produkterna förskrivs på hjälpmedelskort och distribueras via öppenvårdsapotek som förskrivningar i dag regi- streras i registret nationell läkemedelslista. Andra typer av förskriv- ningar hanteras via andra system.
Smidig distribution utifrån patientens behov viktig
Av den enkätundersökning riktad till patienter som utredningen genomfört (se avsnitt 6.2) framgår att det för patienten spelar mindre roll om distributionen av förbrukningsartiklar sker via öppenvårds- apotek eller genom vården så länge distributionen fungerar på ett effektivt sätt. Patienter som använder förbrukningsartiklar som har
137Se 2 kap. 3 § Socialstyrelsens föreskrifter (HSLF-FS 2021:52) om användning av medicin- tekniska produkter i hälso- och sjukvården.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
nära samband med en läkemedelsbehandling ser generellt sett fler fördelar med distribution via öppenvårdsapotek. För dessa patienter underlättar det om beställning och distribution av förbrukningsartik- lar och läkemedel kan ske samlat, även om undantag finns. Ur ett informationsperspektiv behöver då förskrivning ske på hjälpmedels- kort och informationen finnas att tillgå via registret nationell läke- medelslista.
Patienter som använder stomi- eller inkontinensartiklar ser fram- för allt fördelar med distanslösningar som innebär att de kan få en smidig leverans direkt hem eftersom dessa produkter ofta är skrym- mande. Dessa patienter är generellt mer negativt inställda till att hämta produkterna fysiskt på apotek då produkterna, förutom att vara skrymmande och svåra att få med från butik, ändå oftast inte finns i lager. Vilken aktör som de beställer genom och vem som sköter distributionen blir därmed av underordnad betydelse. En smidig dis- tributionslösning är viktigast. Patienter som får sina produkter för- skrivna och distribuerade via vårdgivarnas egna distributionslösningar upplever ibland svårigheter att veta om och hur mycket de har kvar på sina förskrivningar eftersom de olika vårdgivarna har olika lös- ningar för förskrivningar. Dessa förskrivningar finns inte tillgäng- liga i registret nationell läkemedelslista och vad utredningen förstått utifrån enkätsvaren inte eller alltid via e-tjänsten 1177 Journal.
Särskilt om synen på information om implantat
Patienterna ser också ett värde i att ha tillgång till information om medicintekniska implantat. I den enkätundersökning utredningen genomfört lyfts både ett allmänt informationsbehov om vilka im- plantat man har tillförts som specifika behov kopplade till säker- hetskontroller vid resor, akut vård i de fall man inte är kontaktbar, vid kognitiv svikt eller i anhörigvård. Även säkerhetsrelaterade frågor som indragningar av specifika produkter nämns. Man uttrycker också ett behov av att informationen bör kunna göras tillgänglig för andra vårdgivare i de fall vårdgivarna inte har tillgång till journalinforma- tionen. Frågan om implantat besvarades också av förhållandevis många personer som inte har ett implantat men som lyfte fram önskan av att ha tillgång till sådan samlad information om de i framtiden skulle få ett eller flera implantat.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
För vissa implantat finns i dag krav på att patienten ska få ett implantatkort med viss information, se vidare 8.6.2 nedan.
Vårdpersonalens behov av uppgifter om patientens behandling med eller användning av medicintekniska produkter
Som konstaterats i avsnitt 6.4.3 finns även nyttor för hälso- och sjukvårdpersonal när information om en patients medicintekniska produkter kan delas mellan olika vårdgivare. Tydligast är nyttan kopplad till uppgifter om produkter som förskrivs, som används i samband med läkemedelsbehandling samt för medicintekniska im- plantat. Precis som vid läkemedelsbehandling kan information enbart om ordinerade medicintekniska produkter aldrig fullt ut ersätta be- hovet av tillgång även till andra uppgifter i patientjournalen. Det kan dock bidra till att ge en samlad bild av patientens pågående behand- lingar med eller användning av medicintekniska produkter (se av- snitt 8.1).
Behov av information om specifika produkter
När en patient söker vård hos en annan vårdgivare än den som pati- enten tidigare uppsökt, och direktåtkomst till den tidigare vårdgiva- rens patientjournal saknas där, finns det behov för hälso- och sjuk- vårdspersonalen att kunna få veta mer exakt vilken produkt patienten tidigare förskrivits eller använder. Den informationen behövs t.ex. vid bedömning och utfärdande av en ny förskrivning av förbruknings- artiklar eller i samband med att patienten skrivs in för vård på sjuk- hus. Även när patienten får vård genom kommunal vård och omsorg finns behov av tillgång till sådan information. Vid förskrivning av injektionskanyler är det t.ex. viktigt att veta exakt vilken typ av nål patienten tidigare haft, dels avseende kanylens längd men också så att den passar den injektionspenna patienten använder. Stomipro- dukter är ofta individuellt utprovade och alla produkter passar inte alla individer. Tillgång till uppgifter om vilken produkt patienten använder, och att informationen är korrekt, är därför av betydelse för att patienten ska få rätt produkt och är därigenom även av be- tydelse för patientsäkerheten. Felaktig förskrivning eller beställning
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
av produkter leder, förutom de besvär patienten upplever, till onödig användning av ekonomiska, materiella och personella resurser.
Information om medicintekniska produkter kan även vara av indirekt betydelse och säga något om patientens tillstånd
Vårdpersonal uttrycker i enkätsvaren även att information om medi- cintekniska produkter ibland kan vara av indirekt betydelse. Exem- pelvis kan en uppgift om att patienten använder vissa produkter eller produktgrupper ge en indikation om patientens situation, t.ex. när patienten har en sond, kateter eller stomi. Sådan information kan ibland vara av betydelse vid nya vårdbeslut. Här kan noteras en skill- nad i olika yrkesgruppers behov av information. Exakt vilket stomi- material patienten använder är viktigt för sjuksköterskan som ska hjälpa patienten att prova ut och förskriva dessa produkter. För en läkare kan det i stället räcka med att veta att patienten har en stomi för att kunna göra relevanta bedömningar kring patientens vård och behandling. Någon närmare information om de specifika produkterna behövs inte.
Information om implantat och invasiva produkter
Vårdpersonal uttrycker också ett behov av att känna till information om en patients medicintekniska implantat och vissa invasiva produk- ter. Det finns flera skäl till detta. I det fall en patient t.ex. söker vård med ospecifik feber är det viktigt att veta om det finns ett implantat som kan vara infekterat med s.k. biofilm138. Biofilmsetablerade bakte- rier går in i ett vilande stadium där de uppvisar såväl förmåga att und- komma kroppens infektionsförsvar som nedsatt antibiotikakänslig- het. Således måste man ta hänsyn till förekomst av biofilm och välja andra behandlingsstrategier vid implantatassocierade infektioner än vid andra infektioner. Ledprotesinfektion uppskattas inträffa efter cirka 1 procent av elektiva ingrepp respektive 1,7 procent vid fraktur-
138Biofilm – tunna skikt av bakterier eller andra mikroorganismer på ytor i vatten eller andra våta miljöer där organismerna kan leva, t ex på medicinska implantat, på tandytor eller på båtbottnar i sjövatten. Biofilmen består av flera lager celler i ett skyddande slem av poly- merer, som cellerna själva producerar, och som bildar en barriär mot såväl fagocyter som antibiotika.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
protes.139 Kunskap om att patienten har ett implantat kan i dessa situationer innebära att man snabbare kan besluta om rätt behand- ling, vilket av patientsäkerhetsskäl är viktigt dels för att stoppa in- fektionen, dels för att använda rätt antibiotika på rätt sätt och därmed minska risken för resistensutveckling.
Information om implantat är också viktig i samband med radio- logiska undersökningar. Vissa implantat är ferromagnetiska och kan därmed innebära risker för vävnadsskada i samband med radiologiska undersökningar. Även implantat som innehåller känslig elektronik kan vara av betydelse att känna till då det kan få negativa konsekven- ser och äventyra patientsäkerheten om dessa skadas vid undersök- ningen. Det förekommer också situationer då implantatet i sig inte har betydelse för själva röntgenundersökningen men där valet och användningen av kontrastmedel skiljer sig åt beroende på om man t.ex. har en höftprotes inopererad. Felaktigt val av kontrastmedel skulle kunna leda till att undersökningen behöver göras om och där- igenom innebära risk för försenad behandling. Eftersom radiologiska undersökningar ibland utförs akut finns det risk att information av betydelse för patientsäkerheten inte finns tillgänglig i åtkomliga journaler.
Ett annat implantat som det är viktigt att känna till om det före- kommer är användningen av konstgjord sfinkter140 vid urininkonti- nens. Den konstgjorda sfinktern med tillhörande delar opereras in och är inte synlig utvändigt.141 Det är på dessa patienter kontraindi- cerat att använda vanlig urinkateter varför det i akuta situationer är viktigt att känna till förekomst av den implanterade sfinktern.
Det är också viktigt för läkare att vid konstaterande av dödsfall veta om en patient har vissa implantat, t.ex. pacemaker eller defibrilla- tor. Dessa måste föras upp på dödsbeviset då de kan explodera vid kremering. Enligt enkätsvaren kan sökandet efter information om pacemaker vid dödsfall vara ett tidsödande jobb. Konstaterande av dödsfall kan ske i hemmet av jourhavande läkare. Det rör då ofta patienter man inte sedan tidigare känner till, det kan ske under tids- press och det är inte alltid möjligt att leta information i den avlidnes
139Handläggning av infektioner vid ortopediska implantat en utmaning för vården. Läkar- tidningen. 2019,116:FR6C.
140En sfinkter är en ringformad muskel som stänger en öppning, t.ex. runt urinröret eller ändtarmen.
141https://mellanarkiv- offentlig.vgregion.se/alfresco/s/archive/stream/public/v1/source/available/sofia/su9803- 2137832294-78/surrogate/AMS%20800.pdf, besökt 24-08-26.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
alla olika journalhandlingar. Informationen är lätt att missa, även om man vid en noggrannare undersökning kan känna implantatet. Mer lättillgänglig information om att patienten har en pacemaker eller defibrillator anses kunna underlätta arbetet och göra det mer säkert.
Invasiva produkter är närliggande till vissa implantat (se avsnitt 5.3.7). Exempel på invasiva produkter som kan vara relevanta att ha kännedom om är sonder för näringsintag, t.ex. en perkutan endosko- pisk gastrostomi, ofta förkortat PEG. Att patienten sondmatas, och via vilken typ av sond, kan vara av betydelse i valet av t.ex. läkemedels- behandling. Sådan information kan vara nödvändig att känna till för fler personer än bara den behandlande läkaren t.ex. sjuksköterskor som deltar i omvårdnaden, kliniska farmaceuter som deltar i läke- medelsgenomgångar samt dietister. Informationen bör som alltid i första hand finnas i journalen, men när patienten rör sig över vård- givargränser finns det behov av att kunna ta del av denna information för att kunna fatta rätt beslut kring patientens vård.
Utifrån de frivilliga uppgifter som hittills registrerats i Eudamed (se avsnitt 8.7.2) finns 7 952 enskilda produkter på EU-marknaden klassade som implantat enligt EU-förordningen 2017/745 om medi- cintekniska produkter.142
Information om vissa implantat ingår sedan tidigare i journalens uppmärksamhetsinformation
Uppmärksamhetsinformation är information i en patientjournal som man bedömer behöver uppmärksammas särskilt och avser något som avviker från det man normalt kan förvänta sig och som påverkar hand- läggningen av patientens hälso- och sjukvård. Exempel på detta är en pågående behandling, överkänslighet mot ett visst läkemedel eller ett ställningstagande till hjärtlungräddning.143 Information om vissa medicintekniska implantat ingår också redan i dag i uppmärksam- hetsinformationen i patientjournalen. För detta finns sedan tidigare
142https://ec.europa.eu/tools/eudamed/#/screen/search- device?applicableLegislation=refdata.applicable-legislation.mdr&deviceTypes=refdata.device- type.II_b_implantable_exceptions&deviceTypes=refdata.device- type.implantable&deviceStatusCode=refdata.device-model-status.on-the- market&submitted=true, sökning genomförd 2025-03-02.
143Socialstyrelsens termbank, https://termbank.socialstyrelsen.se/?TermId=125, beslutad år 2021. Se även 5 kap. 5 § andra stycket Socialstyrelsens föreskrifter och allmänna råd (HSLF- FS 2016:40) om journalföring och behandling av personuppgifter i hälso- och sjukvården.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
nationella specifikationer och en förvaltningsmodell för vilka implan- tat som ska omfattas.144
Utredningen uppfattar, bl.a. utifrån den enkätundersökning som genomförts riktad till läkare, att det finns behov för dessa att känna till fler implantat än de som i dag omfattas av uppmärksamhetsinfor- mationen. Drygt 60 procent av respondenterna anser att det är ganska viktigt eller helt nödvändigt att känna till information om en patients implantat. Endast 20 procent anser att det inte är så viktigt eller inte alls viktigt.145
Uppmärksamhetsinformationen är, och behöver vara, begränsad eftersom den ger upphov till en särskild signal i patientjournalen. Uppmärksamhetssignalen uttrycks hos de flesta vårdgivare genom en symbol, ofta i form av det s.k. andreaskorset. Signalen kan därför inte användas som en generell metod för att förmedla information om en patients alla implantat. Exempel på implantat som är av bety- delse att känna till som i dag inte omfattas av uppmärksamhets- informationen är t.ex. de artificiella sfinktrar som nämndes ovan.
Det faktum att vissa implantat redan i dag ingår i uppmärksam- hetsinformationen baserat på nationella informationsspecifikationer innebär att det är något som det kan byggas vidare på. Genom en gemensam informationsmodell som utökas till fler produkter kan information om fler implantat än de som redan omfattas, utbytas genom andra tjänster än just uppmärksamhetsinformationen.
Apotekspersonalens behov
Apotekspersonalens behov av information om medicintekniska pro- dukter beskrivs närmare i avsnitt 6.5.2. I den enkätundersökning ut- redningen genomfört riktad till apotekspersonal framkom att apoteks- personal framför allt ser ett behov av att få tillgång till information om medicintekniska produkter som har betydelse i samband med läkemedelsbehandling.
Vissa förskrivna medicintekniska produkter omfattas redan i dag av registret nationell läkemedelslista. Utgångspunkten för detta är behovet av att samla även dessa förskrivningar så att alla öppenvårds- apotek får åtkomst till dem och kan expediera varorna, och för att
144https://www.socialstyrelsen.se/kunskapsstod-och-regler/omraden/e- halsa/tillampning/uppmarksamhetsinformation/, besökt 2024-08-26.
145Sammanställning av enkät till vårdpersonal – läkare (Komm2023/00649/ S 2023:09-20).
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
patienten ska få tillgång till produkterna inom läkemedelsförmånen. Registret omfattar därmed bl.a. förskrivningar av produkter för att tillföra kroppen läkemedel eller för att kontrollera en läkemedels- behandling.
Vissa regioner har som tidigare konstaterats valt ett annat sätt att tillhandahålla dessa produkter till patienten. Informationen om sådana varor är därmed i dag inte heltäckande i registret nationell läkemedelslista. Av enkätundersökningen framkom att apoteksperso- nalen upplever att det finns ett behov av att komplettera informatio- nen i registret med information om vissa sådana förbrukningsartiklar som vårdgivarna valt att inte förskriva via öppenvårdsapotek. Farma- ceuter ska vid expediering av ett förskrivet läkemedel så långt det är möjligt säkerställa att läkemedlet kan användas på rätt sätt.146 Avsak- nad av information i registret om vissa medicintekniska produkter av betydelse för läkemedelsbehandlingen uppges försvåra möjlig- heten att bedöma om patienten har den utrustning som behövs för att praktiskt kunna genomföra sin behandling. Svårast upplevs dessa bedömningar vara i samband med e-handel där patienten inte heller fysiskt finns tillgänglig för dialog. I vissa fall måste apoteken då söka kunden via telefon vilket kan försena expediering och leverans. Apo- tekspersonalen upplever också utmaningar med att hjälpa patienter hemmahörande i en region med egen distribution av nämnda pro- dukter när patienten är på resa och patienten saknar en på apotek tillgänglig och expedierbar förskrivning. Öppenvårdsapotekens till- gängliga sortimentet av förbrukningsvaror i regioner som har valt egna distributionslösningar påverkas också negativt eftersom lager- hållningen anpassas efter efterfrågan.147 Detta påverkar patienter på tillfälligt besök negativt vad gäller möjligheten att få varorna expedie- rade direkt vid förfrågan. Produkterna kan dock alltid beställas.
1462 kap. 9 a § lagen (2009:366) om handel med läkemedel.
147Se även 2 kap. 3 a § lagen (2009:366) om handel med läkemedel. Där anges att öppenvårds- apotekens lager ska anpassas utifrån konsumenternas behov på den marknad som öppen- vårdsapoteken verkar på i syfte att så många konsumenter som möjligt ska kunna expedieras direkt.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
Produkter med avsedd långvarig användning
Regeringen pekar i direktivet till utredningen särskilt på behovet av att utreda tillgången till information om inopererade implantat. Upp- gift om dessa produkter kan med dagens reglering inte tas in i den nationella läkemedelslistan. Produkterna kan påverka kroppen under lång tid och kan om de inte är kända för berörd vårdpersonal föror- saka skada eller risk för skada. Utifrån ett patientsäkerhetsperspektiv är behovet av samlade uppgifter i dessa fall likartat med det behov som finns i fråga om läkemedel, men det finns även behov av sådana uppgifter för uppföljning och statistik.148
Implantat är medicintekniska produkter. Med implantat avses en produkt, även sådan som helt eller delvis absorberas, som är avsedd att helt föras in i människokroppen, eller att ersätta en epitelial yta eller ögats yta genom klinisk intervention och är avsedd att stanna i kroppen efter ingreppet. Även en produkt som är avsedd att delvis föras in i människokroppen genom klinisk intervention och att stanna kvar där i minst 30 dagar efter ingreppet ska anses vara ett implantat.149 Även invasiva produkter kan användas under en längre tid, t.ex. en perkutan endoskopisk gastrostomi, ofta kallad PEG, för sondmat- ning, kanylen som ansluter en insulinpump till kroppen eller en urinvägskateter. Med invasiv produkt avses att artikeln helt eller delvis tränger in i kroppen, antingen genom en kroppsöppning eller genom kroppens yta.
Med anledning av ovanstående bedömer utredningen att det kan vara lämpligt att utgå ifrån medicintekniska produkter med avsedd långvarig användning. Det är olämpligt att avgränsa informationen till enbart implantat. Begreppet medicintekniska produkter med av- sedd långvarig användning kan omfatta både implantat och invasiva produkter. Detta utvecklas närmare i anslutning till förslagen (se avsnitt 12.1).
148Dir. 2023:133, Fortsatt utveckling av registret nationell läkemedelslista, s. 5.
149Artikel 2.5 Europaparlamentets och rådets förordning (EU) 2017/745 av den 5 april 2017 om medicintekniska produkter, om ändring av direktiv 2001/83/EG, förordning (EG) nr 178/2002 och förordning (EG) nr 1223/2009 och om upphävande av rådets direktiv 90/385/EEG och 93/42/EEG.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
8.6.2Europeiska krav på information om medicintekniska produkter
I EU-förordningen om det europeiska hälsodataområdet finns ett krav för primäranvändning av hälsodata att information om bl.a. medicintekniska produkter och implantat ska kunna delas, både nationellt och mellan medlemsstater. Det följer av att uppgifter om medicintekniska produkter och implantat ingår som en av de egen- skaper som ska ingå i en patientöversikt.150 Som framgår av avsnitt 8.5 är det ännu inte helt tydligt vilka medicintekniska produkter, bort- sett från implantat, som avses omfattas av kravet och hur de ska av- gränsas. Av det europeiska e-hälsonätverkets riktlinjer för patient- översikter framgår att egenskapen omfattar en patients implanterade och externa medicintekniska produkter och utrustning som patien- tens hälsotillstånd är beroende av. Det inkluderar produkter som pacemaker, implanterade fibrillatorer, proteser, ferromagnetiska ben- implantat etc. vilka hälso- och sjukvårdspersonalen måste ha känne- dom om.151
I förordningen (EU) 2017/745 om medicintekniska produkter finns krav på särskild information till patienter om vissa implantat. Av artikel 18 framgår att hälso- och sjukvårdsinstitutionerna ska ge informationen på ett sätt som gör den snabbt tillgänglig för de pati- enter i vilka produkten har implanterats. Patienten ska också erhålla ett implantatkort.152 Informationen ska omfatta uppgifter som gör det möjligt att identifiera produkten, alla varningar, försiktighets- åtgärder eller andra åtgärder som patienten eller hälso- och sjukvårds- personal ska vidta med avseende på ömsesidig påverkan som rimligen kan förutses i samband med yttre faktorer, läkarundersökningar eller miljöförhållanden som rimligen kan förutses, all information om produktens förväntade livslängd och om all nödvändig uppfölj- ning samt all annan information för att säkerställa att patienten ska kunna använda produkten på ett säkert sätt, inklusive bruksanvisning.
150Artikel 14 samt bilaga I förordningen (EU) 2025/327 om det europeiska hälsodata- området.
151eHealth Network Guideline on the electronic exchange of health data under Cross- Border Directive 2011/24/EU, Patient Summary, Release 3.3, June 2023, s. 23.
152Artikel 18 Europaparlamentets och rådets förordning (EU) 2017/745 av den 5 april 2017 om medicintekniska produkter, om ändring av direktiv 2001/83/EG, förordning (EG) nr 178/2002 och förordning (EG) nr 1223/2009 och om upphävande av rådets direktiv 90/385/EEG och 93/42/EEG.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
De ovan nämnda kraven på att tillgängliggöra information bör enligt utredningen kunna tillgodoses genom en gemensam lösning där information om att patienten har ett visst implantat kan länkas till aktuell information om själva implantatet, inklusive bruksanvisning. På så sätt kan patienten få tillgång till all nödvändig information via en och samma ingång eller tjänst. Det går sannolikt med stöd av detta att utveckla en digital version av implantatkortet.
Utredningen gör bedömningen att den avgränsning till medicin- tekniska produkter med avsedd långvarig användning som utred- ningen föreslår ska omfattas av en nationell sammanställning kan svara mot vad som framgår av e-hälsonätverkets beskrivningar av vilka medicintekniska produkter som ska omfattas av en patient- översikt.
8.7Förutsättningar för att dela information om medicintekniska produkter
Utredningens bedömning: Infrastrukturen och informatiken för att tillgängliggöra uppgifter om medicintekniska produkter i nationella sammanställningar är inte lika väl utvecklad som inom läkemedelsområdet. En nationell sammanställning som omfattar medicintekniska produkter behöver därför avgränsas. På detta sätt kan utvecklingen drivas framåt stegvis och skapa grund för framtida utökningar av information om medicintekniska produk- ter. Ett första steg är att skapa en nationell produktdatabas över medicintekniska produkter.
I de nedanstående avsnitten redogör utredningen närmare kring de förutsättningar som finns för att dela information om medicintek- niska produkter.
8.7.1Medicintekniska produkter ordineras inte alltid strukturerat
Ordination och förskrivning av medicintekniska produkter har be- skrivits i avsnitt 5.3.3 och 5.3.4. Där konstateras att medicintekniska produkter inte alltid ordineras och dokumenteras på ett strukture-
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
rat sätt i patientjournalen. Det finns ingen svensk reglering som tydligt avgränsar när så måste ske. Däremot så dokumenteras ofta utlånade medicintekniska produkter, såsom hemventilatorer, rull- stolar och syrgaskoncentratorer noggrant i andra system, t.ex. Sesam eller Medusa, där det finns full spårbarhet på serienummersnivå till patient. Enligt EU-förordningen om det europeiska hälsodataområdet är det obligatoriskt att registrera vissa uppgifter på ett sätt så att det är förenligt med den europeiska programvarukomponenten för interoperabilitet för elektroniska hälsodokumentationssystem och att informationen kan utbytas enligt det europeiska formatet för ut- byte av elektronisk hälsodokumentation. För de första prioriterade kategorierna av hälsodata för primäranvändning blir kravet tillämpligt från och med den 26 mars 2029.153 Det gäller då framför allt de medi- cintekniska produkter och implantat som tidigare beskrivits ska om- fattas av patientöversikter.
Det kan i vissa fall anses saknas relevans att, i patientjournalen, detaljerat dokumentera all användning av enklare medicintekniska produkter, t.ex. exakt vilken kanyl, spruta eller kompress som använts vid ett ingrepp. Ibland dokumenteras ordinationer av medicintekniska produkter som en del i en samlad dokumentation, exempelvis en läkemedelsordination. En läkemedelsordination där administrations- sättet är infusion kan t.ex. anses innehålla en ordination avseende de medicintekniska produkter som krävs för administreringssättet. Ibland kan det dock finnas särskilda skäl, när så är av betydelse för att användningen ska ske på ett visst sätt, att tydliggöra att en viss medicinteknisk produkt ska användas, t.ex. en viss pump.
Produkter som förskrivs på hjälpmedelskort för expediering på öppenvårdsapotek dokumenteras ofta strukturerat i journalsystemets läkemedelsmodul. Det görs då ofta för att förskrivningen, på samma sätt som förskrivningen av ett läkemedel, ska föras över till registret nationell läkemedelslista för expediering på apotek. Förskrivningar som görs för distribution av produkterna i regionens egen regi doku- menteras dock ofta i något annat externt system, t.ex. Sesam LMN. Det saknas alltså en enhetlig nationell infrastruktur för förskrivning av medicintekniska produkter. Detta medför att man inte heller tagit sig an de informatiska frågorna på ett enhetligt sätt. Man kan dock överväga om informatiken för förskrivning av sådana förbruknings-
153Se bl.a. artikel 25 samt 36 i förordningen (EU) 2025/327 om det europeiska hälsodata- området.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
varor som historiskt hanterades i sin helhet på hjälpmedelskort borde vara gemensam oavsett vilken distributionslösning som används. I nu- läget får man uppfattningen att distributionslösningen står i centrum och har fått styra de informatiska modellerna och hur vården tvingas arbeta med frågan. Egentligen är det ointressant i mötet mellan patient och vårdpersonalen hur en vara ska distribueras. Stödet för ordination och förskrivning bör enligt utredningen vara centrerat kring och stödja patientmötet. Sedan finns det naturligtvis ett behov för patien- ten att i slutänden veta om denne ska hämta varan vid ett öppen- vårdsapotek eller via någon annan leverantör/logistiklösning som vårdgivaren anvisar.
Mer avancerade produkter ökar sannolikt behovet av dokumentation
I takt med att de patientbundna medicintekniska produkterna blir alltmer medicinskt och teknologiskt avancerade ökar sannolikt be- hovet av att föra mer noggrann dokumentation över användningen av åtminstone sådana produkter, inte minst av produktsäkerhets- och spårbarhetsskäl. I dag sker en del dokumentation i löpande fritext. Information om behandling med vissa medicintekniska implantat förs också in i kvalitetsregister t.ex. information om ortopediska implantat och hjärtimplantat. Kvalitetsregister är dock inte ämnade att utgöra grund för patientens vård och därmed inte heller för att dela information i detta syfte mellan vårdgivare.154
När användningen av olika medicintekniska produkter dokumen- teras i patientjournalen av hälso- och sjukvårdspersonal görs detta som huvudregel inte med samma strukturerade informationshanter- ing som vid läkemedelsbehandling, bortsett från de medicintekniska produkter som förskrivs inom läkemedelsförmånen där det finns visst stöd för dokumentation i läkemedelsmodulerna.
Om information om en patients behandling med eller användning av medicintekniska produkter ska kunna samlas i en nationell sam- manställning är det en grundläggande förutsättning att produkterna dokumenteras i patientjournalen. Sådan dokumentation behöver dessutom vara strukturerad och utgå ifrån en gemensam informations- modell.
154Se 7 kap. 4 § patientdatalagen (2008:355).
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
Särskilt om ordinationsorsak eller användningsområde
Medicintekniska produkter utgör som utredningen tidigare konstaterat ett komplext område med många produktkategorier. Det är inte givet att det i samband med användningen av alla sådana produkter är lämp- ligt att använda begreppet ordination. Ett sådant exempel är vid an- vändningen av medicintekniska implantat. Det uttrycks ofta inte som ordination när ett implantat tillförs en patient. En ordination definieras enligt Socialstyrelsen som ett beslut av behörig hälso- och sjukvårdspersonal som är avsett att påverka en patients hälsotillstånd genom en hälso- och sjukvårdsåtgärd.155 Åtgärden att sätta in ett im- plantat på en patient kan mycket väl uppfattas som ett sådant medi- cinskt beslut. I svensk ordbok beskrivs dock begreppet ordination som instruktion om (viss) behandling eller medicinering vanligen utfärdad av läkare.156 Insättningen av ett implantat är ofta förenat med någon annan typ av ingrepp/åtgärd/behandling som utförs av någon som är ansvarig för behandlingsbeslutet. Därav behövs inte på samma sätt den instruktion eller anvisning som ordinationen kan uppfattas som. Även i situationer när olika är personer involve- rade i åtgärden så är det fortfarande den som tillför implantatet som är ytterst ansvarig för beslutet att det ska tillföras, även om det initiala behandlingsbeslutet ligger hos en annan person. På det sättet liknar det många andra kirurgiska åtgärder som inte heller ordineras. Be- greppet ordination eller ordinationsorsak används inte i samband med en kirurgisk åtgärd som t.ex. en blindtarmsoperation. Även om diagnos och behandlingsbeslut ligger hos den läkare som gjort bedömningen och planerat patienten för operation är det helt och fullt den opererande kirurgens ansvar och beslut att genomföra ope- rationen. Den görs inte på ordination av någon annan även om tidi- gare bedömning ligger till grund för behandlingsbeslutet. På samma sätt kan man många gånger tänka kring implantat.
Isamband med läkemedelsbehandling används begreppet ordina- tionsorsak. Begreppet ordinationsorsak är definierat i Socialstyrelsens termbank som den indikation en ordinatör anger som skäl till en viss ordination.157 Med indikation avses en omständighet som utgör skäl för att vidta en viss åtgärd.158 Begreppet ordinationsorsak brukar
155https://termbank.socialstyrelsen.se/article.php?tid=710, beslutad år 2017.
156https://svenska.se/so/?id=158602, besökt 2025-01-02.
157https://termbank.socialstyrelsen.se/article.php?tid=516, beslutad år 2019.
158https://termbank.socialstyrelsen.se/article.php?tid=731, beslutad år 2013.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
delas upp i behandlingsorsak och ändringsorsak (se även avsnitt 10.3.5). Även om begreppen ordinationsorsak och indikation har en tydlig koppling till just läkemedelsbehandling i kommentaren till definitionen hos Socialstyrelsen är de definierade på ett sätt som gör att de som begrepp kan användas produktneutralt. Begreppet ordinationsorsak skulle därför kunna vara relevant även för vissa medicintekniska produkter. För läkemedel finns en nationell källa till ordinationsorsaker där relevanta ordinationsorsaker är kopplade till respektive produkt utifrån deras tänkta användning. En motsva- rande nationell källa till ordinationsorsak saknas dock för medicin- tekniska produkter.
Diagnos enligt ICD159 utgör grund till åtgärdsbeslutet att sätta in ett implantat, och KVÅ-kod160 utgör beskrivning av åtgärden som inkluderar implantat. För implantatet knäledsprotes kan diagnosen vara M17 Knäledspatros och KVÅ-koden NGB49 Primär totalprotes i knäled med cement. För implantatet Pacemaker kan diagnosen vara I44.1 AV-block II och KVÅ-koden FPE20 Inläggande av transvenös pacemaker. Både diagnoser och KVÅ-koder har befintliga kodverk. Det finns dock en del implantat där processen mer liknar läke- medelsprocessen och där det skulle vara relevant att prata om ordi-
nation. Exempelvis insättande urinkateter eller nasogastrisk sond. De byts regelbundet men sitter så länge, ofta 3 månader resp. 6 veckor, att de klassas som implantat. Dessa sätts ofta av sjuksköterska på ordination av läkare. Här skulle man kunna prata om ordinations- orsak men även här används framför allt diagnos och åtgärdskod. Det finns som tidigare konstaterats inte i vårdinformationssystemet ett särskilt system för ordinationsgivningen som liknar läkemedels- processen, utan ordinationen dokumenteras antingen på särskilt sökord eller i löpande text.
I samband med läkemedelsordinationer är det av betydelse för t.ex. apotekspersonal att känna till orsaken till behandlingen för att kunna göra en korrekt bedömning av doseringen. Detta är en direkt patientsäkerhetsrelaterad fråga då olika användningsområden kan ha olika doseringar. Vid behandling med eller användningen av medicin-
159Internationell statistisk klassifikation av sjukdomar och relaterade hälsoproblem – systematisk förteckning, se https://www.socialstyrelsen.se/statistik-och- data/klassifikationer-och-koder/icd-10/, besökt 2025-01-02.
160Klassifikation av vårdåtgärder (KVÅ) är en åtgärdsklassifikation som är gemensam för olika verksamhetsområden och yrkeskategorier inom hälso- och sjukvården.
Se https://www.socialstyrelsen.se/statistik-och-data/klassifikationer-och-koder/kva/, besökt 2025-01-02.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
tekniska produkter behövs inte alltid uppgiften på samma sätt. Vissa produkter har endast ett användningsområde.
Mot bakgrund av ovanstående bedömer utredningen att det vad avser medicintekniska produkter inte går att begränsa beskrivningen av en produkts användning till ordinationsorsak. I stället bör det vara möjligt att ange ordinationsorsak eller annan lämplig term för användning av produkten. Det bör inte heller vara obligatoriskt att ange uppgiften.
8.7.2Det saknas en samlad produktdatabas för medicintekniska produkter
En förutsättning för att kunna bygga olika tjänster för t.ex. doku- mentation och utbyte av information kring ordination, förskrivning, behandling med eller användning av olika produkter i hälso- och sjukvården är att det finns en nationell produkt- eller artikeldatabas och ett enhetligt kategoriseringssystem för dessa produkter. Avsak- naden av ett nationellt produktregister påverkar även möjligheterna till uppföljning och bör även ha påverkan på t.ex. registreringen av medicintekniska produkter i kvalitetsregister.
På läkemedelsområdet finns en nationell produktdatabas sedan en lång tid tillbaka, dels beroende på de regulatoriska kraven kopp- lade till godkännandeprocessen för läkemedel, dels på grund av den gemensamma infrastruktur kring receptexpediering som utvecklades vid det statliga apoteksmonopolet. Dessa register har sedan legat till grund för utvecklingen av mer vårdnära databaser.
Utmaningarna med avsaknaden av ett produktregister har tidi- gare uppmärksammats av bl.a. Utredningen om hälso- och sjuk- vårdens beredskap.161 Läkemedelsverket och E-hälsomyndigheten har inom ramen för ett gemensamt uppdrag också konstaterat att det saknas en samlad bild över vilka medicintekniska produkter som tillhandahålls i Sverige. Myndigheterna konstaterar att till skillnad från läkemedel föregås inte ett marknadstillträde av en medicin- teknisk produkt av något myndighetsgodkännande. Det är tillverka- ren själv som ansvarar för att den medicintekniska produkten upp- fyller gällande lagstiftning för att få släppas ut på marknaden. Detta
161SOU 2021:19 En stärkt försörjningsberedskap för hälso- och sjukvården, s. 625 ff.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
medför att det i dag inte finns någon nationell sammanställning av vilka medicintekniska produkter som tillhandahålls i Sverige.162
Förutsättningarna för en nationell produktdatabas eller en natio- nell enhetlig hantering ökar dock genom inrättandet av Eudamed, i korthet en europeisk databas över medicintekniska produkter som bygger på de ekonomiska aktörernas skyldighet att registrera infor- mation, se vidare nedan.163 Läkemedelsverket har genom ett nytt uppdrag fått uppgiften att tillsammans med E-hälsomyndigheten och i samarbete med Socialstyrelsen och Inspektionen för vård och omsorg analysera och föreslå hur en enhetlig kategorisering och identifiering av medicintekniska produkter ska införas i Sverige och att utreda hur och om data från Eudamed skulle kunna tillgänglig- göras som en grunddatabas och som skulle kunna stödja ett införande av gemensam kategorisering och identifiering.164 Utredningen kan konstatera att E-hälsomyndigheten nyligen har fått i uppdrag att ta fram förslag på hur en nationell databas för medicintekniska pro- dukter kan utformas och fungera.165
De källor som finns är inte färdiga eller räcker inte till
Trots att det inte finns någon nationell samlad produktdatabas om medicintekniska produkter finns det bitvis information i olika källor. Läkemedelsverket och E-hälsomyndigheten identifierade inom ramen för sitt gemensamma uppdrag en rad olika system hos ekonomiska aktörer, vårdgivare samt myndigheter vilka hanterar medicintekniska produkter.166 Fler källor är under utveckling och implementering.
162Läkemedelsverket och E-hälsomyndigheten, 2023, Förstudie inför framtagandet av en nationell lägesbild över tillgången till läkemedel och medicintekniska produkter – Slutredo- visning gällande medicintekniska produkter, dnr 1.1.8-2022-016969, s. 26.
163Se artikel 27 i medicinteknikförordningen.
164Uppdrag att möjliggöra framtagande av en nationell lägesbild över medicintekniska pro- dukter samt produktionskartläggning av medicintekniska produkter i Sverige, S2024/00545 (delvis).
165Uppdrag att ta fram förslag på en nationell databas för medicintekniska produkter (S2025/00532 [delvis]).
166A.a.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
Eudamed
På EU-nivå pågår utveckling av en gemensam databas för medicin- tekniska produkter benämnd Eudamed efter engelskans European Database on Medical Devices. Eudamed är en integrerad del av genom- förandet av de två förordningarna om medicintekniska produkter, MDR167 och IVDR168, och utvecklas av EU-kommissionen i samråd med medlemsstaterna. Databasen förväntas ge ökad transparens och information om bland annat medicintekniska produkter, eko- nomiska aktörer169 och anmälda organ170. Eudamed består av sex olika moduler och en offentlig webbplats, som kommer att bli obli- gatoriska att använda för berörda ekonomiska aktörer inom EU.171 Utvecklingen av Eudamed har dragit ut på tiden vilket gjort att regi- streringen hittills varit frivillig. Kommissionen har genom en änd- ringsförordning som trädde i kraft den 9 juli 2024 ändrat kraven så att varje modul, ensam eller i kombination med andra moduler, ska kunna testas och konstateras vara tillräckligt fungerande för att den ska göras tillgänglig och obligatorisk att använda, utan att man be- höver invänta alla övriga moduler. De första modulerna som väntas bli obligatoriska att använda är modulerna för aktörsregistrering och produktregistrering. Enligt nuvarande planer hoppas man kunna konstatera att de är tillräckligt fungerande under juli 2025. Detta skulle innebära att det blir obligatorisk att använda dessa från första kvartalet 2026.172
167Europaparlamentets och rådets förordning (EU) 2017/745 av den 5 april 2017 om medicin- tekniska produkter, om ändring av direktiv 2001/83/EG, förordning (EG) nr 178/2002 och förordning (EG) nr 1223/2009 och om upphävande av rådets direktiv 90/385/EEG och 93/42/EEG.
168Europaparlamentets och rådets förordning (EU) 2017/746 av den 5 april 2017 om medicin- tekniska produkter för in vitro-diagnostik och om upphävande av direktiv 98/79/EG och kommissionens beslut 2010/227/EU.
169Med ekonomisk aktör avses tillverkare i och utanför EU, auktoriserade representanter, tillverkare av system/procedurförpackningar och importörer.
170Ett anmält organ är en organisation som utsetts av ett EU-land (eller av andra länder enligt särskilda överenskommelser) att bedöma överensstämmelsen hos vissa produkter innan de släpps ut på marknaden. Dessa organ har rätt att utföra uppgifter kopplade till de förfaranden för bedömning av överensstämmelse som fastställs i tillämplig lagstiftning när ingripande krävs av tredje part.
171Europeiska kommissionen, Medical Devices – EUDAMED, https://health.ec.europa.eu/medical-devices-eudamed_en, besökt 2024-04-02.
172Europaparlamentets och rådets förordning (EU) 2024/1860 om ändring av förordning- arna (EU) 2017/745 och (EU) 2017/746 vad gäller ett gradvist införande av Eudamed, skyl- digheten att informera vid leveransavbrott eller upphörande av leverans och övergångs- bestämmelser för vissa medicintekniska produkter för in vitro-diagnostik.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
Väl implementerad kommer Eudamed att ge tillgång till informa- tion om alla produkter på EU-marknaden samt om var de olika eko- nomiska aktörerna, utom distributörerna, har sin juridiska hemvist. För produkter som är CE-märkta i de högre riskklasserna ska de ekonomiska aktörerna ange i vilka länder produkterna tillhandahålls.173 Detta är dock inte ett krav för produkter i den lägsta riskklassen (klass I). Därmed går det inte heller att få information från Eudamed om exakt vilka produkter som tillhandahålls i Sverige och Eudamed kan inte utgöra en komplett artikel- och produktdatabas för alla medicintekniska produkter på den svenska marknaden. Eudamed skulle dock fungera för produkter som implantat och invasiva pro- dukter som har en högre riskklass.
Nationella register
Medicintekniska produkter i form av förbrukningsartiklar, som är förmånsberättigade och förskrivs på hjälpmedelskort registreras i Tandvårds- och läkemedelsförmånsverkets, i det följande TLV, pris- och beslutsdatabas.174 Informationen hos TLV överförs till det natio- nella produkt- och artikelregistret VARA vid E-hälsomyndigheten.175 VARA bygger inte på uppgifter från Eudamed utan är ett register som funnits under lång tid och som nu förvaltas av E-hälsomyndig- heten. VARA ligger till grund för öppenvårdsapotekens expediering av förskrivningar.
Information från VARA överförs i sin tur till Svenska informa- tionstjänster för läkemedel, förkortat Sil. Sil tillhandahåller läke- medelsinformation från en rad olika källor, där VARA är en.176 Sil förvaltas av Inera AB och återspeglar det sortiment av läkemedel och andra varor som kan förskrivas inom vården i Sverige.177 Tjäns- ten är integrerad i alla stora journalsystem i Sverige.
173Avsnitt 2.3, del A bilaga VI i Europaparlamentets och rådets förordning (EU) 2017/745 av den 5 april 2017om medicintekniska produkter, om ändring av direktiv 2001/83/EG, förordning (EG) nr 178/2002 och förordning (EG) nr 1223/2009 och om upphävande av rådets direktiv 90/385/EEG och 93/42/EEG (MDR).
174https://www.tlv.se/medicinteknikforetag/pris-och-subvention-av-forbrukningsartiklar.html, besökt 2024-04-03.
175VARA innehåller också information om läkemedel men här berörs VARA enbart utifrån registrets innehåll av medicintekniska produkter.
176
https://inera.atlassian.net/wiki/spaces/OISIFLS/pages/345276641/Mer+om+tj+nsten#Register, besökt 2024-04-02.
177https://silonline.silinfo.se/#/about, besökt 2024-04-02.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
Både Sil och VARA klassas som nationella medicinska informa- tionssystem, förkortat NMI, enligt Läkemedelsverkets föreskrifter (HSLF-FS 2022:42) om nationella medicinska informationssystem (NMI).
Både VARA och Sil är i första hand källor för läkemedel och den information som finns om medicintekniska produkter moti- veras av, och begränsas till, att det är förskrivningsbara medicintek- niska produkter som inkluderas i läkemedelsförmånen, då benämnda förbrukningsartiklar. Syftet med detta är att dessa produkter ska kunna förskrivas elektroniskt på hjälpmedelskort. Vilka produkter som omfattas regleras i 18 § 2 och 3 lagen (2002:160) om läkemedels- förmåner m.m. Sil och VARA stödjer därmed bara denna typ av förskrivningar som är tänkta att expedieras via öppenvårdsapotek. Det har framförts till utredningen att i den mån produkter som inte omfattas av förmånen förskrivs för expediering på apotek saknas stöd för detta. Som framgår av avsnitt 5.3.4 hanteras också många medicintekniska produkter av förbrukningskaraktär i dag av regio- nerna själva genom andra system.
Regionala databaser m.m.
Inte heller inom hälso- och sjukvården finns uppgifter om medicin- tekniska produkter samlade. Enligt Läkemedelsverkets och E-hälso- myndighetens ovan nämnda rapport förefaller det inte som om någon region har en samlad bild över alla sina medicintekniska produkter. Beroende på vilken typ av medicintekniska produkter som avses an- vänder vårdgivare olika system för att hantera dem. Generellt han- teras exempelvis hjälpmedel i ett särskilt system, medicinteknisk utrustning och reservdelar till dessa i ett annat system samt förbruk- ningsartiklar i ytterligare en systemlösning. De medicintekniska pro- dukterna inom hälso- och sjukvården är spridda över flera vårdverk- samheter, i olika lager, i drift eller i servande verksamhet, såsom medicintekniska avdelningar eller sterilcentraler.178 De medicin- tekniska produkterna kategoriseras och identifieras på olika sätt i
178Läkemedelsverket och E-hälsomyndigheten, 2023, Förstudie inför framtagandet av en
nationell lägesbild över tillgången till läkemedel och medicintekniska produkter – Slutredovis- ning gällande medicintekniska produkter (dnr 1.1.8-2022-016969), s. 27.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
de olika systemen. Samma produkt kan i olika system och hos olika aktörer kategoriseras och identifieras på olika sätt.179
De olika systemen i vilka de medicintekniska produkterna han- teras fyller olika syften och behov. Systemen har upprättats för spe- cifika grupper av medicintekniska produkter avsedda för specifika användningsområden. I de olika systemen identifieras och kategori- seras de medicintekniska produkterna på olika sätt. En närmare be- skrivning av t.ex. hjälpmedelstjänsten och registret MTPReg finns
iLäkemedelsverkets och E-hälsomyndighetens rapport.180 Öppenvårdsapotek använder, som konstateras ovan, till stor del
VARA som källa för expediering av det förskrivningsbara sortimentet. Även öppenvårdsapotek hanterar dock andra medicintekniska pro- dukter, inte minst sådana som är lämpade för egenvård som plåster, lindor, blodtrycksmätare etc. Register över dessa produkter byggs upp inom ramen för varje apoteksaktörs verksamhet.
Tillverkare och distributörer som vill sälja sina produkter till
svenska kunder kan behöva ange uppgifter om sina produkter i flera olika system och i olika format utifrån den kategorisering, produkt- identifiering och eventuella andra uppgifter som har valts i respektive system.
8.7.3Det saknas en gemensam informatik för medicintekniska produkter
För att det ska vara möjligt att bygga tjänster som stödjer patien- tens, hälso- och sjukvårdens och öppenvårdsapotekens behov av information om medicintekniska produkter räcker det inte med att informationen dokumenteras någonstans i patientjournalen (se av- snitt 8.7.1) eller att det finns en produktdatabas (se avsnitt 8.7.2). Det krävs också, precis som för läkemedel, en ensad informatik som möjliggör utbyte av relevant information på ett strukturerat sätt.
Det starka nationella grepp som historiskt har funnits kring läke- medel, och då särskilt förskrivningar, har möjliggjort närmandet till en nationell infrastruktur både genom t.ex. det tidigare nationella e-receptformatet, ofta förkortat NEF, och dagens register över för- skrivningar. Mycket av arbetet tog sannolikt sin utgångspunkt i arbe- ten vid det statliga apoteksmonopolet när e-recepten först introdu-
179A.a., s. 28.
180A.a., s. 29.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
cerades (se avsnitt 5.2.3). Det är också detta som legat till grund för elektronisk förskrivning på hjälpmedelskort som expedieras på öppenvårdsapotek.
Som konstaterats ovan saknas i många avseenden en gemensam informatik för dokumentation av behandling med och användning av medicintekniska produkter. Vad som dokumenteras och hur det görs kan skilja sig åt mellan olika vårdgivare, dels beroende på skill- nader i rutiner, dels beroende på vad vårdinformationssystemet i dag möjliggör. Områdets bredd och heterogenitet medför sannolikt att det inte är möjligt att hitta en enkel gemensam informationsmodell för alla medicintekniska produkter utan flera modeller, eller anpass- ningar av en gemensam grundmodell, behövs för olika produktkate- gorier, områden eller behov. En fördel med detta är att informatiken går att utveckla stegvis utifrån prioriterade behov för att sedan imple- menteras.
Sedan tidigare finns nationella informationsspecifikationer för uppmärksamhetsinformation. Här ingår bl.a. informationsmängderna förekomst av implantat (hälsotillstånd)181 och implantat (resurs)182. Det finns också sedan tidigare informationsmodeller framtagna för sådana medicintekniska produkter som förskrivs på hjälpmedelskort och som i dag registreras i den nationella läkemedelslistan. Dessa arbe- ten kan sannolikt utgöra viktiga ingångsvärden i ett fortsatt arbete.
Uppmärksamhetsinformation är en del av Nationella gemensamma e-hälsospecifikationer
Uppmärksamhetsinformation är i dag en del av Nationella gemen- samma e-hälsospecifikationer, förkortat NGS.183 NGS-tjänsten är en kvalitetssäkrad katalog med uppgifter om e-hälsospecifikationer där de som arbetar med informationsutbyte inom hälso- och sjuk- vård och socialtjänst kan hitta och dela uppgifter om specifikationer. NGS-tjänsten är ett resultat av E-hälsomyndighetens arbete med regeringsuppdraget Att tillgängliggöra och förvalta gemensamma natio-
181https://informationsstruktur.socialstyrelsen.se/nim/hos/NIM-F%C3%B6rekomst-av- implantat_20211221, besökt 2024-08-27.
182https://informationsstruktur.socialstyrelsen.se/nim/hos/NIM-Implantat_20211221, besökt 2024-08-27.
183https://ngs.ehalsomyndigheten.se/specifikation/Uppmarksamhetsinformation5.1/umi
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
nella specifikationer.184 E-hälsospecifikationer av nationellt intresse kan genom en kvalitetssäkringsprocess få status som nationell gemen- sam e-hälsospecifikation.
Det är E-hälsomyndigheten som tillhandahåller NGS-tjänsten, men det är utgivarna av e-hälsospecifikationer som bidrar med inne- hållet i katalogen. Utgivarna ansvarar för sina respektive specifika- tioner och de avgör också var, och i vilket eller vilka format specifika- tionerna tillhandahålls. Ibland finns även kompletterande material som tillämpningsanvisningar, vägledningar och testdata som kan vara viktiga när specifikationen ska användas. I takt med att allt fler e-hälsospecifikationer blir sökbara i NGS-tjänsten ökar möjligheterna för dem som använder och utvecklar specifikationer att se vilka orga- nisationer som är aktiva inom samma område. Det kan leda till nya och utökade samarbeten och möjliga harmoniseringar på området.
Uppmärksamhetsinformation innehåller vissa uppgifter om implantat
Att information om vissa implantat ingår i uppmärksamhetsinforma- tion i patientjournalen beskrevs i avsnitt 8.6.1. Implantat visas som en del av uppmärksamhetsinformationen under medicinska tillstånd och behandlingar genom den vanligt använda Andreaskorset med ett utropstecken (se figur 8.1).185
Sedan år 2011 finns också en nationell tjänst för uppmärksamhets- information i e-tjänsten nationell patientöversikt som Inera AB till- handahåller. Den första informationsspecifikationen publicerades år 2016. Socialstyrelsen förvaltar och vidareutvecklar informations- specifikationen i samverkan med Sveriges Kommuner och Regioner (SKR) och Inera AB. Socialstyrelsen stödjer också regionerna med implementeringen av informationsspecifikationen.186
184E-hälsomyndigheten (2021): Uppdrag att tillgängliggöra och förvalta nationella gemen- samma specifikationer – Slutrapport, regeringsuppdrag S2019/01521/FS (dnr 2019/01538).
185Socialstyrelsen, 2022, Informationsspecifikation för uppmärksamhetsinformation, version 5.1, art. nr 2022-6-8059, s. 18.
186Socialstyrelsen, 2022, Informationsspecifikation för uppmärksamhetsinformation, version 5.1. Artikelnummer 2022-6-8059.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
Figur 8.1 Uppmärksamhetsinformation
Symbolen med Andreaskorset används för att illustrera de olika delarna i uppmärksamhetsinfomationen
Livshotande överkänslighet (överst)
Skadlig överkänslighet (mitten)
Ej strukturanpassad |
|
|
Medicinsk tillstånd |
uppmärksamhets- |
|
|
och behandling |
information |
|
|
|
|
|
|
|
|
|
Smitta |
Vårdrutinavvikelse |
Besvärande
överkänslighet (underst)
Bearbetad efter Socialstyrelsen, 2022, Informationsspecifikation för uppmärksamhetsinformation, version 5.1 (art. nr 2022-6-8059).
Förvaltning av kodverket för implantat
Kodverkslistan för implantat i uppmärksamhetsinformation förvaltas av en nationell referensgrupp som leds av Socialstyrelsen. Referens- gruppen ser årligen över kodverkslistan och tar ställning till vad som ska tillföras eller tas bort. Alla regioner är inbjudna till referensgrup- pen som består av cirka 30–40 personer och inkluderar både läkare och informatiker. Myndigheten får olika förslag på vad som bör finns med, men det är referensgruppen som gemensamt avgör vad som ska omfattas. Urvalet görs utifrån ett antal kriterier.
–Grad av avvikelse: ju större avvikelse som behöver göras från den ordinarie handläggningen, desto större anledning att se in- formationen som uppmärksamhetsinformation.
–Brådskan: ju mer bråttom det är att genomföra de åtgärder som kan vara skadliga för patienten, alltså ju snabbare informationen behövs, desto större anledning att se informationen som uppmärk- samhetsinformation.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
–Skadepotential – allvarlighetsgrad: ju allvarligare skada patienten riskerar att drabbas av, desto större anledning att se informationen som uppmärksamhetsinformation.
–Skadepotential – duration: ju mer långvarig skada patienten riske- rar att drabbas av, desto större anledning att se informationen som uppmärksamhetsinformation.
–Synlighet: ju mer svårupptäckt och osynligt patientens hälsotill- stånd är, desto större anledning att se informationen som upp- märksamhetsinformation.
–Vanlighet: ju ovanligare ett hälsotillstånd är, desto större anled- ning att se informationen som uppmärksamhetsinformation.
Uppmärksamhetsinformation i nationella patientöversikter
Att det finns publicerade nationella gemensamma e-hälsospecifika- tioner innebär inte att det finns krav på att använda dessa eller att dela viss information. Precis som för läkemedel är det frivilligt att publicera uppmärksamhetsinformation i e-tjänsten nationell patient- översikt. För närvarande visar 16 av 21 regioner samt 99 privata vård- givare uppmärksamhetsinformation. Kommuner kan i dag inte lämna uppmärksamhetsinformation utan endast ta del av sådan information från andra offentliga, icke kommunala, eller privata vårdgivare. Inga statliga vårdgivare, t.ex. Försvarsmakten, producerar heller infor- mation.187
Enligt den gemensamma e-hälsospecifikationen visas uppmärk- samhetsinformation för ett urval av implantat enligt Snomed-CT.188
Frågan om informationsmodeller behöver utredas
Utredningen konstaterar att det är svårt att implementera en enhetlig nationell informationsmodell så länge det saknas enhetlig produkt- och klassificeringsinformation. En utbyggnad av den nationella infra- strukturen bör därför enligt utredningen ske i takt med att Eudamed, klassificeringssystem och en eventuell nationell produktdatabas till-
187Information som visas i NPÖ, Inera AB, https://www.inera.se/tjanster/alla-tjanster-a- o/npo---nationell-patientoversikt/#section-14510, besökt 2024-04-05.
188Snomed-CT, urval implantat, uppmärksamhetsinformation, 59841000052105.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
gängliggörs i Sverige. Utvecklingen av informationsmodeller kan dock sannolikt påbörjas innan övriga uppgifter är fullt tillgängliga. Ett naturligt första steg är enligt utredningens bedömning att uppdra åt berörda myndigheter att utreda frågan om informations- modeller. Ett sådant uppdrag behöver ta sin utgångspunkt i prio- riteringar av vilka informationsbehov som föreligger. Informationsdel-
ningen bör i detta sammanhang samordnas med hur information utbyts med kvalitetsregister, uppdraget att ta fram förslag på hur en nationell databas för medicintekniska produkter kan utformas och fungera189 samt vad som framkommer av de genomförandeakter som kommissionen enligt EU-förordningen om det europeiska hälsodata- området ska fastställa och som har betydelse för delandet av uppgifter om medicintekniska produkter. De svenska behoven av datadelning kan vara mer långtgående än vad som kommer av EU-förordningen. I detta arbete behöver företrädare för hälso- och sjukvården och patienter involveras (se även avsnitt 15.4 om samverkan). Därefter behöver semantiska informationsmodeller tas fram och omsättas i en tillämpning för informationsutbyte, t.ex. genom FHIR.
8.7.4Utredningens bedömning
Utredningen konstaterar att det för både patienter, hälso- och sjuk- vårdspersonal samt apotekspersonal finns behov av att få bättre över- blick över patienters behandling med eller användning av vissa medi- cintekniska produkter. I första hand avser det möjlighet att få del av uppgifter om sådana produkter som traditionellt har förskrivits på hjälpmedelskort men som i dag i vissa regioner inte förskrivs och hämtas ut via öppenvårdsapotek, samt information om implantat och vissa invasiva produkter. I avsnitt 5.3.4 konstateras också att det inte finns ett nationellt sammanhängande system för ordination och förskrivning av medicintekniska produkter. Det medicintekniska området är betydligt mer komplext än läkemedelsområdet som helhet. Både antalet medicintekniska produkter och de olika kategorier av produkter som omfattas gör området stort och svåröverskådligt. Utredningen konstaterar att området som helhet sannolikt skulle gynnas av mer nationell enhetlighet och stöd av nationell infrastruktur.
189Se uppdrag att ta fram förslag på en nationell databas för medicintekniska produkter (2025/00532 [delvis]).
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
Utredningen konstaterar också att hur ordination av medicin- tekniska produkter dokumenteras och hur sådana uppgifter kan delas inte är lika tydligt reglerat som vid läkemedelsbehandling. Ordination och användning av medicintekniska produkter doku- menteras inte heller alltid och i de fall det dokumenteras görs det inte alltid strukturerat. Det saknas än så länge också en gemensam standardiserad produktdatabas att hämta produktinformation ifrån. Utifrån vad som framgår av avsnitt 8.7.3 ovan konstaterar utred- ningen att infrastrukturen och informatiken för medicintekniska produkter inte är lika väl utvecklad som på läkemedelsområdet. Många av de förutsättningar som krävs för ett utökat utbyte av patientinformation finns därför inte på plats för dessa produkter. Utredningen konstaterar att det, inte minst utifrån de erfarenheter som finns av utvecklingen av registret nationell läkemedelslista, finns stora vinster med en stegvis utveckling.
Mot bakgrund av dessa omständigheter gör utredningen bedöm- ningen att infrastrukturen och informatiken för att tillgängliggöra information om medicintekniska produkter i nationella samman- ställningar ligger efter läkemedelsområdet. En nationell sammanställ- ning som omfattar medicintekniska produkter behöver därför avgrän- sas. På detta sätt kan utvecklingen drivas framåt stegvis och skapa grund för framtida utökningar av information om medicintekniska produkter. Ett första steg är att skapa en nationell produktdatabas över medicintekniska produkter.
8.8Hur ska uppgifter om behandling med eller användningen av medicintekniska produkter delas?
Utredningens bedömning: Uppgifter om behandling med eller användning av medicintekniska produkter bör som huvudregel samlas in och delas genom en federerad teknisk lösning. Upp- gifter om behandling med medicintekniska produkter med av- sedd långvarig användning och där det är av särskild betydelse att ha kännedom om produkten i patientens fortsatta vård, t.ex. vissa implantat och invasiva produkter, bör dock delas genom ett register.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
Uppgifter om förskrivna medicintekniska produkter som expedieras på öppenvårdsapotek bör även fortsatt delas genom registret nationell läkemedelslista. För medicintekniska produk- ter som kan förskrivas på hjälpmedelskort och förskrivningen expedieras på öppenvårdsapotek, men där vårdgivaren valt att inte hantera varorna på det sättet, behöver det utredas vidare hur uppgifter om dessa ordinationer dokumenteras i journalen och hur uppgifterna bäst kan delas med berörda aktörer. Detsamma gäller övriga förskrivna medicintekniska produkter.
Precis som vad gäller läkemedelsordinationer behöver det övervägas hur uppgifter om behandling med och användning av medicintek- niska produkter, som i dag inte registreras i registret nationell läke- medelslista, bäst kan delas och göras tillgängliga för olika aktörer. Även i detta fall finns möjlighet att dela uppgifterna federerat med stöd av sammanhållen vård- och omsorgsdokumentation eller genom ett register. En närmare beskrivning av de olika alternativen och deras allmänna för- och nackdelar finns i kapitel 7.
8.8.1Federerade lösningar är förstahandsalternativet
Precis som angavs i avsnitt 8.4.1 är federerade lösningar ofta första- handsalternativet vid utvecklingen av nya tjänster på hälso- och sjuk- vårdsområdet. De fördelar och utmaningar som utredningen ser med federerade lösningar för att dela uppgifter om läkemedelsordina- tioner vad avser t.ex. patientsäkerhet, integritet, tillgänglighet och bevarandetider och som redovisas i avsnitt 8.4 bör även vara tillämp- bara för medicintekniska produkter. I avsnitt 8.4. beskrivs också utmaningar med att samla uppgifter i register. Även dessa bör i huvudsak vara desamma som beskrivits för läkemedel. Där framgår bl.a. att det generellt sett kan finnas utmaningar med uppdatering eller synkronisering av information mellan register och patient- journal, att det innebär en dubbel registrering190 av uppgifter och att många känsliga personuppgifter samlas på ytterligare ett ställe. Dessutom utgör uppgifterna i grunden journalinformation och den extra registreringen av uppgifterna medför ett ytterligare integritets-
190Dubbel registrering behöver inte innebära att uppgiften ska registreras av en individ flera gånger utan syftar här på att informationen dubbleras.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
intrång. Därtill medför en registrering i ett register, behov av särskild hantering av samtycken och spärrar som går utöver den reglering som redan finns i patientdatalagen (2008:355) eller lagen (2022:913) om sammanhållen vård- och omsorgsdokumentation.
Federerade patientuppgifter som delas med stöd av regelverket för sammanhållen vård och omsorgsdokumentation faller också fortsatt under bestämmelserna om bevarandetider som finns för journalinformation och samma spärr- och samtyckesregler gäller som för annan journalinformation. Att dela information federerat genom interoperabilitetslösningar är utredningens huvudalternativ för information som inte utgörs av uppgifter om förskrivningar och som inte heller bör delas med öppenvårdsapotek. Precis som tidi- gare beskrivits behöver dock här ske en anpassning till EU-förord- ningen om det europeiska hälsodataområdet.
8.8.2Information om produkter som förskrivs
Som framgått tidigare förskrivs medicintekniska produkter på olika sätt (se även avsnitt 5.3.4). Förskrivningarna registreras i registret nationell läkemedelslista om de förskrivs elektroniskt på hjälpmedels- kort, eller om de förskrivits på papper, när de expedieras på öppen- vårdsapotek.
Uppgifter om förskrivningar av medicintekniska produkter som i dag finns i registret nationell läkemedelslista bör även fortsatt lagras i registret eftersom de behöver delas med öppenvårdsapotek och andra i lagen angivna aktörer för ekonomisk och annan uppföljning.
Produkter som hade kunnat förskrivas och ingå i den nationella infrastrukturen
Som utredningen redogjort för finns i vissa situationer, framför allt när patienten rör sig mellan vårdgivare och över regiongränser, ut- maningar kopplat till att samma medicintekniska produkter som kan förskrivas på hjälpmedelskort och lämnas ut via öppenvårds- apotek ibland förskrivs och distribueras på andra sätt, genom regio- nalt inrättade system. Det handlar om produkter som regleras i lagen (2002:160) om läkemedelsförmåner m.m. och utgörs av för- brukningsartiklar som en förmånsberättigad behöver vid stomi och
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
som förskrivs av läkare eller någon annan som Socialstyrelsen för- klarat har behörighet till sådan förskrivning, och förbrukningsartiklar som en förmånsberättigad på grund av sjukdom behöver för att till- föra kroppen ett läkemedel eller för egenkontroll av medicinering och som förskrivs av läkare, tandläkare eller någon annan som Social- styrelsen förklarat har behörighet till sådan förskrivning.191 Dessa förskrivningar registreras inte i den nationella läkemedelslistan när de tillhandahålls på annat sätt än via öppenvårdsapotek och är därmed inte del av någon nationell infrastruktur vare sig för distribution av produkter eller information om behandling med eller användning av produkterna.
Information om förskrivningar av ovanstående medicintekniska produkter skulle kunna tillgängliggöras för fler aktörer genom be- fintlig nationell infrastruktur om regionerna, i stället för att använda egna regionalt inrättade system, valde att nyttja den nationella infra- struktur som finns. Eftersom elektroniska förskrivningar på hjälp- medelskort i dag sker genom regionernas läkemedelsmoduler, och att dessa moduler anpassas till interoperabilitetslösningar för registret nationell läkemedelslista, kommer det genom denna infrastruktur framöver vara möjligt att utbyta information om medicintekniska produkter som förskrivs på detta sätt. Infrastrukturen är dock endast öppen för kommunikation med och expediering vid öppenvårds- apotek, och inte andra distributörer av medicintekniska produkter.
Det finns flera skäl till att regionerna valt att inrätta parallella system för förskrivning och distribution. I huvudsak handlar det om att man genom att upphandla produkterna kan erhålla ett lägre pris på dessa samt att man genom att tillhandahålla dessa kostnads- fritt, utan att använda den nationella infrastrukturen och nyttja distributionen via öppenvårdsapotek, också slipper betala moms. Regionerna uppger också att det är en bättre service till patienterna, vilket delvis också framkommer i enkätundersökningarna utredningen genomfört, särskilt vad avser stomiprodukter. Patienterna upplever dock ibland att regionernas upphandlingar avgränsar sortimentet för mycket och att man därmed inte kan erhålla passande produkter. Sortimentet som tillhandahålls via öppenvårdsapotek beslutas av Tandvårds- och läkemedelsförmånsverket och ingår i läkemedels-
19118 § 2 lagen (2002:160) om läkemedelsförmåner m.m.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
förmånen och är endera kostnadsfritt för patienten eller ingår i hög- kostnadsskyddet för läkemedel m.m.192
Produkter som inte kan förskrivas genom den nationella infrastrukturen
Det finns även produkter som förskrivs men som inte ingår bland de produktkategorier som kan förskrivas inom vad som anges i lagen (2002:160) om läkemedelsförmåner m.m. Det handlar t.ex. om inkontinensartiklar och andra typer av hjälpmedel eller andra medicintekniska produkter som inte förknippas med läkemedels- behandling. Dessa produkter finns inte heller i de produktdatabaser, VARA och Sil som beskrivs i avsnitt 8.7.2 utan i olika regionala databaser. Dessa produkter är därmed svåra att förskriva på hjälp- medelskort för expediering på öppenvårdsapotek. För dessa varor finns ingen nationell infrastruktur för information eller som stöd för förskrivning och utlämnande. Det pågår som framgår av avsnitt
7.3vissa initiativ hos Inera AB att ta över en av Västra Götalands- regionen utvecklad webbportal för beställning och att knyta denna till plattformen 1177.se. Som alla andra tjänster som tillhandahålls via 1177 är det frivilligt för de vårdgivare som har möjlighet att an- sluta sig att göra det. Vad utredningen erfar är infrastrukturen också beroende av att distributörens system som hanterar själva förskriv- ningen kan anslutas till plattformen, t.ex. Sesam LMN (se även 5.3.4). Eftersom det i detta fall fortfarande handlar om en förskrivning, ett meddelande till en distributör om vem som ska få tillgång till vilken vara och vem som ska betala för varan, lagras informationen från dessa förskrivningar enligt utredningens bedömning i ett eller flera olika register.
Framtida vägval
Det är utifrån vad som beskrivits ovan tydligt att utvecklingen av infrastruktur vad avser förskrivningsbara medicintekniska produkter i dag sker i två olika spår. Den ena är den nationella infrastrukturen knuten till den nationella läkemedelslistan och som möjliggör att information tillgängliggörs för patienter, vårdgivare och öppenvårds-
192Se 18 § lagen (2002:160) om läkemedelsförmåner m.m.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
apotek i hela Sverige. För utbytet av denna information finns inter- operabilitetslösningar framtagna som bygger på FHIR. Den andra infrastrukturen är från början regional och grundar sig i två delar, dels att alla produkter inte kan eller ska kunna förskrivas på hjälp- medelskort för expediering vid öppenvårdsapotek, dels att regio- nerna valt att ta över viss distribution som kan ske via öppenvårds- apotek i egen regi. Arbete i dessa delar drivs av regionerna och det finns åtminstone vissa initiativ som innebär att infrastruktur centra- liseras till Inera AB och knyts till plattformen 1177.se. Detta gör att infrastrukturen ensas och blir tillgänglig för fler, men som för all infrastruktur som tillhandahålls via Inera är det inte säkert att den blir tillgänglig för alla vårdgivare och därmed går att betrakta som nationell.
Det är möjligt att EU-förordningen om det europeiska hälsodata- området även kommer ha påverkan på delning av information om förskrivna medicintekniska produkter men utifrån vad som framgår av bilaga 1 till förordningen och de specifikationer som sedan tidigare tagits fram av det europeiska e-hälsonätverket är det inte helt tydligt att så kommer ske. En nationell infrastruktur som bygger på gemen- samma specifikationer, tillgänglig för alla vårdgivare, skapar dock bättre förutsättningar för att även kunna dela information över lands- gränser.
En utökning av registret nationell läkemedelslista i denna del kräver mer omfattande utredning
Det är utredningens bedömning att det i nuläget är svårt att utöka informationen i den nationella läkemedelslistan till att även omfatta annan information om förskrivna medicintekniska produkter än de som omfattas av läkemedelsförmånen, förskrivs på hjälpmedelskort och expedieras på öppenvårdsapotek. En sådan utveckling skulle kräva en utökad nationell produktdatabas, men också att andra distribu- törer än öppenvårdsapotek tillåts och kan ansluta till infrastrukturen. Det är möjligt att det skulle gå att utveckla den typen av funktiona- litet på sikt men detta behöver i så fall enligt utredningen utredas närmare. Vid en sådan utredning behöver man kunna fokusera just på förskrivna medicintekniska produkter, närmare kartlägga dagens olika lösningar och bedöma om det är lämpligt och genomförbart, t.ex. genom en förstudie av E-hälsomyndigheten och Inera AB. En
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
sådan lösning behöver även beakta vilka behov av information sådana distributörer har och att tillgången till information i så fall av bl.a. integritetsskäl behöver begränsas till endast det som är nödvändigt för att kunna utföra uppdraget. Distributörer som inte utgör öppen- vårdsapotek ska t.ex. inte ha tillgång till uppgifter om läkemedels- behandlingar. En sådan utveckling skulle också kräva justeringar av lagen (2018:1212) om nationell läkemedelslista.
Det finns fördelar med ett nationellt register
Fördelen med att samla uppgifter om fler förskrivningar i ett register är att det skulle inrättas en samlad nationell infrastruktur för för- skrivning, beställning och distribution av fler medicintekniska för- brukningsartiklar. En sådan infrastruktur behöver inte begränsas till öppenvårdsapotek. Tvärtom bör den i så fall vara öppen för fler produktområden än i dag och öppen för fler distributörer att ansluta sig till. En sådan lösning innebär att informationen kan delas mellan alla vårdgivare, även om det i dag inte är möjligt att expediera dessa regionalt beslutade och utformade förskrivningar annat än enligt vad som beslutats i den region där de utfärdats. Ett sådant tillgäng- liggörande av information skulle kunna underlätta fortsatt förskriv- ning när patienten flyttar eller tillfälligt uppehåller sig på annan ort och behöver hjälp med en ny förskrivning. Om informationen förs in i registret skulle den också kunna tillgängliggöras för personal på öppenvårdsapotek vilket skulle underlätta bedömningen av patientens möjlighet att använda förskrivna läkemedel när hjälpmedlet behövs för läkemedelsanvändningen. Det skulle också kunna underlätta för patienten att själv kunna köpa rätt produkt i den händelse att den förskrivning som finns tillgänglig inte är sådan att den kan expedieras på öppenvårdsapotek. Hur en nationell infrastruktur och regioner- nas val att styra distributionen till enskilda leverantörer genom upp- handling och avtal kan kombineras behöver dock beaktas i utforman- det av ett sådant system. Även hur informationen kan avgränsas på ett lämpligt sätt så att respektive distributör endast får tillgång till information om relevanta medicintekniska produkter behöver beaktas.
Att samla uppgifterna i en nationell infrastruktur skulle sannolikt också skapa bättre förutsättningar för att ta fram nationell statistik och att genomföra uppföljning på området. Frågan om att lägga till
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
uppgifter om fler typer av hjälpmedelsförskrivningar än hjälpmedels- kort är dock för omfattande för att kunna rymmas i denna utred- nings uppdrag.
Det behövs en ökad struktur på dokumentationen
Som framgår av avsnitt 5.3.3 dokumenteras inte ordinationer för alla medicintekniska produkter och i de fall de dokumenteras sker det inte alltid strukturerat (se avsnitt 8.7.1). Dokumentationen av de produkter som förskrivs på hjälpmedelskort utgörs ofta av själva förskrivningen. Så länge det inte finns en systematiserad informatik kring ordinationerna av förskrivna produkter i journalen är det enligt utredningens bedömning också svårt att gå vidare med en federerad lösning för att dela information ur patientjournalen. Både en federe- rad lösning eller en utökad registerlösning kräver dessutom en ut- ökad nationell produktdatabas.
8.8.3Information om produkter med avsedd långvarig användning
Som konstaterats i avsnitt 8.6 finns det behov av att tillgängliggöra uppgifter om vissa medicintekniska produkter med avsedd långvarig användning, t.ex. implantat och invasiva produkter. Eftersom pro- dukterna är avsedda för långvarig användning kan det också vara ända- målsenligt att bevara och göra uppgifterna tillgängliga under lång tid i de fall det är av betydelse att ha kännedom om produkterna i patientens fortsatta vård. Implantat ska i många fall sitta kvar i pati- enten under flera år.
Hur länge används ett implantat
Hur länge ett implantat ska, eller kan, sitta kvar i patienten varierar beroende på patientens behov av implantatet, patientens hälsotillstånd och implantatets tekniska livslängd. Vissa implantat kan behövas under en kortare tid för att sedan avlägsnas. Ett sådant exempel kan vara kopparspiraler för att förhindra oönskad graviditet. Spiralerna används normalt under en period av tre till åtta år, varefter de behö-
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
ver bytas ut, men de kan avlägsnas tidigare om patienten så önskar. Andra implantat behövs under lång tid då de åtgärdar ett fysiolo- giskt problem. Ett exempel kan vara de tidigare nämnda artificiella sfinktrarna vid inkontinens. Där uppges ungefär hälften av patien- terna vara reopererade efter 10 år, men då är ofta inte hela implan- tatet utbytt, utan delar av det. De flesta av dessa sfinktrar har därmed en användningstid på mer än 10 år. Detsamma gäller andra liknande implantat som t.ex. höftproteser och pacemakers. Det finns också implantat med en livslång användningstid, så länge det inte uppstår problem eller att de behöver bytas ut för att patientens hälsotillstånd försämras. Detta gäller t.ex. för ögonlinser eller kranskärlsstentar. Alla implantat kan behöva bytas ut tidigare än vad som framgår
av den angivna tekniska livslängden. Patientens hälsotillstånd kan försämras och produkten kan bedömas inte längre vara nödvändig. Även innovationer som möjliggör ett bättre behandlingsresultat skulle kunna vara en orsak till att byta ut ett implantat mot en mer modern version.
Uppgifter om vissa implantat delas i dag genom federerade lösningar men bör också delas genom register
Utredningen konstaterar att uppgifter om implantat som i dag delas inom ramen för uppmärksamhetsinformation delas genom federerade lösningar. Federerade lösningar har som beskrivits i avsnitt 8.4 många fördelar. Som framgår av avsnitt 8.4.5 kan dock registerlösningar ha fördelar för uppgifter som behöver bevaras under längre tidsperioder. Den huvudsakliga orsaken till detta är att det kan finnas utmaningar med tillgänglighet till uppgifter i källsystem när uppgifter behöver sparas under lång tid. En journalhandling ska bevaras i minst tio år efter det att den sista uppgiften fördes in i handlingen om inte Social- styrelsen föreskrivit annat.193 Vid upphörande av hälso- och sjukvårds- verksamhet är det i dag inte heller garanterat att journalhandlingar, även om de t.ex. överförs till annan vårdgivare, kan tillgängliggöras elektroniskt för andra vårdgivare. Ett tydligt exempel på detta är att Västragötalandsregionen vid det försök till införande av det nya vård- informationssystemet Millennium som genomfördes hösten 2024 t.ex. valt att starta med en tom patientjournal.194 Det kan utifrån
1933 kap. 17 § patientdatalagen (2008:355).
194Journaler nollställs när regionen byter it-system, Göteborgsposten 2024-11-01.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
ovanstående enligt utredningen finnas skäl att, precis som för läke- medel, överväga att spara uppgifter hänförliga till medicintekniska produkter som har betydelse för patientens fortsatta vård under lång tid i ett register. Uppgifter om implantat och vissa invasiva produkter utgör exempel på medicintekniska produkter där detta skulle kunna vara lämpligt. Utredningen bedömer att det annars medför en risk att inte all nödvändig information kommer finnas tillgänglig över tid.
De utmaningar med uppdatering eller synkronisering av infor- mation som utredningen har beskrivit i samband med registerlös- ningar har också större betydelse för uppgifter om behandlingar som ändras ofta, t.ex. förskrivningar, jämfört med uppgifter om t.ex. implantat som inte förändras på flera år.
För uppgifter om implantat och andra till patienten tillförda medicintekniska produkter med lång användningstid, t.ex. vissa invasiva produkter, gör därmed utredningen bedömningen att en registerlösning bättre kan tillgodose behovet av att uppgifter är tillgängliga under lång tid. En förutsättning är dock att uppgifterna kan bevaras i registret under hela den nödvändiga tiden. Utred- ningen bedömer dock att om det framöver skulle vara aktuellt att tillgängliggöra uppgifter om behandling med andra medicintekniska produkter och som inte utgör förskrivningar (se 8.10.1), där beva- randetiden inte utgör ett starkt argument för en registerlösning, bör delas genom federerade lösningar.
Registret nationell läkemedelslista begränsar bevarandetiden
Lagen (2018:1212) om nationell läkemedelslista begränsar i sin gällande lydelse bevarandet av uppgifter i registret till fem år, eller för uppgifter om samtycken och spärrar, tills uppgifterna inte längre är nödvändiga för lagens ändamål.195 En tidsbegränsning för upp- gifters bevarande i registret är lämplig för de ändamål som registret i dag är avsett att fylla för apoteks- och hälso- och sjukvårdsperso- nal. Det vill säga att apotekspersonal ska ha tillgång till uppgifter om aktuella förskrivningar och tidigare expedierade läkemedel och andra varor för att kunna göra kontroller i samband med expediering av läkemedel och vid rådgivning till patient för underlättande av
1953 kap. 10 § lagen (1018:1212) om nationell läkemedelslista.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
dennes läkemedelsanvändning. Hälso- och sjukvårdspersonal ska ha tillgång till uppgifter om aktuella förskrivningar och tidigare expedierade läkemedel och andra varor bl.a. för åstadkommande av en säker ordination av läkemedel och andra varor eller beredande av vård eller behandling av en patient. Registret är inte avsett att lagra information för inhämtning av historiska patientuppgifter. För histo- riska uppgifter får hälso- och sjukvårdspersonal i stället ta del av upp- gifter i patientens journal.
Ett register över förskrivna och expedierade läkemedel och andra varor, där patienten som huvudregel inte kan påverka att uppgifter registreras, behöver av integritetsskäl gallras efter en rimlig bevarande- tid. Genom att registret fylls på med nya förskrivningar och att in- aktuella förskrivningar med tiden tas bort ur registret ger registret, trots bevarandetiden, en aktuell bild över de vid varje tillfälle förskrivna produkterna.
Om det i registret nationell läkemedelslista skulle läggas till upp- gifter om t.ex. implantat blir begränsningen av bevarandetiden till fem år problematisk och behöver utökas. Uppgifter om implantat kräver därför, för att det ska vara fullt ut ändamålsenligt att samla in- formationen, en längre bevarandetid än registrets nuvarande fem år.
Informatik och produktdatabas begränsar
Som framgick av avsnitt 8.7.3 saknas i stora delar en gemensam informatik kring medicintekniska produkter. För implantat finns dock viss informatik på plats genom de nationella gemensamma specifikationerna för uppmärksamhetsinformation. Utredningen kan inte bedöma huruvida dessa specifikationer går att bygga vidare på om uppgifter om fler implantat ska tillgängliggöras via t.ex. ett register men de utgör i vilket fall en utgångspunkt för fortsatt arbete. Även en nationell produktdatabas som omfattar alla implantat är nödvändig.
8.8.4Utredningens bedömning
Utifrån vad som anges ovan gör utredningen bedömningen att den mest ändamålsenliga lösningen är att behålla information om på hjälpmedelskort förskrivna medicintekniska produkter, som kan
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
lämnas ut från apotek, i det befintliga registret nationell läkemedels- lista. Dessa varor har så nära samband med andra förskrivningar i aktuellt sammanhang att utredningen inte ser att det finns skäl att ändra på den befintliga ordningen för detta i registret nationell läke- medelslista.
För medicintekniska produkter som kan förskrivas på hjälpmedels- kort, men där vårdgivaren valt att inte förskriva varorna på det sättet, behöver det utredas vidare hur uppgifter om dessa ordinationer doku- menteras i journalen. Det kan finnas behov för personal på öppen- vårdsapotek att ta del av dessa uppgifter vilket talar för att det finns ett värde av att kunna dela även denna information genom registret nationell läkemedelslista. Samtidigt har regionerna ett behov av att dela denna information med andra leverantörer än öppenvårdsapotek. En fråga blir då om även dessa leverantörer ska få ta del av information i registret. Även detta behöver utredas vidare. Utredningen lämnar därför inga förslag avseende dessa produkter.
Utredningen bedömer att uppgifter om medicintekniska pro- dukter med avsedd långvarig användning och som det är av bety- delse att ha kännedom om i patientens fortsatta vård, såsom vissa implantat och invasiva produkter, utifrån att uppgifterna behöver finnas tillgängliga för både vårdgivare och patienten under lång tid bör delas genom ett register. Information om patientens använd- ning av eller behandling med andra medicintekniska produkter, som det finns anledning att tillgängliggöra uppgifter om för andra vård- givare eller patienten själv, bör ske genom federerade lösningar.
8.9En nationell infrastruktur för information om en patients läkemedelsbehandling
Utredningens bedömning: Uppgifter om en patients läkemedels- behandling, dvs. information om ordinationer, administrerade läkemedel, förskrivningar och expedierade läkemedel samt upp- gifter om en patients behandling med eller användning av vissa medicintekniska produkter bör alla utgöra en del av en nationell infrastruktur för information om en patients läkemedelsbehandling och behandling med eller användning av vissa medicintekniska pro- dukter. Denna infrastruktur utgör en del av den nationella infra- strukturen på hälso- och sjukvårdens område.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
En sådan infrastruktur kan bygga på information som hämtas från flera olika källor och distribueras eller tillgängliggöras genom olika tekniska lösningar.
Infrastrukturen bör vara statlig.
Utredningen har i avsnitt 8.2–8.4 beskrivit vilka uppgifter om en patients läkemedelsbehandling som behöver delas med patient och mellan olika vårdgivare eller öppenvårdsapotek och hur dessa kan tillgängliggöras. Utredningen har vidare i avsnitt 8.6 och 8.8 beskri- vit vilka uppgifter om en patients behandling med eller användning av medicintekniska produkter som utredningen bedömer behöver delas och hur de kan tillgängliggöras. I följande avsnitt beskrivs hur detta kan sammanfattas i en nationell infrastruktur.
Uppgifter om läkemedelsbehandlingar
Utredningen bedömer i avsnitt 8.3 att en nationell sammanställning över en patients läkemedelsbehandling, utöver informationen i regi- stret nationell läkemedelslista i sin nuvarande utformning, även be- höver innehålla information om ordinationer och om i hälso- och sjukvården administrerade eller överlämnade läkemedel. I avsnitt
8.4bedömer utredningen att denna information i första hand bör delas genom federerade lösningar. Vissa uppgifter om behandlingar av betydelse under lång tid kan dock behöva samlas och delas genom ett register. En konsekvens av ovanstående bedömningar är att all information i den nationella sammanställningen inte kommer att samlas i registret nationell läkemedelista. En nationell sammanställ- ning av läkemedelsbehandlingar behöver inte innebära att all infor- mation sparas i ett och samma register. Det behöver inte heller betyda att all information sparas i flera olika register. Var och hur infor- mationen tekniskt lagras eller presenteras är ur detta perspektiv av mindre betydelse. Det viktiga är att den kan göras tillgänglig för den som, utifrån sina författningsreglerade arbetsuppgifter eller som patient, har ett behov av informationen och att detta kan göras på ett ändamålsenligt sätt. Utredningen anser av denna anledning att det är mer lämpligt att prata om en nationell infrastruktur för information om en patients läkemedelsbehandling än att enbart prata om en nationell läkemedelslista. En sådan infrastruktur utgör en
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
del av den nationella infrastrukturen på hälso- och sjukvårdens om- råde. Den nya benämningen klargör att det snarare handlar om ett system, en infrastruktur, för att tillgängliggöra information så att olika aktörer kan använda denna utifrån sina uppgifter eller behov. Utredningen analyserar vilka som bör ha tillgång till olika delar av informationen närmare i avsnitt 8.11.
Uppgifter om behandling med eller användning av medicintekniska produkter
Utredningen bedömer i avsnitt 8.6 att en nationell sammanställning över en patients behandling med eller användning av medicintekniska produkter som ett första steg bör omfatta alla medicintekniska pro- dukter som kan förskrivas samt medicintekniska produkter med avsedd långvarig användning, t.ex. vissa implantat och invasiva pro- dukter, som det är av betydelse att ha kännedom om i patientens fortsatta vård. I avsnitt 8.8 bedömer utredningen att även uppgifter om medicintekniska produkter i första hand bör delas genom fede- rerade lösningar. Samtidigt konstaterar utredningen precis som för läkemedel att det för behandlingar med avsedd långvarig påverkan på patientens hälsotillstånd finns nackdelar med federerade lösningar och att en registerlösning är att föredra.
Vad gäller förskrivna medicintekniska produkter konstaterar ut- redningen att det redan i dag finns uppgifter om elektroniskt för- skrivna förbrukningsartiklar i registret nationell läkemedelslista.
Utredningen konstaterar också att vissa av de varor som kan för- skrivas på hjälpmedelskort förskrivs på andra sätt genom regionala initiativ samt att även andra varor är föremål för förskrivning. Infra- strukturen för förskrivning av medicintekniska produkter är därmed betydligt mer fragmenterad än för läkemedel.
En konsekvens av ovanstående är att all information om medicin- tekniska produkter i dag inte finns, och sannolikt inte heller inom en snar framtid, kommer finnas på samma ställe. Liksom för läke- medel behöver inte en nationell sammanställning av behandling med eller användning av medicintekniska produkter innebära att all in- formation sparas i ett och samma register eller att alla uppgifter delas genom federerade lösningar. Det viktiga är att informationen kan göras tillgänglig för den som, utifrån sina författningsreglerade upp- gifter eller som patient, har ett behov av informationen och att detta
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
kan göras på ett ändamålsenligt sätt. Utredningen anser av denna anledning att det är mer lämpligt att prata om en nationell infrastruk- tur för information om en patients behandling med eller användning av medicintekniska produkter. Även en sådan infrastruktur utgör en del av den nationella infrastrukturen på hälso- och sjukvårdens område.
Infrastrukturen bör vara statlig
Behovet av ökad statlig styrning på området beskrevs ingående av E-hälsokommittén redan år 2015.196 Staten har sedan dess försökt att styra mot gemensam tillämpning av standarder genom samverkan, bl.a. genom Vision e-hälsa 2025, men den har inte varit tillräckligt effektiv.197 Enligt utredningen är det olyckligt att det de senaste åren förts en debatt om nyttor och risker med informationen i registret nationell läkemedelslista samtidigt som det helt saknats en debatt om informationen i tjänsterna den nationella patientöversikten och 1177 Journal. Som framgår av kapitel 7 finns flera oklarheter avseende faktiskt informationsinnehåll och hur informationen presenteras i dessa tjänster. Informationen i den nationella patientöversikten och 1177 Journal är inte tillgänglig för alla aktörer och kan därmed aldrig fullt ut bli en nationell infrastruktur. Begreppet nationell patient- översikt kan därmed i detta sammanhang anses missvisande.
EU-förordningen om det europeiska hälsodataområdet198 ställer också krav på en nationell och europeisk infrastruktur för datadelning. Det är utredningens uppfattning att detta behöver hållas samman i statlig regi.
Utredningens bedömning
Utredningen gör utifrån vad som anges ovan bedömningen att upp- gifter om en patients läkemedelsbehandling, dvs. information om ordinationer, administrerade läkemedel, förskrivningar och expedi- erade läkemedel samt uppgifter om en patients behandling med eller användning av vissa medicintekniska produkter alla bör utgöra en del av en nationell infrastruktur för information om en patients
196SOU 2015:32 Nästa fas i e-hälsoarbetet.
197Statskontoret, 2022, Vision e-hälsa 2025 – ett försök att styra genom samverkan.
198Förordningen (EU) 2025/327 om det europeiska hälsodataområdet.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
läkemedelsbehandling och behandling med eller användning av vissa medicintekniska produkter. Denna infrastruktur utgör i sin tur en del av den nationella infrastrukturen på hälso- och sjukvårdens område. En sådan infrastruktur bör bygga på information som hämtas från flera olika källor och distribueras eller tillgängliggörs genom olika tekniska lösningar. Infrastrukturen bör vara statlig.
8.10Informationsdelning som rör behandling
med läkemedel och medicintekniska produkter måste stödja patient och verksamhet
Bedömning: Information om och informationshantering kring en patients läkemedelsbehandlingar och behandling med eller an- vändning av medicintekniska produkter måste presenteras på ett ändamålsenligt sätt så att den stödjer användarens behov och underlättar inhämtande av information. Endast då kan patient- säkerheten öka och den personliga integriteten upprätthållas.
Att förmedla information på ett ändamålsenligt sätt är en svår upp- gift. Det har under utvecklingen av registret nationell läkemedelslista riktats en del kritik mot hur de tekniska lösningarna, och därmed informationshanteringen, stödjer vårdens arbetsprocesser. Detta utvecklas vidare i kapitel 15. Det har också framförts kritik mot hur information riktad till patienten presenteras så att den kan uppfattas korrekt. Enligt utredningen är det rimligt att anta att den utökade information som bör finnas i en framtida nationell infrastruktur, för information om en patients läkemedelsbehandling och behand- ling med eller användning av vissa medicintekniska produkter enligt utredningens förslag i avsnitt 8.9, skapar nya utmaningar med att informationen förmedlas och presenteras på ett ändamålsenligt sätt. Hur informationen presenteras har stor betydelse för hur lätt den är att konsumera för berörda aktörer och om, eller hur, den påverkar patientsäkerheten. Enbart det faktum att olika aktörer och patienten själv ges tillgång till mer information innebär inte med självklarhet en ökad patientsäkerhet.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
Hur information presenteras ska inte regleras i lag
Hur tillgänglig information ska presenteras för patienter och hälso- och sjukvårdspersonal är inte lämpligt att reglera i lag utan måste lösas på andra sätt. Vilken faktisk nytta som realiseras genom till- gången till uppgifterna avgörs ytterst i samverkan mellan dem som ska använda informationen och dem som ansvarar för utveckling av de system där informationen konsumeras.
Vårdinformationsystem är medicintekniska produkter och måste därigenom uppfylla de krav som kommer av EU:s medicinteknikför- ordning. Genom EU-förordningen om det europeiska hälsodata- området kommer det också framöver ställas krav på interoperabilitet mellan elektroniska hälsodokumentationssystem för vissa uppgifter vid primäranvändning. Att uppfylla dessa krav räcker dock inte för att ett vårdinformationssystem ska vara anpassat och användbart för all vårdverksamhet. I dag ansvarar varje vårdgivare för de vård- informationssystem som används i verksamheten för att hantera patientjournaler. Det innebär att varje vårdgivare ställer krav utöver ovanstående EU-förordningar på de system man upphandlar. Vård- givaren ansvarar också för att verksamheten utvecklas och är patient- säker vilket också bör avspeglas i en sådan kravställning. Det står vårdgivare fritt att samverka och ensa kravbilden så länge det ryms inom bestämmelserna för offentlig upphandling. Inköpssamverkan och gemensamma kravspecifikationer är inget unikt för hälso- och sjukvårdsområdet och inte heller någon ny företeelse. Det underlättar även för leverantörerna eftersom många särlösningar är tidsödande och kostnadsdrivande också för dem.
Statliga aktörer som t.ex. E-hälsomyndigheten, eller kommunernas och regionernas ”it-bolag” Inera AB kan också tillhandahålla lösningar som gör det möjligt att konsumera information i den nationella infra- strukturen för information om en patients läkemedelsbehandling och behandling med eller användning av vissa medicintekniska pro- dukter. Även dessa myndigheter och företag behöver vara lyhörda för användarnas behov när de skapar gränssnitt och presenterar in- formation så att de lösningar som tas fram stärker patientsäkerheten och inte i stället riskerar den. Detsamma gäller vid framtagande av krav och specifikationer för nationell infrastruktur. Aktörerna ska i dessa fall, om systemen inte utgör medicintekniska produkter, också förhålla sig till Läkemedelsverkets föreskrifter (2022:42) om natio-
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
nella medicinska informationssystem. Elektroniska hälsodokumen- tationssystem behöver också uppfylla kraven i EU-förordningen om det europeiska hälsodataområdet.
Samverkan med användarna nödvändig
Det är utredningens bedömning att ju mer information som tillgäng- liggörs, desto större är risken att det kan leda till informationsöver- belastning. Tillgång till mer information ställer därför än större krav på berörda aktörer att samverka kring utveckling och implementering av lösningar för hur informationen kan konsumeras. Det kan t.ex. röra hur informationen segmenteras, presenteras eller integreras med annan information som vårdgivare har som stöd i arbetet med vård av patienter. Även artificiell intelligens kan i framtiden stödja eller förenkla informationshanteringen.
Det är också av stor vikt hur uppgifter presenteras för patienten. Informationen måste presenteras så att den är överskådlig och lätt att förstå. Det måste tydligt framgå vad som visas samtidigt som det är lika viktigt att det framgår vad som eventuellt inte visas. Rätt presenterad stödjer den information som utredningen föreslår ska tillgängliggöras patientens egen förmåga att ta ansvar för sin behand- ling. Den stödjer också vårdpersonalens arbete och möjliggör min- skad administration. Att uppnå detta är ett av huvudsyftena med de förslag utredningen lämnar.
I EU-förordningen om det europeiska hälsodataområdet finns krav på att elektroniska hälsodata med personuppgifter ska presen- teras på ett användarvänligt sätt i den elektroniska hälsodokumen- tationen så att hälso- och sjukvårdspersonal enkelt kan använda dem när de får tillgång till dem. Motsvarande skrivningar vad gäller patien- ternas tillgång till information riktar sig enbart till personer med funktionsnedsättning, utsatta grupper och personer med låg digital kompetens men det är enligt utredningens bedömning lika viktigt för alla patienter.199 Om information inte presenteras på ett ända- målsenligt sätt kan det i stället leda till att patienten missförstår upp- gifterna och att det i värsta fall leder till vårdskador. Om uppgifterna inte presenteras på ett sätt som gör dem enkla att använda i hälso-
199Se artikel 4 och artikel 12 i förordningen (EU) 2025/327 om det europeiska hälsodata- området.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
och sjukvårdens arbetsprocesser ökar risken för framför allt dubbel- dokumentation och det bidrar inte heller till att minska vårdens administration.
8.10.1Särskilt om presentation av information om medicintekniska produkter
Som beskrevs ovan har informationshanteringen kring läkemedel diskuterats flitigt, både ur hälso- och sjukvårdspersonalens och pati- entens perspektiv. Betydligt mindre har sagts om information kring behandling med eller användning av medicintekniska produkter. Det faktum att viss information om medicintekniska produkter som för- skrivs på hjälpmedelskort redan finns i den nationella läkemedels- listan och presenteras genom olika tjänster diskuteras sällan. De aspekter på informationshantering som diskuterats ovan gäller även för medicintekniska produkter.
Merparten av de medicintekniska produkterna har ingen koppling till läkemedel
Som beskrevs i avsnitt 5.3.7 uppskattas att det finnas runt 800 000 medicintekniska produkter på marknaden i Sverige. Ungefär 50 000 av dessa beställs och används i vårdens verksamhet, t.ex. förbruknings- artiklar. Merparten av de medicintekniska produkterna har inte en direkt koppling till en läkemedelsbehandling utan behövs på andra sätt i samband med patientens vård. Därmed är det inte givet att den hälso- och sjukvårdspersonal som har behov av information om en patients medicintekniska produkter också har behov av informa- tion om en patients pågående, planerade eller avslutade läkemedels- behandling.
Många medicintekniska produkter är förbrukningsartiklar som används för patientens vård eller omvårdnad. Uppgifter om sådana produkter kan, i den mån de dokumenteras, vara relevanta för helt andra yrkesgrupper än de som har behov av och behörighet att ta del av information om patientens läkemedelsbehandling. Detta får också stöd av svaren i den enkätundersökning som utredningen genomfört (se avsnitt 6.2). Åtkomst till, och presentation av, vissa uppgifter om medicintekniska produkter, i den mån och takt de
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
förs in i en nationell sammanställning, måste därför kunna hanteras separerat från uppgifter om läkemedelsbehandlingar, bl.a. med hänsyn till patientens integritet.
Ibland används medicintekniska produkter tillsammans med läkemedel
Det finns situationer när användningen av medicintekniska pro- dukter har en tydlig koppling till en läkemedelsbehandling. Det är t.ex. vanligt att kanyler, sprutor eller infusionsset behövs för admi- nistrering av injektionsläkemedel. Det förekommer också olika former av pumpar för läkemedelsadministrering, både patientbundna och sådana som används till flera patienter på t.ex. en vårdavdel- ning. Medicinska förband kan användas som täckförband, för ocklu- sion, i samband med läkemedelsbehandling på huden. Medicintekniska produkter används också i uppföljningen av, och för att styra, läke- medelsbehandlingar, t.ex. vid laboratorieprover eller egenkontroll av blod eller urin samt kontroll av andningsförmåga med olika for- mer av flödesmätare.
Medicintekniska produkter som har en tydlig koppling till behand- ling med läkemedel kan, till skillnad från vad som angavs i föregående avsnitt, vara relevant att kunna tillgängliggöra i direkt anslutning till den aktuella läkemedelsbehandlingen. Det ger möjlighet för berörd hälso- och sjukvårdspersonal, apotekspersonal och patienten att i större grad se sammanhanget i behandlingen och t.ex. bedöma om samtliga förskrivningar finns som behöver finnas när en patient själv ska utföra sin behandling.
Vissa medicintekniska produkter som i dag finns i den nationella läkemedelslistan
Förbrukningsartiklar som en förmånsberättigad på grund av sjuk- dom behöver för att tillföra kroppen ett läkemedel eller för egen- kontroll av sin medicinering, dvs. vissa medicintekniska produkter, omfattas av läkemedelsförmånen och är kostnadsfria när de för- skrivs på hjälpmedelskort. Även förbrukningsartiklar som behövs
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
vid stomi förskrivs inom läkemedelsförmånen på hjälpmedelskort.200 Ovanstående varor omfattas av registret nationell läkemedelslista endast när de förskrivs på hjälpmedelskort inom läkemedelsförmå- nen, elektroniskt eller på papper, och varorna lämnas ut från öppen- vårdsapotek.
I dag har vissa regioner valt att inte längre förskriva alla eller vissa förbrukningsartiklar på hjälpmedelskort. Dessa regioner har i stället, av bl.a. ekonomiska skäl, valt att starta egen distribution av dessa pro- dukter (se bl.a. avsnitt 5.3.7 samt 8.6). Registret nationell läkemedels- lista ger därför inte en nationellt heltäckande bild av patienternas behandling med eller användning av dessa förbrukningsartiklar. Detta är av betydelse när man överväger hur information tillgängliggörs och presenteras genom elektroniska tjänster. Det finns ett gemensamt flöde för hur de produkter som förskrivs på hjälpmedelskort hanteras i regionernas läkemedelsmoduler när de förskrivs för utlämning via öppenvårdsapotek. Det finns däremot i övrigt endast lite gemensamt i hur behandling med medicintekniska produkter och läkemedel han- teras i hälso- och sjukvården och på öppenvårdsapotek t.ex. avse- ende informationshantering och föreskrifter på området. Det finns t.ex. inte motsvarande strukturerade ordinationshandlingar för medi- cintekniska produkter som för läkemedel. Det som har förenat dessa produkter med läkemedel är alltså
a)att de förskrivs,
b)utlämnandet via öppenvårdsapotek mot en förskrivning och
c)att de omfattas av läkemedelsförmånen.
Detta behöver beaktas när informationstjänster designas och ut- vecklas.
Medicintekniska produkter är en delmängd i e-hälsospecifikationer
Även EU-förordningen om det europeiska hälsodataområdet på- verkar information om medicintekniska produkter. Mycket är, i avvaktan på att de genomförandeakter som kommissionen enligt
20018–19 §§ lagen (2002:160) om läkemedelsförmåner m.m. samt 8 § förordningen (2002:687) om läkemedelsförmåner m.m.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
förordningen ska anta blir beslutade, okänt kring detaljerna om hur informationen ska delas. I det europeiska e-hälsonätverkets riktlinjer för patientöversikter inom EU/EES, och som funnits längre, behand- las medicintekniska produkter som en egen informationsmängd. Enligt riktlinjerna omfattar informationsmängden en patients implanterade och externa medicintekniska produkter och utrustning som patien- tens hälsotillstånd är beroende av. Det inkluderar produkter som pacemaker, implanterade defibrillatorer, proteser, ferromagnetiska benimplantat etc. som hälso- och sjukvårdspersonalen måste ha känne- dom om.201
8.10.2Utredningens bedömning
Utredningen bedömer att information om en patients läkemedels- behandlingar och behandling med eller användning av medicintek- niska produkter måste presenteras på ett ändamålsenligt sätt så att den stödjer användarens behov och underlättar inhämtande av in- formation. Det kan t.ex. innebära att olika informationsmängder presenteras separerat från varandra, i olika vyer eller listor av integ- ritetsskäl eller för att det helt enkelt saknas rational att presentera informationen samlad. Det kan också innebära att vissa läkemedel och medicintekniska produkter behöver kopplas till varandra för att de ingår i samma behandling eller att ordinationer och förskriv- ningar knyts ihop för att informationen ska kunna hållas uppdaterad och synkroniserad. Endast när tekniken effektivt stödjer informa- tionshanteringen kan patientsäkerheten öka och den personliga in- tegriteten skyddas så långt möjligt.
201eHealth Network Guideline on the electronic exchange of health data under Cross- Border Directive 2011/24/EU, Patient Summary, Release 3.3, June 2023, s. 23.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
8.11Vem bör få ta del av ytterligare uppgifter om behandling med läkemedel
och medicintekniska produkter
Utredningens bedömning: Utöver den åtkomst till uppgifter som ska säkerställas enligt förordningen (EU) 2025/327 om det europeiska hälsodataområdet, bör åtkomst till uppgifter om en patients ordinerade och administrerade läkemedel och informa- tion om behandling med eller användning av medicintekniska produkter ges till patienten själv och till hälso- och sjukvårds- personal inom de ramar som anges i patientdatalagen (2008:255) och lagen (2022:913) om sammanhållen vård- och omsorgsdoku- mentation.
Som en konsekvens av ovanstående kommer apotekspersonal i nuläget inte få tillgång till uppgifter om en patients läkemedel som administrerats i hälso- och sjukvården eller uppgifter om medicintekniska produkter när de tillgängliggörs via dessa regel- verk.
Gällande bestämmelser i lagen (2018:1212) om nationell läke- medelslista om vilka personer och personalkategorier som får ges direktåtkomst till vilka uppgifter i registret nationell läke- medelslista bör inte ändras.
Vem som får ges direktåtkomst till uppgifter i registret nationell läkemedelslista är tydligt reglerat i lagen (2018:1212) om nationell läkemedelslista och omfattar patienten, hälso- och sjukvårdsperso- nal och expedierande personal vid öppenvårdsapotek. Av artikel
11.3i EU-förordningen om det europeiska hälsodataområdet202 framgår också att i enlighet med de principer som anges i artikel 5 i förordning (EU) 2016/679 ska medlemsstaterna fastställa regler för de kategorier av elektroniska hälsodata med personuppgifter som ska vara tillgängliga för olika kategorier av hälso- och sjukvårds- personal eller olika hälso- eller sjukvårdsuppdrag. Patienten ska en- ligt artikel 4 i EU-förordningen om det europeiska hälsodataområdet ha rätt till tillgång till de uppgifter som förordningen omfattar. Det behöver därför övervägas vilka som har behov av att ha tillgång de uppgifter utredningen analyserat.
202Förordningen (EU) 2025/327 om det europeiska hälsodataområdet.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
Enligt de bedömningar utredningen gör i avsnitt 8.3 och 8.6 bör informationen som kan samlas och tillgängliggöras om en patients medicinska behandlingar utökas. Detta bör enligt utredningens redo- visade bedömningar inte enbart göras genom att uppgifterna samlas i register. I avsnitt 8.9 bedömer utredningen att uppgifter om en patients läkemedelsbehandling, dvs. information om ordinationer, administrerade läkemedel, förskrivningar och expedierade läkemedel samt uppgifter om en patients behandling med eller användning av vissa medicintekniska produkter alla utgör en del av en nationell infrastruktur för information om en patients läkemedelsbehandling och behandling med eller användning av vissa medicintekniska pro- dukter. Denna infrastruktur utgör en del av den nationella infra- strukturen på hälso- och sjukvårdens område. Enligt utredningens bedömning i 8.4 samt 8.8 bör vissa av dessa nya uppgifter hämtas och delas med stöd av andra regelverk än lagen om nationell läke- medelslista. I det följande beskrivs utredningens bedömningar av- seende aktörernas tillgång till information i den nya nationella infra- strukturen.
8.11.1Patienten får tillgång till all information som inte är spärrad eller omfattas av sekretess
Utredningens förslag till utökning av nationellt tillgänglig information om behandlingar med läkemedel och vissa medicintekniska produkter innebär sammantaget att patienten kommer att kunna ta del av fler uppgifter om sin läkemedelsbehandling och behandling med vissa medicintekniska produkter. Utredningen gör bedömningen att patien- ten därigenom på ett bättre sätt kan vara delaktig i och ta ansvar för sin egen vård.
För att patienten ska kunna ha nytta av samlade uppgifter om sina behandlingar med läkemedel och vissa medicintekniska produk- ter behöver patienten medges åtkomst till uppgifterna. Utifrån de överväganden om ett ökat tillgängliggörande av uppgifter om be- handlingar med läkemedel och medicintekniska produkter som ut- redningen gör i avsnitt 8.3 och 8.6 behöver patientens tillgången till dessa uppgifter analyseras.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
Patienten får tillgång till ospärrade uppgifter
Enligt lagen (2018:1212) om nationell läkemedelslista får patienten ges direktåtkomst till sina uppgifter i registret under förutsättning att de inte spärrats av E-hälsomyndigheten.203 En spärr gentemot patienten själv kan endast gälla uppgift om ordinationsorsak. En spärr gentemot en vårdnadshavare till en underårig som införts på grund av sekretesskäl kan dock gälla samtliga barnets uppgifter i registret. Spärr sätts av E-hälsomyndigheten av sekretesskäl vilket kan ske på begäran av hälso- och sjukvårdspersonal om denna finner att det finns sekretesskäl för det.204
Utredningen har gjort bedömningen att uppgifter om behand- lingar med läkemedel och vissa medicintekniska produkter i första hand bör delas genom federerade lösningar. I dessa fall kommer patientens elektroniska åtkomst till uppgifter om läkemedel som administrerats av hälso- och sjukvårdspersonal, och om behandling med vissa medicintekniska produkter, att följa av patientdatalagen (2008:355) och lagen (2022:913) om sammanhållen vård och om- sorgsdokumentation, i det följande PDL och SVOD. Dessa regel- verk ger andra möjligheter till att införa spärrar gentemot patienten, se 10.6.3 och 10.6.4. Inom hälso- och sjukvården kan uppgifter om- fattas av sekretess som behöver upprätthållas gentemot patienten själv och uppgifterna får då inte lämnas ut till patienten.205
Enligt 25 kap. 6 § offentlighets- och sekretesslagen (2009:400), nedan OSL, gäller sekretess i förhållande till den vård- eller behand- lingsbehövande själv för uppgift om hans eller hennes hälsotillstånd, om det med hänsyn till ändamålet med vården eller behandlingen är av synnerlig vikt att uppgiften inte lämnas till honom eller henne. Detsamma gäller i fråga om sekretess om uppgiften om hälsotill- ståndet avser ordinationsorsak i den nationella läkemedelslistan enligt lagen (2018:1212) om nationell läkemedelslista. När bestäm- melsen om sekretess i förhållande till den enskilde infördes i OSL bedömdes att det fanns ett behov av en sådan reglering, men att det var fråga om ett ”snävt begränsat undantag”. Syftet med bestämmel- sen var att under de förutsättningar som i övrigt gäller enligt para-
203Se 5 kap. 6 § samt 4 kap. 4 § lagen (2018:1212) om nationell läkemedelslista.
2044 kap. 4 § lagen (2018:1212) om nationell läkemedelslista.
2055 kap. 5 § patientdatalagen (2008:355) samt 4 kap. 2 § lagen (2022:913) om sammanhållen vård- och omsorgsdokumentation.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
grafen hindra patienten från att ta del av uppgifter i sin journal.206 I förarbetena till lagen om nationell läkemedelslista anges att även i detta lagstiftningsärende kan det endast i undantagsfall komma i fråga att en myndighet under hänvisning till patientens behandling nekar honom eller henne rätt att ta del av uppgifter om sig själv. Det kan emellertid inte uteslutas att det i undantagsfall kan finnas ett sådant medicinskt betingat behov av en möjlighet att sekretess- belägga uppgift om ordinationsorsak i den nationella läkemedels- listan i förhållande till patienten själv.207
Av EU-förordningen om det europeiska hälsodataområdet208 framgår att patienten ska ha rätt att få tillgång till åtminstone sådana prioriterade kategorier av personliga elektroniska hälsodata som avses i förordningens artikel 14, bl.a. elektroniska förskrivningar, elektroniska expedieringar och patientöversikter. Det finns enligt EU-förordningen vissa undantag från denna rätt till tillgång.209 Vad gäller EU-förordningens påverkan på nuvarande bestämmelser så analyseras detta inom ramen för det arbete som görs av utredaren med uppdrag att möjliggöra en nationell digital infrastruktur för hälsodata (S 2024:A).
Det kan inte vara frivilligt för hälso- och sjukvården att dela uppgifter med patienten
Enligt bestämmelserna i PDL och SVOD är det frivilligt för vård- givare att genom elektronisk åtkomst tillgängliggöra de uppgifter som får lämnas ut till patienten. Samtliga vårdgivare har inte ut- nyttjat denna möjlighet. Utredningen gör bedömningen att för att säkerställa att patienter ges möjlighet till elektronisk åtkomst till sina journaluppgifter i enlighet med PDL och SVOD bör vårdgiva- res elektroniska tillgängliggörande av patientuppgifter för patienten själv inte vara frivilligt. EU-förordningen om det europeiska hälso- dataområdet ställer krav på att tillgängliggöra de uppgifter som ut- görs av prioriterade kategorier av elektroniska hälsodata med person- uppgifter för primäranvändning. Detta är dock mer begränsat än
206Se prop. 1979/80:2 Förslag till sekretesslag, s. 178 f.
207Prop. 2017/18:223 Nationell läkemedelslista, s. 198.
208Förordningen (EU) 2025/327 om det europeiska hälsodataområdet.
209Se bl.a. artikel 1.6 och 3.3 i förordningen (EU) 2025/327 om det europeiska hälsodata- området.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
vad som i dag går att dela utifrån PDL och SVOD. Utredningen återkommer till detta i avsnitt 8.13 nedan.
Vissa uppgifter föreslås ingå i register
Som framgår av avsnitt 8.4.9 och 8.8.4 bedömer utredningen att det finns vissa uppgifter som är mer ändamålsenliga att tillgängliggöra genom att de registreras i register. Det rör i huvudsak uppgifter som behöver bevaras över lång tid som t.ex. uppgifter om administrerade vaccin och andra läkemedel med långvarig effekt samt om tillförda implantat och vissa invasiva produkter. Om sådana uppgifter förs in i register behöver det också säkerställas att patienten ges tillgång till dessa uppgifter och vad som ska gälla avseende spärr i förhållande till patienten själv. Utredningen behandlar detta vidare i kapitel 11 och 12.
Informationen måste presenteras på ett ändamålsenligt sätt
När patienten ges tillgång till information både från journalhand- lingar och register ställer det stora krav på den som tillhandahåller tjänster där informationen kan konsumeras samlat att uppgifterna kommuniceras och presenteras på ett tydligt och begripligt sätt (se föregående avsnitt 8.10). Syftet med att dela information är att öka patientens delaktighet i sin behandling och att öka patientsäkerheten genom att patienten ges tillgång till fler uppgifter om sin vård. Om informationen tillhandahålls på ett oriktigt, motsägelsefullt eller på ett komplicerat sätt finns risk att informationen misstolkas eller miss- förstås och därigenom i stället försämrar patientsäkerheten. Att jour- nalhandlingar ska vara skrivna på svenska, vara tydligt utformade och så lätta som möjligt att förstå för patienten anges i 3 kap. 13 § patientdatalagen (2008:355). Det måste även gälla när information ur patientjournalen presenteras genom olika tjänster.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
8.11.2Hälso- och sjukvårdpersonal får tillgång till uppgifter på samma sätt som till annan journal- och registerinformation
Hälso- och sjukvårdpersonal har tillgång till uppgifter i registret natio- nell läkemedelslista för de ändamål som anges i lagen (2018:1212) om nationell läkemedelslista, under förutsättning att patienten gett sitt samtycke och att uppgifterna inte spärrats på patientens begäran.210 Utredningen har i 8.4 samt 8.8 gjort bedömningen att ytterligare uppgifter om behandlingar med läkemedel och vissa medicintekniska produkter i första hand ska delas genom federerade lösningar. I dessa fall kommer vårdpersonalens tillgång till uppgifter om läkemedel som administrerats av hälso- och sjukvårdspersonal och om pati- entens behandling med vissa medicintekniska produkter, enligt
de överväganden som utredningen gör, följa av patientdatalagen (2008:355) och lagen (2022:913) om sammanhållen vård och om- sorgsdokumentation, i det följande PDL samt SVOD. Där anges bl.a. att den som arbetar hos en vårdgivare får ta del av dokumen- terade uppgifter om en patient endast om han eller hon deltar i vår- den av patienten eller av annat skäl behöver uppgifterna för sitt arbete inom hälso- och sjukvården.211 Vårdgivaren ska också bestämma vill- kor för behörighetstilldelning för elektronisk åtkomst till patient- uppgifter.212 Åtkomsten förutsätter dock att patienten inte spärrat uppgifterna.
Det kan inte vara frivilligt att dela uppgifter mellan vårdgivare
Enligt SVOD är det frivilligt för en vårdgivare att tillgängliggöra uppgifter för andra vårdgivare. Det är en viktig skillnad i förhållande till vad som gäller när uppgifter registreras i registret nationell läke- medelslista. Enligt utredningens bedömning bör det vara tvingande för vårdgivare att möjliggöra för hälso- och sjukvårdspersonal att få elektronisk tillgång till nödvändiga uppgifter även när de delas i enlig- het med bestämmelserna i PDL eller SVOD. Detta innebär ingen skillnad i patientens möjlighet att motsätta sig tillgängliggörandet.
210Se 5 kap. 3–5 §§ samt 4 kap. 3 § lagen (2018:1212) om nationell läkemedelslista.
2114 kap. 1 § patientdatalagen (2008:355). Se också 3 kap. 1 § lagen (2022:913) om samman- hållen vård- och omsorgsdokumentation.
2124 kap. 2 § patientdatalagen (2008:355) samt 4 kap. 4 § lagen (2022:913) om sammanhållen vård- och omsorgsdokumentation.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
EU-förordningen om det europeiska hälsodataområdet213 ställer krav på att tillgängliggöra de uppgifter som utgörs av prioriterade kategorier av elektroniska hälsodata med personuppgifter för pri- märanvändning. Detta är dock mer begränsat än vad som i dag går att dela utifrån PDL och SVOD. Utredningen berör detta närmare i avsnitt 8.13 nedan.
Vissa uppgifter föreslås ingå i ett register
Som framgår av avsnitt 8.4.9 och 8.8.4 bedömer utredningen att det finns vissa uppgifter där det är mer ändamålsenligt att tillgängliggöra uppgifterna genom att de registreras i ett register. Det rör i huvud- sak uppgifter som behöver bevaras över lång tid som t.ex. uppgifter om administrerade vaccin och vissa andra läkemedel med långvarig effekt och vissa tillförda medicintekniska produkter. Om sådana uppgifter förs in i register behöver det säkerställas att hälso- och sjukvårdspersonalen kan ges tillgång till dessa uppgifter i registren. Utredningen behandlar detta vidare i kapitel 11 och 12.
Alla behöver inte ha tillgång till all information
Som framgår av avsnitt 8.10 behöver inte all vårdpersonal alltid ha tillgång till all information som utredningen föreslår ska kunna samlas och tillgängliggöras. Informationen bör därför struktureras på ett sätt som medger att tillgången till informationen kan styras på ett lämpligt sätt, t.ex. genom att dela upp tillgången dels till uppgifter om läkemedel, dels till medicintekniska produkter. Även tillgången till uppgifter om patientens olika läkemedelsbehandlingar bör struk- tureras så att det går att styra åtkomsten utifrån behovet av uppgif- ter i varje enskilt fall så att hälso- och sjukvårdspersonal kan upprätt- hålla kraven på att de bara ska ta del av uppgifter som det finns behov av för bl.a. patientens vård.
213Förordningen (EU) 2025/327 om det europeiska hälsodataområdet.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
8.11.3Apotekspersonal bör inte få tillgång till uppgifter om läkemedel administrerade i vården eller om implantat
Enligt lagen (2018:1212) om nationell läkemedelslista får expedierande apotekspersonal ges direktåtkomst till uppgifter i registret nationell läkemedelslista för expediering av läkemedel och andra varor som förskrivits, och för underlättande av en patients läkemedelsanvänd- ning.214 Direktåtkomst till uppgift om ordinationsorsak får endast ske för ändamålet expediering av förskrivna läkemedel och andra varor och åtkomsten till uppgiften förutsätter patientens samtycke.215 Utan tillgång till uppgifter i registret kan inte personal på öppen- vårdsapotek expediera förskrivna läkemedel och andra varor. Lagen ger därför inte heller patienten någon möjlighet att spärra uppgifter för expedierande apotekspersonal för det ändamålet, annat än upp- giften om ordinationsorsak.216
För att apotekspersonal ska kunna dra nytta av ytterligare upp- gifter om behandlingar med läkemedel eller vissa medicintekniska produkter behöver de få tillgång till sådana uppgifter. Utifrån de överväganden om en utökad tillgång till uppgifter om behandlingar med läkemedel och medicintekniska produkter som utredningen gör i avsnitt 8.3 och 8.6 behöver tillgången till dessa uppgifter ana- lyseras.
Utredningen har i avsnitt 8.4 samt 8.8 gjort bedömningen att ytterligare uppgifter om behandlingar med läkemedel och vissa medi- cintekniska produkter i första hand ska delas genom federerade lös- ningar. I dessa fall kommer tillgången till uppgifter om läkemedel som administrerats av hälso- och sjukvårdspersonal och om patien- tens behandling med vissa medicintekniska produkter, enligt de över- väganden som utredningen gör, följa regleringen avseende detta i patientdatalagen (2008:355) och lagen (2022:913) om sammanhållen vård och omsorgsdokumentation, i det följande PDL samt SVOD. Apotekspersonal har enligt dessa lagars gällande lydelse inte möjlighet att ta del av information i patientjournaler.
Som framgår av avsnitt 8.4.9 och 8.8.4 bedömer utredningen att det finns vissa uppgifter där det är mer ändamålsenligt att dela upp- gifterna efter att de har registrerats i ett register. Det avser uppgifter som behöver bevaras över lång tid som t.ex. uppgifter om admini-
2145 kap. 1 och 2 §§ samt 3 kap. 3 § lagen (2018:1212) om nationell läkemedelslista.
2155 kap. 1 § andra stycket ovan nämnda författning.
2164 kap. 3 § första stycket ovan nämnda författning.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
strerade vaccin och andra läkemedel med långvarig effekt och till- förda implantat. Om sådana uppgifter förs in i register kan det över- vägas att apotekspersonal ska medges tillgång till uppgifterna.
Apotekspersonalens behov av tillgång till ytterligare uppgifter
Som framgår av avsnitt 6.5.1 finns viss nytta för personal på öppen- vårdsapotek att ta del av information om sådana läkemedel som i olika situationer administreras eller delas ut i hälso- och sjukvården. Det handlar i huvudsak om behov av att kunna göra en vidare bedöm- ning än i dag av lämpligheten i en patients samlade läkemedelsanvänd- ning genom t.ex. interaktionskontroll, och behov av att kunna hjälpa patienten att se hur olika läkemedelsbehandlingar hänger samman och förstå vad som är en korrekt fortsatt behandling efter att patien- ten t.ex. varit inlagd på sjukhus.
När det gäller medicintekniska produkter finns viss nytta för apotekspersonal att kunna ta del av ytterligare uppgifter om fram- för allt sådana produkter som en patient får ordinerade för att till- föra kroppen läkemedel eller för egenkontroll av en läkemedels- behandling, men som inte har förskrivits på hjälpmedelskort (se avsnitt 6.5.2). Om ordinationen av produkterna inte lett till en för- skrivning på hjälpmedelskort sker i dag ingen registring i registret nationell läkemedelslista. Apotekspersonal har därigenom inte till- gång till uppgifter om vilka produkter som patienten har fått utläm- nade tidigare eller om vilka produkter som det är avsett att patien- ten ska använda.
Öppenvårdsapotekens uppdrag
Apotekens grunduppdrag regleras i lagen (2009:366) om handel med läkemedel. Där framgår att öppenvårdsapoteken ska verka för en god och säker läkemedelsanvändning genom att säkerställa att konsumenten så snart det kan ske får tillgång till förordnade läke- medel och varor, ge sakkunnig och individuellt anpassad informa- tion och rådgivning, och genomföra och upplysa om utbyte av läke- medel.217 Vidare anges i lagen att en farmaceut vid expediering av en förskrivning ska lämna information och rådgivning enligt vad som
2172 kap. 3 a § lagen (2009:366) om handel med läkemedel.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
anges i lagen och utföra de övriga uppgifter som har särskild bety- delse för en säker hantering och användning av läkemedlet.218 Farma- ceuten ska vid expedieringen tillhandahålla individuell och produ- centoberoende information och rådgivning om läkemedel, utbyte av läkemedel, läkemedelsanvändning och egenvård.219 Farmaceuten ska också så långt det är möjligt säkerställa att läkemedlet kan an- vändas på rätt sätt.220
Enligt Läkemedelsverkets föreskrifter ska en farmaceut vid expe- diering av ett föreskrivet läkemedel bl.a. också göra en bedömning av om expedieringen är lämplig med hänsyn till den som receptet avser och dennes behov. Vid bedömningen ska patientens samtliga recept i elektronisk form samt information om expedierade läke- medel beaktas.221
Hur långt sträcker sig öppenvårdsapotekens uppdrag
En relevant fråga är hur långt öppenvårdsapotekens uppdrag sträcker sig vad gäller vilka uppgifter apotekspersonal ska ta hänsyn till vid expediering av läkemedel. Den huvudsakliga regleringen återfinns som ovan nämnts i 2 kap. 3 a och 9 a §§ i lagen om handel med läke- medel samt i Läkemedelsverkets föreskrifter (HSLF-FS 2021:75) om förordnande och utlämnande av läkemedel och teknisk sprit.
I förarbetena till lagen om handel med läkemedel anges angående 2 kap. 3 a § bl.a. att öppenvårdsapoteken, genom tillståndshavaren, ska verka för en god läkemedelsanvändning. Detta har varit en ut- gångspunkt vid omregleringen av apoteksmarknaden. Den samlade regleringen av handel med läkemedel utgör grunden för apotekens ansvar i detta avseende, t.ex. bestämmelsen i 1 kap. 2 § att handel med läkemedel ska bedrivas på ett sådant sätt att läkemedlen inte skadar människor, egendom eller miljö samt att läkemedlens kvalitet inte försämras. När det gäller att öppenvårdsapoteken ska verka för en säker läkemedelsanvändning avses också det samlade regelverket om handel med läkemedel och läkemedelslagstiftningen i relevanta delar, t.ex. 13 kap. 1 § läkemedelslagen (2015:315).222
2182 kap. 9 a § ovan nämnda författning.
2192 kap. 6 § 11 ovan nämnda författning.
2202 kap. 9 a § andra stycket ovan nämnda författning.
2218 kap. 11 § Läkemedelsverkets föreskrifter (HSLF-FS 2021:75) om förordnande och utlämnande av läkemedel och teknisk sprit.
222Prop. 2017/18:157 Nationell läkemedelslista, s. 269.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
Vidare anges i förarbetena att kravet i lagen på att öppenvårds- apoteken ska ge sakkunnig och individuellt anpassad information och rådgivning, handlar om öppenvårdsapotekens informations- och rådgivningsskyldighet dels när apoteken hanterar förordnade läkemedel och varor, dels i egenvården. Enligt 2 kap. 6 § 11 lagen om handel med läkemedel ska apoteken tillhandahålla individuell och producentoberoende information och rådgivning om läkemedel, utbyte av läkemedel, läkemedelsanvändning och egenvård till kon- sumenter samt se till att informationen och rådgivningen endast lämnas av personal med tillräcklig kompetens för uppgiften. Enligt 13 kap. 1 § läkemedelslagen ska den som lämnar ut läkemedel särskilt iaktta kraven på sakkunnig och omsorgsfull vård samt kraven på upp- lysning till och samråd med patienten eller företrädare för denne. Vidare anges i nämnd paragraf i läkemedelslagen att sådan informa- tion som har särskild betydelse för att förebygga skada eller för att kunna främja en ändamålsenlig användning ska lämnas skriftligen när läkemedlet tillhandahålls en användare.223
Av förarbetena till lagen om handel med läkemedel framgår avse- ende 2 kap. 9 a § att en farmaceut så långt det är möjligt ska säker- ställa att läkemedlet kan användas på rätt sätt. Med ”så långt det är möjligt” avses att informationen som ges av farmaceuten ska syfta till att patienten kan använda läkemedlet på ett optimalt sätt och att farmaceuten ska anpassa informationen eller hanteringen i övrigt till behoven hos den som tar emot läkemedlet. Behovet av information och rådgivning kan skilja sig mycket mellan olika individer och i olika situationer. Kravet gäller vidare vid all receptexpediering vid öppen- vårdsapotek oavsett hur läkemedlet distribueras till konsumenten.224
Utifrån vad som anges i lagen om handel med läkemedel och dess förarbeten får man tolka vilka uppgifter som expedierande farmaceut bör väga in vid receptexpediering eller i samband med rådgivning om egenvård på öppenvårdsapotek. Läkemedelsverkets föreskrifter anger vilka uppgifter som ska beaktas vid expediering av ett förskrivet läkemedel, dvs. patientens övriga elektroniska recept och expedierade läkemedel. Att föreskrifterna är formule- rade så har sin grund i att det är uppgifter som farmaceuten har möjlighet att få tillgång till genom lagen (2018:1212) om nationell
223A.a.
224A.a., s. 284.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
läkemedelslista. Det går inte att ställa krav på att uppgifter ska be- aktas som det inte går att få tillgång till.
Det kan inte utifrån vad som anges i förarbetena till lagen om handel med läkemedel med säkerhet slås fast att det inte ingår i ett öppenvårdsapoteks uppdrag att, om informationen finns tillgänglig, även beakta uppgifter om sådana läkemedel som administreras eller delas ut av hälso- och sjukvårdspersonal. Det kan dock vara svårare att utifrån öppenvårdsapotekens uppdrag se att det finns ett behov av tillgång till information om medicintekniska implantat eller andra medicintekniska produkter än sådana som har direkt samband med en läkemedelsbehandling. Något sådant behov har inte heller fram- kommit i den enkätundersökning utredningen genomfört.
Lämplighetsbedömning
Som framgått ovan har Läkemedelsverket föreskrivit att en bedöm- ning av om expedieringen är lämplig med hänsyn till den som recep- tet avser och dennes behov ska genomföras vid receptexpediering.
En sådan lämplighetsbedömning omfattar många olika delar och förutsätter farmaceutens yrkeskompetens, det gäller t.ex. att beakta läkemedlets dosering, om det är förskrivet till en person med rele- vant kön för behandlingen, om expedieringen är rimlig utifrån patien- tens ålder, vilka andra läkemedel patienten har förskrivits och för- skrivna läkemedel som hämtats ut i närtid samt lämplighet/olämplighet i förhållande till patientens eventuella andra sjukdomstillstånd. I vissa fall skulle det kunna vara av värde att även väga in uppgifter om andra läkemedel än de som förskrivs på recept eller används för egenvård i dessa lämplighetsbedömningar.
Apotekspersonal är dock inte ensamma om att genomföra sådana lämplighetsbedömningar vilket framgår av bl.a. 13 kap. 1 § läkemedels- lagen (2015:315). Där framgår att den som förordnar eller lämnar ut läkemedel särskilt ska iaktta kraven på sakkunnig och omsorgsfull vård samt på upplysning till och samråd med patienten eller före- trädare för denne. Detta regleras också i Socialstyrelsens föreskrifter där det anges att den som ordinerar en läkemedelsbehandling ska göra en lämplighetsbedömning i samband med detta.225 Det är viktigt
2256 kap. 2 § Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordination och hantering av läkemedel i hälso- och sjukvården.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
att ta i beaktande det samlade ansvaret för berörd hälso- och sjuk- vårdspersonal och apotekspersonal att bedöma lämpligheten i en patients behandling.
Särskilt om bedömning av interaktioner mellan olika läkemedel
Den som ordinerar en patient en läkemedelsbehandling, nedan ordi- natören, har bl.a. ansvar för att bedöma möjliga interaktioner som ordinationen av läkemedlet kan medföra. Ordinatören ska också säker- ställa att ordinationen är lämplig med utgångspunkt i patientens behov. Detta innebär att ordinatören särskilt ska göra en lämplighetsbedöm- ning där hänsyn tas till bl.a. patientens läkemedelsanvändning och pågående behandling.226 I detta ryms bl.a. att bedöma hur olika läke- medel fungerar tillsammans. Utöver ordinatörens ansvar för detta har expedierande personal på öppenvårdsapotek också en viktig roll i att säkerställa en för patienten korrekt och säker läkemedelsanvänd- ning, vilket även inbegriper att identifiera möjliga relevanta interaktio- ner. Apotekspersonalen utgör här en extra säkerhetsfunktion i det fall ordinatören förbisett någon interaktion. Innan registret nationell läkemedelslista integreras fullt ut mot patientjournalen utgör apoteket en särskilt viktig instans för att kontrollera interaktioner mellan olika förskrivna läkemedel. Apotekspersonalen har i dag tillgång till ett elektroniskt expertstöd som omfattar interaktionskontroll och som kan analysera samtliga förskrivningar i registret nationell läkemedels- lista för en enskild patient.227 För att motsvarande beslutsstöd ska kunna användas av förskrivaren behöver information om de ordine- rade läkemedlen registreras i patientens journal. Utan systemstöd och integrerade lösningar där information om förskrivningar från andra vårdgivare från registret nationell läkemedelslista kan impor- teras till patientjournalen och presenteras på ett ändamålsenligt sätt är detta omständligt. När den nationella läkemedelslistan i sin nu- varande utformning är fullt ut implementerad i vårdgivarnas verk- samhet bör hälso- och sjukvårdens möjligheter att utföra interaktions- kontroller förenklas och förbättras. Det är utredningens bedömning att vetenskapliga undersökningar utgör ett viktigt redskap för att
226A.a.
227Elektroniskt expertstöd, EES, se https://www.ehalsomyndigheten.se/fragor-svar/vad-ar- elektroniskt-expertstod/, besökt 2024-09-03.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
följa upp införandet av den nationella läkemedelslistan och effek- terna därav i alla dess delar.
I dag avgränsas apotekspersonalens möjlighet att bedöma inter- aktioner oftast till receptförskrivna läkemedel. I vissa fall kan apoteks- personalen även beakta receptfria läkemedel, t.ex. om de inköps på öppenvårdsapoteket i samband med expediering, eller om patienten frågar om något specifikt läkemedel. Annan läkemedelsbehandling som skulle kunna vara aktuell att beakta vid denna kontroll, men som apotekspersonal i dag inte har möjlighet att elektroniskt hämta information om, är t.ex. läkemedel som regelbundet administreras patienten som injektioner av hälso- och sjukvårdspersonal och där effekten sitter i under längre tid. Det samma gäller läkemedel som överlämnas av hälso- och sjukvårdspersonal i samband med ett vård- besök eller i samband med t.ex. specialiserad sjukvård i hemmet. Det finns också behandlingar som ges vid vårdkontakt där det är uppenbart onödigt att göra en bedömning av interaktionsrisk vid en senare expediering av läkemedel, exempelvis administrering av korttidsverkande läkemedel som ges under ett avgränsat vårdtillfälle och där effekten helt upphört när patienten skrivs ut, t.ex. ett narkos- medel eller ett korttidsverkande blotrycksreglerande läkemedel som ges parenteralt under intensivvård.
Utredningen konstaterar att för ändamålet expediering av läke- medel och varor som förskrivits får apotekspersonal enligt gällande bestämmelser ha direktåtkomst till andra uppgifter i den nationella läkemedelslistan än ordinationsorsak, även utan patientens sam- tycke.228 Om registret skulle utökas med uppgifter om andra ordi- nerade eller administrerade läkemedel än sådana som förskrivits, och apotekspersonal skulle medges åtkomst till sådana uppgifter, skulle det vara tekniskt möjligt att genomföra bl.a. mer omfattande inter- aktionskontroller med hjälp av t.ex. det elektroniska expertstöd som i dag används för att bl.a. identifiera interaktioner.229 Expertstödet bygger på Janusmed interaktioner som omfattar i princip alla läke- medelssubstanser som finns i Sverige och är samma grundinformation som vården grundar sina beslutsstöd på.230
2285 kap. 1 § första stycket samt 3 kap. 3 § 1 lagen (2018:1212) om nationell läkemedelslista.
229Elektroniskt expertstöd, EES, är en tjänst från E-hälsomyndighetem, se https://www.ehalsomyndigheten.se/yrkesverksam/apotek/ees-elektroniskt-expertstod/, besökt 2024-04-23.
230https://vardgivarguiden.se/it-stod/e-tjanster-och-system/janusmed-interaktioner/, besökt 2024-04-23.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
Utmaningar för apotekspersonal att hantera frågor om interaktioner
Av den enkät som utredningen genomfört riktad till apotekspersonal (se avsnitt 6.5) framgår att det finns utmaningar att i samband med receptexpediering genomföra bedömningar av interaktioner. Det är svårt för apotekspersonal att veta om en möjlig interaktion redan bedömts av den som ordinerade läkemedlet. Ordinatören kan t.ex. ha bedömt interaktionen vara av ingen eller ringa betydelse för pati- entens läkemedelsbehandling. Även ordinatörer uttrycker att det
i dag är svårt att förmedla sådan information. Det saknas ett sätt för öppenvårdsapotek och förskrivare att enkelt kommunicera i dessa frågor. Eftersom en interaktion alltid involverar mer än ett läkemedel är det inte heller helt givet att t.ex. ett recept, som endast omfattar ett läkemedel, är rätt bärare av information kring bedömning av inter- aktioner. Frågan om säker och effektiv kommunikation mellan apo- tekspersonal och förskrivare har tidigare uppmärksammats i bl.a. den nationella läkemedelsstrategin år 2018.231 Frågan lämnades till Läkemedelsverket att utreda vidare inom ett regeringsuppdrag att förebygga och hantera rest- och bristsituationer avseende läkemedel.232 Myndigheten bedömde nyligen i sin delrapport att former för hur kommunikation mellan farmaceut och förskrivare ska ske behöver diskuteras vidare mellan aktörerna och att den nationella läkemedels- strategin kan utgöra ett forum för sådan dialog.233 Utredningen kan därmed konstatera att frågan ännu inte är löst.
Tillgång till ytterligare information om fler läkemedelsbehandlingar kommer inte göra frågan om bedömning av interaktioner enklare med annat än att man finner en lösning på hur kommunikationen mellan förskrivare och apotekspersonal kring en patients läkemedels- behandlingar kan lösas på ett bra sätt, och den frågan kommer enligt utredningens bedömning inte vara löst i närtid.
231Apotekarsocieteten, 2019, Slutrapport Nationell läkemedelsstrategi aktivitet 1.15 – Strukturerad läkemedelsinformation från apotek till ordinatör.
232Uppdrag att förebygga och hantera rest- och bristsituationer avseende läkemedel (S2023/01609).
233Läkemedelsverket, 2024, Uppdrag att förebygga och hantera rest- och bristsituationer avse- ende läkemedel – Delredovisning, dnr 1.1.8-2023-040343, s. 40.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
Rådgivning för en korrekt läkemedelsanvändning
Som konstaterades inledningsvis har apoteken i uppdrag bland annat att verka för en god och säker läkemedelsanvändning. En viktig del i detta är att ge råd om läkemedel och att hjälpa patienten att förstå vilket läkemedel denne ska använda mot vad, i vilken dos och hur ofta samt att säkerställa att patienten praktiskt kan hantera sitt läke- medel.
Som framkom i enkätsvar från personal på öppenvårdsapotek uppstår ofta oklarheter för patienten om sin läkemedelsbehandling i samband med att patienten varit inskriven för vård och en läke- medelsbehandling påbörjats eller ändrats under vårdtillfället. Det är inte heller ovanligt att patienten under vårdtillfället vårdats på flera vårdenheter. Även inom sjukhusvården är vården uppdelad mellan olika specialiteter. Det är inte säkert att den läkare som skriver ut patienten har detaljkunskap och till fullo kan redogöra för alla in- satta behandlingar. Det är heller inte ovanligt att patienten för fort- satt läkemedelsbehandling får ett annat läkemedel förskrivet eller expedierat på apoteket än det som gavs under vårdtillfället. Apoteks- personalen uppger att de, om de hade tillgång till behandlingsinfor- mation från ett vårdtillfälle, på ett bättre sätt skulle kunna bidra till patientens förståelse för den fortsatta behandlingen.
Ibland är också en behandling som påbörjats under ett vårdtillfälle relevant att väga in i förhållande till den totala behandlingstiden. Detta gäller ofta för t.ex. antibiotika eller blodförtunnande läke- medel som ska användas under en viss sammanlagd tid. Även om hälso- och sjukvårdspersonal hos vårdgivaren har ett ansvar för att ge information om behandlingen är det, av olika skäl, inte säkert att den når fram till eller förstås av patienten. Ibland har patienten fått med sig en läkemedelsberättelse eller en utskriven lista över aktuella läkemedelsordinationer men så är inte alltid fallet. I dessa fall skulle det kunna vara relevant för apotekspersonal att kunna ta del av upp- gifter om hur mycket av läkemedlet, eller hur länge läkemedlet givits, under vårdtillfället så att receptexpedieringen kompletterar detta och att patienten vet hur länge till denne ska använda läkemedlet.
Det förekommer avvikelser mellan de läkemedelslistor som lämnas ut till patienten från hälso- och sjukvården och de förskrivningar som finns registrerade i registret nationell läkemedelslista (se avsnitt 6.5.1). Det har också framförts till utredningen att patienter i hälso- och
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
sjukvården inte får all information de har behov av om sin läkemedels- behandling. Utredningen kan i denna del konstatera att det finns krav i lagstiftningen på att det informationsbehovet ska fyllas i sam- band med att läkemedel förskrivs. Öppenvårdsapoteken ska, såsom regelverket är utformat, utgöra en extra säkerhetsfunktion för patient- säkerheten i samband med expediering av läkemedel i vilket bl.a. ingår att informera patienten om läkemedelsbehandlingen, men det ligger inte i deras uppdrag att ta över ansvaret för och göra det som hälso- och sjukvården har i uppdrag att utföra. Om hälso- och sjuk- vården brister i sina åligganden är det något som ytterst måste åtgärdas genom tillsyn. Det är genom tillsyn som det ska säkerställas att de krav som åligger både vårdgivare och öppenvårdsapotek uppfylls.
När lagen (2018:1212) om nationell läkemedelslista i sin gällande lydelse implementerats och börjar tillämpas fullt ut kommer apoteks- personal ha tillgång till mer information än i dag. Bland annat kom- mer de ha tillgång till information om senaste datum för när läke- medelsbehandlingen ska följas upp eller avslutas.234 Förutsatt att denna information kommer anges korrekt kan expedierande personal enligt utredningens bedömning bättre lösa vissa av de utmaningar som i dag finns kopplat till behandlingens längd vid t.ex. expedie- ring av antibiotika eller blodförtunnande läkemedel. Effekterna av detta är enligt utredningens bedömning en viktig fråga att utvär- dera efter att registret nationell läkemedelslista i sin gällande om- fattning börjar tillämpas och användas fullt ut (se även avsnitt 15.3.8).
Som tidigare konstaterats har apotekspersonalen inte ensamma ansvar för att patienten har förstått sin behandling. Skyldigheten för hälso- och sjukvårdpersonal i allmänhet att ge information till patienten följer av bl.a. läkemedelslagen (2015:315) och patient- säkerhetslagen (2010:659). Kravet att den som förordnar eller lämnar ut läkemedel särskilt ska iaktta kraven på sakkunnig och omsorgs- full vård samt på upplysning till och samråd med patienten eller företrädare för denne är kanske det tydligaste författningsreglerade uttrycket för detta.235 Att ovanstående också sker är en viktig fråga att beakta vid tillsyn.
2343 kap. 8 § 5 lagen (2018:1212) om nationell läkemedelslista.
235Se 13 kap. 1 § läkemedelslagen (2015:315).
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
Apotekspersonalens kunskaper om de utökade informationsmängderna
Utbildningen till apotekare och receptarie, i de följande benämnda farmaceuter, är reglerad och ger breda kunskaper i såväl utveckling, tillverkning och användning av läkemedel. Utbildningen avslutas med ett halvårs praktik vid öppenvårdsapotek. Sammantaget ger utbildningen farmaceuterna tillgång till en bred arbetsmarknad. En stor andel av farmaceuterna väljer att arbeta på öppenvårdsapotek.
Öppenvårdsapotekens uppdrag har beskrivits närmare i inled- ningen till detta avsnitt. En stor del av farmaceuternas arbete inne- bär att expediera läkemedel mot recept och att ge rådgivning om läkemedelsanvändning. En viktig förutsättning för arbetet vid öppen- vårdsapotek är att den som är ansvarig för verksamheten tillser att upprätthålla personalens kompetens avseende de läkemedel som per- sonalen kommer i kontakt med och att personalen inhämtar kun- skap om nya läkemedel i takt med att de introduceras på marknaden.
Det faller sig naturligt att kompetensutvecklingen, och därmed kunskapen, koncentreras till de läkemedel som personalen oftast kommer i kontakt med. Även om grundutbildningen ger den teo- retiska kunskapen kring alla läkemedel är det sannolikt lättare att upprätthålla djupare kunskap om de läkemedel som ingår i det dag- liga arbetet. I dag innebär det för de flesta som arbetar på öppenvårds- apotek kunskap om läkemedel som förskrivs på recept och som används för egenvård. Det förekommer läkemedel som både förskrivs på recept och som administreras i hälso- och sjukvården i samband med ett vårdtillfälle, t.ex. många av läkemedel mot smärta och folk- sjukdomar.
Om apotekspersonal ges tillgång till information om läkemedels- behandlingar som administreras i hälso- och sjukvården innebär det tillgång till information om läkemedel som apotekspersonal normalt inte kommer i kontakt med, som vanligtvis inte förskrivs på recept och som inte är receptfria för egenvård. Om apotekspersonal ges tillgång till informationen måste det enligt utredningens bedömning förutsättas att också den informationen beaktas vid rådgivning och att informationen tas i beaktande vid den lämplighetsbedömning som ska göras i samband med en expediering. För att kunna göra detta behöver kompetensutvecklingen avseende dessa läkemedel sannolikt utökas och fördjupas.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
Av 13 kap. 1 § första stycket läkemedelslagen (2015:315) framgår att den som förordnar eller lämnar ut läkemedel särskilt ska iaktta kraven på sakkunnig och omsorgsfull vård samt på upplysning till och samråd med patienten eller företrädare för denne. Grunderna till kravet finns i förarbetena till 5 § lagen (1980:11) om tillsyn över hälso- och sjukvårdspersonalen m.fl. Där anges bl.a. följande.
Självfallet får bestämmelsen i första stycket om iakttagande av sakkun- skap i vårdarbetet olika innehåll för olika personalgrupper. Men den slår fast att var och en skall vinnlägga sig om att i vården använda de kunskaper han fått under sin utbildning och den erfarenhet som sam- lats i hans fack. Regeln ger också uttryck för samhällets ansvar för att personalen på alla nivåer har den utbildning som behövs for att fylla kravet på sakkunskap.236
Om apotekspersonalen ges tillgång till utökade uppgifter om alla läkemedel som administreras i hälso- och sjukvården behöver därför kunskapen för att ge rätt råd och att kunna göra relevanta lämplighets- bedömningar säkerställas genom t.ex. utökad kompetensutveckling.
Särskilt om information om behandling med eller användning av medicintekniska produkter
Som beskrevs inledningsvis ser apotekspersonal, som ett led i att kunna bedöma patientens möjlighet att genomföra läkemedels- behandlingen, ibland även ett behov av tillgång till uppgifter om sådana medicintekniska produkter som används för att tillföra läke- medel eller för egenkontroll av behandlingen. I dag är det inte själv- klart att dessa produkter förskrivs på hjälpmedelskort och expedieras vid öppenvårdsapotek. I dessa fall har apotekspersonalen inte möjlig- het att få tillgång till uppgifterna elektroniskt (se 5.3.4 och 6.5.2). Apotekspersonal uppger att ovanstående kan vara särskilt utmanande i samband med e-handel då de inte kan föra en direkt dialog med patienten på samma sätt som vid apoteksdisken. Det föreligger dock ingen skillnad i krav på apoteken eller deras arbete om läkemedel expedieras genom distanshandel eller fysiskt på öppenvårdsapotek. Apoteken får vid distanshandel söka kontakt med patienten eller förskrivaren på andra sätt, t.ex. per telefon. Det kan dock innebära att expedieringen fördröjs.
236Prop. 1978/79:220 Regeringens proposition om samhällets tillsyn över hälso- och sjuk- vårdspersonalen m.fl., s. 44.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
Om patienten får ett akut behov av tillgång till förskrivna medi- cintekniska produkter, och inte befinner sig i sin hemregion, kan patienten inte heller få dessa expedierade på öppenvårdsapotek när det saknas en förskrivning på hjälpmedelskort. Som framgår av kap
5.3.4är inte försäljning av medicintekniska produkter reglerad på samma sätt som för läkemedel och patienten kan därför själv köpa de produkter denne har behov av förutsatt att patienten vet vilka produkter den behöver. När det saknas en nationellt tillgänglig för- skrivning eller på annat sätt åtkomst till relevanta uppgifter och patienten inte heller själv kan redogöra för det exakta behovet, kan dock patienten inte själv köpa motsvarande vara. Öppenvårdsapote- kens skyldighet att så snart som möjligt tillhandahålla förmånsvaror omfattar också bara sådana varor som förskrivits.237
Apotekens tillgång till information som delas genom federerade lösningar
Som angavs inledningsvis har apotekspersonal i dag inte någon laglig möjlighet att ta del av uppgifter direkt ur patientens journal. Patient- datalagen (2008:355), i det följande PDL, reglerar vårdgivares skyldig- het att bl.a. föra patientjournal. Lagen (2022:913) om sammanhållen vård- och omsorgsdokumentation, i det följande SVOD, reglerar i korthet, och i delar som är relevanta för utredningens uppdrag, bl.a. vårdgivares möjlighet att ta del av varandras dokumentation. Den verksamhet som bedrivs vid öppenvårdsapotek omfattas inte av PDL och SVOD.238 Det innebär att öppenvårdsapotek inte kan ta del av information i patientjournaler och därmed inte heller kan ta del av information som delas genom federerade lösningar med stöd av ovan nämnda regelverk.
Som nämnts ovan finns situationer där apotekspersonal, före- trädesvis farmaceuter, kan ha nytta av att få tillgång till fler upp- gifter än i dag. Det rör framför allt uppgifter om vissa läkemedel som administrerats eller överlämnats i hälso- och sjukvården och som utredningen bedömer huvudsakligen bör delas via federerade lösningar. Utifrån vad som angetts ovan skulle tillgången till sådana uppgifter kunna motiveras utifrån öppenvårdsapotekens uppdrag
237Se 2 kap. 6 § 3 lagen (2009:366) om handel med läkemedel.
238Se 1 kap. 3 § patientdatalagen (2008:355) och 1 kap. 1 § lagen (2022:913) om samman- hållen vård- och omsorgsdokumentation.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
både vad gäller lämplighetsbedömningar och rådgivning. Tillgång till sådana uppgifter skulle, som ett komplement till de skyldigheter som åligger övrig hälso- och sjukvårdspersonal, utgöra ett ytter- ligare lager av skydd för att upprätthålla patientsäkerheten.
Som beskrivits i avsnitt 8.4 samt 8.8 bedömer utredningen att federerade lösningar är huvudalternativet när det kommer till att dela uppgifter inom hälso- och sjukvården om inte andra särskilda skäl föreligger. Utredningen gör bedömningen att den identifierade nyttan med apotekspersonalens tillgång till uppgifter om i sjuk- vården administrerade läkemedel inte kan anses utgöra ett sådant särskilt skäl som motiverar den särlösning som det skulle innebära att föra över information om dessa läkemedel till ett register. Detta ändrar därför inte utfallet av den bedömning utredningen redovisat ovan, se avsnitt 8.4, där fördelarna med federerade lösningar för att dela bl.a. denna information överväger.
Utredningen har ovan redovisat att apotekspersonal i viss utsträck- ning kan ha ett behov av tillgång till ytterligare information. Utred- ningen konstaterar att förslaget, att som huvudregel dela uppgifter om läkemedel som administreras eller överlämnas i vården och vissa medicintekniska produkter med stöd av regelverken i PDL och SVOD, innebär att apotekspersonal för närvarande inte kan få del av uppgifterna. Det blir en konsekvens av att uppgifterna fortsatt utgör uppgifter i patientens journal vid delningen av uppgifterna genom en federerad lösning på det sätt som utredningen föreslår. Om utredningens förslag genomförs innebär det dock att de aktuella uppgifterna kommer att kunna samlas och delas. Om det framkommer att apotekspersonalens behov av uppgifter som samlas på detta sätt är tillräckligt stort finns det möjlighet att se över regelverken PDL och SVOD i dessa delar. En sådan utredning har inte kunnat genom- föras inom ramen för utredningens arbete eftersom en sådan ändring av tillgång till journaluppgifter innebär en systemförändring i hur hälso- och sjukvård och apoteksverksamhet för närvarande är upp- delad. Konsekvenserna av en sådan förändring är svåra att överblicka. Det är därför utredningens bedömning att denna fråga i så fall i fram- tiden bör utredas tillsammans med andra frågor som rör apotekens förhållande till PDL och SVOD.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
Apotekspersonalens tillgång till information i register
I avsnitt 8.4.5 och 8.8.3 gör utredningen bedömningen att vissa upp- gifter lämpar sig mindre väl för att uteslutande delas genom federe- rade lösningar. Det handlar om uppgifter som behöver bevaras över lång tid och där få eller inga förändringar sker i behandlingen. Utred- ningen har identifierat tre sådana produktkategorier, information om i hälso- och sjukvården administrerade vaccin, vissa andra läkemedel som har långvarig effekt, t.ex. genterapier, och behandling med vissa medicintekniska produkter. Utredningen bedömer att dessa uppgifter i stället bäst tillgängliggörs genom registerlösningar.
Om ovan nämnda uppgifter förs in i register enligt lagen (2018:1212) om nationell läkemedelslista skulle de kunna göras tillgängliga även för apotekspersonal, förutsatt att det finns till- räcklig grund och stöd för behovet av tillgång till de tillkommande personuppgifterna i apoteksverksamheten. Utredningen har ovan konstaterat att det finns stöd för viss tillgång till uppgifter om läke- medel som administreras i hälso- och sjukvården och sådana medi- cintekniska produkter (förbrukningsartiklar) som har nära samband med läkemedelsbehandling och som förskrivs. Det är också uppgifter som apotekspersonalen uppgett att de skulle ha nytta av i arbete för att bistå patienten med deras läkemedelsanvändning.
Vacciner är förvisso läkemedel som huvudsakligen administreras av hälso- och sjukvårdspersonal och som därmed skulle kunna falla in under vad som anges ovan, men det är inte en läkemedelskategori utredningen uppfattat att apotekspersonal har ett särskilt behov av att känna till. Utredningen bedömer därför att det saknas tillräckliga skäl att medge åtkomst till sådana uppgifter för expedierande apoteks- personal.
Uppgifter om andra läkemedel med långvarig effekt som admini- streras i hälso- och sjukvården och som utredningen föreslår bör samlas i register (se avsnitt 8.4.5 samt kapitel 11) är uppgifter som skulle kunna omfattas av den lämplighetsbedömning som apoteks- personal ska göra vid en expediering av läkemedel. Den uttryckliga skyldigheten i detta avseende i nu gällande föreskrifter avser att patientens samtliga recept i elektronisk form samt information om expedierade läkemedel ska beaktas.239 Utifrån vad utredningen ovan
239Se 8 kap. 11 § Läkemedelsverkets föreskrifter (2021:75) om förordnande och utlämnande av läkemedel och teknisk sprit.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
konstaterar om det ansvar hälso- och sjukvården har i samband med läkemedelsordinationer och förskrivningar, och att det ansvaret inte bör tas över av öppenvårdsapoteken vid expediering, finner utred- ningen att åtkomst till uppgifter om dessa i sjukvården administrerade läkemedel inte kan anses utgöra en förutsättning för att patientsäkra expedieringar ska kunna utföras. Den kontroll och lämplighetsbedöm- ning öppenvårdsapoteken utför i samband med receptexpediering utgör en åtgärd, utöver det ansvar som redan åligger förskrivaren, i syfte att öka patientsäkerheten. Utredningen har gjort bedöm- ningen att de läkemedel med långvarig effekt som bör omfattas av ett register är sådana uppgifter som, genom att de behövs över lång tid, annars riskerar att inte vara åtkomliga för behandlande hälso- och sjukvårdspersonal. Det rör sig alltså inte om något stort antal läkemedel. Utredningen bedömer att det därmed inte föreligger tillräckliga skäl för upprätthållandet av patientsäkerheten att även tillgängliggöra uppgifter om sådana administrerade läkemedel som avses ovan även för expedierande personal på öppenvårdsapotek.
Det finns inget författningsreglerat stöd för att apotekspersonal behöver tillgång till uppgifter om patientens behandling med medi- cintekniska produkter såsom implantat eller invasiva produkter i utövandet av sin yrkesverksamhet. Apotekspersonalen har inte heller uttryckt behov av dessa uppgifter.
Utredningen gör vid beaktande av det ovanstående bedömningen att apotekspersonal inte bör medges direktåtkomst till uppgifter om administrerade vaccin eller andra läkemedel med långvarig effekt eller om tillförda medicintekniska produkter i de register där upp- gifter om dessa förs.
Konsekvenser av utredningens val av lösningar
Utredningens bedömning att vissa uppgifter om patientens behand- ling bör delas genom federerade lösningar i stället för genom en regi- sterlösning innebär att apotekspersonal i nuläget inte kan få tillgång till dessa uppgifter. Utredningen har också bedömt att åtkomst till uppgifter om sådana långtidsverkande administrerade läkemedel, vaccin och tillförda implantat som bör samlas i register i nuläget inte bör vara åtkomliga för apotekspersonal. I förhållande till vilka uppgifter apotekspersonal har tillgång till i nuläget i sin verksamhet
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
bedömer utredningen att detta inte medför någon försämring av pati- entsäkerheten. Utredningen finner att det faktum att andra aktörer får tillgång till mer information innebär att patientsäkerheten sanno- likt ändå förbättras. Nedan beskriver utredningen detta närmare.
Genom utredningens bedömningar i 8.3 och 8.6 kommer patien- ten att kunna få bättre tillgång till egen information om både de läke- medel som administreras av hälso- och sjukvårdspersonal och vissa medicintekniska produkter. Med patientens tillgång till fler uppgifter kommer förhoppningsvis dennes frågor kring behandlingen i apo- tekssituationen att minska. Patienten får större makt över sina egna uppgifter.
Patienter får ibland i samband ett vårdbesök eller vid utskrivning från ett vårdtillfälle en utskriven lista på aktuella läkemedelsbehand- lingar. En sådan lista är inte nödvändigtvis komplett och är statisk, den förändras inte förrän en ny lista skrivs ut. Den omfattar inte heller information om expedierade läkemedel. Utredningens förslag att fler uppgifter om läkemedelsbehandlingar ska delas mellan vård- givare och att denna information ska göras tillgänglig digitalt genom en ny nationell infrastruktur även för patienten bör enligt utred- ningen kunna medföra att patienten oftare kommer ha tillgång till en samlad, uppdaterad, digital lista över sina behandlingar. En för- utsättning är dock att man beaktar vad utredningen anför i 8.10 om hur uppgifter presenteras för patienten. En sådan lista bör också knytas till vilka läkemedel som faktiskt lämnats ut. Som utredningen konstaterat i 8.2 har vi i Sverige en hög användning i befolkningen av digitala vårdtjänster, även i de äldsta åldersgrupperna, även om användningen ännu inte når alla. Den digitala mognaden ökar också för varje år som går och allt fler personer ansluter till digitala tjänster. Hur man kan hantera det utanförskap som ändå finns framgår t.ex. av betänkandet Digital myndighetspost.240
Patienten har med stöd av tillgången till ytterligare information möjlighet att diskutera denna med en farmaceut om det är så att patienten behöver hjälp med att tolka sin sammantagna behandling i samband med en expediering på öppenvårdsapotek. Det är inte samma sak som att expedierande personal har direktåtkomst till uppgifterna, men det är en förbättring jämfört med hur situationen är i dag. Tanken är heller inte ny utan anfördes bl.a. av regeringen när patientdatalagen infördes. Direktåtkomst skulle också kunna
240SOU 2024:47 Digital myndighetspost, s. 119.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
vara ett sätt att låta journalen följa patienten genom att denne då kan låta en vårdgivare som han eller hon besöker för första gången, ta del av uppgifterna.241
Utredningen kan också konstatera att det i första hand är den som ska ordinera en behandling som har ansvar för att göra en bedömning av huruvida en läkemedelsbehandling som påbörjas är förenlig med annan pågående eller tidigare avslutad eller planerad behandling. Det är också ordinatören som har ansvar för och har möjlighet att göra någonting åt eventuella felaktigheter i samband med ordinationen. Genom utredningens bedömning att informa- tion om fler läkemedelsbehandlingar bör delas mellan vårdgivare ökar förskrivarnas möjligheter att göra sådana bedömningar.
Utredningens bedömning
Som framgår ovan uppstår ibland situationer då personal på öppen- vårdsapotek kan ha nytta av att få tillgång till uppgifter om fler läke- medelsbehandlingar och medicintekniska produkter än om de som förskrivs på recept eller hjälpmedelskort. Dessa behov är framför allt kopplade till bedömningen om en expediering är lämplig, t.ex. ur ett interaktionsperspektiv, och för att säkerställa att patienten för- står sin behandling och kan använda sina läkemedel på rätt sätt. Det finns också behov av ytterligare information kring medicintekniska produkter av betydelse för läkemedelsbehandling och som förskrivs på andra sätt än på hjälpmedelskort. Det kan inte uteslutas att till- gång till, och användningen av, sådan information som beskrivs ovan ryms inom öppenvårdsapotekens uppdrag och att tillgång till denna skulle stärka patientsäkerheten.
Kravet på att informera patienten om dennes läkemedelsbehand- ling åligger både förskrivare och farmaceuter. Utredningen konsta- terar att det stora ansvar att informera patienten om aktuell behand- ling som vilar på förskrivaren, t.ex. hur läkemedelsbehandlingen ska fortlöpa efter ett vårdtillfälle, måste vara utgångspunkten när infor- mation ska tillgängliggöras i läkemedelsprocessen. Förskrivaren har, genom tillgång till hela patientjournalen, en annan helhetsbild av patientens hälsotillstånd än vad farmaceuten har. Många av de interaktioner som kan identifieras genom en mer heltäckande sam-
241Prop. 2007/08:126 Patientdatalag m.m., s. 158.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
manställning av en patients pågående läkemedelsbehandling kräver också att de hanteras av den ansvariga förskrivaren. Utredningen menar att det vid beaktande av detta är rimligt att i första hand söka lösa förskrivarens tillgång till information och ge förskrivaren de ytterligare verktyg som krävs för att minimera antalet fel. Förskri- varen å sin sida måste säkerställa att dessa verktyg också används.
Som utredningen redogjort för är förstahandsalternativet för ett utökat tillgängliggörande av information federerade lösningar med stöd av SVOD. Det innebär att patienter och hälso- och sjukvårds- personal kan ges tillgång till ytterligare information om patientens behandling genom att relevanta delar i lagstiftningen om samman- hållen vård- och omsorgsdokumentation blir tvingande. Att i större utsträckning, än med nuvarande lagstiftning, möta patientens och hälso- och sjukvårdspersonalens behov av de aktuella uppgifterna bör som angetts ovan få effekter som gör att även apoteksperso- nalens möjligheter att uppfylla sitt uppdrag förbättras. Utredningen bedömer att detta behöver följas upp och utvärderas och om inte de positiva effekterna uppstår bör även andra lösningar för uppgiftsdel- ning övervägas. Om det i framtiden skulle visa sig att de åtgärder som utredningen föreslår inte räcker till och att öppenvårdsapotek behöver få tillgång till fler uppgifter som delas federerat behöver patientdata- lagen och SVOD ses över. Det kräver ett omfattande utredningsarbete och förutsätter också att den nuvarande uppdelningen mellan hälso- och sjukvårdsverksamhet i hälso- och sjukvården och på öppenvårds- apotek ses över.
Att i nuläget i stället skapa en registerlösning för samtliga patient- uppgifter som utredningen haft att utreda, med de nackdelar detta innebär i jämförelse med federerade lösningar för elektronisk data- delning, för att fylla de behov av ytterligare uppgifter i vissa situatio- ner som identifierats för apotekspersonal, framstår vid en samlad bedömning enligt utredningen inte som motiverat. Utredningen kon- staterar att det förvisso skulle finnas vissa nyttor med att tillgänglig- göra ytterligare information om sådana läkemedel som administreras i hälso- och sjukvården och vissa medicintekniska produkter för per- sonal på öppenvårdsapotek. Dessa nyttor bedöms dock inte vara tillräckliga för att det ska vara proportionerligt att föra in uppgifter om alla i hälso- och sjukvården administrerade läkemedel och om medicintekniska produkter i ett register för primäranvändning.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
Utredningen föreslår dock att vissa ytterligare uppgifter bör samlas i register. De största nyttorna med registret nationell läkemedelslista för personal på öppenvårdsapotek bedömer utredningen är hänför- liga till ökad möjlighet att få tillgång till uppdaterade och korrekta förskrivningar. Den fulla effekten avseende detta kommer att uppnås först när alla aktörer fullt ut är anslutna till registret och den beslu- tade lagen träder i kraft i samtliga delar. Det är utredningens bedöm- ning att man därmed först bör invänta det införande som nu pågår och att effekterna av införandet för öppenvårdsapotekens verksam- het utvärderas, innan man går vidare med och utreder om de ytter- ligare uppgifter som utredningen föreslår att register enligt lagen (2018:1212) om nationell läkemedelslista ska innehålla bör delas också med apoteken för att ytterligare förstärka patientsäkerheten. Utredningen finner därför att det ännu är för tidigt att konstatera att de tillkommande uppgifterna är nödvändiga för att apoteken ska kunna utföra sin verksamhet på ett patientsäkert sätt och att deras behov av uppgifterna i sin verksamhet därigenom i nuläget inte kan anses överväga det ytterligare intrång i den personliga integriteten som ett sådant tillgängliggörande skulle innebära.
8.12Utredningar av betydelse för utredningens förslag och förordningen om det europeiska hälsodataområdet
Utredningen konstaterade redan i avsnitt 4.6 att det pågår och nyligen har genomförts flera olika utredningar och initiativ som har betydelse för denna utrednings uppdrag. I detta avsnitt redogörs närmare för de tidigare lämnade förslag som har betydelse för nationell interopera- bilitet och datadelning i de delar som har mest bäring för de bedöm- ningar och förslag som vi gör avseende delning av de uppgifter som omfattas av vår utrednings uppdrag. Sist i avsnittet anges kortfattat vad förordningen (EU) 2025/327 om det europeiska hälsodata- området innehåller med särskild relevans för överväganden om inter- operabilitet. I avsnitt 8.13 redovisar utredningen sina bedömningar avseende hur dessa tidigare lagda förslag påverkar utredningens över- väganden om en federerad lösning för tillgängliggörande av informa- tion om en patients läkemedelsbehandlingar och användning av vissa medicintekniska produkter.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
8.12.1Utredningen om interoperabilitet vid datadelning
I december 2023 lämnade Utredningen om interoperabilitet vid dataanvändning betänkandet SOU 2023:96, En reform för data- delning. I betänkandet konstateras att den offentliga förvaltningens datadelning i dag sker utifrån så olika förutsättningar att det krävs en tydlig och sammanhållen styrning i form av ett nytt regelverk för att uppnå interoperabilitet. Den tvingande styrning som finns i dagsläget är ytterst begränsad och sker primärt sektorsvis och inte gemensamt för hela den offentliga förvaltningen. I betänkandet görs bedömningen att det krävs att grundläggande förutsättningar för datadelning utgår från ett tydligt och sammanhängande regelverk om interoperabilitet som gäller för hela offentliga förvaltningen. En- ligt betänkandet är behovet av en sammanhållen och likartad styr- ning, utifrån den analys som görs i betänkandet, särskilt stort inom och mellan kommuner och regioner.242
I betänkandet föreslås att styrning för att uppnå interoperabilitet vid datadelning ska samlas i en ny lag benämnd lagen om den offent- liga förvaltningens interoperabilitet. Den föreslagna lagen ska tilläm- pas vid den offentliga förvaltningens datadelning. I den offentliga förvaltningen ingår statliga myndigheter, kommuner, regioner, kom- munalförbund och kommunala bolag och det är dessa som ska tillämpa kraven i lagen.
För att få den nytta och effekt av datadelning som eftersträvas med interoperabilitet samt för att få gynnsamma effekter på digi- taliseringen behöver enligt betänkandet hela den offentliga förvalt- ningen gå i samma riktning. I betänkandet anges vidare att bedöm- ningen är att interoperabilitet vid datadelning inom sektorer eller områden med olika förvaltningsregleringar bör styras genom lag- stiftning för respektive sektor eller område. Enligt betänkandet finns det behov av fortsatt utredning av förutsättningarna för att införa styrning av interoperabilitet inom sektorer eller områden motsvarande Utredningen om infrastruktur för hälsodata som natio- nellt intresse (S 2022:10), som pågick när det aktuella betänkandet lämnades.243,244
242SOU 2023:96 En reform för datadelning, s. 15 f.
243A.a., s. 20.
244Den nämnda utredningen har därefter lämnat sitt betänkande, SOU 2024:33 Delad hälsodata – dubbel nytta.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
I betänkandet föreslås att det ska vara ett politiskt mål att offentlig förvaltnings mest angelägna datadelning ska vara fullt interoperabel senast år 2030.
Förslaget till lag om den offentliga förvaltningens interoperabilitet
I betänkandet SOU 2023:96 föreslås som anges ovan en ny lag om den offentliga förvaltningens interoperabilitet. I lagen anges defini- tioner av centrala begrepp rörande interoperabilitet.
Data definieras som information i digitalt format oberoende av medium. Med datadelning avses i lagen att tillhandahålla data eller att ta del av data.
Interoperabilitet vid datadelning är enligt lagens definition för- mågan att tillhandahålla, eller ta del av, data genom informations- system som interagerar med varandra. Med begreppet ’förmågan’ i definitionen avses förmågan hos de myndigheter och andra aktörer som ingår i offentlig förvaltning. Uttrycket omfattar samtliga lager av interoperabilitet, dvs. tekniska, semantiska, rättsliga och organi- satoriska aspekter. Delning av data sker genom informationssystem (it-system) som interagerar med varandra. Definitionen omfattar datadelning mellan myndigheter eller andra aktörer inom offentlig förvaltning och när offentlig förvaltning tillhandahåller data till en privat aktör.245
Interoperabilitetslösning definieras som en återanvändbar resurs som avser rättsliga, organisatoriska, semantiska eller tekniska krav, såsom konceptuella ramverk, riktlinjer, referensarkitekturer, tekniska specifikationer, standarder, tjänster och applikationer, samt doku- menterade tekniska komponenter, såsom källkod, som syftar till att uppnå interoperabilitet vid datadelning. Sådana lösningar är till exem- pel maskinläsbara format, såsom JSON, och olika gränssnitt, t.ex. ett API. De tjänster som avses kan exempelvis vara olika former av s.k. växeltjänster, dvs. tjänster som växlar från ett format till ett annat. En tjänst kan även vara ett API.246
Med nationell interoperabilitetslösning avses i lagförslaget en inter- operabilitetslösning som är gemensam för den offentliga förvaltningen. Lösningen används av myndigheter och andra aktörer i offentlig
245A.a., s. 298.
246A.a., s. 298.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
förvaltning, således även mellan sektorer samt områden med olika förvaltningsregleringar och bör utgå från behoven hos förvaltningen. Styrningen inom olika sektorer behöver utgå från de nationella inter- operabilitetslösningarna och kan vara mer detaljerad.247
Enligt förslagen i betänkandet ska den offentliga förvaltningen använda nationella interoperabilitetslösningar vid datadelning enligt föreskrifter som har meddelats med stöd av lagen. Undantag från detta krav görs när det är olämpligt med hänsyn till krav på informa- tionssäkerhet eller krav på skydd av Sveriges säkerhet.
Det föreslås ett bemyndigande i lagen som avser ge möjlighet att meddela föreskrifter om vilka nationella interoperabilitetslösningar som ska användas av offentlig förvaltning vid datadelning. Bemyn- digandet är brett och kan exempelvis avse både att bestämma att vissa gränssnitt, såsom API:er, ska användas samt att en viss API- profil ska användas, till exempel REST API-profil.248
Det föreslås att Myndigheten för digital förvaltning, nedan Digg, ska ansvara för att ta fram interoperabilitetslösningar och att före- skriva om dem. Digg kan också enligt betänkandet välja att rekommen- dera nationella interoperabilitetslösningar, utan att de blir tvingande att använda. Med bemyndigandet till Digg avses inte att myndigheten ges en möjlighet att meddela föreskrifter om att en myndighet eller annan aktör inom offentlig förvaltning ska ansluta sig till en viss tjänst. Enligt betänkandet ska föreskrifter om nationella interopera- bilitetslösningar främst avse tekniska och semantiska aspekter av datadelning.249
Privata aktörer som tar del av data eller tillhandahåller data träffas inte av kraven på att använda interoperabilitetslösningar enligt för- slaget, men de kan vara mottagare av data på så vis att de tar del av data som tillhandahålls av myndigheter eller andra aktörer inom offentlig förvaltning. Därtill kommer att offentlig förvaltning vid upphandlingar, som innebär att tjänster eller produkter upphandlas från privata aktörer för att utföra uppgifter för deras räkning som inkluderar datadelning, kommer att behöva ställa krav på användande av de nationella interoperabilitetslösningar som Digg föreskrivit om, t.ex. vissa gränssnitt eller format. I betänkandet görs bedömningen att privata aktörers möjlighet att nyttja data kommer att öka i och
247A.a., s. 299.
248A.a.,s. 300.
249A.a.,s. 229.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
med att myndigheter kommer att tillhandahålla data på det sätt som följer av bestämmelserna.
Användning av nationella interoperabilitetslösningar inom den offentliga förvaltningen kommer således att förenkla för alla mot- tagare att veta vilka utgångspunkter som gäller för den data de tar del av.250
Sektorsspecifik styrning enligt Utredningen om interoperabilitet vid datadelning
I betänkandet SOU 2023:96 anges att för att på sikt uppnå en högre grad av interoperabilitet vid datadelning inom och med offentlig förvaltning krävs att den förvaltningsgemensamma styrningen kom- pletteras med styrning inom sektorer.
Den förvaltningsgemensamma styrningen kommer att avse de grundläggande förutsättningarna som krävs för att åstadkomma interoperabilitet inom hela den offentliga förvaltningen. Det kan emellertid också krävas en mer detaljerad styrning på sektorsspeci- fik nivå, som exempelvis kan avse särskilda data som huvudsakligen utbyts inom sektorer. I betänkande konstateras vidare att det är mest lämpligt att åtgärder vidtas så nära de mest berörda myndig- heterna och andra aktörer som möjligt. Styrningen inom sektorer kommer i de flesta fall att behöva vara mer detaljerad än på förvalt- ningsgemensam nivå för att få effekt. Interoperabilitet inom sektorer bör vidare enligt betänkandet lämpligen styras av statliga myndig- heter som redan har någon form av ansvar inom respektive sektor. Det anges också i betänkandet att den lagstiftning inom sektorer som redan finns bör användas som grund för styrning av interopera- bilitet inom respektive sektor. Om utrymme för ytterligare styrning saknas bör det vidtas lagstiftningsåtgärder som ger myndigheterna möjlighet till styrning. I betänkandet konstateras att det finns behov av fortsatta utredningar om införande av sektorsspecifik interopera- bilitetsstyrning.251
Enligt betänkandet finns det behov av att förstärka möjligheten till interoperabilitetsstyrning med möjligheten att meddela bindande föreskrifter om sektorsspecifika interoperabilitetslösningar. Det kan enligt betänkandet förenklat uttryckas som att det som behöver vara
250A.a.,s. 221.
251A.a.,s. 246 f.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
gemensamt på förvaltningsgemensam nivå ska styras med nationella interoperabilitetslösningar, medan det som enbart behöver reglas för en sektor bör regleras sektorsvis. Genom ett delat ansvar mellan den förvaltningsgemensamma nivån och den sektorsspecifika nivån säkerställs en mer effektiv styrning.252
8.12.2Utredningen om infrastruktur för hälsodata som nationellt intresse
I april 2024 lämnade Utredningen om infrastruktur för hälsodata som nationellt intresse sitt betänkande SOU 2024:33, Delad hälso- data – dubbel nytta. Utredningen hade i uppdrag bland annat att lämna förslag på ändamålsenliga och samhällsekonomiskt effektiva åtgärder för att åstadkomma en bättre och säkrare informations- försörjning av patienters hälsodata. Syftet med detta är att öka pati- entsäkerheten, skapa förutsättningar för en mer patientcentrerad vård och minska administrativt dubbelarbete för hälso- och sjukvårds- personalen. Utredningen utgjorde en sådan sektorsspecifik utredning avseende interoperabilitet som efterfrågas i SOU 2023:96, se av- snitt 8.12.1.
I betänkandet SOU 2024:33 föreslås följande fem huvudsakliga åtgärder.253
1.Ett statligt åtagande för hälso- och sjukvårdens interoperabilitet. I åtagandet ingår att stödja men också att styra vårdgivares data- delning. I betänkandet föreslås att E-hälsomyndigheten ska ta fram interoperabilitetslösningar för hälso- och sjukvården och arbeta för hälso- och sjukvårdens interoperabilitet.
2.Arbetet med hälso- och sjukvårdens interoperabilitet behöver utgå från vårdens och patienternas behov och baseras på samarbete och kunskap om vården. E-hälsomyndigheten ska stödja vård- givare att använda framtagna interoperabilitetslösningar för hälso- och sjukvården. Syftet är att på frivillig basis främja en effektiv och patientsäker vård.
252A.a.,s. 247.
253SOU 2024:33 Delad hälsodata – dubbel nytta, s. 221.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
3.När incitament och frivillighet inte räcker behöver det finnas ett statligt mandat som kan styra mot gemensamma mål och standar- der. I vissa fall räcker det inte med att vårdgivarna fritt kan välja att använda interoperabilitetslösningarna. I betänkandet föreslås därför att det ska bli möjligt att ställa krav på vårdgivare att i vissa fall använda interoperabilitetslösningar vid frivillig delning av patientuppgifter genom sammanhållen vård- och omsorgsdoku- mentation.
4.När avsaknaden av viktiga patientuppgifter riskerar patientsäker- heten behöver det finnas ett statligt mandat som säkerställer att uppgifterna kan användas där, och när, de behövs. I betänkandet föreslås att vårdgivare i vissa fall måste tillgängliggöra vissa upp- gifter för andra vårdgivare med stöd av interoperabilitetslösningar. Kravet styr både vilka uppgifter som måste delas och hur det ska göras.
5.De statliga myndigheterna ska försöka förenkla för vårdgivare att fullgöra sina skyldigheter genom att beakta de krav på inter- operabilitet som ställs på vårdgivare. Statliga myndigheteter bör utgå från de interoperabilitetslösningar som tagits fram för vården när de ställer krav på hur vårdgivare ska fullgöra sin uppgiftsskyl- dighet för att förenkla vårdgivarnas inrapportering och minska den administrativa bördan. Förslaget syftar enligt betänkandet till att underlätta för vårdgivare att fullgöra sina uppgiftsskyldig- heter gentemot de statliga myndigheterna.254
Författningsförslag i SOU 2024:33 med särskild betydelse för vår utredning
I betänkandet SOU 2024:33 avses med en interoperabilitetslösning för hälso- och sjukvården en återanvändbar resurs som beskriver rättsliga, organisatoriska, semantiska eller tekniska förutsättningar, såsom konceptuella ramverk, riktlinjer, referensarkitektur, specifi- kationer, standarder, vissa tjänster och applikationer, samt doku- menterade tekniska komponenter, såsom källkod, som syftar till förmågan att ge eller få tillgång till personuppgifter hos andra vård- givare genom elektroniskt system. En definition med denna lydelse
254A.a.,s. 332.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
föreslås i betänkandet tas in i lagen (2022:913) om sammanhållen vård- och omsorgsdokumentation.255
Enligt betänkandet utgår definitionen från, och överensstämmer i princip med, den definition som föreslås i lagen om den offentliga förvaltningens interoperabilitet (se avsnitt 8.12.1) och EU:s inter- operabilitetsförordning256. Det handlar om beskrivningar av olika förutsättningar som informationssystem ska följa för att kunna inter- agera med varandra och på så sätt skapa interoperabilitet. Det är således enligt betänkandet inte fråga om några nya rättsliga eller organisatoriska krav. Exempel som tas upp i betänkandet på sådana förutsättningar är följsamhet till standarder som SnomedCT eller FHIR, eller följsamhet till utpekade applikationsgränssnitt (API). Det innefattar också beskrivningar av befintliga rättsliga och orga- nisatoriska förutsättningar, exempelvis beskrivning av krav på sam- tycke eller den organisatoriska tillhörighet som ställs som krav för att få ta del av en uppgift.257
Vad gäller begreppet ’tjänst’ i definitionen anges i betänkandet att en sådan kan tillhandahållas som ett API som beskriver vilken information som behöver kunna hanteras av ett system som måste använda API:et, och vilket format informationen behöver vara i. Däremot avses inte det som ofta kallas e-tjänster, det vill säga appli- kationer med ett användargränssnitt, exempelvis 1177.se eller nationell patientöversikt, NPÖ. Det anges i betänkandet att denna gräns- dragning är viktig eftersom den innebär att det bemyndigande att föreskriva om användning av vissa interoperabilitetslösningar som också föreslås i betänkandet, inte kan avse att föreskriva om en skyl- dighet för vårdgivare att ansluta sig till sådana tjänster. Däremot kommer det att finnas generella interoperabilitetskrav som måste vara uppfyllda. Dessa krav kommer att framgå av de interoperabilitets- lösningar som Digg och E-hälsomyndigheten kommer att föreskriva om enligt förslagen i SOU 2023:96 respektive SOU 2024:33.258
I betänkandet SOU 2024:33 föreslås också en ny paragraf i lagen om sammanhållen vård- och omsorgsdokumentation som ålägger vårdgivare att ge andra vårdgivare tillgång, genom direktåtkomst
255A.a., s. 32, förslag till ändring av 1 kap. 1 § lagen (2022:913) om sammanhållen vård- och omsorgsdokumentation.
256Europaparlamentets och rådets förordning (EU) 2024/903 av den 13 mars 2024 om åt- gärder för en hög nivå av interoperabilitet inom den offentliga sektorn i hela unionen (för- ordningen om ett interoperabelt Europa).
257A.a., s. 379 f.
258A.a.,s. 380.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
eller annat elektroniskt utlämnande, till vissa uppgifter om en patient som behövs för en effektiv och säker vård. I paragrafen anges under vilka förutsättningar sådan tillgång får ges och vilka personuppgifter som avses. I paragrafen ges också regeringen eller den myndighet som regeringen bestämmer bemyndigande att meddela föreskrifter om hur uppgiftsskyldigheten ska fullgöras.259
I betänkandet anges att det är olämpligt att i lag ytterligare pre- cisera vilka uppgifter om en patient som uppgiftsskyldigheten om- fattar än att det där anges att det är uppgifter som behövs för en effektiv och säker vård av en patient. Som exempel på sådana upp- gifter anges uppmärksamhetsinformation, nationella patientöver- sikter, gränsöverskridande patientöversikter inom EES eller sådana uppgifter som ska delas enligt EU-förordningen om det europeiska hälsodataområdet.260,261 Enligt betänkandet vill man inte heller föreslå att det i lag ska begränsas vilka vårdgivare som ska träffas av uppgifts- skyldigheten i det enskilda fallet. Det är något som enligt förslaget ska bestämmas i samverkan med sektorns aktörer och utgå från hälso- och sjukvårdens behov. Med anledning av detta föreslås ett bemyn- digande till regeringen eller den myndighet regeringen bestämmer att meddela föreskrifter om hur uppgiftsskyldigheten ska fullgöras. Bemyndigandet avser att innebära en rätt att föreskriva både om vilka personuppgifter om patienter som ska göras tillgängliga för andra vårdgivare och om hur det ska ske, exempelvis om patient- uppgifterna ska tillgängliggöras enligt en specifikation baserat på semantiska och tekniska standarder. Eftersom sådana föreskrifter innebär åligganden för de regioner, kommuner, juridiska personer och enskilda näringsidkare som bedriver hälso- och sjukvård är be- myndigandet placerat i lag enligt förslaget. Kraven föreslås inte gälla för omsorgsgivare.262
Det föreslås även en ny bestämmelse i lagen om sammanhållen vård- och omsorgsdokumentation som ålägger vårdgivare att använda föreskrivna interoperabilitetslösningar för hälso- och sjukvården även vid frivillig delning av uppgifter om en patient i enlighet med lagens bestämmelser. Regeringen eller den myndighet regeringen
259A.a., s. 34, förslag till en ny 2 kap. 1 a § lagen (2022:913) om sammanhållen vård- och omsorgsdokumentation.
260Förordningen (EU) om det europeiska hälsodataområdet.
261A.a.,s. 381.
262A.a.,s. 381 f.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
bestämmer bemyndigas att meddela föreskrifter om sådana inter- operabilitetslösningar.263
Det föreslås också i betänkandet nya bestämmelser i patientdata- förordningen (2008:360) där E-hälsomyndigheten ges bemyndigande att meddela föreskrifter. I förslaget anges att Myndigheten för digital förvaltning och Socialstyrelsen ska ges tillfälle att yttra sig innan sådana föreskrifter beslutas.264
Vidare föreslås att det i E-hälsomyndighetens instruktion ska anges att myndigheten ska ansvara för att ta fram och förvalta inter- operabilitetslösningar för hälso- och sjukvården, att myndigheten ska samverka med vårdgivare, statliga myndigheter och andra rele- vanta aktörer när sådana interoperabilitetslösningar tas fram samt att myndigheten ska stödja hälso- och sjukvårdens arbete med att uppnå interoperabilitet.
Det föreslås också bestämmelser i E-hälsomyndighetens instruk- tion som fastslår att det inom myndigheten ska finnas ett rådgivande organ som benämns Rådet för hälso- och sjukvårdens interopera- bilitet. Rådet ska samverka i arbetet med en nationell strategisk plan för den digitala informationsförsörjningen inom hälso- och sjuk- vården och bidra till utvecklingen av den nationella digitala infrastruk- turen inom hälso- och sjukvården genom att exempelvis stödja tillämp- ningen av interoperabilitetslösningar. Rådet ska även medverka till ökad samordning och samarbete mellan berörda aktörer i frågor om den nationella digitala infrastrukturen. Vad gäller rådets samman- sättning föreslås i betänkandet att rådet ska bestå av en ordförande och minst åtta andra ledamöter som utses av E-hälsomyndigheten. Av ledamöterna ska minst hälften företräda vårdgivarna, minst en företräda Socialstyrelsen och minst en företräda Myndigheten för digital förvaltning.265
Vidare föreslås i betänkandet att det ska åligga Socialstyrelsen att stödja hälso- och sjukvårdens arbete med att uppnå interoperabilitet genom att ett tillägg avseende detta görs i förordningen (2015:284) med instruktion för Socialstyrelsen. Socialstyrelsen föreslås även åläggas att delta i arbetet med att ta fram interoperabilitetslösningar för hälso- och sjukvården genom att skapa och tillhandahålla ända-
263A.a., s. 34 f., förslag till ny 2 kap. 1 b § lagen om sammanhållen vård- och omsorgsdoku- mentation.
264A.a., s. 43 f., förslag till nya 3 a och 3 b §§ patientdataförordningen (2008:360).
265A.a., s. 46 f., förslag till ändring av 2 §, samt nya 7 c och 7 d §§ i förordningen (2013:1031) med instruktion för E-hälsomyndigheten.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
målsenliga informatiska beskrivningar samt standarder för hälsodata särskilt innefattande begreppsutredning, juridisk utredning och modellering.266
8.12.3Uppdrag att möjliggöra en nationell digital infrastruktur för hälsodata
Den 22 januari 2024 gav regeringen ett uppdrag att möjliggöra en nationell digital infrastruktur för hälsodata.267 En utredare får där i uppdrag att analysera och föreslå åtgärder som möjliggör en nationell digital infrastruktur för hela hälso- och sjukvården. I uppdrags- beslutet anges bl.a. att hälsodata blir tillgängliga i hela vårdkedjan för både hälso- och sjukvård och tandvård. Syftet med uppdraget är att öka kvaliteten i vården och förbättra patientsäkerheten samt att den administrativa bördan för vårdpersonalen ska minska. Utredaren ska även analysera och ta fram förslag kopplade till EU-förordningen om det europeiska hälsodataområdet. Syftet med uppdraget i den delen är att påbörja arbetet med att förbereda införandet av EHDS.
I uppdragets direktiv konstateras att regeringen har påbörjat arbetet med att införa en nationell digital infrastruktur. E-hälsomyndig- heten har som ett led i det arbetet fått ett uppdrag att ta fram ett förslag till färdplan för genomförandet av en nationell digital infra- struktur för hälso- och sjukvården (S2023/02108). I uppdraget ingår att analysera och presentera vilka förmågor som staten behöver eta- blera för att bygga upp en väl fungerande nationell digital infrastruktur för hälso- och sjukvården.
Av direktivet framgår också att regeringen i december 2023 be- slutade att tillsätta en samordnare för en nationell digital infrastruktur i hälso- och sjukvården (S 2023:14).268 Samordnaren ska bistå reger- ingen i arbetet med att införa en nationell digital infrastruktur för hälso- och sjukvården med målet att hälsodata ska bli tillgängliga i hela vårdkedjan för all vård, såväl kommunal som regional, och för tandvård, oavsett huvudman. Arbetet ska bedrivas genom att infor- mera om regeringens arbete med nationell digital infrastruktur och föra dialog med berörda aktörer.
266A.a., s. 49, förslag till ändring av 4 § i förordningen (2015:284) med instruktion för Socialstyrelsen.
267Uppdrag att möjliggöra en nationell digital infrastruktur för hälsodata, S 2024:A.
268Dir. 2023:177, Samordnare för en nationell digital infrastruktur i hälso- och sjukvården.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
Det konstateras i uppdragsdirektivet att det även pågår intensivt arbete på EU-nivå vad gäller delning av hälsodata. EU-förordningen om det europeiska hälsodataområdet269 ställer bl.a. krav på att varje medlemsstat ska dela patientuppgifter när det gäller primäranvänd- ning av hälsodata, dvs. inom hälso- och sjukvården. Vidare ska varje medlemsstat säkerställa att hälso- och sjukvårdspersonal har tillgång till vissa prioriterade kategorier av hälsodata för patienter som de be- handlar, oavsett var patienten är bosatt. Tillgången ska säkerställas genom tillgångstjänster för hälso- och sjukvårdspersonal. Även patien- ter ska ha tillgång till sina egna patientuppgifter via s.k. patientpor- taler. Varje medlemsstat ska dessutom utse en nationell kontaktpunkt som bl.a. alla vårdgivare ska vara anslutna till. Enligt EU-förord- ningen om det europeiska hälsodataområdet ska kravet på delning bli obligatoriskt för medlemsländerna.
Sammanfattningsvis pågår enligt uppdragsdirektivet ett omfattande EU-gemensamt arbete och ett arbete på nationell nivå för att vidare- utveckla den nationella infrastrukturen inom hälso- och sjukvårdens och tandvårdens område. Därför behöver de rättsliga förutsätt- ningarna för behandling av personuppgifter i den nationella digitala infrastrukturen analyseras.270 Uppdraget ska slutredovisas senast den 1 april 2026.
8.12.4EU-förordningen om det europeiska hälsodataområdet
Genom förordningen (EU) 2025/327 om det europeiska hälsodata- området ställs bl.a. krav på att elektroniska hälsodokumentations- system ska innehålla en europeisk programvarukomponent för inter- operabilitet och en europeisk programvarukomponent för loggning (de harmoniserade programvarukomponenterna för elektroniska hälsodokumentationssystem).271 Kraven gäller för behandling av de prioriterade kategorier av elektroniska hälsodata med person- uppgifter för primäranvändning som anges i EU-förordningens artikel 14.
Enligt EU-förordningen ska medlemsstaterna, när elektroniska hälsodata behandlas för tillhandahållande av hälso- och sjukvård, säkerställa att vårdgivare registrerar relevanta elektroniska hälsodata
269Förordningen (EU) 2025/327 om det europeiska hälsodataområdet.
270Direktiv för uppdraget, dnr S2024/00100.
271Artikel 25 förordningen (EU) 2025/327 om det europeiska hälsodataområdet.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
med personuppgifter som helt eller delvis omfattas av åtminstone de prioriterade kategorier av elektroniska hälsodata med person- uppgifter som avses i artikel 14 i elektroniskt format i ett elektro- niskt hälsodokumentationssystem. När vårdgivare behandlar data i elektroniskt format ska de säkerställa att elektroniska hälsodata med personuppgifter för de fysiska personer som står under deras behandling uppdateras med information om hälso- och sjukvården. När elektroniska hälsodata med personuppgifter registreras eller uppdateras ska elektronisk hälsodokumentation identifiera den hälso- och sjukvårdspersonal och den vårdgivare som utförde en sådan registrering eller uppdatering, samt den tidpunkt då registreringen eller uppdateringen skedde. Medlemsstaterna får kräva att även andra aspekter av dataregistreringen ska registreras.272
Senast den 26 mars 2027 ska kommissionen genom genomförande- akter fastställa de tekniska specifikationerna för de prioriterade kate- gorier av elektroniska hälsodata med personuppgifter som avses i artikel 14.1 och ange det europeiska format för utbyte av elektronisk hälsodokumentation som ska användas. Ett sådant format ska vara allmänt använt och maskinläsbart och tillåta överföring av elektro- niska hälsodata med personuppgifter mellan olika programvaru- applikationer, anordningar och vårdgivare.273
8.13Utredningens överväganden om federerade lösningar i förhållande till tidigare lämnade förslag om datadelning och andra pågående initiativ
Vår utredning har bl.a i uppdrag att se över möjligheterna att utveckla registret nationell läkemedelslista genom att fler uppgifter läggs till, att regleringen blir tydligare, mer förutsägbar och flexibel. Utred- ningen har i arbetet bl.a. beaktat att det finns en av staten uttalad ambition att förbättra den hittills bristande interoperabiliteten i den offentliga förvaltningen som helhet, såväl som inom hälso- och sjuk- vårdssektorn. Även EU-förordningen om det europeiska hälsodata- området nödvändiggör att interoperabilitetslösningar finns och är
272Artikel 13.1, 13.2 och 13.4 förordningen (EU) om det europeiska hälsodataområdet.
273Artikel 15.1 förordningen (EU) om det europeiska hälsodataområdet.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
implementerade i hälso- och sjukvårdssektorn för att Sverige som medlemsland ska kunna uppfylla kraven i EU-förordningen.
Utredningen har vid översynen funnit att det finns skäl att föreslå inte bara en utökad registerlösning (se vidare kapitel 11–13), utan även att lägga grunden för en federerad lösning för tillgängliggörande av vissa patientuppgifter inom hälso- och sjukvården. Utredningen har i avsnitt 8.9 valt att benämna den samlade informationen på området läkemedel och medicintekniska produkter för en nationell infrastruktur för information om en patients läkemedelsbehandling och behandling med eller användning av vissa medicintekniska pro- dukter. Som utredningen redovisat i avsnitt 8.4 samt 8.8 finns det flera fördelar med en federerad lösning i jämförelse med en register- lösning för vissa patientuppgifter. I avsnitt 8.12 har utredningen redogjort för andra utredningars förslag av relevans för utveck- lingen av federerade lösningar. I det följande avsnittet redovisar utredningen sina bedömningar avseende hur en sådan federerad lösning kan genomföras.
8.13.1Interoperabilitet och datadelning utgör grunden
Utredningens bedömning: Vid en fortsatt utveckling av en natio- nell infrastruktur för information om en patients läkemedels- behandling och behandling med eller användning av medicin- tekniska produkter bör nationella och europeiska initiativ till interoperabilitet och datadelning utgöra utgångspunkt.
Sverige bör ta en ledande position i det fortsatta europeiska och internationella samarbetet kring interoperabilitet på hälso- och sjukvårdsområdet.
Som konstaterats i avsnitt 4.4 samt 8.12 pågår många olika initiativ på hälsodataområdet, både nationellt och internationellt. Gemen- samt för dessa initiativ är att de syftar till att skapa strukturer för att utbyta hälsodata mellan olika aktörer, både för primär- och sekun- däranvändning. Förmåga att utbyta hälsodata är enligt utredningens bedömning central för en fortsatt utveckling av en modern hälso- och sjukvård i världsklass. Det är samtidigt kanske en av de största it-relaterade utmaningarna i vår tid då det omfattar stora mängder data inom ett mycket brett område. Det är inte den tekniska över-
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
föringen av uppgifter i sig som är den egentliga utmaningen utan det är framtagandet av, och anpassningen till, modeller som medger teknisk och semantisk interoperabilitet.
I det sektorsöverskridande betänkandet En reform för datadel- ning (se avsnitt 4.4.1 samt 8.12.1) konstateras att det bör vara ett politiskt mål att offentlig förvaltnings mest angelägna datadelning ska vara fullt interoperabel senast år 2030.274 Med datadelning avses både att tillhandahålla data och att ta del av data.275 Eftersom det kan ta tid att få interoperabilitetslösningar på plats föreslås i betänkandet att målet avgränsas till den mest angelägna datadelningen. Det kan exempelvis gälla datadelning för att underlätta hantering av angelägna samhällsutmaningar eller för att utveckla viktiga tjänster som till- handahålls till medborgare.276 I betänkandet föreslås att den offent- liga förvaltningen vid datadelning ska använda nationella interopera- bilitetslösningar som har föreskrivits med stöd av lag.277 Vidare görs bedömningen att interoperabilitet vid datadelning inom sektorer eller områden bör styras genom lagstiftning för respektive sektor eller område, och att det finns behov av fortsatt utredning av för- utsättningarna för att införa styrning av interoperabilitet inom sek- torer eller områden.278
En sådan sektorsspecifik utredning är Utredningen om infrastruk- tur för hälsodata som nationellt intresse (se avsnitt 4.4.2 samt 8.12.2).
Ibetänkandet Delad hälsodata – dubbel nytta föreslås att E-hälso- myndigheten ska ansvara för att ta fram och förvalta interopera- bilitetslösningar för hälso- och sjukvården i samverkan med vård- givare, statliga myndigheter och andra relevanta aktörer.279 Ansvaret innebär inte att alla komponenterna i interoperabilitetslösningarna måste förvaltas och kontrolleras av E-hälsomyndigheten. Tvärt om uppges de flesta standarderna komma att förvaltas av andra natio- nella eller internationella organisationer. E-hälsomyndigheten före- slås dock ansvara för att interoperabilitetslösningarnas specifikationer är ändamålsenliga och aktuella när det kommer till hänvisningar till andra komponenter. På samma sätt som framtagandet av interopera-
274SOU 2023:96 En reform för datadelning, s. 200.
275A.a., s. 212.
276A.a., s. 201.
277A.a., s. 220.
278A.a., s. 246.
279SOU 2024:33 Delad hälsodata – dubbel nytta, s. 245.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
bilitetslösningarna ska göras i samverkan med sektorn, måste för- valtningen av dem ske i samverkan.280
Genom EU-förordningen om det europeiska hälsodataområdet kommer krav ställas på Sverige som medlemsstat att också kunna dela hälsodata över nationsgränsen (se avsnitt 4.4.7 samt 8.12.4). Genom EU-förordningen inrättas det europeiska hälsodataområdet genom fastställande av gemensamma regler, standarder, infrastruktu- rer och en styrningsram i syfte att underlätta tillgången till e-hälsodata för primär och sekundär användning av dessa data.281 I förordningens artikel 14 anges prioriterade kategorier av elektroniska hälsodata med personuppgifter för primäranvändning. Bland dessa nämns patient- översikter, elektroniska recept och information om uthämtade läkemedel. Närmare egenskaper hos dessa prioriterade kategorier av personliga e-hälsodata anges i förordningens bilaga I. Av bilagan framgår att patientöversikter bl.a. ska innehålla information om vaccinering, medicintekniska produkter och implantat samt aktuella och relevanta tidigare läkemedel. Tidigare bedömningar och förslag kring patientöversikter i EES har lämnats i betänkandet Patientöver- sikter inom EES och Sverige (se avsnitt 4.4.5).
E-hälsomyndigheten har haft i uppdrag att ta fram ett förslag till färdplan för genomförande av en nationell digital infrastruktur för hälso- och sjukvården (se avsnitt 4.4.9). E-hälsomyndigheten föreslår bl.a. att den nationella digitala infrastrukturen ska bestå av en rad olika komponenter och strukturer. Dessa föreslås vara relativt tekniskt fristående från varandra och vara återanvändningsbara (även kallat modulära), eftersom ett sådant tillvägagångssätt gör det lättare att utveckla infrastrukturen stegvis allt eftersom nya behov uppstår. Ett sådant exempel är utvecklingen av komponenten för tjänsteadressering som föreslås i E-hälsomyndighetens rapport Förutsättningar för en lösning som möjliggör automatisk informationsöverföring till natio- nella kvalitetsregister. Komponenten behövs för uppdraget som rör informationsöverföring till kvalitetsregister, men behövs även för utbyte av information inom flera andra områden och skulle enligt utredningens bedömning sannolikt även kunna utgöra en del i vår utrednings överväganden kring federerade lösningar.
280A.a., s. 246.
281Artikel 1, Europaparlamentets och rådets förordning (EU) 2025/327 av den 11 februari 2025 om det europeiska hälsodataområdet och om ändring av direktiv 2011/24/EU och förordning (EU) 2024/2847.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
E-hälsomyndigheten deltar även i det EU-gemensamma arbetet med Xt-EHR samt THEDAS2. Projektet Xt-EHR ska t.ex. skapa specifikationer och implementationsguider för det europeiska elek- troniska utbytesformatet, benämnt EEHRxF. Projektet THEDAS2 ska skapa tekniska specifikationer och policyvägledningar för sekun- däranvändning. Båda projekten ska utgöra underlag till EU-kom- missionens kommande genomförandeakter enligt EHDS.282
Utredningens bedömning
Utredningen kan utifrån ovanstående konstatera att flera initiativ avseende datadelning och interoperabilitet pågår nationellt såväl som internationellt. Initiativen har delvis gemensamma eller över- lappande målbilder men som är bredare än de frågor denna utred- ning har att utreda. Utredningen bedömer att det inte är ändamåls- enligt att söka lösningar som går i en annan riktning än den som redan påbörjats. Utredningen bedömer därför att dessa övergripande nationella och europeiska initiativ bör utgöra utgångspunkt även i arbetet med en fortsatt utveckling av en nationell infrastruktur för information om en patients läkemedelsbehandling och behandling med eller användning av medicintekniska produkter.
Sverige kommer inte ensamt kunna styra hur interoperabilitets- lösningar som sträcker sig utanför våra gränser ska se ut. Vi kommer däremot vara tvungna att anpassa oss till sådana lösningar. Genom att arbeta proaktivt och ta en ledande position i det europeiska arbetet ökar sannolikheten för att Sveriges kompetenser på området kommer EU till nytta och att Sverige är med och påverkar hur det framtida utbytet av information ska gå till. På så sätt bedömer utredningen att vi minskar risken att senare tvingas anpassa oss till lösningar som inte stämmer överens med vägval vi redan gjort eller vill göra nationellt. Enligt utredningen bör Sverige därför fortsätta att enga- gera oss i det europeiska arbetet och ta en ledande position i det fortsatta internationella samarbetet kring interoperabilitet på hälso- och sjukvårdsområdet.
282E-hälsomyndigheten, 2024, Nationell kontaktpunkt för e-hälsa och förberedelser för det europeiska hälsodataområdet – Årsrapportering enligt punkt 4, E-hälsomyndighetens reglerings- brev 2024, dnr 2024/00492, s. 3.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
8.13.2Utredningens bedömer att viss hälsodata bör delas genom en federerad lösning
Som framgår av avsnitt 8.4 är utredningens bedömning att som huvudregel bör uppgifter om i vården administrerade läkemedel och om vissa ordinerade medicintekniska produkter delas mellan olika vårdgivare och med patienten genom en federerad lösning.
Vid vård av patienter ska det föras patientjournal.283 När hälso- och sjukvårdspersonal ordinerar patienten en behandling eller utför en åtgärd för att verkställa ett beslut om en ordinerad behandling som ska utföras i samband med hälso- och sjukvård ska dessa åt- gärder därför dokumenteras i patientens journal.284 Enligt gällande föreskrifter ska uppgifter i en patientjournal vara entydiga, vilket innebär att fastställda termer och klassificeringar bör användas så långt möjligt.285 Läkemedelsordinationer ska dokumenteras i patient- journalen på ett strukturerat sätt och i ett enhetligt format.286 Av föreskrifterna framgår också tydligt vilka uppgifter som ska doku- menteras.287
Det är uppgifter i denna dokumentation som behöver kunna delas mellan alla berörda kommunala, regionala, statliga såväl som privata vårdgivare, genom den federerade lösningen. För att data ska kunna delas säkert och brett måste det finnas interoperabilitets- lösningar för datadelning i hälso- och sjukvårdssektorn. Detta är nödvändigt för att de olika vårdinformationssystemen ska kunna utbyta information som också ska gå att läsa efter utbytet.
Det har under en längre tid varit frivilligt för offentligt finansierade vårdgivare att dela information federerat genom e-tjänsten nationell patientöversikt. Detta har inte lett till den täckning som behövs för att tjänsten ska kunna betraktas som nationell infrastruktur. Bristen i täckningsgrad gör inte heller att tjänsten ger de patientsäkerhets- vinster som eftersträvas. För att data som kan delas också faktiskt
2833 kap. 1 § patientdatalagen (2008:355).
2845 kap. 5 § Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2016:40) om journal- föring och behandling av personuppgifter i hälso- och sjukvården och 6 kap. 9–10 §§ Social- styrelsens föreskrifter och allmänna råd (2017:37) om ordination och hantering av läkemedel i hälso- och sjukvården.
2855 kap. 2 § Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2016:40) om journal- föring och behandling av personuppgifter i hälso- och sjukvården och allmänna råd till den bestämmelsen.
2866 kap. 9 § Socialstyrelsens föreskrifter och allmänna råd (2017:37) om ordination och hantering av läkemedel i hälso- och sjukvården.
2876 kap. 10 § ovan nämnda föreskrift.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
delas förutsätter den federerade lösningen enligt utredningens bedöm- ning att vårdgivare är skyldiga att dela de aktuella uppgifterna och att uppgifterna delas på föreskrivet sätt.
För att efterfrågade uppgifter ska kunna avropas hos samtliga vård- givare och korrekt kunna sammanställas behöver det också finnas tjänsteadressering (se 4.4.8) och ett s.k. patientdataindex. Ett pati- entdataindex är ett index över hos vilka vårdgivare eller vårdinfor- mationssystem data om respektive patient finns lagrade. På detta sätt kan frågor om en patient riktas till de vårdgivare som har data om patienten, vilket innebär en betydande minskning av belast- ningen på de system som blir anropade. Dessa skulle utan tillgång till patientdataindex få en mångdubbel mängd anrop varav de flesta skulle generera tomma svar. För system som anropar andra system för att efterfråga data innebär detta bättre prestanda och en enklare och robustare hantering av anrop och svar.288
Det fastslås i EU-förordningen om det europeiska hälsodata- området att patienten har rätt till åtkomst till de egna elektroniska hälsodata som omfattas av EU-förordningen.289 Utredningen gör bedömningen att patienten bör ha elektronisk tillgång till de upp- gifter om patienten som kan samlas genom den federerade lösningen, även sådana som inte omfattas av EU-förordningen. Dock måste sekretess för dessa uppgifter kunna upprätthållas gentemot patien- ten i de fall det finns skäl för sådan sekretess. Det behöver finnas en patientportal för sådan åtkomst, dvs. en tjänst genom vilken det är möjligt för patienten att få åtkomst till sina uppgifter. Viss sådan tillgång till uppgifter finns i dag via e-tjänsten 1177 Journal, men precis som vad gäller den nationella patientöversikten är täckningen och informationsinnehållet i dag inte tillfredställande.
Även om det i dag alltså delvis finns tekniska lösningar och tjänster på plats, för att dela uppgifter ur patientjournaler genom federerade lösningar (se avsnitt 7.2) både för hälso- och sjukvårdspersonal och patienter är det utredningens bedömning att de angivna förutsätt- ningarna inte föreligger, eller uppfylls i tillräcklig utsträckning, för närvarande. Det har dock nyligen lagts fram förslag till lösningar i vissa av dessa delar och i andra delar pågår utredningar av hur nöd- vändiga förutsättningar ska genomföras. I de följande avsnitten redo-
288E-hälsomyndigheten, 2024, Förutsättningar för en lösning som möjliggör automatisk informationsöverföring till nationella kvalitetsregister, s. 34.
289Se bl.a. artikel 3 förordningen (EU) 2025/327 om det europeiska hälsodataområdet.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
visar utredningen hur vår utrednings överväganden kring en fede- rerad lösning för datadelning kan möjliggöras.
8.13.3Struktur för interoperabilitet
Utredningens bedömning: Genom förslagen i SOU 2023:96, En reform för datadelning, och SOU 2024:33, Delad hälsodata – dubbel nytta, om hur interoperabilitetslösningar ska tas fram och implementeras nationellt och inom sektorn för hälso- och sjuk- vård läggs grunden för att möjliggöra delning av nödvändiga pati- entuppgifter i hälso- och sjukvården.
I SOU 2023:96, En reform för datadelning, föreslås att Myndigheten för digital förvaltning, nedan Digg, ska ta fram nationella interopera- bilitetslösningar i samarbete med offentlig förvaltning och andra aktörer. Digg ska också föreskriva om sådana interoperabilitetslös- ningar för den offentliga förvaltningen. Interoperabilitetslösningar på nationell nivå ska enligt SOU 2023:96 samordnas med de sektors- specifika interoperabilitetslösningar som beslutas inom varje sektor.
För hälso- och sjukvårdssektorn har det i SOU 2024:33, Delad hälsodata – dubbel nytta, föreslagits att E-hälsomyndigheten får huvudansvaret för interoperabilitetslösningar inom sektorn. E-hälso- myndigheten föreslås ansvara för att ta fram och förvalta interopera- bilitetslösningar för hälso- och sjukvården. Myndigheten ska också samverka med vårdgivare, statliga myndigheter och andra relevanta aktörer när interoperabilitetslösningar tas fram och stödja hälso- och sjukvårdens arbete med att uppnå interoperabilitet.
Enligt SOU 2024:33 ska Socialstyrelsen bidra i ovan beskrivna ansvar genom att stödja hälso- och sjukvårdens arbete med att uppnå interoperabilitet och genom att delta i arbetet med att ta fram inter- operabilitetslösningar för hälso- och sjukvården. Socialstyrelsen föreslås skapa och tillhandahålla ändamålsenliga informatiska beskriv- ningar samt standarder för hälsodata, särskilt innefattande begrepps- utredning, juridisk utredning och modellering samt annan expert- kunskap inom myndighetens verksamhetsområde.
Inom E-hälsomyndigheten föreslås det i samma betänkande in- rättas ett rådgivande organ, Rådet för hälso- och sjukvårdens inter- operabilitet. Rådet ska medverka i arbetet med en nationell strategisk
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
plan för den digitala informationsförsörjningen inom hälso- och sjukvården, bidra till utvecklingen av den nationella digitala infra- strukturen inom hälso- och sjukvården och medverka till ökad sam- ordning och samarbete mellan berörda aktörer i frågor om den natio- nella digitala infrastrukturen. Ett sådant nationellt råd startades under hösten 2024 som en del av den nationella funktionen för interopera- bilitet.290,291
Utredningen konstaterar att när ovanstående förslag genomförs finns förutsättningar för att möjliggöra interoperabilitet för datadel- ning inom hälso- och sjukvårdssektorn i stort. Detta lägger också en grund för mer specifik datadelning avseende uppgifter om en pati- ents läkemedelsbehandling och behandling med och användning av medicintekniska produkter som vår utredning ska analysera och lämna förslag kring.
Utredningen gör därför bedömningen att genom förslagen i SOU 2023:96, En reform för datadelning, och SOU 2024:33, Delad hälsodata – dubbel nytta, om hur interoperabilitetslösningar ska tas fram och implementeras nationellt och inom sektorn för hälso- och sjukvård läggs grunden för att möjliggöra delning av nödvändiga patientuppgifter i hälso- och sjukvården.
EU-förordningen om det europeiska hälsodataområdet påverkar gällande nationell lagstiftning. EU-förordningen möjliggör och kräver kompletterande bestämmelser. Eftersom EU-förordningen, och därmed de mer specifika förutsättningarna, inte funnits på plats under ovanstående utredningars arbete kan det inte uteslutas att delar av förslagen behöver justeras i och med att EU-förordningen ska börja tillämpas. Utredningen bedömer dock att EU-förordningen om det europeiska hälsodataområdet sannolikt inte helt kommer att ersätta nationell lagstiftning avseende möjligheterna att dela uppgifter mellan vårdgivare. Den möjlighet att dela uppgifter som
i dag möjliggörs genom sammanhållen vård- och omsorgsdokumen- tation är t.ex. mer omfattande än vad som följer av EU-förordningen. Sådan svensk reglering behöver därför enligt utredningens bedöm- ning finnas kvar och samexistera med det europeiska regelverket.
En anpassning av svensk rätt pågår nu genom uppdraget att möjlig- göra en nationell digital infrastruktur för hälsodata (S 2024:A). De
290https://www.ehalsomyndigheten.se/om-oss/regeringsuppdrag/nationell-funktion-for- interoperabilitet/nationellt-rad-for-interoperabilitet/, besökt 2024-11-12.
291Se avsnitt 4, villkor för anslag 1:10, ap.1 i Regleringsbrev för budgetåret 2024 avseende E-hälsomyndigheten.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
principer som dras upp i ovan nämnda betänkanden bör dock ändå gå att luta sig emot på principiell nivå.
8.13.4Interoperabilitetslösning för ordinerade och administrerade läkemedel
Utredningens förslag: E-hälsomyndigheten ska få i uppdrag att tillsammans med Socialstyrelsen ta fram de specifikationer som behövs för en interoperabilitetslösning för utbyte av information om ordinationer och administrerade läkemedel mellan olika aktö- rer i Sverige. Myndigheten ska i framtagandet beakta arbeten av relevans inom ramen för det europeiska hälsodataområdet. Myn- digheten ska i uppdraget samverka med SKR samt vårdgivare inom både privat och offentlig sektor.
En grundförutsättning för en nationell infrastruktur för information om en patients läkemedelsbehandling är att information kan utbytas mellan berörda aktörer. För detta krävs specifikationer om bl.a. tek- nisk och semantisk interoperabilitet.
E-hälsomyndigheten beskriver i sin rapport Förslag till en färd- plan för genomförandet av en nationell infrastruktur för hälso- och sjukvården ett ekosystem av olika förutsättningsskapande kompo- nenter, t.ex. patientdataindex, tjänsteadressering samt samtyckes-, spärr- och ombudskomponenter.292 Myndigheten menar att färd- planen ska bygga på ett modultänk med generiska återanvändbara lösningar.293 Detta preciseras närmare avseende t.ex. tjänsteadressering i arbetet med att ta fram en lösning för automatisk överföring till nationella kvalitetsregister.294
En interoperabilitetslösning är också starkt beroende av tekniska och semantiska specifikationer. Även dessa kan vara återanvändnings- bara i ekosystemet för hälso- och sjukvårdens interoperabilitet. Genom att fokusera på de allra viktigaste gemensamma tekniska kompo- nenter som möjliggör informationsutbyte och lägga mer fokus på gemensamma specifikationer skapas ett dynamiskt ekosystem som
292E-hälsomyndigheten, 2023, Förslag till övergripande färdplan för genomförandet av en nationell digital infrastruktur för hälso- och sjukvården – delredovisning, s. 49 f.
293A.a., s. 41.
294E-hälsomyndigheten, 2024, Förutsättningar för en lösning som möjliggör automatisk infor- mationsöverföring till nationella kvalitetsregister – slutrapport, s. 12 f.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
möjliggör för många fler aktörer att anpassa och skapa lösningar som passar deras behov samtidigt som alla delar fungerar tillsammans. Det finns flera fördelar med en sådan infrastruktur jämfört med en monolitisk lösning. Flexibiliteten ökar, enskilda delfunktioner kan enkelt och kostnadseffektivt bytas ut eller uppgraderas och riskerna minskar för negativ påverkan på den övriga infrastrukturen.295 Ge- mensamma specifikationer publiceras i tjänsten för nationella gemen- samma e-hälsospecifikationer.296
Specifikationer för utbyte av information om ordinerade och administrerade läkemedel behövs för flera aktörer för flera syften
En interoperabilitetslösning inklusive specifikationer för ordinerade och administrerade läkemedel behövs för flera delar i den av utred- ningen föreslagna nationella infrastrukturen för information om en patients läkemedelsbehandling, oavsett om informationen ska till- gängliggöras genom registrering i ett register eller genom att infor- mationen tillgängliggörs för olika aktörer genom federerade lösningar. Att ta fram de specifikationer som krävs är därför centralt för att kunna genomföra denna utrednings förslag.
Specifikationerna är också centrala för andra uppdrag t.ex. de förslag om rapportering av uppgifter till ett nytt register över admi- nistrerade läkemedel som lämnas i betänkandet Ett nytt regelverk för hälsodataregister, se även avsnitt 8.4.7 och kapitel 17.297 Det är även sannolikt att t.ex. specifikationer för dokumentation och utbyte av information om ordinerade och/eller administrerade läkemedel behövs för sådan rapportering av uppgifter till kvalitetsregister som beskrivs i E-hälsomyndighetens rapport om automatisk informations- överföring till nationella kvalitetsregister. Även vårdgivare bedöms ha stor nytta av gemensamma specifikationer på området då det även underlättar utbyte av information mellan olika vårdinforma- tionssystem inom vårdgivarens verksamhet. Med gemensamma spe- cifikationer är det enligt utredningens bedömning inte otänkbart att det varit möjligt att fylla på det nya vårdinformationsystemet som
295E-hälsomyndigheten, 2024, Förslag till färdplan för genomförandet av en nationell digital infrastruktur för hälso- och sjukvården – slutredovisning, s. 28.
296https://ngs.ehalsomyndigheten.se/, besökt 2024-11-13.
297SOU 2024:57 Ett nytt regelverk för hälsodataregister, s. 258 ff. samt s. 402 f.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
hösten 2024 driftsattes i delar av vårdverksamheten i Västra Götalands- regionen med information om aktuella läkemedelsordinationer.
I sammanhanget bör det också framhållas skillnaden mellan in- formation om ordinerade och administrerade läkemedel. Admini- strering av läkemedel i hälso- och sjukvården grundar sig alltid på en ordination, och om det ordinerade läkemedlet är det som faktiskt administreras kompletteras dokumentationen över ordinationen ofta med att det ordinerade läkemedlet är administrerat, när och av vem. Endast i fall då ordinationen gjorts på aktiv substans i stället för ett specifikt angivet läkemedel, eller då ett annat läkemedel än det ordinerade administreras, behöver information om själva läke- medlet anges på nytt. Det är därför rimligt att behandla specifika- tioner för ordinerade och administrerade läkemedel samlat som en helhet även om man i vissa situationer, t.ex. avseende uppgifterna till det föreslagna hälsodataregistret för administrerade läkemedel avser att registrera endast administrerade läkemedel. Sådan informa- tion kräver alltså ofta även uppgifter från själva ordinationen.
Som utredningen konstaterade i avsnitt 8.13.1 kommer även genomförandet av det europeiska hälsodataområdet att påverka Sverige på många sätt, inte minst genom nya rättsliga krav på att tillgängliggöra och dela information. Vissa av de informationsmäng- der som behandlas i detta betänkande överlappar enligt utredningens bedömning med sådana uppgifter som ingår i de patientöversikter som regleras i EU-förordningen. Utredningen bedömer i avsnitt
8.13.1att Sverige ska ta en ledande position i det europeiska arbete med interoperabilitet bl.a. i syfte att säkerställa att svenska intressen beaktas i det närmare arbetet med specifikationer för informations- utbytet. För att kunna göra detta vad avser de informationsmängder denna utredning har att hantera, krävs att en myndighet ges i upp- drag att påbörja arbetet med att ta fram tekniska och semantiska specifikationer utifrån svenska behov och föder in detta i det EU- gemensamma arbetet. I föregående avsnitt (8.13.3) beskrivs en struk- tur för interoperabilitet. Flera av de delar som där beskrivs finns redan på plats eller har nyligen startats upp, även om föreskrifts- rätten ännu inte är beslutad.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
Funktionen för interoperabilitet
E-hälsomyndigheten har regeringens uppdrag att inrätta en funktion för interoperabilitet. Funktionen ska identifiera prioriterade områden för standardisering samt verka för framtagning och användning av implementationsnära specifikationer inom hälso- och sjukvården.298 Funktionen består förutom av ett nationellt råd, rådet för interopera- bilitet, även av operativa arbetsgrupper med deltagare från sektorns olika aktörer.
Utredningen kan konstatera att E-hälsomyndigheten därmed på övergripande nivå redan har de uppdrag som krävs för att leda arbetet med att ta fram de specifikationer som krävs. För att denna utred- nings, och flera av andra tidigare lämnade förslag, ska kunna genom- föras krävs därför att specifikationer för ordinerade och administre- rade läkemedel prioriteras. Arbetet behöver bedrivas i bred samverkan med berörda aktörer såsom offentliga och privata vårdgivare, system- leverantörer och andra berörda myndigheter.
Socialstyrelsens arbete med nationell informationsstruktur
Socialstyrelsen har i uppdrag att skapa, beskriva och tillhandahålla en ändamålsenlig informationsstruktur inom sitt verksamhets- område.299 För att personal och system ska förstå varandra genom informationen som dokumenteras, semantisk interoperabilitet, erbjuder Socialstyrelsen verktyg för en ändamålsenlig och struktu- rerad dokumentation i vård och omsorg. Verktygen består av natio- nell informationsstruktur och nationella informationsmängder samt de fackspråkliga resurserna begreppssystemet Snomed CT, hälso- relaterade klassifikationer och Socialstyrelsens termbank.300
Utredningen kan konstatera att även de strukturer för nationell informationsstruktur som finns vid Socialstyrelsen är viktiga i ett fortsatt arbete med att skapa interoperabilitetslösningar för informa- tion om en patients ordinerade och administrerade läkemedel.
298Se avsnitt 4, villkor för anslag 1:10, ap.1 i Regleringsbrev för budgetåret 2024 avseende E-hälsomyndigheten.
2994 § 10 förordning (2015:284) med instruktion för Socialstyrelsen.
300https://www.socialstyrelsen.se/kunskapsstod-och-regler/omraden/e-halsa/, besökt 2024-11-19.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
Regionernas gemensamma kunskapsstyrning
Sveriges kommuner och regioner, i det följande SKR, har under flera år bedrivit arbete med att strukturera läkemedelsinformation. Arbetet har till stor del finansierats genom överenskommelser mellan SKR och Socialdepartementet.301 Arbetet har bl.a. lett fram till den s.k. läkemedelsdomänen. I läkemedelsdomänen finns dokument och modeller som beskriver kliniska scenarier och informationsbehov, begreppsmodeller, arbetsflödesmodeller, verksamhetsregler och informationsmodeller.302 I dag är insatsområde informatikstöd en del av regionernas gemensamma kunskapsstyrning.
Utredningen kan konstatera att det finns mycket upparbetad kunskap genom arbetet med läkemedelsdomänen och inom insats- område informatikstöd. Att inte ta tillvara dessa kunskapsvinningar som redan finansierats vore ett slöseri med resurser. Även om ut- redningen ser att det formella ansvaret för att ta fram en interopera- bilitetslösning som en del av en nationell infrastruktur behöver ligga på en statlig myndighet är det arbete som bedrivs av regionerna i samverkan och med stöd av SKR viktigt att ta till vara. I överens- kommelsen om statens bidrag till regionerna för kostnader för läke- medelsförmånerna m.m. år 2025 anges att läkemedelsdomänen under året ska föras över till en statlig myndighet och att former för natio- nell samverkan kring läkemedelsinformatik ska etableras.303
Vårdgivarnas ansvar
Regioner och kommuner har ett huvudmannaansvar och utför som vårdgivare stora delar av den offentligfinansierade hälso- och sjuk- vården. Därutöver finns ett antal privata vårdgivare som på uppdrag utför offentligfinansierad vård eller på eget initiativ utför privat finan- sierad vård. Inom den privat finansierade vården finns även företags- hälsovård och försäkringsvård. Ansvaret att leva upp till de krav som finns i lagstiftningen åligger alla vårdgivare. Det är ytterst vårdgivarna, och deras olika vårdinformationssystem, som behöver kunna imple-
301Se bl.a. punkt 9 i God och nära vård 2024 – En personcentrerad och patientsäker hälso- och sjukvård med primärvården som nav – Överenskommelse mellan staten och Sveriges Kommuner och Regioner.
302https://lakemedelsdomanen.kunskapsstyrningvard.se/, besökt 2024-11-19.
303Överenskommelsen mellan Staten och Sveriges kommuner och regioner om statens bidrag till regionerna för kostnader för läkemedelsförmånerna m.m. 2025, dnr S2024/02235, s. 9 f.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
mentera de interoperabilitetslösningar som tas fram varför både de offentliga och de privata vårdgivarna är viktiga representanter i arbetet.
Utredningens förslag
Mot ovanstående bakgrund föreslår utredningen att E-hälsomyndig- heten ska få i uppdrag att tillsammans med Socialstyrelsen ta fram de specifikationer som behövs för en interoperabilitetslösning för utbyte av information om ordinationer och administrerade läkemedel mellan olika aktörer i Sverige. EU-förordningen om det europeiska hälsodataområdet fastslår krav på, och kommer att ange förutsätt- ningar för, interoperabilitet för datadelning som faller inom EU- förordningens tillämpningsområde. Uppdraget avser således specifi- kationer för delning av övriga uppgifter som bör kunna delas nationellt. Myndigheterna bör i framtagandet beakta arbeten av relevans inom ramen för det europeiska hälsodataområdet. Myndigheterna bör i uppdraget samverka med SKR samt med vårdgivare inom både privat och offentlig sektor.
8.13.5Tillgängliggörande av patientdata för vårdgivare
Utredningens bedömning: Genom EU-förordningen om det europeiska hälsodataområdet och genom förslagen i SOU 2024:33, Delad hälsodata – dubbel nytta, att det ska vara tvingande för vård- givare att elektroniskt dela vissa patientuppgifter och att det kan fastslås i föreskrifter hur delningen ska gå till, möjliggörs att vård- givare åläggs vara skyldiga att dela uppgifter om i vården admini- strerade läkemedel och vissa ordinerade medicintekniska pro- dukter med andra vårdgivare genom en federerad lösning.
Utredaren som fått i uppdrag att möjliggöra en nationell digi- tal infrastruktur för hälsodata, S 2024:A, ska bl.a. utreda de rätts- liga förutsättningarna för ett patientdataindex. Ett patientdata- index är en nödvändig förutsättning för att en federerad lösning för insamling av data ska fungera. Detta bör utredas samlat för den nationella digitala infrastrukturen för hälsodata varför några förslag avseende patientdataindex inte lämnas i detta betänkande.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
Utredningen har beaktat förslaget i betänkandet SOU 2024:33 att det ska vara tvingande för vårdgivare att elektroniskt dela patient- uppgifter som behövs för en effektiv och säker vård med andra vård- givare. Detta anges i en föreslagen ny bestämmelse i lagen (2022:913) om sammanhållen vård- och omsorgsdokumentation. Det föreslås inga ändringar i lagen avseende förutsättningarna för att få ta del av sådan information. Vilka uppgifter som behövs för en effektiv och säker vård anges inte närmare i lagen. Enligt betänkandet skulle sådana uppgiftsmängder exempelvis kunna vara uppmärksamhetsinforma- tion, nationella patientöversikter, gränsöverskridande patientöver- sikter inom EES eller sådana uppgifter som ska delas enligt förord- ningen om det europeiska hälsodataområdet. Vilka vårdgivare som ska träffas av uppgiftsskyldigheten i det enskilda fallet anges inte heller i lagen. Uppgiftsskyldigheten ska i stället enligt betänkandet bestämmas i samverkan med sektorns aktörer och utgå från hälso- och sjukvårdens behov. Regeringen eller den myndighet regeringen bestämmer föreslås få meddela närmare föreskrifter om hur upp- giftsskyldigheten ska fullgöras. Bemyndigandet innebär både en rätt att ange vilka personuppgifter om patienter som ska göras till- gängliga för andra vårdgivare och hur det ska ske, exempelvis om patientuppgifterna ska tillgängliggöras enligt en specifikation baserat på semantiska och tekniska standarder.304
Ett genomförande av förslagen i SOU 2024:33 skulle innebära att det genom bestämmelser i förordning eller myndighetsföreskrif- ter kan bli tvingande för vårdgivare att dela de uppgifter som vår utredning föreslår ska delas mellan vårdgivare genom en federerad lösning. De uppgifter som omfattas av utredningens förslag i denna del är i ett första skede uppgifter om ordinerade och administrerade läkemedel, och när förutsättningar för det föreligger, också om vissa medicintekniska produkter hänförliga till patientens pågående be- handlingar. Vår utrednings förslag omfattar endast en begränsad del av de informationsmängder som föreslås kunna delas genom förslagen i SOU 2024:33. Eftersom de behov som vår utredning identifierat täcks in och möjliggörs av vad som redan föreslagits i SOU 2024:33 lämnar vår utredning inga egna förslag i denna del.
Även EU-förordningen om det europeiska hälsodataområdet innebär krav på att dela uppgifter som utgör prioriterade kategorier av elektroniska hälsodata med personuppgifter för primäranvänd-
304SOU 2024:33 Delad hälsodata – dubbel nytta, s. 381 f.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
ning. Som tidigare framgått omfattar detta delar av den information utredningen har haft i uppdrag att utreda. De närmare specifikatio- nerna är dock ännu inte beslutade och de riktlinjer kring innehållet i patientöversikter som det europeiska e-hälsonätverket publicerat omfattar sannolikt t.ex. inte alla i hälso- och sjukvården administre- rade eller överlämnade läkemedel eller medicintekniska produkter. Möjligheten till nationella tillägg finns dock.
Federerade lösningar i kombination med register
De uppgifter som tillgängliggörs genom att patientuppgifter enligt ovan tvingande delas federerat mellan vårdgivare genom interopera- bilitetslösningar, tillsammans med de uppgifter som hälso- och sjuk- vårdspersonal kommer att ha direktåtkomst till i register genom lagen (2018:1212) om nationell läkemedelslista enligt utredningens förslag (se kapitel 11 och 12), kommer enligt utredningens förslag sammantaget att utgöra den nationella infrastrukturen för informa- tion om en patients läkemedelsbehandling och behandling med eller användning av vissa medicintekniska produkter. Denna möjlighet till informationssamling kommer att ge hälso- och sjukvårdspersonal betydligt större möjlighet att få en mer omfattande samlad bild av patientens aktuella hälsotillstånd och pågående behandlingar än vad som är möjligt för närvarande. Som konstateras i avsnitt 8.10 medför möjliggörandet av att elektroniskt tillgängliggöra en större mängd samlad patientinformation för hälso- och sjukvårdspersonal vid ett vårdtillfälle, att stor vikt behöver läggas vid säkerställandet av att informationen presenteras och kan användas på ett patientsäkert och användarvänligt sätt. Detta är dock en fråga om tillämpning av de möjligheter som lagstiftningen ger som inte är lämplig att detalj- reglera i lag. Det ankommer i stället på dem som utvecklar den typen av lösningar att säkerställa detta (se även avsnitt 15.3.3).
Det krävs rättsliga förutsättningar för ett patientdataindex
För att en federerad lösning för insamling av uppgifter ska kunna fungera i praktiken behöver det finnas bl.a. ett s.k. patientdataindex. I en förstudie om en statlig, nationell infrastruktur för bilddiagno- stik gör E-hälsomyndigheten bedömningen att det behövs två olika
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
huvudlösningar för att kunna tillgodose de behov som förstudien har identifierat, dels en nationell datadelningstjänst, dels ett patient- dataindex för att erbjuda en sökfunktion. Ett patientdataindex ska möjliggöra en sökfunktion för att kunna hitta patientens alla tidigare undersökningar hos samtliga vårdgivare. Av E-hälsomyndighetens rapport framgår också att för att ett patientdataindex ska bli en till- förlitlig lösning krävs en lagstadgad uppgiftsskyldighet för vårdgivarna att digitalt och automatiserat rapportera vissa uppgifter om varje relevant vårdkontakt. En sådan sökfunktion kan antingen konstru- eras som ett centralt index eller som flera mindre decentraliserade index. Gemensamt för de båda lösningsalternativen är att de kan bygga på och binda samman befintliga lösningar och infrastruktur, en så kallad federerad lösning.305
Ett patientdataindex är en nödvändighet för att möjliggöra den federerade delning av uppgifter som utredningen bedömer är mest lämplig för att dela uppgifter om i vården ordinerade och admini- strerade läkemedel och vissa medicintekniska produkter. Ett patient- dataindex är också att betrakta som en av de återanvändningsbara komponenter i den nationella infrastrukturen som behövs för flera olika tjänster. En sökfunktion som innebär att information måste sökas om alla patienter hos samtliga vårdgivare har påverkan på data- skyddet och innebär ett intrång i de registrerades personliga integ- ritet. E-hälsomyndigheten pekar därför i den ovan nämnda rappor- ten på behovet av vidare utredning av de rättsliga förutsättningarna. En sådan utredning ingår i det tidigare nämnda uppdraget att möj- liggöra en nationell digital infrastruktur för hälsodata, S2024:A. E- hälsomyndigheten har också i regleringsbrevet för år 2024 i upp- drag att utreda och förbereda etableringen av en teknisk infrastruktur för en söktjänst som möjliggör att uppgifter som ska delas kan hittas (patientdataindex).306 Utredningen gör bedömningen att en utred- ning avseende hur patientdataindex ska regleras behöver göras samlat för den nationella digitala infrastrukturen på hälso- och sjukvårdens område och lämnar därför till den nämnda utredningen att utreda och lämna förslag avseende detta.
305E-hälsomyndigheten, 2022, Förstudie om ett statligt, nationellt datautrymme för bild- diagnostik (S2021/05259) – Slutrapport.
306Regleringsbrev för budgetåret 2024 avseende E-hälsomyndigheten.
SOU 2025:71 En ny nationell infrastruktur för information om en patients läkemedelsbehandling ...
8.13.6Patientens åtkomst till egna hälsodata
Utredningens bedömning: Utredningen lämnar inget förslag om hur patienten ska få möjlighet att få elektronisk åtkomst till de uppgifter som utredningen bedömer bör delas. Detta bör följa av hur patienten ges åtkomst till annan hälsodata vilket ska säker- ställas enligt EU-förordningen om det europeiska hälsodata- området.
Som framgår av bl.a. avsnitt 6.3 och 8.2.1 finns ett behov för pati- enter att kunna ta del av uppgifter om sina pågående läkemedels- behandlingar. I avsnitt 8.1 gör utredningen bedömningen att en sammanställning över ordinerade och förskrivna produkter som är tillgänglig för patienten och berörd hälso- och sjukvårdspersonal, av patientsäkerhetsskäl är ett viktigt komplement till den dokumen- tation som finns i patientjournalerna. Det föreligger inte för när- varande någon tvingande rätt för patienter att kunna ta del av sina patientuppgifter elektroniskt enligt patientdatalagen (2008:35) eller enligt lagen (2022:913) om sammanhållen vård- och omsorgsdoku- mentation. I dessa lagar anges endast att vårdgivare får ge patienten elektronisk åtkomst till sina journaluppgifter.307 I Sverige är detta implementerat t.ex. genom Inera AB:s e-tjänst 1177 Journal. Som utredningen beskriver i avsnitt 7.2.2 och 7.4 ger varken den nationella patientöversikten som riktar sig till vårdpersonal eller e-tjänsten 1177 Journal den samlade bild av en patients läkemedelsbehandling som är nödvändig.
Enligt EU-förordningen om det europeiska hälsodataområdet ska medlemsstater säkerställa att patienten har elektronisk tillgång till sina e-hälsodata.308 Utredningen S 2024:A har i uppdrag att bl.a. utreda de rättsliga förutsättningarna för hur EU-förordningen ska kunna tillämpas i Sverige. Eftersom en s.k. patientingång till hälso- data behöver lösas inom ramen för det arbetet har vår utredning valt att inte föreslå någon särlösning för detta för de uppgifter som omfattas av vår utrednings uppdrag. Av den enkätundersökning utredningen genomfört riktad till patienter framkommer bl.a. också att patienterna värdesätter en väg in till sina uppgifter och vill inte
3075 kap. 5 § patientdatalagen (2008:355) och 4 kap. 2 § lagen (2022:913) om sammanhållen vård- och omsorgsdokumentation.
308Se artikel 3 förordningen (EU) 2025/327 om det europeiska hälsodataområdet.
En ny nationell infrastruktur för information om en patients läkemedelsbehandling ... |
SOU 2025:71 |
ha ”ytterligare en app”.309 De uppgifter som ska tillgängliggöras enligt EU-förordningen omfattar även uppgifter som vår utredning har att beakta, pågående eller relevanta tidigare läkemedelsbehandlingar, vaccinationer, medicintekniska produkter och implantat.310 Det finns därför enligt vår utredning i denna del all anledning att avvakta kom- mande arbeten.
Uppgifter om en patients läkemedelsanvändning och behandling med eller användning av medicintekniska produkter måste också som beskrevs i avsnitt 5.1.3 så långt det är möjligt ses i ett större sammanhang tillsammans med all annan vårddokumentation. En särlösning för viss information, där kopplingen till övriga vårddata helt tappas eller omöjliggörs är därför inte heller en ändamålsenlig ordning. Utredningen föreslår en nationell infrastruktur för infor- mation om en patients läkemedelsbehandling och behandling med eller användning av vissa medicintekniska produkter. Denna infra- struktur utgör en del av den nationella infrastrukturen på hälso- och sjukvårdens område och behöver behandlas som en sådan.
Vid det framtida utformandet av elektroniska lösningar där pati- enten kan ta del av sina uppgifter behöver däremot vad utredningen anför i 8.10 angående ändamålsenlig presentation av uppgifter särskilt beaktas.
I det fall en interimistisk lösning skulle övervägas bedömer ut- redningen att de informationsmängder som utredningen bedömer ska hanteras genom register skulle kunna tillgängliggöras via en vidareutveckling av Läkemedelskollen. I en sådan utveckling be- höver vad som sägs i 8.10 särskilt beaktas.
309Sammanställning av enkät till patienter (Komm2023/00649/ S 2023:09-23).
310Jfr artikel 5.1 och bilaga I förslag till EHDS.
9Överväganden kring vaccinationer
Utredningen ska, som en del i uppdraget ta ställning till om och hur uppgifter om ordination och administrering av sådana läkemedel som patienter får vid behandling inom hälso- och sjukvården, analy- sera och ta ställning till om även uppgifter om vacciner ska läggas till i den nationella läkemedelslistan. I detta kapitel redovisas utred- ningens analys och ställningstaganden avseende förutsättningarna för detta. Utredningens förslag redovisas sedan i kapitel 11 och 13. Patientens och hälso- och sjukvårdens behov av information om vaccinationer beskrivs i kapitel 6. De allmänna förutsättningarna för att kunna dela information beskrivs i kapitel 7.
9.1Allmänt om vaccinationer
Vaccinationsområdet är svåröverskådligt. Många vaccinationer er- bjuds av det offentliga genom olika aktörer på statlig, regional och kommunal nivå. Vaccinationer erbjuds även direkt till enskilda av privata vaccinatörer. Även arbetsgivare erbjuder vaccinationer, främst genom företagshälsovård, som ett led i att förebygga risker för arbets- tagare på grund av deras arbetsuppgifter.
Vissa vacciner, som inom nationella vaccinationsprogram, är alltid avgiftsfria för den enskilde medan vacciner som erbjuds via en region kan vara antingen avgiftsfria eller mot en avgift. Ett vaccin som er- bjuds avgiftsfritt i en region kan i andra regioner vara den enskildes ansvar att bekosta. Vaccinationer genom privata vårdgivares regi betalas oftast av den enskilde men ibland av arbetsgivaren.
577
Överväganden kring vaccinationer |
SOU 2025:71 |
9.1.1Vad är ett vaccin
Begreppet vaccin används med lite olika betydelse i olika samman- hang och på senare år har s.k. cancervacciner och andra läkemedel med immunologisk verkan med nya verkningsmekanismer introdu- cerats vilket påverkat begreppsanvändningen. Ursprungligen fram- kallade vacciner ett immunsvar mot olika smittämnen och förhind- rade på detta sätt infektionssjukdomar. På senare år har vacciner mot smittämnen även kunnat förhindra andra sjukdomar än infektioner, t.ex. cancersjukdom. Ett exempel på detta är vaccination mot humant papillomvirus, förkortat HPV. Vaccination mot HPV har visats för- hindra t.ex. cervixcancer och kondylom.
I dag finns även en annan form av cancervacciner där immunför- svaret ska aktiveras och lära sig känna igen ett annat främmande ämne som inte är ett smittämne, en del av cancercellen, för att kunna attack- era det och behandla cancern. Den stora skillnaden mellan dessa nya cancervacciner och traditionella vacciner är att de nya cancervacci- nerna inte riktar sig mot ett smittämne och att de inte ges i förebygg- ande syfte. Cancervacciner utgör i stället en form av immunterapi där kroppens immunförsvar nyttjas mot andra biologiska strukturer. Det finns även andra moderna terapier som riktar in sig på immunför- svaret på olika sätt men som inte utgör vaccin i traditionell mening.
Smittskyddsinstitutet definierade år 2009 begreppet vaccin som förebyggande läkemedel som består av delar av det smittämne som orsakar en sjukdom, eller hela smittämnet men i avdödad eller för- svagad form.1 Läkemedelsverket definierade år 2016 vaccin som av- dödade eller försvagade bakterier eller virus, eller delar av bakterier eller virus, som används för att via kroppens eget immunförsvar framkalla skydd mot en infektionssjukdom.2
Nu gällande läkemedelslagstiftning vilar på skrivningar som går tillbaka till år 1975.3 Där anges att uttrycket ”vacciner, toxiner eller sera” särskilt avser
–medel som används för att framkalla aktiv immunitet (såsom koleravaccin, BCG, poliovaccin, smittkoppsvaccin),
1Rikstermbanken, vaccin. https://www.rikstermbanken.se/termposter/997/vaccin (hämtad 2024-06-26).
2Rikstermbanken, vaccin. https://www.rikstermbanken.se/termposter/3472/vaccin (hämtad 2024-06-26).
3Artikel 34 i rådets andra direktiv av den 20 maj 1975 om tillnärmning av bestämmelser som fastställts genom lagar eller andra författningar och som gäller farmaceutiska specialiteter. (75/319/EEG) och bilagan till direktivet.
SOU 2025:71 |
Överväganden kring vaccinationer |
–medel som används för att diagnostisera immunstatus innefatt- ande särskilt tuberkulin och tuberkulin PPD, toxiner för Schicks och Dicks test, brucellin,
–medel avsedda att framkalla passiv immunitet (såsom difterianti- toxin, antismittkoppsglobulin, antilymfocytglobulin).
Vacciner omfattas, tillsammans med toxiner och sera, av begreppet immunologiska läkemedel i det nu gällande direktivet för humanläke- medel4 och lydelsen är densamma som i 1975 års direktiv.
I kommissionens förslag till nytt läkemedelsdirektiv för human- läkemedel som nu förhandlas definieras vaccin som varje läkemedel som är avsett att framkalla ett immunsvar för förebyggande, inklusive postexponeringsprofylax, och för behandling av sjukdomar som orsakas av ett smittämne.5 Utredningen kommer i det följande att förhålla sig till den av kommissionen föreslagna lydelsen där just skyddet mot ett smittämne utgör en viktig del i definitionen. Andra behand- lingar som påverkar immunförsvaret, t.ex. genom att få detta att reagera på andra strukturer och därigenom t.ex. påverka cancersjuk- dom eller andra folksjukdomar, bedömer utredningen tills vidare ska betraktas som immunterapi. Sådana immunologiska behand- lingar, är läkemedel och hanteras i utredningens förslag på samma sätt som andra läkemedel med långvarig effekt.
9.1.2Olika möjligheter till vaccination
I Sverige erbjuds eller möjliggörs vaccinationer i huvudsak på följande sätt.
–Som del av ett nationellt vaccinationsprogram, till exempel barn- vaccinationsprogrammet som riktar sig till alla barn upp till 18 år. Programmet omfattar för närvarande vaccination mot elva smitt- samma sjukdomar. Regeringen fattade i februari 2025 beslut om att vaccination mot infektionssjukdomen tuberkulos blir ett natio-
4Artikel 1.4 Europaparlamentets och rådets direktiv 2001/83/EG av den 6 november 2001 om upprättande av gemenskapsregler för humanläkemedel.
5Artikel 4.1.28 i förslag till Europaparlamentets och rådets direktiv om unionsregler för humanläkemedel och om upphävande av direktiv 2001/83/EG och direktiv 2009/35/EG [COM(2023) 192 final].
Överväganden kring vaccinationer |
SOU 2025:71 |
nellt särskilt vaccinationsprogram riktat till barn.6 Nationella vaccinationsprogram är obligatoriska för regioner, kommuner och annan huvudman för elevhälsan att erbjuda. Vaccinationerna är avgiftsfria för den enskilde.7
–Som del i en nationell rekommendation om vaccination som Folk- hälsomyndigheten tar fram mot ett flertal sjukdomar. Dessa är inte tvingande för vare sig huvudman eller vårdgivare, offentlig eller privat, att följa. Rekommendationerna riktar sig antingen till befolkningen i stort eller till riskgrupper. Det finns ingen skyldighet att erbjuda vaccinerna avgiftsfritt. Exempel på ett rekommenderat vaccinationsprogram är det mot influensa för riskgrupper. Det erbjuds nu avgiftsfritt av samtliga regioner för den enskilde. Ett annat exempel är vaccination mot RS-virus till personer över 75 år eller personer över 60 år med vissa riskfak- torer.8 Det vaccinet bekostas av patienten själv.
–Regionalt beslutade vaccinationsprogram eller rekommendatio- ner som erbjuds efter beslut i en region. Dessa kan vara avgifts- fria för den enskilde eller erbjudas till en reducerad kostnad. Till exempel finns regionala program mot fästingburen encefalit (TBE). Avgiftsfrihet eller kostnadsreducering kan begränsas till av regio- nen utvalda utförare.
–Vaccinationer som individen själv ser ett behov av, exempel på detta är olika resevacciner samt vaccination mot TBE eller bältros. Dessa erbjuds vanligtvis av privata vårdgivare samt på vårdcentraler. Kostnaden bärs av individen.
–Vaccinationer som arbetsgivare erbjuder arbetstagare samt stu- denter som ett led i att förebygga risker som arbetstagaren utsätts för inom ramen för sina arbetsuppgifter samt av patientsäkerhets- skäl. Exempel är vaccinationer för dem som arbetar med smitt- ämnen i laboratorier, personal inom vård- och omsorg eller ut- landsstationerad personal. Sådana vaccinationer kan erbjudas utan kostnad för den enskilde.
6Pressmeddelande, Socialdepartementet, 2025-02-20, samt bilaga 3 till Smittskyddsförord- ningen (2004:255).
77 kap. 2 a § smittskyddslagen (2004:168).
8https://www.folkhalsomyndigheten.se/smittskydd-beredskap/vaccinationer/vacciner-som- anvands-i-sverige/vaccin-mot-rs-virus/, besökt 2024-10-07.
SOU 2025:71 |
Överväganden kring vaccinationer |
Alla vaccinationer är frivilliga i Sverige. Det har tidigare gjorts upp- skattningar att det administreras cirka 5 miljoner vaccinationsdoser per år i Sverige, ungefärligt fördelat på 30 procent i nationella vacci- nationsprogram, 30 procent till riskgrupper (främst influensa), 30 pro- cent vaccinationer mot TBE och 10 procent övriga vaccinationer.9 År 2023 gjordes enligt Folkhälsomyndighetens statistik även 2,7 mil- joner vaccinationer mot covid-19.
Alla vacciner administreras inte av hälso- och sjukvårdspersonal
Det finns vacciner som inte behöver administreras av hälso- och sjukvårdspersonal utan som är tillverkade i en beredningsform som patienten själv kan hantera. Sådana vacciner kan förskrivas för pati- enten att hämta ut på öppenvårdsapotek. Detta gäller t.ex. vaccin för aktiv immunisering mot sjukdom orsakad av Vibrio cholerae (kolera) och för aktiv oral immunisering mot tyfoidfeber. Båda vaccinatio- nerna är att betrakta som resevaccinationer och effekten sitter i två respektive tre år efter genomgången immunisering. Därefter behöver vaccinationen kompletteras eller förnyas.
Vacciner i beredningsformer som skulle kunna hanteras av patienten själv men som ändå administreras av hälso- och sjukvårdspersonal
Det förekommer också orala vaccinationer mot rotavirus och vacciner i form av nässpray mot influensa. Vaccination mot rotavirus ingår i dag i det allmänna vaccinationsprogrammet för barn. Vaccinationen genomförs när barnet är mellan sex veckor och fem månader gammalt. Även om beredningsformen är sådan att den normalt kan hanteras av vårdnadshavaren genomförs vaccinationen av hälso- och sjukvårds- personal i barnhälsovården eftersom barnen är väldigt små, att det är viktigt att veta att hela dosen administrerats och att vaccinationen, då den ingår i det allmänna vaccinationsprogrammet, ska erbjudas kostnadsfritt. En annan viktig orsak till att vaccinet administreras av hälso- och sjukvårdspersonal är att i samband med vaccinationen kunna ge information om en väldigt sällsynt men potentiellt allvarlig biverkning, tarminvagination.
9E-hälsomyndigheten, 2020 Förstudie digitalt vaccinationskort, dnr 2019/03799, s. 21.
Överväganden kring vaccinationer |
SOU 2025:71 |
Nasalt vaccin mot influensa är avsett för användning i ålders- grupperna 12 eller 24 månader (beroende av vaccin) upp till 18 år, som ett alternativ ifall injektion inte är möjlig eller önskvärd. Även om patienten teoretiskt kan administrera vaccinet själv ska patienten, som vid administrering av många andra vacciner, övervakas en tid efter vaccinationen. Det är därför utredningens bedömning att dessa vacciner oftast administreras i hälso- och sjukvården.
Uppgifter om beställning och distribution av vacciner
De flesta vacciner rekvireras och distribueras direkt till vårdgivarna via partihandelsaktörer. Uppgifter från E-hälsomyndigheten visar att det via partihandeln år 2024 såldes knappt 1,8 miljoner för- packningar vaccin. Av dessa rekvirerades och distribuerades runt 244 000 förpackningar via sjukhusapotek och 15 500 via öppen- vårdsapotek.
Knappt 29 000 förpackningar förskrevs på recept. Av dessa var cirka 7 300 förpackningar vacciner i en oral beredningsform som patienten kan hantera själv. Resterande dryga 21 000 förpackningar utgjordes av olika vacciner för injektion, mestadels vaccination mot TBE, HPV och vattkoppor eller bältros.10
9.1.3Informationen om genomförda vaccinationer är i dag fragmenterad
Vaccinationer ska, liksom alla andra hälso- och sjukvårdsåtgärder, journalföras. Därför finns den mest kompletta informationen om en patients genomförda vaccinationer i de olika journalhandlingar som tillsammans utgör patientjournalen. Problemet är detsamma som med all annan vårdinformation, den är ofta spridd över flera olika vårdgivare och, om den är digital, spridd över olika informa- tionssystem. Som huvudregel gäller också att en journalhandling ska bevaras minst tio år efter det att den sista uppgiften fördes in i handlingen.11 Därefter kan handlingen gallras.
Vårdgivare som är anslutna till Inera AB:s e-tjänst Nationell pati- entöversikt kan där ta del av journalinformation om genomförda
10Försäljningsuppgifter från E-hälsomyndigheten.
113 kap. 17 § patientdatalagen (2008:355).
SOU 2025:71 |
Överväganden kring vaccinationer |
vaccinationer utan någon bakre tidsgräns.12 Som beskrevs i avsnitt 7.2 kan dock inte alla vårdgivare vare sig producera eller konsumera information i den nationella patientöversikten. I dag delar 19 av
21 regioner, 8 av 290 kommuner och 4 privata vårdgivare informa- tion om vissa genomförda vaccinationer genom tjänsten.13 Infor- mationen i tjänsten är bara tillgänglig för hälso- och sjukvårdsper- sonal.
Enligt lagen (2012:453) om register över nationella vaccinations- program ska vårdgivare rapportera alla vaccinationer inom barn- vaccinationsprogrammet, vaccinationer inom det särskilda vacci- nationsprogrammet för riskgrupper samt covid-19-vaccinationer till det nationella vaccinationsregistret vid Folkhälsomyndigheten. Detta gäller de barnvaccinationer som har getts i Sverige från den
1januari 2013 samt covid-19-vaccinationer från den 1 januari 2021 och, från den 1 december 2022, vaccinationer mot pneumokocker givna inom det särskilda programmet för riskgrupper. För vaccina- tioner som getts före detta har det inte funnits något nationellt regi- ster att rapportera till. Vilka vaccinationer som framgent ska rappor- teras till registret har nyligen utretts, se vidare avsnitt 9.3. En enskild har enligt artikel 15 i EU:s dataskyddsförordning14 rätt att få del av vilka uppgifter som finns registrerade om den enskilde i vaccinations- registret genom att kontakta Folkhälsomyndigheten.
Information om hur vaccinationsprogrammen sett ut historiskt går att ta del av via Folkhälsomyndighetens websidor.15 Den individ som t.ex. vet att den fått vaccinationer i enlighet med programmen kan utifrån denna information sannolikt dra slutsats om vilket skydd den borde ha mot vissa sjukdomar. Den individ som vill ta reda på exakt vilka vaccinationer man tidigare fått, och som inte har kvar någon egen dokumentation, är däremot hänvisad till att begära ut journalhandlingar från de vårdgivare där man blivit vaccinerad.
Information om vissa genomförda vaccinationer finns för den enskilde att tillgå genom e-tjänsten 1177 journal på sajten 1177.se. I dag delar 19 av 21 regioner, 22 av 290 kommuner och 2 privata
12Inera AB, 2024, Nationell patientöversikt 4.8, ver. AK.
13https://www.inera.se/globalassets/inera/media/dokument/tjanster/nationell- patientoversikt/informationsmangder-npo.xlsx, besökt 2024-10-07.
14Europaparlamentets och rådets förordning (EU) 2016/679 av den 27 april 2016 om skydd för fysiska personer med avseende på behandling av personuppgifter och om det fria flödet av sådana uppgifter och om upphävande av direktiv 95/46/EG (allmän dataskyddsförordning).
15https://www.folkhalsomyndigheten.se/smittskydd-beredskap/vaccinationer/nationella- vaccinationsprogram/tidigare-vaccinationsprogram/, besökt 2024-07-02.
Överväganden kring vaccinationer |
SOU 2025:71 |
vårdgivare information om vissa genomförda vaccinationer genom tjänsten.16 Eftersom en individs alla vaccinationer genomförts över lång tid kan en enskild person finna information om vissa vaccina- tioner genom tjänsten medan andra vaccinationer tidigare genom- förda av samma vårdgivare inte visas. Den som fått sin vaccination hos vissa privata vårdgivare kan också logga in direkt hos den privata aktören MittVaccin och få information om vaccinationer genom- förda av någon av de anslutna vårdgivarna. I andra fall kan patienten också ha fått ett vaccinationskort på papper med uppgifter om vacci- nationen.
För barnhälsovård, elevhälsa och vaccinationsmottagningar gäller samma lagar om journalhantering som för andra vårdgivare. Det inne- bär att om det gått mer än tio år sedan sista uppgiften fördes in i jour- nalhandlingen så är det inte säkert att dokumentationen finns kvar eftersom uppgiften därefter kan gallras. Det finns dock rutiner för överföring av journalinformation mellan barnhälsovård och elevhälsa och rekommendationen är att patientjournaler upprättade i barnhälso- vård och skolhälsovård bör bevaras. Detsamma gäller journalhand- lingar som rör vaccinationer generellt.17
Utredningen kan avslutningsvis konstatera att den som i dag vill göra en sammanställning av en individs genomförda vaccinationer med stor sannolikhet behöver söka information i flera olika källor. Det gäller både när individen själv eller hälso- och sjukvårdspersonal eftersöker informationen.
9.2E-hälsomyndighetens och Folkhälsomyndighetens förstudie
E-hälsomyndigheten och Folkhälsomyndigheten fick i augusti 2019 i uppdrag att gemensamt genomföra en förstudie om hur individen på ett digitalt och lättillgängligt sätt kan få en samlad och enhetlig bild över de vaccinationer som den enskilde tagit.18 I rapporten Förstudie digitalt vaccinationskort konstateras bl.a. att det finns ett
16https://journalen.1177.se/CountyInfo/ModuleCounty/?moduleEnum=Vaccination, besökt 2024-10-07.
17Riksarkivet och Sveriges kommuner och landsting (2014): Bevara eller gallra – råd om patientjournaler och övrig vårddokumentation i landsting/region och kommun (ISBN 978-91-7585-161-7), s. 43 ff. och 91.
18Uppdrag att genomföra en förstudie om tillgång till information om vaccinationer (S2019/03409/FS [delvis]).
SOU 2025:71 |
Överväganden kring vaccinationer |
samstämmigt och tydligt behov av en sammanhållen digital bild över givna vaccinationer – både utifrån individens, hälso- och sjukvårdens, smittskyddets och olika myndigheters perspektiv.19 Man konstaterar också att staten bör ta ansvar för att samla in information om vacci- nationer och göra den tillgänglig i en centraliserad källa för att möta både individens, hälso- och sjukvårdens och smittskyddets behov. Myndigheterna föreslog därför att utöka registret nationell läke- medelslista med information om alla givna vaccinationer och att ge individen och hälso- och sjukvården tillgång till informationen. Som alternativ föreslog man att skapa ett nytt nationellt register för samlad vaccinationsinformation. Registret föreslogs fyllas med information genom att införa en skyldighet för alla vårdgivare som ger vaccinationer, både privata och offentliga, att hantera informa- tion digitalt och rapportera alla givna vaccinationer till E-hälso- myndigheten samt att kunna ta del av informationen därifrån. Vidare föreslog man att informationen om givna vaccinationer ska hanteras livslångt. Eftersom information om alla vaccinationer föreslogs samlas i ett register föreslog man vidare att det nationella vaccina- tionsregistret hos Folkhälsomyndigheten, som används för upp- följning av nationella vaccinationsprogrammen och epidemiologisk forskning, i framtiden får uppgifter om vaccinationer via den nya lösningen i stället för direkt från vårdgivarna.
9.3Vaccinationsprogramsutredningen
Vaccinationsprogramsutredningen har haft i uppdrag att göra en översyn av och lämna förslag till ändrad reglering av de nationella vaccinationsprogrammen och det nationella vaccinationsregistret (se även 4.4.4). Syftet med utredningen var att säkerställa att de nationella vaccinationsprogrammen och det nationella vaccinations- registret är ändamålsenliga och effektiva, med beaktande av erfaren- heterna från covid-19-pandemin. Utredningen lämnade sitt betänk- ande Ett samordnat vaccinationsarbete – för effektivare hantering av kommande vacciner (SOU 2024:2) i januari 2024 och berör delvis frågor vår utredning har att beakta.
Vaccinationsprogramsutredningen föreslår bl.a. att tillämpnings- området för lagen (2012:453) om register över nationella vaccina-
19E-hälsomyndigheten, 2020, Förstudie digitalt vaccinationskort, dnr 2019/03799, s. 4.
Överväganden kring vaccinationer |
SOU 2025:71 |
tionsprogram m.m. ska utökas till att även omfatta regionalt beslutade vaccinationsprogram. Det nationella vaccinationsregistret kommer i så fall att kompletteras med fler uppgifter om vaccinationer som är relevanta för Folkhälsomyndighetens uppföljning av det svenska smittskyddet och hälsan på befolkningsnivå.20 Utredningen föreslår också att för att enklare kunna genomföra förändringar i registrets innehåll ska lagens uppgiftskatalog ange vilka personuppgifter som får behandlas på en lägre detaljnivå. En uppgiftskatalog på den detalj- nivå som i dag finns i lagen ska i stället finnas i en ny förordning.21 I samband med den nya förordningen föreslås också att uppgift om dosnummer hänförligt till den aktuella vaccinationen ska föras in i registret.22 Vaccinationsprogramsutredningens förslag är ännu inte genomförda.
Vaccinationsprogramsutredningen har även haft i uppdrag att analysera och lämna förslag på hur ett uppgiftslämnande till Läke- medelsverket skulle kunna göras på ett sätt som inte förutsätter att statistiksekretessen i det nationella vaccinationsregistret bryts. Läke- medelsverkets behov av uppgifter från registret motiveras av att myndigheten ska kunna fullgöra sina skyldigheter i fråga om säker- hetsövervakning.23 Mer konkret består behovet av tillgång till upp- gifter om t.ex. aktuellt vaccin och satsnummer för att komplettera inkomna biverkningsrapporter. Myndighetens behov identifierades även i den rapport som beskrevs i avsnitt 9.2.
Vaccinationsprogramsutredningen tolkade sitt uppdrag som att det inte var aktuellt att införa en sekretessbrytande uppgiftsskyldighet i det nationella vaccinationsregistret.24 Utredningen pekar i stället i sin bedömning på att den nationella läkemedelslistan på sikt, genom tillförande av uppgifter om läkemedel som administreras i hälso- och sjukvården, kan vara en lösning för Läkemedelsverkets infor- mationsbehov.25
20SOU 2024:2 Ett samordnat vaccinationsarbete – för effektivare hantering av kommande vacciner, s. 306 ff.
21A.a., s. 312 ff.
22A.a., s. 319.
23A.a., s. 324.
24A.a., s. 329–330.
25A.a., s. 337.
SOU 2025:71 |
Överväganden kring vaccinationer |
9.4En nationell sammanställning över en individs genomförda och planerade vaccinationer
Utredningens bedömning: Uppgifter om en patients genom- förda och planerade vaccinationer bör tillgängliggöras genom en nationell sammanställning. Informationen bör vara tillgänglig i primäranvändningssyfte för patienten själv och för vissa personer som utför hälso- och sjukvård och som har en vårdrelation till patienten. En sådan sammanställning bör åstadkommas genom att uppgifterna samlas i ett nationellt register för primäranvändning.
Utredningen bedömer att det finns skäl att samla information om en individs genomförda vaccinationer. Detta har även tidigare kon- staterats i bl.a. E-hälsomyndighetens och Folkhälsomyndighetens förstudie kring samlad information om en patients vaccinationer (se avsnitt 9.2 ovan). Utredningens analys av patientens behov av uppgifter om sina behandlingar beskrivs närmare i avsnitt 6.3.2 och hälso- och sjukvårdspersonalens behov av uppgifter i 6.4.1.
9.4.1Patientens behov av tillgång till information om vaccinationer
I korthet bedömer utredningen att den enskilde, avseende uppgifter om vaccinationer, behöver uppgifter om:
–vilka sjukdomar administrerade vaccin förmodas skydda mot,
–när senaste dosen av ett vaccin administrerades och när nästa dos behöver tas för att upprätthålla ett visst skydd, samt
–vilket specifikt vaccin som administrerats, för det fall en biverk- ning uppstår.
Uppgift om förmodat skydd och mot vilka sjukdomar är viktigt för en enskild att känna till t.ex. i samband med utbrott av en smittsam sjukdom. Ett exempel är den ökade förekomsten av mässlingen i Europa vilket leder till en ökad risk för smitta och insjuknande vid
Överväganden kring vaccinationer |
SOU 2025:71 |
utlandsresor.26 Utbrott kan också leda till inreserestriktioner om man inte är vaccinerad vilket utbrottet av covid-19 var ett tydligt exempel på.27 Vaccination mot gula febern är ett annat exempel där det för inresa till vissa länder krävs ett giltigt vaccinationsintyg.28 Det kan därför vara av vikt för den enskilde att känna till om, och i vissa fall även kunna visa att, man t.ex. fått de doser som genom åren ingått i det nationella vaccinationsprogrammet eller om man vaccinerats särskilt och därmed kan förmodas ha ett fullgott skydd mot sjukdom. Vad gäller möjligheterna att vid uppbyggnad av en sammanställning hantera historiska uppgifter se avsnitt 9.5.3.
I Arbetsmiljöverkets föreskrifter finns bestämmelser om att arbetsgivaren, vid behov, ska erbjuda vaccination, andra medicinska förebyggande åtgärder, kontroller och uppföljande kontroller, om arbetstagare kan ha utsatts för eller riskerar att utsättas för smitt- ämnen i arbetet.29 Det innebär att det är nödvändigt för den enskilde att, om man söker anställning hos en arbetsgivare där särskild risk finns för smitta eller i samband med utlandsstationering, veta vilket förmodat skydd man sedan tidigare har mot olika sjukdomar. Det kan t.ex. gälla vaccination mot hepatit. Problemet med den enskil- des tillgång till uppgifter om genomförda vaccinationer i detta syfte har t.ex. lyfts i Vaccinationsprogramsutredningen.30
För att så långt möjligt säkerställa ett fullgott skydd är det också viktigt för den enskilde att veta när den senaste dosen av ett vaccin togs och när det är dags att ta nästa dos i det fall en vaccination inte är slutförd. Att lämna sådan information måste anses utgöra en skyl- dighet för hälso- och sjukvårdspersonalen.31 Ofta kräver en grund- vaccination flera doser och i vissa fall krävs därefter en påfyllnadsdos inom vissa givna tidsintervall. Besök i barnhälsovården är anpassade till vaccinationstillfällena i det allmänna vaccinationsprogrammet och elevhälsan kallar elever för vaccination i enlighet med program-
26https://www.folkhalsomyndigheten.se/nyheter-och- press/nyhetsarkiv/2024/februari/vaccination-mot-massling-viktigt-sarskilt-vid- utlandsresor/, besökt 2024-06-28.
27Se t.ex. förordningen (2020:1258) om tillfälligt inreseförbud vid resor från EES-stater och några andra stater till Sverige.
28Världshälsoorganisationen, International travel and health, annex 1, 18 November 2022
(revised on 3 January 2023). Countries with risk of yellow fever transmission and countries requiring proof of vaccination against yellow fever.
2910 § första stycket Arbetsmiljöverkets föreskrifter och allmänna råd (AFS 2018:4) om smittrisker.
30SOU 2024:2 Ett samordnat vaccinationsarbete – för effektivare hantering av kommande vacciner, s. 214 samt 260 ff.
31Se t.ex. 3 kap. 1 och 7 §§ patientlagen (2014:821).
SOU 2025:71 |
Överväganden kring vaccinationer |
met. Behovet av påminnelse om vaccination gäller därför framför allt vaccinationer som inte ingår i ett nationellt eller regionalt program där hälso- och sjukvården eller elevhälsan har kontroll på givna doser och aktivt erbjuder individen nästa dos. Det gäller t.ex. vid resevacci- nationer samt vaccinationer mot TBE som tas på en enskilds eget initiativ. Även vissa privata aktörer erbjuder olika påminnelsetjänster. Om en vaccination inte förnyas med det tidsintervall som gäller för det specifika vaccinet finns en risk att skyddet minskar eller helt upphör och individen riskerar att smittas och insjukna i sjukdom. Det finns även risker förknippade med att ta vacciner för ofta då det kan öka risken för biverkningar.
I samband med resa kan en enskild också av andra skäl behöva känna till och kunna uppvisa intyg på vilka vaccinationer denne genomfört, vilka doser den fått och när, för att kunna resa in till och vistas i vissa områden. Särskilda internationellt överenskomna regler finns t.ex. för vaccination mot gula febern.32
Alla läkemedel kan ge biverkningar, så även vaccin. I dag finns möjlighet för patienten själv att, på eget initiativ, göra en biverk- ningsrapport direkt till Läkemedelsverket. En sådan biverknings- rapport behöver bl.a. innehålla information om vilken specifik pro- dukt och vilket enskilt satsnummer rapporten gäller. Det räcker t.ex. inte att ange att den rör vaccination mot TBE eller covid-19. För att kunna upprätta en komplett biverkningsrapport, tex om biverkningar i samband med vaccinering, behöver patienten tillgång till detaljerad information om vilket vaccin som givits. Om rappor- ten saknar information kan Läkemedelsverket behöva komplettera rapporten på annat sätt (se avsnitt 9.4.4).
9.4.2Hälso- och sjukvårdens behov av tillgång till information om vaccinationer
Vaccin är läkemedel och att korrekta uppgifter om vaccinationer finns tillgängliga på ett sammanhållet sätt är av betydelse för patient- säkerheten i samma utsträckning som för andra läkemedel. Att hälso- och sjukvården har tillgång till en nationell sammanställning är därför av stor betydelse även avseende administrerade vaccin. Att samhället inte ansvarar för att rekommendera eller aktivt erbjuda
32Se 15–17 §§ Folkhälsomyndighetens föreskrifter och allmänna råd (HSLF-FS 2015:8) om skydd mot internationella hot mot människors hälsa.
Överväganden kring vaccinationer |
SOU 2025:71 |
alla olika typer av vaccinationer innebär inte att hälso- och sjukvår- den saknar ansvar när sådana vacciner ges. Hälso- och sjukvårdslagens (2017:30), patientlagens (2014:821) och patientsäkerhetslagens (2010:659) bestämmelser gäller även när vaccinationer genomförs. Hälso- och sjukvårdspersonal behöver t.ex. tillgång till uppgift om när senaste dosen av ett vaccin administrerats och när nästa dos ska ges i samband med att den enskilde uppsöker en vaccinationsmot- tagning för att komplettera sitt skydd. Ett för långt intervall mot vad som är angivet i det aktuella vaccinets produktresumé kan inne- bära att en justering av doseringsschemat behöver göras eller i säll- synta fall att hela vaccinationen behöver börjas om. Ett för tätt inter- vall innebär också patientsäkerhetsrisker då det ökar risken för biverkningar.
Tillgången till informationen blir särskilt viktig i de fall den en- skilde rör sig mellan olika vårdgivare för att få sina vaccinationer vilket torde vara särskilt vanligt förekommande vid vaccination inför resor eller mot TBE. Även om grundimmuniseringen görs hos en och samma vårdgivare är det inte säkert att efterföljande påfyllnadsdoser flera år senare administreras där. Det kan också vara betydelsefullt att i samband med en akut skada veta när t.ex. den senaste dosen av stelkrampsvaccin togs för att bedöma om en ny dos behöver ges. Eftersom det i dag saknas en nationell källa till information bedömer utredningen att det finns risk att en viss övervaccination sker i dessa fall om osäkerhet föreligger.
Hälso- och sjukvårdspersonal kan också behöva bedöma vilket förmodat skydd som uppnåtts genom tidigare vaccinationer t.ex. i samband med att en enskild beviljas särskild boendeform enligt vad som beskrivs i 5 kap. 5 § socialtjänstlagen (2001:453). Det är inte alltid den enskilde erbjuds ett särskilt boende i samma kommun eller region där denne tidigare har varit bosatt.33 Genom tillgång till korrekt information om tidigare vaccinationer kan sjukvården upprätta system för information, kallelse och bokning för kommande vaccinations- tillfällen, vilket är särskilt viktigt för de grupper som av olika anled- ningar har lägre tillgång till sjukvård/vårdinrättningar. Att sådan information kan användas av vårdgivare kan bidra till ökad jämlik- het i hälsa. Även i den mån ett särskilt intyg om vaccination ska utfärdas, t.ex. enligt 24 § lagen (2006:1570) om skydd mot internatio-
33Högsta förvaltningsdomstolens dom, HFD 2024 ref. 36.
SOU 2025:71 |
Överväganden kring vaccinationer |
nella hot mot människors hälsa, behövs tillgång till komplett informa- tion om givna vaccinationer.
Även i situationer när vacciner ges för att skydda individen inom ramen för arbetsgivarens arbetsmiljöansvar bedömer behövs uppgift om tidigare givna vacciner. Svårigheter att överblicka arbetstagarens vaccinationsstatus i dessa fall uppmärksammades bl.a. av Vaccina- tionsprogramsutredningen.34
En situation när det är viktigt för hälso- och sjukvårdspersonal i barnhälsovård och elevhälsa att ha tillgång till information om givna vaccinationer är när patienten flyttar eller byter skola under uppväxt- åren när vaccinerna i det nationella vaccinationsprogrammet genom- förs. Även om kopior av barnets journal sannolikt följer med till den nya skolan underlättar tillgången till informationen i en natio- nell källa upprätthållandet av vaccinationsschemat om det finns en sammanställning av givna vaccinationer.
Säkerhetsövervakning
Säkerhetsövervakning är viktig vid användning av alla läkemedel. Särskilt när nya läkemedel, inklusive vacciner, beviljas godkännande saknas omfattande erfarenhet av dessa och det är inte säkert att re- gistreringsstudierna omfattar alla olika patientgrupper t.ex. gravida eller äldre. Fortsatt säkerhetsövervakning är därför mycket viktig för patientsäkerheten och för att samla ytterligare kunskap om an- vändningen och dess effekter.
Utredningen kan konstatera att vaccination med nya, godkända men mindre beprövade vacciner, förekommer till stora delar av be- folkningen i samband med vissa utbrott av smittsamma sjukdomar inklusive pandemier, t.ex. svininfluensan år 2009/10 och covid-19 år 2021. I samband med sådana händelser kan biverkningsrappor- teringen bli omfattande. Även i andra sammanhang introduceras nya vacciner men som riktar sig till mindre grupper. Aktuella exem- pel är nya vacciner mot RS-virus samt Dengue-feber där säkerhets- övervakningen och uppföljning blir viktig. När det gäller RS-virus finns t.ex. ännu inga tydliga rekommendationer för användning till
34SOU 2024:2 Ett samordnat vaccinationsarbete – för effektivare hantering av kommande vacciner, s. 214 samt 260 ff.
Överväganden kring vaccinationer |
SOU 2025:71 |
gravida och för Dengue-feber saknas erfarenhet vid vaccination av personer äldre än 60 år.35,36
Den som bedriver verksamhet inom hälso- och sjukvården ska snarast rapportera samtliga misstänkta biverkningar av läkemedel till Läkemedelsverket. Även misstänkta biverkningar som har sam- band med exponering i arbetet ska rapporteras.37 Hälso- och sjuk- vårdspersonal behöver därför tillgång till uppgifter om vilket vaccin, inklusive satsnummer, som administrerats en individ. Denna infor- mation ska finnas dokumenterad i patientjournalen men, som fram- gått tidigare, kan informationen vara av olika kvalitet och fragmen- terad. Det är inte heller säkert att vaccinationen genomförts hos den vårdgivare där patienten nu söker vård och som handlägger biverkningsrapporten. Det skulle därför underlätta även för hälso- och sjukvårdspersonalen om de kunde få tillgång till information om samtliga vacciner en individ fått.
Tillgången till information ligger i den enskildes intresse
I de situationer som beskrivits ovan bedömer utredningen att det ligger det i den enskildes intresse att hälso- och sjukvårdspersonal har tillgång till informationen och det kan därför antas att patien- ten som huvudregel är villig att lämna sitt samtycke till åtkomst till denna. Administrering av vaccin utgör inte heller behandling av en pågående sjukdom och är därför i de flesta fall en mindre integritets- känslig uppgift än andra uppgifter om sjukdom, även om det fort- farande utgör en känslig personuppgift.
9.4.3Apotekspersonalens behov av tillgång till information om vaccinationer
Som framgått ovan tillhandahålls de flesta vacciner direkt via hälso- och sjukvården vid vaccinationstillfället. Endast ett fåtal vacciner förskrivs på recept (se avsnitt 9.1.2). Bedömningen om en patient
35https://www.folkhalsomyndigheten.se/smittskydd-beredskap/vaccinationer/vacciner- som-anvands-i-sverige/vaccin-mot-rs-virus/, besökt 2024-10-08.
36https://infektion.net/kunskap/vagledning-for-vaccination-med-qdenga-till-svenska- resenarer/, besökt 2024-10-08.
3719 § Läkemedelsverkets föreskrifter (LVFS 2012:14) om säkerhetsövervakning av human- läkemedel.
SOU 2025:71 |
Överväganden kring vaccinationer |
bör ges ett vaccin görs därför av hälso- och sjukvårdspersonal i sam- band med beslutet om vaccination. Det har inte till utredningen framkommit några skäl för att apotekspersonal behöver ha tillgång till information om genomförda vaccinationer för att t.ex. göra en bedömning av dessa läkemedel i förhållande till annan läkemedels- behandling.
Det faktum att vissa vacciner förskrivs, trots att de administre- ras av hälso- och sjukvårdspersonal, kan innebära att information om vissa vaccinationer kommer framgå både av dagens register nationell läkemedelslista och av den sammanställning av uppgifter om administrerade vacciner som utredningen föreslår. Utredningen bedömer att detta är något som måste hanteras i den framtida ut- vecklingen och i hur uppgifter presenteras för dem som har behov av och använder informationen.
Det förekommer att apotekskedjor genom samarbeten med andra vårdgivare upplåter lokalyta för vaccinationer på öppenvårdsapotek. Utredningen bedömer att de som ordinerar och genomför dessa vaccinationer kommer att kunna ha tillgång till informationen i sin egenskap av hälso- och sjukvårdspersonal på samma sätt som gäller för annan läkemedelsbehandling. Apotekspersonal som genomför expedieringar på öppenvårdsapotek bedöms inte behöva ha tillgång till information om genomförda vaccinationer.
9.4.4Andra identifierade behov
IE-hälsomyndighetens och Folkhälsomyndighetens rapport För- studie digitalt vaccinationskort identifieras andra behov än patien- tens och hälso- och sjukvårdspersonalens tillgång till information om givna vaccinationer.38 Myndigheterna konstaterar bl.a. att Läke- medelsverket har ett behov av tillgång till information för att kunna genomföra säkerhetsövervakning. Läkemedelsverkets behov har också analyserats av Vaccinationsprogramsutredningen (se avsnitt 9.3 ovan). Myndigheterna identifierar också att smittskyddsläkare i sin myndighetsutövning har behov av viss information om givna vacci- nationer. Folkhälsomyndigheten har också framfört behov av ytter- ligare uppgifter.
38E-hälsomyndigheten, 2020, Förstudie digitalt vaccinationskort, dnr 2019/03799, s. 68 ff.
Överväganden kring vaccinationer |
SOU 2025:71 |
Läkemedelsverkets behov av uppgifter för säkerhetsövervakning
Det finns ett behov av tillgång till olika uppgifter för att kunna genomföra en effektiv säkerhetsövervakning av läkemedel i enlighet med de uppgifter som åligger Läkemedelsverket.39 Vaccinations- programsutredningen hade bl.a. i uppgift att analysera och lämna förslag på hur uppgiftslämnandet till Läkemedelsverket kan göras på ett sätt som inte förutsätter att statistiksekretessen i det natio- nella vaccinationsregistret bryts.40 Den utredningen bedömde att det inte var möjligt att, utan att bryta statistiksekretessen, öppna möjligheten att dela uppgifter ur vaccinationsregistret. I stället pekade den utredningen på vår utredning och möjligheter för myndigheten att ta del av uppgifter i registret nationell läkemedelslista.41
Säkerhetsövervakning av läkemedel är en viktig uppgift och att biverkningsrapporter är ett viktigt led i att genomföra denna över- vakning. Att stimulera biverkningsrapportering är därför viktigt.
Utredningens bedömning är att tillgång till uppgifter genom en nationell sammanställning av genomförda vaccinationer inte med automatik påverkar biverkningsrapporteringen. Det utgör däremot ett verktyg som, när en biverkan uppstår och en patient själv tar initiativ till att rapportera biverkan eller kontaktar hälso- och sjuk- vården, underlättar själva rapporteringen så att den blir korrekt och effektiv.
Vad gäller frågan om att kunna upprätta kompletta biverknings- rapporter gör vår utredning bedömningen att det bör finnas andra alternativ än att tillåta Läkemedelsverket ta del av information i ett register. Det kan inte anses vara en effektiv åtgärd att myndigheten i efterhand ska eftersöka information som, om den varit tillgänglig, enkelt hade kunnat ingå i en biverkningsrapport från början. Behovet bör i stället lösas genom att patienten och hälso- och sjukvårdsper- sonalen ges bättre tillgång till uppgifter om individens vaccinationer. Utredningen menar att om patient och hälso- och sjukvårdspersonal får tillgång till information om givna vaccinationer, inklusive det givna vaccinets satsnummer, bör den information som krävs för att kunna upprätta biverkningsrapporten i mycket högre grad kunna
39Se 6 kap. 1 § läkemedelslagen (2015:315) samt 19 § förordningen (2020:57) med instruktion för Läkemedelsverket.
40En mer ändamålsenlig och effektiv ordning för de nationella vaccinationsprogrammen och det nationella vaccinationsregistret (dir. 2022:109), s. 15.
41SOU 2024:2 Ett samordnat vaccinationsarbete – för effektivare hantering av kommande vacciner, s. 337.
SOU 2025:71 |
Överväganden kring vaccinationer |
anges redan vid rapportens upprättande. Initialt kan myndigheten i e-tjänsten för biverkningsrapportering göra en hänvisning till att individen kan hitta informationen i ett nationellt register. I ett längre perspektiv finns eventuellt möjlighet att vidareutveckla den elek- troniska tjänsten biverkningsrapportering så att uppgifter på patien- tens initiativ kan importeras direkt till rapporten. En sådan ordning som beskrivs ovan ger patienten fortsatt kontroll över informationen. Eftersom en biverkningsrapport ligger i patientens intresse bedömer utredningen att det inte heller finns skäl att anta att patienten skulle avstå från att genomföra biverkningsrapporten eller samtycka till att hälso- och sjukvårdspersonal tar del av och använder uppgifter ur en nationell sammanställning för att skapa en biverkningsrapport. I de fall en patient skulle välja att inte samtycka till att informationen används får myndigheten falla tillbaka på de i dag tillgängliga meto- derna för att komplettera information. Till exempel får personupp- gifter i patientjournalen behandlas inom hälso- och sjukvården om det behövs för att upprätta annan dokumentation som följer av lag, förordning eller annan författning.42 Hälso- och sjukvårdspersonal är enligt vad som tidigare beskrivits skyldiga att genomföra biverk- ningsrapportering ifall en misstänkt biverkning uppstår. Det kan dock vara ett tidsödande arbete att hitta uppgifterna ifall de finns i en annan vårdgivares journalhandlingar.
Utredningen bedömer att möjligheten för olika myndigheter att ta del av personuppgifter i registret nationell läkemedelista avse- ende en enskild person bör vara begränsat för att upprätthålla för- troendet för informationshanteringen och säkerställa en god infor- mationstäckning. Tillgång till information genom registret nationell läkemedelslista innebär vissa skillnader i förhållande till hälsodata- register som t.ex. läkemedelsregistret eller det nationella vaccinations- registret där informationen omfattas av statistiksekretess och en en- skild individ inte kan identifieras. Risken är att det övergripande målet, en god tillgång till information om genomförda vaccinationer för patienten och hälso- och sjukvårdspersonalen, äventyras om förtro- endet för vilket integritetsskydd som tillförsäkras registrerade upp- gifter äventyras. I det aktuella fallet bedömer utredningen att det syfte som E-hälsomyndigheten och Folkhälsomyndigheten föreslog i rapporten kan uppnås på ett alternativt och mindre ingripande sätt.
422 kap. 4 § första stycket 3 patientdatalagen.
Överväganden kring vaccinationer |
SOU 2025:71 |
Folkhälsomyndighetens behov av ytterligare information om vaccinationer
Enligt 16 och 17 §§ förordningen (2021:248) med instruktion för Folkhälsomyndigheten ska myndigheten samordna, följa och ut- veckla smittskyddet på nationell nivå och även utvärdera effekterna av vaccinationer och andra smittskyddsåtgärder inom hälso- och sjukvården och andra samhällssektorer. I Folkhälsomyndighetens uppdrag ingår arbete med att rekommendera vaccinationer och vac- cinationsprogram, samt bistå med implementering och uppföljning av dessa. En viktig del i uppföljningen är att sammanställa och åter- koppla data om vaccinationstäckning till relevanta målgrupper som underlag i arbetet att höja vaccinationstäckningen och därmed skyd- det mot smittsamma sjukdomar. Uppföljning och jämförelse mellan regioner är en fråga om jämlik vård.
Folkhälsomyndigheten har till vår utredning framfört behov av uppgifter om fler vaccinationer än vad som i dag finns tillgängliga via det nationella vaccinationsregistret eller vad som blir tillgängligt genom Vaccinationsprogramsutredningens förslag. I dag registreras de vaccinationer som ges inom nationella program, samt covid-19, i hälsodataregistret det nationella vaccinationsregistret. Data ur detta register kan användas för myndighetens arbete med att följa vaccina- tionstäckning och effekt, för att kunna upptäcka ojämlikhet i vacci- nationstäckningsgrad mellan regioner och områden och för att kunna arbeta med vaccinacceptans. För att kunna följa vaccinationstäckning för vaccinationer som inte ingår i ovan nämnda program inhämtar myndigheten data via andra register till exempel graviditetsregistret och olika regionala register. Vissa av dessa register är inte av samma kvalitet som det nationella vaccinationsregistret avseende vaccina- tionsuppgifter, eller har uppföljning av vaccinationer som ändamål. Rapportering av dessa uppgifter är ofta frivillig och att dela data med myndigheten är frivilligt. Medverkan till statistik för vaccina- tionstäckning varierar därför. Viss justering av registrets innehåll har föreslagits av Vaccinationsprogramsutredningen men dessa för- slag täcker inte alla myndighetens behov av information om vacci- nationer.
Folkhälsomyndigheten ser utifrån ovanstående ett behov att kunna inhämta data om till exempel antalet vaccinerade per åldersgrupp och region från en annan nationell källa av god kvalitet i de fall vaccina-
SOU 2025:71 |
Överväganden kring vaccinationer |
tioner inte registreras i det nationella vaccinationsregistret. Sådana uppgifter behövs för att kunna följa vaccinationstäckning även för dessa vacciner, för att kunna upptäcka ojämlikhet i vaccinations- täckning mellan regioner och områden samt för att kunna arbeta med vaccinacceptans och även för att få data som underlag för kom- mande program och rekommendationer.
Utredningen ser att det för sekundäranvändning finns ett behov av tillgång till uppgifter om fler vaccinationer, för Folkhälsomyn- digheten och för andra aktörer. Utredningen bedömer att uppgifter för sekundäranvändning i första hand bör hämtas i de hälsodata- register vars syfte är sekundäranvändning. Utredningen om hälso- dataregister har föreslagit att uppgifter om rekvisitionsläkemedel ska samlas in till ett nytt hälsodataregister, registret över admini- strerade läkemedel, hos Socialstyrelsen.43 Registret föreslås innehålla uppgifter om en patient som tillhandahållits ett läkemedel inom sluten vård eller öppen specialiserad vård.44 Det föreslagna hälso- dataregistret omfattar även administrerade vacciner men avgränsas i förslaget till sluten vård eller öppen specialiserad vård. De flesta vacciner administreras i öppen vård. Genom tilläggsdirektiv har vår utredning bl.a. fått i uppdrag att se över den ovan nämnda avgräns- ningen. Genom vår utrednings förslag kommer även läkemedel admi- nistrerade i icke specialiserad öppenvård att få ingå i registret, se vidare kapitel 17. Därmed kommer uppgifter om samtliga vacciner finnas i ett hälsodataregister med sekundäranvändning som huvuds- akligt syfte. Utredningen bedömer att detta är en mindre ingripande lösning än att möjliggöra sekundäranvändning av uppgifter ur ett register med primäranvändning som huvudsakligt syfte.
Smittskyddsläkares tillgång till information om vaccinationer
E-hälsomyndigheten och Folkhälsomyndigheten föreslår i ovan nämnda rapport Förstudie digitalt vaccinationskort att även smitt- skyddsläkare ges viss tillgång till information om vaccinationer om dessa förs in i registret nationell läkemedelslista.45 Smittskydds- läkare uppges ha behov av tillgång till uppgifter
43SOU 2024:57 Ett nytt regelverk för hälsodataregister, s. 287 ff.
44A.a., s. 388 ff.
45E-hälsomyndigheten, 2020, Förstudie digitalt vaccinationskort, dnr 2019/03799, s. 69.
Överväganden kring vaccinationer |
SOU 2025:71 |
–för att analysera och jämföra vaccinationstäckning inom sitt ansvarsområde,
–som stöd för att planera, utveckla och förbättra information och tillgänglighet samt
–som stöd för att förebygga och hantera utbrott.
För ovanstående behov behövs tillgång till information både på anonymiserad aggregerad nivå och på individnivå.
Analyser av vaccinationstäckning på anonymiserad aggregerad nivå
I dag får smittskyddsläkare huvudsakligen information om vacci- nationstäckning avseende vaccinationer inom det allmänna vaccina- tionsprogrammet från det nationella vaccinationsregistret. Detta sker halvårsvis när Folkhälsomyndigheten sammanställer och leve- rerar data ur detta register.46 Vaccinationsprogramsutredningen har därutöver lämnat förslaget att det nationella vaccinationsregistret även ska omfatta regionalt beslutade vaccinationsprogram. Detta ska enligt den utredningen ge Folkhälsomyndigheten bättre möj- ligheter till uppföljning av det svenska smittskyddet och hälsan på befolkningsnivå.47 Utöver att Folkhälsomyndigheten ges bättre möjlighet att övervaka det samlade svenska smittskyddet kan myn- digheten även stötta regionerna i deras smittskyddsarbete med underlag för uppföljning.48 Exempel på vaccinationsinsatser som det finns givna vinster för att registrera i det nationella vaccinations- registret är de för influensa och för pneumokocker till andra än de som omfattas av det nationella vaccinationsprogrammet. Även vacci- nationer mot kikhosta till gravida är önskvärda att inkludera i det nationella vaccinationsregistret eftersom den statistiken är svårtill- gänglig.49
Av rapporten från de båda myndigheterna framgår att smittskydds- läkarna för att analysera och jämföra vaccinationstäckning även har behov av tillgång till aktuell sammanställd (aggregerad) och anony- miserad, samlad information baserad på individers samtliga vacci-
46A.a.
47SOU 2024:2 Ett samordnat vaccinationsarbete – för effektivare hantering av kommande vacciner, s. 288 ff. samt 306 ff.
48A.a., s. 288.
49A.a.
SOU 2025:71 |
Överväganden kring vaccinationer |
nationer på regional nivå.50 Vaccinationsprogramsutredningen gör dock en annan bedömning. För vaccinationer som individer på eget initiativ beslutar att ta och bekostar, så som resevaccinationer, finns inte något skäl att bevaka täckningsgrad. Detsamma gäller vaccina- tioner som ges inom arbetsgivaransvaret eller vaccinationer som ordineras av den behandlande läkaren i det enskilda fallet, något som kan jämställas med annan läkemedelsanvändning och som kan följas upp av den behandlande läkaren. Utifrån Folkhälsomyndig- hetens uppdrag att följa smittskydd och hälsa på befolkningsnivå i Sverige anser vaccinationsprogramsutredningen att det ligger nära till hands att vaccinationsregistret fortsatt ska vara ett register för övervakning av offentligt organiserade vaccinationsinsatser, och inte av enskilda vaccinationer eller vacciner.51
Registret nationell läkemedelslista och de frågor denna utred- ning ska utreda rör i första hand patientens, hälso- och sjukvårdens samt öppenvårdsapotekens tillgång till uppgifter för den enskilde patientens vård, vilket utredningen bedömer är att betrakta som primäranvändning. De huvudsakliga ändamålen med registret är i dag primäranvändning bortsett från de specifika ändamål som regleras i 3 kap. 5 § lagen (2018:1212) om nationell läkemedelslista. Uppföljning av vaccinationstäckning och att förebygga och hantera utbrott av smittsamma sjukdomar på gruppnivå bedömer utred- ningen vara att betrakta som sekundäranvändning52 av hälsodata. Den syftar inte till den enskilde patientens vård. För sekundäranvänd- ning av hälsodata på aggregerad nivå finns andra hälsodataregister t.ex. det nationella vaccinationsregistret vid Folkhälsomyndigheten eller läkemedelsregistret vid Socialstyrelsen. Utredningen om hälso- dataregister föreslår som angetts ovan även inrättandet av ett nytt register vid Socialstyrelsen med uppgifter om läkemedel som admi- nistreras i hälso- och sjukvården.53 Samtliga dessa register innehåller eller kan komma att innehålla uppgifter om vacciner.
Genom vaccinationsprogramsutredningen föreslås det nationella vaccinationsregistrets innehåll utökas med bl.a. uppgifter om vacci- nationer även i regionalt inrättade vaccinationsprogram. När det
50E-hälsomyndigheten, 2020, Förstudie digitalt vaccinationskort, dnr 2019/03799, s. 69.
51SOU 2024:2 Ett samordnat vaccinationsarbete – för effektivare hantering av kommande vacciner, s. 291.
52För en översikt över begreppet se SOU 2023:76 Vidareanvändning av hälsodata för vård och klinisk forskning s. 96 ff.
53SOU 2024:57 Ett nytt regelverk för hälsodataregister, s. 287 ff.
Överväganden kring vaccinationer |
SOU 2025:71 |
gäller analyser av t.ex. vaccinationstäckning på regional nivå av be- tydelse för smittskyddet gör utredningen utifrån vad som angetts ovan bedömningen att dessa frågor bäst hanteras inom ramen för vaccinationsregistret och lagen (2012:453) om register över natio- nella vaccinationsprogram m.m. Vaccinationsregistret innehåller bl.a. uppgifter om folkbokföringsort och lämnas i dag ut till regio- nerna halvårsvis. Utredningens bedömning är att det utifrån infor- mationen i registret bör gå att göra analyser även på regional nivå. Personuppgifter i det nationella vaccinationsregistret får behandlas för framställning av statistik, uppföljning, utvärdering och kvalitets- säkring av nationella vaccinationsprogram och vaccinationer mot sjukdomen covid-19 samt för forskning och epidemiologiska under- sökningar.54 I den mån det finns ytterligare hinder i den nuvarande lagen, t.ex. om information om ytterligare vacciner än de som föreslås läggas till genom vaccinationsprogramsutredningens förslag gör är det utredningen bedömningen att lösningar i första hand bör sökas inom ramen för den befintliga lagstiftning som reglerar dessa behov. Om utmaningarna består i med vilken frekvens eller hur snabbt upp- gifter kan tillgängliggöras via t.ex. vaccinationsregistret är det utred- ningens bedömning att ändamålsenlig tillgång i första hand bör lösas genom att åtgärda detta, innan alternativa lösningar initieras, som att ge tillgång till andra register. Lagen om nationell läkemedels- lista syftar inte till att utgöra grund för epidemiologiska analyser på vacciner eller något annat läkemedel.
Som redovisats tidigare föreslår utredningen om hälsodataregister att uppgifter om rekvisitionsläkemedel, inklusive vacciner, ska samlas in till ett nytt hälsodataregister över administrerade läkemedel hos Socialstyrelsen.55 Personuppgifter föreslås få behandlas i registret om det är nödvändigt för att framställa statistik, framställa underlag för uppföljning, utvärdering och kvalitetssäkring, utföra epidemio- logiska studier, bedriva forskning, och fullgöra uppgiftslämnande som sker i enlighet med lag eller förordning.56 De av smittskydds- läkarna framförda behoven är av tydlig sekundäranvändningskaraktär och registret över administrerade läkemedel bör därmed även kunna användas för deras behov. Utredningen om hälsodataregister avgrän- sade dock insamlingen av uppgifter till sluten vård eller specialise-
546 § lagen (2012:453) om register över nationella vaccinationsprogram m.m.
55SOU 2024:57 Ett nytt regelverk för hälsodataregister, s. 287.
56A.a., s. 304.
SOU 2025:71 |
Överväganden kring vaccinationer |
rad öppenvård. Vår utredningen föreslår att denna begränsning tas bort, se vidare kapitel 17.
Patienten kan inte motsätta sig behandlingen av personuppgifter i de ovan redovisade hälsodataregistren. Patienten kan inte heller spärra uppgifter. Personuppgifter får dock inte användas på ett sätt som gör att en enskild individ kan identifieras.
Analyser på individnivå
Myndigheterna konstaterar i ovan nämnda rapport att smittskydds- läkare även behöver tillgång till vaccinationsdata på individnivå i sam- band med utbrottsutredningar och smittspårningsärenden, i syfte att vidta lämpliga åtgärder för att hindra vidare smittspridning.57
I rapporten bedöms smittskyddsläkare inte få ha direktåtkomst till patientjournaler.58
Sekretessbrytande bestämmelser om myndigheter och hälso- och sjukvårdspersonals skyldigheter att lämna uppgifter till smittskydds- läkaren om en person som smittats av en allmänfarlig sjukdom finns i 6 kap. 9 § smittskyddslagen (2004:168). Denna skyldighet omfattar även utlämnande av handlingar.59 Utredningens bedömning är där- med att det redan i dag är möjligt för smittskyddsläkare att, i en- skilda fall, eftersöka information ur t.ex. patientjournaler i samband med smittspårningsärenden förutsatt att det rör en allmänfarlig sjuk- dom även om det inte sker genom direktåtkomst. Den hälso- och sjukvårdspersonal som har behov av uppgifter för en enskild patients vård kommer också kunna ta del av dessa genom den sammanställning som utredningen föreslår. Utredningen gör därför bedömningen att det inte är lämpligt att ge smittskyddsläkare direktåtkomst till uppgifter i en nationell sammanställning av vaccinationer för att, på individnivå, eftersöka information om enskildas vaccinationer. En sådan möjlighet skulle ge smittskyddsläkare tillgång till information om vacciner som går utöver än vad som i dag är möjligt genom smitt- skyddslagens bestämmelser. Vidare bedömer utredningen att om till- gång till uppgifter om vaccinationer mot fler sjukdomar än de som klassas som allmänfarliga är nödvändig bör detta utredas särskilt i förhållande till smittskyddslagens bestämmelser.
57E-hälsomyndigheten, 2020, Förstudie digitalt vaccinationskort, dnr 2019/03799, s. 69.
58A.a.
59Se prop. 2003/04:30 s. 188 ff. samt prop. 1988/89:5 s. 115.
Överväganden kring vaccinationer |
SOU 2025:71 |
Utredningen bedömer att möjligheten för olika myndigheter att, avseende en enskild person, ta del av personuppgifter bör vara begränsad för att upprätthålla förtroendet för informationshanter- ingen och säkerställa en god informationstäckning.
Utredningens bedömning
Det är utifrån vad som ovan anförts utredningens bedömning att uppgifter om en patients administrerade vacciner inte ska göras tillgängliga för vare sig Läkemedelsverket, Folkhälsomyndigheten eller smittskyddsläkare genom ett nationellt register för primär- användning av sådana uppgifter som t.ex. den nationella läkemedels- listan.
9.4.5EU-förordningen om det europeiska hälsodataområdet
Uppgifter om vaccineringar ingår bland de prioriterade kategorier av elektroniska hälsodata med personuppgifter för primäranvänd- ning som regleras i EU-förordningen om det europeiska hälsodata- området och kommer därmed att vara obligatoriska att dela med andra vårdgivare nationellt och inom EU samt med patienten.60 Hur dessa data ska utbytas kommer närmare regleras i genomför- andeakter.61 Kravet på att kunna dela dessa uppgifter börjar tilläm- pas den 26 mars 2029.
9.4.6Register eller federerad lösning?
Utredningen för i kapitel 7 resonemang om för- och nackdelar med registerlösningar och federerade lösningar som grund för att dela information. I kapitel 8 utvecklas resonemanget att information om ordinerade läkemedel som administreras i hälso- och sjukvården bör delas genom federerade lösningar. Argumenten för den föreslagna federerade lösningen är bl.a. att läkemedelsordinationer kan ändras över tid och att det finns behov av att ha tillgång till den senaste informationen från alla aktuella vårdgivare. Med bl.a. den informa-
60Se artikel 14 samt bilaga I förordningen (EU) 2025/327 om det europeiska hälsodata- området.
61Se artikel 15.1 ovan nämnda EU-förordning.
SOU 2025:71 |
Överväganden kring vaccinationer |
tionen som underlag kan det hända att nya, ändrade ordinationer beslutas. Informationen kan också användas för att bedöma lämp- ligheten i annan medicinsk behandling. Utredningen bedömer att historiska data i dessa sammanhang kan ha relevans för nya beslut men att de inte alltid är nödvändiga. Oftast torde det vara informa- tion från det eller de senaste åren som är av relevans.
Inera har valt att tillgängliggöra vaccinationsinformation som en del av e-tjänsterna 1177 Journal och Nationell patientöversikt (se av- snitt 9.1.3). Ineras lösning är federerad precis som all annan informa- tion som delas genom 1177 journal och den nationella patientöver- sikten. Ineras nuvarande lösning fungerar av allt att döma i dag för de vårdgivare som är anslutna och för den information som delas genom tjänsten. En fråga som uppstår är hur dessa eller liknande tjänster skulle fungera om alla vårdgivare tvingades dela informa- tion och syftet var att bygga upp livslång information om en enskilds vaccinationer. Utredningen bedömer att det kan vara skillnad i val av lösning utifrån om syftet med informationsdelningen är att till- gängliggöra vissa ordinationer av vaccinationer som finns i en journal, eller att på sikt bygga upp ett komplett register över en enskilds genomförda vaccinationer som t.ex. kan användas som underlag för ett vaccinationskort.
Enligt utredningens bedömning finns det skäl att hantera upp- gifter om administrerade vacciner annorlunda mot andra läkemedels- ordinationer (se avsnitt 8.4.5). En ordination av ett vaccin avser inte en kontinuerlig behandling där styrka eller dosering ändras över tid. Det är snarare bevarandet av uppgifterna om det administrerade vaccinet som är av betydelse. Uppgifter om en genomförd vaccina- tion behöver finnas tillgängliga över lång tid då den avsedda effek- ten med flera vaccinationer är att uppnå livslångt skydd. Världshälso- organisationen (WHO) har t.ex. fastställt att en dos vaccin mot gula febern ger livslångt skydd.62
Behovet av att spara information under lång tid innebär en utma- ning vid federerade lösningar bl.a. genom att de elektroniska käll- systemen måste vara tillgängliga över tid. Även om det finns bestäm- melser om bevarandetider för journalhandlingar finns inget som säger att det ska upprätthållas genom elektronisk tillgång.63 Det finns exempel på att detta varit mycket svårt (se exemplet Pålsboda
62https://www.who.int/news-room/fact-sheets/detail/yellow-fever, besökt 2024-07-01.
63Se 3 kap. 17 § första stycket patientdatalagen (2008:355).
Överväganden kring vaccinationer |
SOU 2025:71 |
i avsnitt 8.4.5). Med tillgängliga avses här att systemen kontinuerligt är i drift och kan svara på anrop närhelst informationen efterfrågas. Det saknas i dag uppgifter om hur många olika elektroniska system som används för att dokumentera vaccinationer och därmed skulle påverkas av sådana krav. Enligt uppgifter från Folkhälsomyndigheten rapporterar 98 procent av de som lämnar uppgifter till vaccinations- registret uppgifter genom en direkt koppling från vårdinformations- systemet. Detta indikerar att det redan i dag finns stora möjligheter att genom gränssnitt ansluta de på marknaden större informations- system som hanterar dokumentation av vaccinationer. Det är inte osannolikt att även mindre vaccinatörer använder större kommer- siellt tillgängliga system i sin verksamhet givet det omfattande krav på dokumentation som finns.
Vaccinationsverksamheterna bedrivs bl.a. av många små vård- givare, t.ex. i form av mobila mottagningar vilket kan göra det svårt med fast uppkoppling till nätverkstjänster för att lämna uppgifter. Motsvarande situation gäller t.ex. för mindre näringsidkare när det gäller att hantera mobila digitala betallösningar. Dessa verksamhe- ter har inte heller nödvändigtvis tillgång till fast internetuppkopp- ling. Givet att utbyggnaden av mobilt bredband i Sverige överlag är god, och att enskilda verksamheter med dålig täckning kan använda satellitbaserade tjänster, bedömer utredningen att detta sannolikt utgör ett mindre problem för att kunna lämna uppgifter så länge inte kraven på bandbredd är väldigt stora.64
Det finns i dag utmaningar i hanteringen av digital information när vårdgivare upphör med sin verksamhet eller vid byte av vårdinfor- mationssystem. Även om lösningar för interoperabilitet bör under- lätta att migrera och göra information tillgänglig även i sådana situa- tioner bedömer utredningen att en registerlösning har fördelar när det gäller information som behöver finnas tillgänglig över lång tid. Vaccinationer sker inte heller så ofta utan det skulle sannolikt räcka att information om en genomförd vaccination rapporteras till ett register dagligen eller med ännu längre intervall. Även om mindre aktörer har tillgång till mobila lösningar och många gånger kan direkt- rapporter skulle detta underlätta mindre aktörers förmåga att ansluta och lämna uppgifter om de t.ex. saknar täckning. Även om olika tekniska lösningar för direkt replikering och inrapportering av upp-
64Ang. täckning se t.ex. https://pts.se/internet-och-telefoni/mobiltackning/, besökt 2024-11-29.
SOU 2025:71 |
Överväganden kring vaccinationer |
gifter i bulk bygger på samma förmåga till interoperabilitet får det konsekvenser för hur t.ex. E-hälsomyndigheten bygger ett register. Att utredningen förordar en registerlösning för uppgifter om vaccinationer bedöms inte påverka vårdens administrativa börda då
uppgifterna hämtas direkt ur patientjournalen.
Ett register över vaccinationer kan utgöra grunden för information som ska delas inom det europeiska hälsodataområdet
Vaccinationer är en av de informationsmängder som föreslås ingå i patientöversikter som ska delas för primäranvändning av hälsodata inom det europeiska hälsodataområdet.65 Sverige behöver därför finna sätt att dela denna information i enlighet med de krav som kommer att gälla. Delningen behöver antingen ske genom att in- formationen hämtas via en federerad lösning direkt från vårdgivar- nas system eller från ett nationellt register. Ett register i enlighet med det som utredningen diskuterat ovan skulle enligt utredningens bedömning kunna utgöra en källa för att dela uppgifter om admini- strerade vaccinationer såväl nationellt som över landsgränser. En sådan ordning ställer dock krav på samordning av tidslinjerna vid lagstiftning och utveckling. Enligt utredningens bedömning är detta ändå ur ett resurs- och effektivitetsperspektiv såväl som för att inte dubbelregistrera uppgifter att föredra framför att skapa separata lösningar. Hur det europeiska hälsodataområdet ska implementeras i svensk rätt utreds för närvarande av S 2024:A.
EU-kommissionen tog år 2019 initiativ till att utreda förutsätt- ningarna för ett gemensamt vaccinationskort för EU-medborgare.66 Arbetet har tagits vidare inom konsortiet Euvabeco67 som nu genom- för tolv olika pilotprojekt i sju länder med bl.a. ett EU-gemensamt vaccinationskort under perioden september 2024 till augusti 2025. Från Sverige deltar Linköpings Universitet i konsortiet men Sverige deltar inte i piloterna.68
65Se artikel 14 samt bilaga I förordningen (EU) 2025/327 om det europeiska hälsodata- området.
66EU kommissionen, Europeiska genomförandeorganet för hälsofrågor och digitala frågor,
Provision of options and recommendations for an EU citizen’s vaccination card, Europeiska unionens publikationsbyrå, 2022.
67Akronym för European Vaccination Beyond COVID-19.
68https://euvabeco.eu/, besökt 2024-07-02.
Överväganden kring vaccinationer |
SOU 2025:71 |
9.4.7Utredningens bedömning
Utifrån vad som redovisats ovan gör utredningen bedömningen att det finns behov av ytterligare uppgifter om vaccinationer som i dag inte kan tillgodoses genom befintliga lösningar. Informationen bör vara tillgänglig i primäranvändningssyfte för patienten själv och för vissa personer som utför hälso- och sjukvård och som har en vård- relation till patienten. En sådan sammanställning bör åstadkommas genom att uppgifterna samlas i ett nationellt register för primäran- vändning. Utredningens förslag redovisas i kapitel 11 och 13.
9.5Vilka uppgifter behöver tillgängliggöras
Utredningens bedömning: Ett register över vaccinationer ska utöver uppgifter som normalt framgår av en läkemedelsordina- tion t.ex. även innehålla vilken dos den aktuella administreringen utgör i förhållande till det tänkta vaccinationsschemat, när nästa dos ska ges samt vilken sjukdom vaccinationen är avsedd att skydda mot. Ett nationellt register behöver även beakta europeiska krav på informationsutbyte.
Det bör vara obligatoriskt för vårdgivare att lämna uppgifter till registret. Uppgifterna bör vid behov få lagras hela patientens livstid samt ytterligare en tid för att möjliggöra utredning i sam- band med dödsfall.
Information i registret behöver byggas upp stegvis. Det bör inte vara möjligt för individen själv att komplettera registret med egen information.
För att utgöra relevant information om en vaccination behövs till- gång till fler uppgifter än vad som framgår av en normal läkemedels- ordination.69 I samband med vaccination är det, utöver information om själva vaccinet, av betydelse att känna till information om själva vaccinationstillfället t.ex. vilken dos den aktuella administreringen utgör i förhållande till det tänkta vaccinationsschemat. Det är också relevant att i förekommande fall känna till vilken tid som ska gå till nästa dos ska administreras. Det sistnämnda är inte minst viktigt
696 kap. 10 § Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordina- tion och hantering av läkemedel i hälso- och sjukvården.
SOU 2025:71 |
Överväganden kring vaccinationer |
för patienten själv att känna till. Det är också viktigt att känna till vilken eller vilka sjukdomar den aktuella vaccinationen skyddar mot. Uppgifter om detta bör därför också ingå i registret. Sådana uppgif- ter framgår av kodverket för behandlingsorsak och finns i den natio- nella källan för ordinationsorsak.
Registrering av uppgifter i ett nationellt register måste också ske med hänsyn taget till vad som är känt kring andra beroenden till upp- gifterna, för att möjliggöra synergier och vidare datadelning. Det är t.ex. nödvändigt att ta hänsyn till de detaljkrav för delning av upp- gifter om vaccinationer inom EU genom det europeiska hälsodata- området, även om dessa detaljer ännu inte är beslutade, se vidare nedan. Det är också vara relevant att ta hänsyn till uppgifter som registreras i det nationella vaccinationsregistret (se vidare 9.6 nedan).
9.5.1Uppgifter vid informationsdelning inom Europeiska unionen
Information om vaccinering, eventuellt i form av ett vaccinationskort, är en del av de patientöversikter som utgör en prioriterad kategori elektroniska hälsodata med personuppgifter för primäranvändning inom det europeiska hälsodataområdet.70 Senast den 26 mars 2027 ska kommissionen genom genomförandeakter fastställa de tekniska specifikationerna och ange det europeiska format för utbyte av elek- tronisk hälsodokumentation som ska användas.71 Sådana specifika- tioner ska t.ex. innehålla tekniska interoperabilitetsspecifikationer för utbyte av elektroniska hälsodata, inklusive innehållsbeskrivningar, standarder och profiler för dessa data.72 EU-kommissionen tog år 2019 initiativ till att analysera information i olika länders vaccina- tionskort som en grund för vidare arbeten. I analysen framkom behovet av uppgifter om
–patienten i form av patientens namn, födelsedatum och kön,
–det aktuella vaccinationstillfället i form av datum för vaccinatio- nen, namn på vaccinet, vilken sjukdom vaccinet är avsett att skydda mot och vaccinatörens namn samt enhet,
–datum för nästa vaccination,
70Artikel 14 samt bilaga 1 förordningen (EU) 2025/327 om det europeiska hälsodataområdet.
71Artikel 15.1 ovan nämnda förordning.
72Artikel 15.1 c ovan nämnda förordning.
Överväganden kring vaccinationer |
SOU 2025:71 |
–allergier,
–om individen motsatt sig vaccination, samt
–syftet med kortet.73
I samband med utbrottet av sjukdomen covid-19 tog också det euro- peiska e-hälsonätverket fram en vägledning kring viktiga element för interoperabilitet av vaccinationsintyg.74 Utöver informations- mängderna ovan nämns unikt patientid, klassificering av vaccinet enligt Snomed CT och Världshälsoorganisationens klassificerings- system för läkemedel ofta förkortat ATC, tillverkare av vaccinet, dosnummer i förhållande till totala antalet doser, satsnummer samt närmare uppgifter om vem som utfärdat intyget.75
Kommissionens genomförandeakter som närmare ska specificera innehållet i patientöversikter och utbytet av information finns ännu inte tillgängliga. Det europeiska e-hälsonätverket har dock utifrån arbete med patientöversikter kopplat till patientrörlighetsdirektivet publicerat riktlinjer om vilka vaccinationsuppgifter som bör ingå.76 Riktlinjerna täcker in samma uppgifter som ovan redogjorts för.
Även om detaljerade specifikationer för utbyte av information om vaccinationer inom EU ännu inte är beslutade bedömer utred- ningen, mot ovanstående bakgrund, att ett nationellt register över vaccinationer för att kunna utgöra grunden för utbyte av informa- tion inom det europeiska hälsodataområdet behöver ta höjd för att kunna innehålla fler uppgifter än vad som normalt framgår av en läkemedelsordination.
9.5.2Information i registret behöver kunna bevaras livslångt
Som konstaterats tidigare (se 9.4.1) behöver ett register över vacci- nationer innehålla information som registreras under lång tid för att vara komplett och stödja individen och hälso- och sjukvårds- personalen. Generellt ges första dosen i det nationella vaccinations-
73EU kommissionen, Europeiska genomförandeorganet för hälsofrågor och digitala frågor,
Provision of options and recommendations for an EU citizen’s vaccination card Annex 2,
Design and testing of three dual templates, Europeiska unionens publikationsbyrå, 2022.
74eHealth Network Guidelines on verifiable vaccination certificates – basic interoperability elements Release 2 (2021-03-12).
75A.a., s. 8–11.
76eHealth Network Guideline on the electronic exchange of health data under Cross-Border Directive 2011/24/EU, Patient Summary, Release 3.3, June 2023.
SOU 2025:71 |
Överväganden kring vaccinationer |
programmet för barn, mot rotavirus, redan vid 6 veckors ålder även om individuella variationer förekommer. Vaccinationerna i program- met fortsätter sedan till årskurs 8–9 i grundskolan. Frivillig vaccina- tion mot TBE kan enligt produktresumé ske från 1 års ålder och skyddet behöver sedan fyllas på med jämna mellanrum hela livet för att bibehålla ett fullgott skydd. Resevaccinationer kan ske redan från småbarnsåren och fortgå hela livet beroende på resvanor. Om man föds med, eller senare under livet utvecklar sjukdom som gör att man tillhör en riskgrupp tillkommer ytterligare vaccinationer mot t.ex. influensa eller pneumokocker. Vaccination mot pneumo- kocker ska erbjudas som en del av ett särskilt nationellt vaccina- tionsprogram till den som fyller 75 år under kalenderåret och är födda år 1947 eller senare. Förutom riskgrupper rekommenderas dessutom alla över 65 år årlig influensavaccination. Rekommenda- tionerna förändras över tid men generellt sett verkar antalet vacci- nationer öka i takt med att det utvecklas skydd mot fler sjukdomar och att det framkommer evidens om effekt och kostnadseffektivitet. Information om en patients vaccinationer byggs alltså upp under hela livet och kan, om man väljer att följa rekommendationerna, omfatta en mängd vaccinationer. Av detta följer också att informa- tionen om vissa vaccinationer behöver sparas under en persons hela livstid. För att möjliggöra utredning och uppföljning även i samband med dödsfall behöver bevarandetiden vara ytterligare något längre.
9.5.3Registret behöver byggas upp över tid
Att momentant bygga upp ett komplett register över alla genom- förda vaccinationer för hela befolkningen framstår som utmanande. Informationen om vaccinationer finns i patientens journal, på papper eller digitalt, och hanteras enligt gällande journal-, arkiv- och gallrings- regler. För många nu levande personer upprättades informationen initialt i pappersjournaler och kan vara svåra att finna, om de ens finns kvar. Historisk information som finns i elektroniska journal- system skulle sannolikt tekniskt kunna importeras till ett register förutsatt att det finns lösningar för interoperabilitet på plats. Sådan information omfattar dock endast en begränsad del av befolkningen och förmodligen inte heller alla deras vaccinationer. Region Sörmland har t.ex. strukturerad information om de vacciner som administre-
Överväganden kring vaccinationer |
SOU 2025:71 |
rats i verksamheten i sina system sedan man införde Svevac77 år 2016. En person som valt att vaccinera sig i Sörmland kan dock ha infor- mation även hos andra vårdgivare. Uppbyggnad av ett register över vaccinationer kommer därför sannolikt inte kunna bli komplett för samtliga nu levande personer. Utredningen kan dock konstatera att ju förr arbetet påbörjas desto snabbare kommer nyttorna med till- gång till informationen kunna realiseras.
Nyttan ökar gradvis även om alla inte kommer ha tillgång till komplett information
Det faktum att många personer initialt inte kommer ha tillgång till komplett information om sina vaccinationer i ett register innebär inte att dessa personer på grund av det inte skulle ha nytta av infor- mation som samlas i ett nationellt register. Alla vaccinationer som genomförs efter registrets inrättande kommer inkluderas och som framgår nedan finns sannolikt möjligheter att komplettera med ytterligare information från journaler. Därmed kommer många få nytta av att få en samlad tillgång till information om t.ex. sina rese- vaccinationer och sina vaccinationer mot TBE även om de inte får tillgång till uppgifter om sina barnvaccinationer.
Viss historisk information kan finnas i patientjournalen
Flera regioner och några kommuner och privata vårdgivare delar
idag viss information om vaccinationer i e-tjänsten 1177 journal och den nationella patientöversikten. Denna information delas genom en federerad lösning från de anslutna vårdgivarnas anslutna vårdinformationssystem. Hur omfattande information, och för hur lång tid tillbaka som uppgifter finns tillgängliga i tillräckligt god kvalitet i elektroniska patientjournaler har denna utredning inte haft förutsättningar att utreda. Tillgången till uppgifter varierar sannolikt också mellan olika vårdgivare. Även om det därmed finns en teoretisk möjlighet att dela viss historisk information skulle de praktiska möjligheterna behöva utredas vidare. Om en sådan ord- ning införs skulle det också, av patientsäkerhetsskäl, behöva tydlig-
77Svevac var ett journalsystem för vaccinationer som utmönstrades år 2022. I samband med utmönstringen har några regioner valt att migrera informationen till andra system.
SOU 2025:71 |
Överväganden kring vaccinationer |
göras i registret från och med vilket datum uppgifter är att betrakta som kompletta så att informationsinnehållet kan värderas korrekt. Det behöver sannolikt även tas hänsyn till om uppgifterna går att göra interoperabla i enlighet med kommande interoperabilitetsspeci- fikationer.
Som framgått av 9.4.5 finns krav i EU-förordningen om det europeiska hälsodataområdet att registrera och dela uppgifter om vaccinationer. Utredningen har inte av förordningen kunnat utläsa hur historiska data ska hanteras.
Nationella vaccinationsregistret innehåller också historisk information
En annan källa som innehåller historisk information om vissa vac- cinationer är det nationella vaccinationsregistret vid Folkhälso- myndigheten. Registret omfattas av statistiksekretess vilket gör det svårt att direkt hämta information från detta register till ett annat register. Däremot kan en enskild, i enlighet med vad som anges i artikel 15 i EU:s dataskyddsförordning78, begära ut de uppgifter om sig själv som behandlas i registret. Det kan inte uteslutas att det där- med går att hitta vägar att komplettera ett nytt register med infor- mation, t.ex. baserat på att patienten själv begär ut informationen från Folkhälsomyndigheten och att denna används för att komplettera det nya registret genom att själv registrera uppgifterna. En sådan manuell lösning skulle dock innebära ett stort arbete för myndigheten om många individer skulle nyttja möjligheten. En mer avancerad lösning skulle vara att utreda de rättsliga och tekniska möjligheterna till en särskild tjänst där patienten, med stöd av dataskyddsförordningens bestämmelser, genom en e-tjänst kan begära ut informationen och fylla på den i det nya registret. De juridiska och tekniska förutsätt- ningarna för att patienten själv begär ut grunddata från ett register och därefter kompletterar, bearbetar och förmedlar information till vården genom andra applikationer har tidigare t.ex. undersökts i en pilotstudie vid Tandvårds- och läkemedelsförmånsverket.79
78Europaparlamentets och rådets förordning (EU) 2016/679 av den 27 april 2016 om skydd för fysiska personer med avseende på behandling av personuppgifter och om det fria flödet av sådana uppgifter och om upphävande av direktiv 95/46/EG (allmän dataskyddsförordning), EUT L 119, 4.5.2016, s. 1–88.
79Tandvårds- och läkemedelsförmånsverket, 2020, Uppföljning av cancerläkemedel och andra läkemedel via alternativa datakällor, s. 23 samt bilaga pilotstudie 3.
Överväganden kring vaccinationer |
SOU 2025:71 |
Om det skulle gå att finna möjligheter att, enligt ovan, nyttja redan befintliga uppgifter i vaccinationsregistret för att komplettera ett annat register med data skulle det endast ge tillgång till infor- mation från år 2013 när registret skapades. Om en sådan möjlighet ska övervägas behöver det också värderas i förhållande till hur om- fattande historisk information som går att göra tillgänglig via befint- liga elektroniska patientjournaler. Om t.ex. motsvarande information finns i patientjournaler från runt år 2015 bedömer utredningen att det är tveksamt om det kan motiveras att även hämta uppgifter från vaccinationsregistret givet den begränsade ytterligare mängd upp- gifter som detta skulle ge. Givet att de tekniska och rättsliga förut- sättningarna finns är det ytterst en fråga om prioriteringar av resur- ser. Utredningen bedömer utifrån ovanstående att det är tillräckligt att hämta uppgifter från befintliga elektroniska patientjournaler.
Möjlighet att själv komplettera registret med information om erhållna vaccinationer
I den rapport som togs fram av E-hälsomyndigheten och Folkhälso- myndigheten om digitala vaccinationskort föreslog att patienten skulle ges möjlighet att själv komplettera ett register med infor- mation och att få denna vidimerad av hälso- och sjukvården. Det kan till exempel gälla personer som flyttar till Sverige och har på- börjat sina vaccinationsprogram utomlands eller personer som bor delar av sina liv utomlands.80 I EU-förordningen om det europeiska hälsodataområdet fastslås att fysiska personer eller deras företrädare ska kunna föra in uppgifter i sina egna elektroniska patientjournaler. Det ska då tydligt framgå att informationen förts in av den fysiska personen eller dennes företrädare.81
Vår utrednings bedömning är att en möjlighet för patienten att komplettera ett register med uppgifter om vaccinationer är förenat med flera utmaningar. För det första krävs att uppgifterna kan läggas in i strukturerad form. För det andra är det högst osäkert om patien- ten skulle kunna lämna komplett och helt korrekt information för enskilda vaccinationer. I det fall patienten har lösa vaccinationskort på papper finns viss information registrerad som kanske, med stöd i form av t.ex. kodverk och flervallistor, skulle kunna bidra till infor-
80E-hälsomyndigheten, 2020, Förstudie digitalt vaccinationskort, dnr 2019/03799, s. 77.
81Artikel 5 förordningen (EU) 2025/327 om det europeiska hälsodataområdet.
SOU 2025:71 |
Överväganden kring vaccinationer |
mationens korrekthet i viss utsträckning. När det gäller informa- tion om i Sverige tidigare givna vacciner i nationella vaccinations- program är det inte säkert att man ens vet vilket vaccin som gavs, bara vilken sjukdom man vaccinerats mot och vilket år. Även om det i vissa fall är tillräckligt med information om en patient deltagit i det nationella vaccinationsprogrammet och vilket år de är födda för att hälso- och sjukvårdspersonalens ska kunna bedöma om de sannolikt har skydd mot en viss sjukdom utgör det en utmaning om det ska dokumenteras strukturerat tillsammans med övriga ordi- nationsuppgifter. Vad gäller de som påbörjat sina vaccinationer utan- för EU saknas också t.ex. grunduppgifter över tillgängliga vacciner och kompletteringen skulle sannolikt behöva göras i fritext. Om patienten själv skulle tillåtas att komplettera uppgifter om genom- förda vaccinationer behöver sannolikt vissa minimikrav ställas på vilka uppgifter som minst måste vara med t.ex. vilket vaccin, mot vilken sjukdom och när vaccinationen gavs. Det är också viktigt att det i så fall även tydligt framgår att det är patientrapporterade upp- gifter.
Vad gäller hälso- och sjukvårdens möjligheter att komplettera information kan det i stället övervägas en ordning där informatio- nen om tidigare givna doser i stället registreras i patientjournalen i strukturerad form och den vägen importeras som övrig information om vaccinationer till ett nationellt register. På så sätt genomförs redan vid registreringen en viss kvalitetskontroll. Detta blir också viktigt om det nationella registret ska kunna utgöra underlag för t.ex. ett europeiskt vaccinationskort. Det finns som beskrivits i avsnitt 5.2 t.ex. redan krav i Socialstyrelsens föreskrifter och allmänna råd (HSLF-FS 2017:37) om ordination och hantering av läkemedel i hälso- och sjukvården på att inhämta information, t.ex. om tidigare behandlingar, som underlag för att fatta nya beslut. Sådan information ska dokumenteras i patientjournalen.
Utredningen bedömer sammanfattningsvis att det är tveksamt om det bör vara möjligt för patienten att direkt komplettera regi- stret med information om genomförda vaccinationer. Utredningen bedömer att en sådan möjlighet i så fall bör övervägas i samband med implementeringen av övriga möjligheter för komplettering av elektronisk hälsodokumentation i enlighet med EU-förordningen om det europeiska hälsodataområdet. Det ska då tydligt framgå att informationen har förts in av den fysiska personen eller av dennes
Överväganden kring vaccinationer |
SOU 2025:71 |
företrädare. Utredningen bedömer att komplettering av uppgifter i registret bör ske i eller i anslutning till patientjournalen. På så sätt kan en kvalitetssäkring av informationen genomföras innan den, via journalen, införs i ett nationellt register.
Vårdgivares skyldighet att lämna uppgifter
För att uppgifter om genomförda vaccinationer i ett nationellt register ska vara tillförlitliga behöver alla vårdgivare, såväl privata som offentliga lämna uppgifter till registret. Dagens ordning där det är frivilligt att ansluta sig och lämna uppgifter om vaccinationer via e-tjänsterna 1177 Journal och Nationell patientöversikt är inte tillräckliga. Det är inte heller möjligt för privata vårdgivare som genomför t.ex. resevaccinationer att ansluta sig till tjänsterna. Ut- redningen anser därför att det behövs en annan ordning. I och med EU-förordningen om det europeiska hälsodataområdet kommer det också att bli obligatoriskt att registrera och dela uppgifter om vaccinationer.82
Utifrån vad som anförts ovan är det därför utredningens bedöm- ning att det bör införas en skyldighet för alla vårdgivare som genomför vaccinationer att lämna uppgifter till det föreslagna registret. Sådana uppgifter hämtas lämpligen från patientjournalen.
För att kunna bygga upp ett så komplett register som möjligt torde det vara intressant att noggrannare utreda hur mycket histo- risk information från nuvarande elektroniska patientjournaler som skulle kunna importeras med god kvalitet. En sådan utredning är dock inte nödvändig för att fatta beslut om att börja samla in upp- gifter och bygga upp ett register. Tvärtom är det av betydelse att snarast påbörja uppbyggnaden av ett register så att information regi- streras och att möjliggöra de nyttor registret kan skapa. För att inled- ningsvis kunna komplettera registret så långt möjligt finner utred- ningen att det kan finnas skäl att möjliggöra för vårdgivare att, med patientens samtycke, registrera uppgifter i registret om vaccinatio- ner som utförts innan det föreslagna nya registret skapades.
82Artikel 14 samt bilaga I förordningen (EU) 2025/327 om det europeiska hälsodata- området.
SOU 2025:71 |
Överväganden kring vaccinationer |
9.6Information till Folkhälsomyndighetens hälsodataregister över vaccinationsprogram
Utredningens bedömning: Det är lämpligt att avvakta med att föreslå en ändring i uppgiftsskyldigheten för information om vaccinationer enligt 8 § lagen (2012:453) om register över natio- nella vaccinationsprogram m.m.
Som beskrivits ovan (se avsnitt 9.1.3) rapporteras i dag uppgifter om alla vaccinationer inom barnvaccinationsprogrammet, vaccina- tioner inom det särskilda vaccinationsprogrammet för riskgrupper samt covid-19-vaccinationer till det nationella vaccinationsregistret. I betänkandet Ett samordnat vaccinationsarbete – för effektivare han- tering av kommande vacciner föreslås att registret ska utökas med ytterligare information om regionalt beslutade vaccinationsprogram. I det betänkandet förs också resonemang om att uppgifter till Folk- hälsomyndighetens hälsodataregister över nationella vaccinations- program, fortsatt det nationella vaccinationsregistret, i framtiden bör kunna hämtas direkt från den nationella läkemedelslistan och inte från vårdgivarna. Uppgifterna behöver då bara rapporteras vid ett tillfälle.83
En första fråga man behöver ställa sig kring huruvida en ordning som beskrivs ovan är möjlig är huruvida de uppgifter som rappor- teras till det nationella vaccinationsregistret också enligt våra för- slag skulle återfinnas i ett register över administrerade vaccin. Enligt Vaccinationsprogramsutredningens förslag ska det nationella vac- cinationsregistret vid Folkhälsomyndigheten få omfatta:84
1.datum för vaccinationen,
2.den vaccinerades personnummer, samordningsnummer eller annat identifikationsnummer,
3.vilket vaccin som har använts,
4.satsnummer,
5.den vårdgivare som har ansvarat för vaccinationen,
83Ett samordnat vaccinationsarbete – för effektivare hantering av kommande vacciner (SOU 2024:2), s. 293.
84A.a., s. 42.
Överväganden kring vaccinationer |
SOU 2025:71 |
6.vaccinationens dosnummer, och
7.den vaccinerades folkbokföringsort.
Utifrån vad som beskrivs i avsnitt 9.5 bedömer denna utredning att uppgifterna ovan i allt väsentligt motsvarar de uppgifter som före- slås ingå i ett register över administrerade vaccin. Det skulle därmed teoretiskt vara möjligt att överföra uppgifter från ett sådant register direkt till det nationella vaccinationsregistret. Om uppgifterna om administrerade vaccin ska ingå i registret nationell läkemedelslista skulle en sådan ordning kräva att det införs ett ändamål i lagen (2018:1212) om nationell läkemedelslista som medger den person- uppgiftsbehandling som detta skulle nödvändiggöra samt en upp- giftsskyldighet för E-hälsomyndigheten att lämna de relevanta uppgifterna till Folkhälsomyndigheten. Det skulle också kräva en ändring av uppgiftsskyldigheten i 8 § lagen (2012:453) om register över nationella vaccinationsprogram m.m.
En orsak till att Vaccinationsprogramsutredningen föreslår att uppgifterna ska hämtas från den nationella läkemedelslistan är för att minska dubbelregistrering och administrationen i vården. Rappor- teringen till det nationella vaccinationsregistret sker i dag på olika sätt men enligt Folkhälsomyndigheten hämtas cirka 98 procent av uppgifterna i dag direkt från vårdinformationssystemen. Folkhälso- myndigheten uppger att de därmed inte delar den problembeskriv- ning kring dubbelrapportering som Vaccinationsprogramutredningen gör.
Vår utredning har i kapitel 7 och 8 argumenterat för lösningar för att dela uppgifter inom hälso- och sjukvården och tandvården som bygger på interoperabilitet. Behovet av interoperabilitet upp- står oavsett om uppgifter delas federerat eller samlas i ett nationellt register. Det behövs en överenskommen standard, en interopera- bilitetslösning, oavsett hur uppgifterna ska utbytas. Själva utbytet däremot kan automatiseras. Det är därmed tveksamt om rapporter- ing av uppgifter till två olika register är betungande för vårdgivarna om vårdpersonalen inte manuellt behöver mata in uppgifterna i olika register. Folkhälsomyndigheten uppger att manuell inmatning redan i nuläget sker i mycket liten omfattning. I avsnitt 8.13.4 föreslår ut- redningen ett uppdrag till bl.a. E-hälsomyndigheten att ta fram sådana interoperabilitetsspecifikationer som krävs för att kunna utbyta
SOU 2025:71 |
Överväganden kring vaccinationer |
information om administrerade läkemedel. En sådan specifikation behöver även kunna hantera administrerade vacciner.
Utredningens förslag om en skyldighet för vårdgivare att rappor- tera uppgifter om vaccinationer till ett nationellt register ställer krav på interoperabilitet och en gemensam informationsmodell. För att utbytet av uppgifter ska fungera även med det nationella vaccinations- registret behöver även Folkhälsomyndigheten delta i arbete med framtagande av gemensamma nationella specifikationer på området. När sådana specifikationer finns på plats och är implementerade, bl.a. med anledning av vår utrednings förslag om uppgiftsskyldighet för vårdgivarna, bör även en fullständig automatiseringen av inrappor- tering till det nationella vaccinationsregistret vara möjlig. Utredningen bedömer därför att det är rimligt att avvakta med att föreslå en änd- ring av uppgiftsskyldigheten i lagen om vaccinationsregister. Skälen för det är i huvudsak dels att nuvarande rapportering måste fortgå till dess att nya krav och lösningar är implementerade, dels att det kanske inte alls är nödvändigt att göra en sådan ändring. I de fall det under implementeringsarbetet framkommer skäl för att en rappor- tering via det av utredningen föreslagna registret är ändamålsenlig, kan bestämmelserna senare ändras.
9.7Vårdnadshavares tillgång till minderårigs vaccinationsinformation
Utredningens bedömning: Frågor om vårdnadshavares tillgång till minderårigas vaccinationsinformation behöver hanteras i ett sammanhang tillsammans med övriga frågor om tillgång till hälso- och sjukvårdsuppgifter och information om förskrivningar och uthämtade läkemedel. Utredningen bedömer att det inte är lämp- ligt att särreglera tillgången till information om genomförda vac- cinationer.
Det är inte självklart att vårdnadshavare får ha direktåtkomst till en minderårigs journal- eller receptinformation. Tillämpningen av gällande rätt får även betydelse för vårdnadshavares tillgång till information om minderårigas genomförda vaccinationer. En mer nog- grann redogörelse för gällande rätt återfinns i departementsprome- morian Elektronisk tillgång till barns uppgifter inom hälso- och sjuk-
Överväganden kring vaccinationer |
SOU 2025:71 |
vården och tandvården.85 I följande avsnitt analyserar utredningen dessa frågor i förhållande till frågan om att tillgängliggöra informa- tion om vaccinationer.
9.7.1Nuvarande tillämpning av regelverket
Som konstaterats tidigare tillhandahåller Inera en teknisk lösning via 1177 för att ge patienter direktåtkomst till sina patientjournaler genom e-tjänsten 1177 journal. I tjänsten kan patienter logga in med sin e-legitimation och få elektronisk tillgång till sina patient- uppgifter från de vårdgivare som är anslutna. Informationen hämtas automatiskt från hälso- och sjukvårdens journalsystem. Målet är att det ska gå att ta del av all information som dokumenteras i region- finansierad hälso- och sjukvård och tandvård. Tjänsten ska bidra till att patienter får ökad kunskap om och ökad kontroll över sin hälso- situation samt en ökad upplevelse av delaktighet och trygghet.86
Regionerna har kommit överens om ett gemensamt ramverk för invånares åtkomst till 1177 journal. Av ramverket framgår bland annat att all digital journalinformation i regionfinansierad hälso- och sjukvård och tandvård ska lämnas ut till alla invånare som fyllt 16 år och göras tillgänglig genom direktåtkomst.87 Det innebär att alla invånare som fyllt 16 år till exempel kan se anteckningar från vårdbesök, information om vaccinationer, remisser, diagnoser, läke- medel och provsvar.88 Vidare framgår att invånare själva ska kunna välja vilken information de vill ha åtkomst till och om närstående ska kunna ta del av informationen. Vårdnadshavare ska ha tillgång till barns uppgifter till det att barnet fyller 13 år. Beroende på barnets situation kan vårdnadshavares direktåtkomst till barnets journal förlängas eller förkortas. Det är också möjligt att tidigarelägga bar- nets egen tillgång till sin information.89 Om vårdnadshavare och barn vill att åtkomsten ska förlängas behöver de ansöka om detta
85Ds 2023:26 Elektronisk tillgång till barns uppgifter inom hälso- och sjukvården och tandvården.
86https://www.inera.se/tjanster/alla-tjanster-a-o/1177-journal/#section-3219, besökt 2024-07-05.
87Inera AB och Sveriges Kommuner och Landsting, 2016, Ramverk för invånares åtkomst till journalen – Målbild och gemensamma principer för enskilds direktåtkomst till sin egen journal- information via e-tjänster, s. 3.
88Inera AB, 2022, Åldersgränser i 1177-tjänster, Utredningsrapport och barnkonsekvensanalys, s. 21 f.
89Inera AB och Sveriges Kommuner och Landsting, 2016, Ramverk för invånares åtkomst till journalen – Målbild och gemensamma principer för enskilds direktåtkomst till sin egen journal- information via e-tjänster, s. 3.
SOU 2025:71 |
Överväganden kring vaccinationer |
tillsammans med vårdpersonal. Det kan till exempel vara aktuellt när barnet har en kronisk sjukdom, en funktionsnedsättning eller om det finns andra särskilda skäl.90 Under vissa omständigheter kan patienter också nekas åtkomst till anteckningar i e-tjänsten 1177 journal. Det gäller bland annat uppgifter om patienten själv, om det är av synnerlig vikt med hänsyn till ändamålet med pågående vård och behandling att uppgiften inte lämnas ut till patienten.91
Även om det är möjligt att förlänga vårdnadshavarnas eller tidi- garelägga barnets tillgång till uppgifter i journalen finns praktiska hinder. Eftersom spärrar enligt patientdatalagen (2008:355) han- teras på vårdenhetsnivå eller utifrån vårdprocess har vissa regioner, t.ex. region Sörmland, valt att, trots beslutet om att möjliggöra till- gång genom att kontakta vårdgivaren, tillämpa principen att vårdnads- havaren måste kontakta varje enskild verksamhet där information finns tillgänglig.92 Motiveringen är bl.a. att varje enskild verksam- hetschef måste göra en mognadsbedömning av den minderårige.
I praktiken försvårar detta tillgången till information då patienten ofta helt saknar information om hur en vårdgivare organisatoriskt och tekniskt delat upp verksamheten i vårdenheter. För patienter med kronisk sjukdom eller funktionsnedsättning betyder detta att alla involverade verksamheter ska genomföra separata mognadsbe- dömningar i stället för en samlad koordinerad bedömning. En sådan ordning leder till dubbelarbete och försvårar avsevärt för patienten.
9.7.2E-hälsomyndighetens och Folkhälsomyndighetens inställning till tillgången på information om vaccinationer
I den rapport som togs fram av E-hälsomyndigheten och Folkhälso- myndigheten om digitala vaccinationskort gjorde myndigheterna bedömningen att det inte torde föreligga något principiellt hinder mot att generellt tillåta vårdnadshavare direktåtkomst till sitt barns vaccinationsuppgifter fram till dess att barnet fyller 18 år.93 Myn-
90https://www.1177.se/Stockholm/sa-fungerar-varden/lagar-och-bestammelser/barns-och- vardnadshavares-rattigheter-i-varden/#section-94045, besökt 2024-07-05.
91Inera AB och Sveriges Kommuner och Landsting, 2016, Ramverk för invånares åtkomst till journalen – Målbild och gemensamma principer för enskilds direktåtkomst till sin egen journal- information via e-tjänster, s. 4.
92https://www.1177.se/Sormland/om-1177/nar-du-loggar-in-pa-1177.se/det-har-kan-du- gora-nar-du-loggat-in/gor-ditt-barns-vardarenden-via-natet/, besökt 2024-07-05.
93E-hälsomyndigheten (2020): Förstudie digitalt vaccinationskort, dnr 2019/03799, s. 104.
Överväganden kring vaccinationer |
SOU 2025:71 |
digheterna bygger sin bedömning på i huvudsak två argument. För det första utgår gällande tillämpning av direktåtkomst för vårdnads- havare avseende sina barns journal- och receptuppgifter från att vård- nadshavarna förfogar över sekretessen fram till den minderåriges
13-årsdag. Myndigheterna anser därmed att det inte föreligger skäl att göra någon annan bedömning avseende minderårigas vaccinations- uppgifter.
För det andra, när det gäller åldersspannet 13 år fram tills barnet fyller 18 år – beroende på barnets mognadsgrad, minskar vårdnads- havarnas dispositionsrätt över sekretessen successivt. Myndigheterna anser då att uppgiften om vilka vaccinationer den minderårige har tagit, exempelvis resevaccin och vaccinationer som ingår i barnvacci- nationsprogrammet, typiskt sett inte anses vara fråga om någon sär- skilt integritetskänslig information i förhållande till vårdnadshavaren. Myndigheterna stödjer sig här på ett resonemang i propositionen En nyordning för nationella vaccinationsprogram.94 Myndigheterna menar också att det dessutom är uppgifter som vårdnadshavaren normalt har kunskap om.
E-hälsomyndigheten och Folkhälsomyndigheten anser mot bak- grund av vad som angetts ovan att det inte torde föreligga något principiellt hinder mot att generellt tillåta vårdnadshavare direkt- åtkomst till sitt barns vaccinationsuppgifter fram till dess att barnet fyller 18 år. I fall där det inte står klart att uppgifterna kan lämnas ut eller att den minderårige riskerar att utsättas för betydande men menar myndigheterna att detta kan lösas på två sätt, antingen genom borttagen direktåtkomst för vårdnadshavaren eller genom att upp- giften spärras gentemot vårdnadshavaren (spärr på begäran av hälso- och sjukvårdspersonal, se 4 kap. 4 § tredje stycket lagen (2018:1212) om nationell läkemedelslista).95
9.7.3Utredning om elektronisk tillgång till barns uppgifter inom hälso- och sjukvården och tandvården
Frågan om vårdnadshavares och minderårigas egen tillgång till infor- mation aktualiserades bl.a. under pandemin kopplat till individers åtkomst till resultat på självtester för covid. Regeringen har där- efter låtit utreda frågan. Uppdraget var att kartlägga hur den nuva-
94En nyordning för nationella vaccinationsprogram (prop. 2011/12:123), s. 67.
95E-hälsomyndigheten (2020): Förstudie digitalt vaccinationskort, dnr 2019/03799, s. 105.
SOU 2025:71 |
Överväganden kring vaccinationer |
rande ordningen fungerar när det gäller vårdnadshavares direktåt- komst till barns uppgifter inom hälso- och sjukvården inklusive tandvården samt hur situationen eventuellt kan förändras. Resul- taten presenteras i departementspromemorian Elektronisk tillgång till barns uppgifter inom hälso- och sjukvården och tandvården.96 I pro- memorian lämnas förslag på åtgärder för att åstadkomma en mer ändamålsenlig ordning för att ge vårdnadshavare, enskilt eller till- sammans med barnet, tillgång, genom direktåtkomst eller annat elek- troniskt utlämnande, till barns patientuppgifter och andra hälso- och sjukvårdsuppgifter.
I departementspromemorian föreslås i korthet att vårdnadshavare får medges elektronisk tillgång till sina barns patientuppgifter.97 Den elektroniska tillgången får ges genom direktåtkomst eller annat elek- troniskt utlämnande.98 Uppgifter som omfattas av sekretess ska spärras för vårdnadshavaren.99 Vårdgivaren ska spärra uppgifter för vårdnadshavarens elektroniska tillgång om barn som har fyllt tretton år motsätter sig vårdnadshavarens åtkomst till uppgifterna.100 Vård- givaren ska informera barn som har fyllt tretton år om rätten att motsätta sig vårdnadshavarens elektroniska åtkomst.101
Barn som har fyllt tretton år får medges elektronisk tillgång till sina patientuppgifter.102 Om vårdgivaren har spärrat en uppgift för vårdnadshavaren med hänvisning till sekretess, ska den även spärras för barnet.103
I promemorian lämnas också förslag kopplat till den nationella läkemedelslistan. Barn som har fyllt tretton år och vårdnadshavare får var för sig medges direktåtkomst till barns uppgifter i den natio- nella läkemedelslistan.104 Uppgifter som omfattas av sekretess ska spärras för vårdnadshavaren.105 E-hälsomyndigheten ska spärra upp- gifter för vårdnadshavarens direktåtkomst, om barn som har fyllt tretton år motsätter sig vårdnadshavarens åtkomst till uppgifterna.106
96Ds 2023:26 Elektronisk tillgång till barns uppgifter inom hälso- och sjukvården och tandvården.
97A.a., s. 167.
98A.a., s. 168.
99A.a., s. 168.
100A.a., s. 169.
101A.a., s. 170.
102A.a., s. 171.
103A.a., s. 172.
104A.a., s. 174.
105A.a., s. 176.
106A.a., s. 176.
Överväganden kring vaccinationer |
SOU 2025:71 |
Om E-hälsomyndigheten har spärrat en uppgift för vårdnadshavaren med hänvisning till sekretess, ska den även spärras för barnet.107 Hälso- och sjukvårdspersonal som har behörighet att förskriva läkemedel är skyldig att vid varje förskrivning till barn pröva sek- retessen. Om uppgiften inte får lämnas ut till vårdnadshavaren, är hälso- och sjukvårdspersonalen skyldig att hos E-hälsomyndighe- ten begära att få uppgiften spärrad i den nationella läkemedelslistan för direktåtkomst av vårdnadshavaren.108 Hälso- och sjukvårdsper- sonalen ska informera barn som har fyllt tretton år om rätten att motsätta sig vårdnadshavarens direktåtkomst. Om ett barn som har fyllt tretton år motsätter sig vårdnadshavarens direktåtkomst, är hälso- och sjukvårdspersonalen skyldig att hos E-hälsomyndigheten begära att få uppgiften spärrad i den nationella läkemedelslistan för direktåtkomst av vårdnadshavaren.109
Genom förslagen skulle vårdnadshavares och minderårigas till- gång till journaluppgifter och information i den nationella läke- medelslistan underlättas. Samtidigt lyfter remissinstanserna flera utmaningar med förslagen bl.a. att de kan vara svårt för en tretton- åring att ta beslut om att spärra uppgifter för en vårdnadshavare, likväl som att det finns en risk att de spärrar mer än vad som kan vara nödvändigt. Frågorna är inte enkla. De förslag som lämnas i departementspromemorian har betydelse även för vår utredning och våra förslag.
9.7.4EU-förordningen om det elektroniska hälsodataområdet
Av EU-förordningen om det elektroniska hälsodataområdet framgår att medlemsstaterna ska säkerställa att det inom ramen för tjäns- terna för tillgång till elektroniska hälsodata inrättas en eller flera fullmaktstjänster och som gör det möjligt för fysiska personer att ge andra fysiska personer som de själva väljer tillstånd att få tillgång till deras personliga elektroniska hälsodata, eller delar av dem, för deras räkning under en begränsad eller obegränsad period och vid behov, endast för ett särskilt ändamål, samt att förvalta dessa till- stånd, och för rättsliga företrädare för fysiska personer att få till-
107A.a., s. 176.
108A.a., s. 178.
109A.a., s. 179.
SOU 2025:71 |
Överväganden kring vaccinationer |
gång till personliga elektroniska hälsodata för de fysiska personer vars angelägenheter de har hand om, i enlighet med nationell rätt.
Medlemsstaterna ska fastställa regler för de tillstånd som avses i första stycket och för åtgärder som vidtas av förmyndare och andra rättsliga företrädare.110 Utredningen med uppdrag att möjliggöra en nationell digital infrastruktur för hälsodata (S 2024:A) har i uppdrag bl.a. att analysera och ta ställning till vilka anpassningar av nationell rätt som är nödvändiga respektive lämpliga med anledning av EU- förordningen och att lämna nödvändiga författningsförslag.111
9.7.5Analys angående vårdnadshavares och minderårigas tillgång till information om vacciner
Utredningen bedömer i avsnitt 9.4 att information om en enskilds vaccinationer bör samlas i ett nationellt register. Frågan om vård- nadshavares och minderårigas tillgång till uppgifterna blir därmed aktuell.
Vaccinationer i det nationella barnvaccinationsprogrammet är frivilliga. Första dosen ges vid 6 veckors ålder och huvuddelen av doserna ges innan barnet fyllt två år. Därefter sker vaccination vid
5 års ålder, i årkurs 1–2, årskurs 5 samt 8–9. Det är endast den sista vaccinationen i årskurs 8–9 som faller inom åldersintervallet 13–16 år där åtkomsten till information särskilt måste grundas på bedöm- ningar. För vaccination tillämpas en princip där båda vårdnads- havarna behöver samtycka till vaccinationen fram till dess att barnet fyllt 15 år.112 Från 15 års ålder tillämpas principen om mognads- bedömning. Grunden för detta finns i 6 kap. 11 och 13 §§ föräldra- balken (1949:381) samt 4 kap. 3 § patientlagen (2014:821). Denna ordning innebär att vårdnadshavare har kännedom om de vaccina- tioner som genomförs, även efter att barnet fyllt 13 år och fram till dess att det fyllt 15 år. Utredningen finner därmed inga skäl till att vårdnadshavare inte med automatik skulle kunna få direktåtkomst till genomförda vaccinationer fram till dess att barnet fyllt 15 år.
Efter det att barnet fyllt 15 år förändras situationen. Då kan den minderåriga på eget initiativ, efter en mognadsbedömning, begära
110Se skäl 21 samt artikel 4.2 förordningen (EU) 2025/327 om det europeiska hälsodata- området.
111Se beslut om ändrat uppdrag, S2024/01340, 2024-07-03.
112https://vardgivarguiden.se/kunskapsstod/smittskydd/amnesomraden/vaccination/halsode klaration/samtycke-barn-till-och-med-15-ar/, besökt 2024-08-22.
Överväganden kring vaccinationer |
SOU 2025:71 |
att få bli vaccinerad utan vårdnadshavarnas vetskap. Frågan har prö- vats av JO. I ett beslut från år 2022 prövade JO en vårdnadshavares anmälan gentemot Region Uppsala med anledning av att regionen vaccinerat hennes 15-åriga son utan vårdnadshavarnas samtycke. Regionens rutin var att i första hand använda sig av mognadsbedöm- ningar. Om ungdomen själv bedömdes tillräckligt mogen, var inför- stådd med vad vaccinationen innebar och syftet med denna krävde regionen inte vårdnadshavares samtycke. JO hade inga synpunkter på regionens val att som utgångspunkt inte kräva vårdnadshavares samtycke för att i stället tillämpa individuella mognadsbedömningar i de enskilda fallen.113
Det resonemang som E-hälsomyndigheten och Folkhälsomyndig- heten för kring att vaccinationsinformation inte är integritetskänslig i förhållande till vårdnadshavarna (se 9.7.2 ovan) kan behöva analy- seras vidare. I den proposition som myndigheterna använder som stöd för sitt antagande anges förvisso att de uppgifter som gäller vac- cinationer i barnvaccinationsprogrammet anses vara mindre integ- ritetskränkande. Bedömningen görs i förhållande till att uppgifterna föreslås föras in i vad som i dag är vaccinationsregistret. Proposi- tionen är några år gammal men regeringen konstaterar också i pro- positionen att det i framtiden kan komma vacciner mot sjukdomar som är mer integritetskränkande och lägger bl.a. detta till grund för valet att utforma vaccinationsregistret som ett hälsodataregister med stark sekretess.114 Regeringen valde därmed inte att gå vidare med den öppna tolkning som myndigheterna gör i sin bedömning. Myndigheterna för i den nämnda rapporten vidare resonemang om att inte heller resevaccinationer är integritetskänslig information och bör vara sådan information som vårdnadshavaren redan känner till. Vår utredning menar att det inte med automatik går att dra den slutsatsen för samtliga vaccin. Utredningen kan konstatera att det i dag finns vaccinationer mot sjukdomar som kan ges till minderåriga och som kan anses vara särskilt integritetskränkande. Det gäller t.ex. vaccination mot Mpox, tidigare benämnt apkoppor, som kan ges som både pre- och postexpositionsprofylax till riskgrupper, även till per- soner under 18 år. Mpox smittar sexuellt, bl.a. bland män som har sex med män. Det är därmed inte självklart att vaccinationsinforma-
113JO:s beslut den 28 april 2022, dnr 5984–2021.
114Prop. 2011/12:123 En nyordning för nationella vaccinationsprogram, s. 67.
SOU 2025:71 |
Överväganden kring vaccinationer |
tion för minderåriga är att betrakta som oproblematisk ur ett integ- ritetsperspektiv.
EU-förordningen om det europeiska hälsodataområdet
Utredningen konstaterar att det i EU-förordningen om det euro- peiska hälsodataområdet, enligt vad som anges i 9.7.4, finns bestäm- melser om fullmaktstjänster för att möjliggöra att fullmaktstagare kan ges tillgång till uppgifter. I skäl 21 till EU-förordningen anges dock att för att ta hänsyn till fall där visandet av vissa personliga elektroniska hälsodata om personer i beroendeställning för deras vårdnadshavare skulle kunna strida mot intressena eller viljan hos personerna i beroendeställning, inbegripet minderåriga, bör medlems- staterna kunna föreskriva begränsningar och skyddsåtgärder i natio- nell rätt, liksom mekanismer för det tekniska genomförandet av sådana begränsningar och skyddsåtgärder. Sverige behöver därför säkerställa att sådana regler finns. Som angetts ovan har utredningen S 2024:A i uppdrag bl.a. att analysera och ta ställning till vilka anpass- ningar av nationell rätt som är nödvändiga respektive lämpliga med anledning av EU-förordningen och att lämna nödvändiga författ- ningsförslag.115
Särskilt om utfärdande av vaccinationsintyg
Möjligheten att skapa ett samlat vaccinationskort eller vaccinations- intyg utifrån genomförda vaccinationer är något som ofta kommer upp som en av nyttorna med att samla information om vaccinatio- ner. Det är i dessa sammanhang viktigt att beakta behoven av sek- retess, både för vuxna och minderåriga. Det är inte självklart att all information i ett vaccinationsregister behöver vara med på vaccina- tionskortet eller vaccinationsintyget för ett visst ändamål. Det skulle i så fall innebära att innehavaren behöver visa upp mer information än vad som är nödvändigt i en given situation. Om information i ett nationellt register ska kunna användas som grund för ett digitalt eller utskrivet vaccinationsintyg inför t.ex. en resa är det nödvän- digt att detta kan tillgängliggöras på ett integritetssäkert sätt för den resande, det gäller även minderåriga. Därför behövs sannolikt
115Se beslut om ändrat uppdrag, S2024/01340, 2024-07-03.
Överväganden kring vaccinationer |
SOU 2025:71 |
en ordning där informationen kan filtreras och att ett barn kan få tillgång till nödvändig information inför resan utan att röja annan information som skulle kunna medföra men. Ett sätt som skulle kunna fungera för minderåriga är att den enskilde får möjlighet att sekretessmarkera vissa vaccinationer gentemot t.ex. vårdnadshavare. Ett annat sätt som skulle kunna fungera för äldre tonåringar som t.ex. reser på egen hand och vuxna är att möjliggöra val vid utskrift eller tillskapandet av ett digitalt kort. Bland annat dessa frågor be- höver beaktas i det vidare utvecklandet av tjänster på området.
Utredningens bedömning
Frågor om vårdnadshavares tillgång till minderårigas vaccinations- information behöver hanteras samlat i ett sammanhang tillsammans med övriga frågor om tillgång till hälso- och sjukvårdsuppgifter och information om förskrivningar och uthämtade läkemedel. Utred- ningen bedömer att det inte är lämpligt att särreglera tillgången till information om genomförda vaccinationer. En sådan ordning riske- rar att göra ett redan komplext område än mer komplext. Olika re- gler för olika närliggande områden ökar svårighetsgraden för både enskilda och hälso- och sjukvårdspersonal att överblicka, informera om och hantera sekretessfrågor. Utredningen bedömer därför att det är en mer lämplig ordning att frågor om vårdnadshavares till- gång till minderårigas vårdinformation hanteras inom ramen för den vidare beredningen av departementspromemorian Elektronisk tillgång till barns uppgifter inom hälso- och sjukvården och tandvården som redan genomförts (Ds 2023:26) samt i förhållande till de krav om fullmaktstjänster som kommer av EU-förordningen om det europeiska hälsodataområdet.