Beslutad:
Diarienummer: 2022/0603
RiR 2023:23
Till: Riksdagen
Härmed överlämnas enligt 9 § lagen (2002:1022) om revision av statlig verksamhet m.m. följande granskningsrapport:
Läkemedelsförskrivningen
– statens styrning och tillsyn
Riksrevisionen har granskat statens styrning och tillsyn av läkemedelsförskrivningen. Resultatet av granskningen redovisas i denna granskningsrapport. Den innehåller slutsatser och rekommendationer som avser regeringen (Socialdepartementet), Inspektionen för vård och omsorg, Läkemedelsverket, Socialstyrelsen, Statens beredning för medicinsk och social utvärdering och Tandvårds- och läkemedelsförmånsverket.
Riksrevisor Helena Lindberg har beslutat i detta ärende. Revisionsdirektör Gabriella Sjögren Lindquist har varit föredragande. Enhetschef Magdalena Brasch och stabsutredare Sofie Brandberg har medverkat i den slutliga handläggningen.
Helena Lindberg
Gabriella Sjögren Lindquist
För kännedom
Regeringskansliet; Socialdepartementet
Inspektionen för vård och omsorg, Läkemedelsverket, Socialstyrelsen, Statens beredning för medicinsk och social utvärdering, Tandvårds- och läkemedelsförmånsverket
Riksrevisionen
Riksrevisionen
Innehåll
| Sammanfattning | 5 | |
| 1 | Inledning | 9 |
| 1.1 | Motiv till granskning | 9 |
| 1.2 | Övergripande revisionsfråga och avgränsningar | 10 |
| 1.3 | Bedömningsgrunder | 10 |
| 1.4 | Metod och genomförande | 15 |
| 2 | Aktörerna och systemets funktionssätt | 17 |
| 2.1 | Flera yrkeskategorier har rätt att förskriva läkemedel | 17 |
| 2.2 | Regeringens styrning med överenskommelser om statsbidrag | 17 |
| 2.3 | Kunskapsstyrning av läkemedelsförskrivningen | 19 |
| 2.4 | Tillsyn av läkemedelsförskrivningen | 22 |
2.5Statens tillsyn av felaktig användning av läkemedelsförmånerna
| och smittskyddssubventioner | 24 | |
| 3 | Statsbidraget som styrmedel av förskrivningen | 26 |
| 3.1 | Styrkedjan från statsbidrag till läkemedelsförskrivning | 26 |
3.2Statsbidragets konstruktion bör ge regionerna incitament att hålla
| nere läkemedelsutgifterna | 26 |
3.3Statsbidraget mindre viktig komponent i regionernas arbete med
| läkemedelsbudgeten | 28 |
3.4Majoriteten av regionerna har decentraliserat kostnadsansvaret för
| läkemedel inom primärvården | 31 | |
| 3.5 | En statistisk analys av statsbidragets styrförmåga | 33 |
| 4 | Myndigheternas styrning med kunskap | 37 |
4.1Kunskapsunderlagen grundas på vetenskap och beprövad
| erfarenhet | 37 |
| 4.2 Myndigheterna har gedigna processer för kvalitetssäkring | 39 |
4.3Patienters och brukares medverkande i kunskapsstöden skiljer sig
| mellan myndigheterna | 44 |
4.4Involverandet av professionsrepresentanter och huvudmän i
| kunskapsstöden | 47 |
| 4.5 Myndigheternas rekommendationer är i hög grad samordnade | 49 |
4.6Myndigheternas kunskapsstyrning ger svaga resultat vad gäller
| jämlik och jämställd läkemedelsförskrivning | 52 | |
| 5 | Tillsyn av förskrivare | 58 |
5.1IVO riskerar att missa förskrivare som systematiskt ägnar sig åt
| felaktiga förskrivningar | 58 | |
| 5.2 | Långa handläggningstider vid felaktiga förskrivningar | 61 |
| 5.3 | IVO:s sanktioner påverkar förskrivarna | 65 |
Riksrevisionen
| 6 | Statens tillsyn av användningen av läkemedelssubventioner | 67 |
6.1Läkemedel för estetiska behandlingar, smittskydd och
| extemporeberedningar subventioneras felaktigt | 68 |
6.2Myndigheterna saknar förutsättningar att tillsyna användningen av
| läkemedelssubventioner | 75 |
| 6.3 Oklara sanktionsmöjligheter vid tillsyn av läkemedelssubventioner | 76 |
6.4TLV:s arbete med att följa upp och ompröva förmånsbeslut kan
| förbättras | 77 |
| 6.5 TLV saknar förutsättningar att tillsyna extemporeläkemedel | 78 |
6.6TLV har förutsättningar att tillsyna prissättningen på
| smittskyddsläkemedel | 79 |
6.7Regionerna har små möjligheter att stoppa förskrivare och få
| ersättning för felaktiga subventioner | 80 | |
| 7 | Slutsatser och rekommendationer | 82 |
7.1Tillgång till läkemedel är en förutsättning för en god vård för hela
| befolkningen | 82 |
7.2Statsbidraget är inte ett effektivt styrmedel för en mer
| kostnadseffektiv läkemedelsförskrivning | 82 |
7.3Myndigheternas styrning med kunskap ger ett bra underlag men
| den har en begränsad effekt | 85 |
| 7.4 Tillsynen av felaktiga förskrivningar är inte effektiv | 88 |
7.5Stora brister i tillsynen av förskrivningar som leder till felaktigt
| användande av läkemedelssubventioner | 90 |
| 7.6 Rekommendationer | 92 |
| Referenslista | 94 |
| Elektroniska bilagor | |
| Till rapporten finns bilagor i |
webbplats. Bilagorna kan även begäras ut från ärendets akt genom registraturen.
Bilaga 1. Överenskommelser mellan staten och regionerna om statsbidraget för läkemedelsförmåner m.m.
Bilaga 2. Statistisk undersökning av läkemedelsförskrivningen innan och efter ett kunskapsstöd publicerats
Riksrevisionen
Sammanfattning
Statsbidraget är inte ett effektivt styrmedel för en mer kostnadseffektiv läkemedelsförskrivning
Riksrevisionens bedömning är att regeringens styrning av läkemedelsförskrivningen genom statsbidraget för läkemedelsförmånerna m.m. inte är effektiv. Bidragets konstruktion ger teoretiskt regionerna incitament att verka för att hålla nere läkemedelsutgifterna. Men regionerna utgår i liten utsträckning från statsbidragets storlek under arbetet med läkemedelsbudgeten. Orsaker regionerna anger till det är att de inte getts förutsättningar att planera läkemedelsbudgeten utifrån statsbidraget. Dels annonseras vanligen storleken på statsbidraget efter att regionernas läkemedelsbudget för kommande år redan är fastslagen. Dels har de återkommande förändringarna av bidragskonstruktionen lett till svårigheter för regionerna att prognostisera statsbidragets storlek inför kommande budgetår. Sedan 2021 bistår Sveriges Kommuner och Regioner (SKR) regionerna med prognoser över kommande statsbidrag för att underlätta budgetplaneringen. Trots det baserar regionerna framför allt läkemedelsbudgeten på andra faktorer än statsbidraget. Statsbidraget kan därför mer betraktas som ett allmänt budgetstöd till regionerna än ett styrmedel.
Myndigheternas styrning med kunskap har en begränsad effekt på förskrivningen av läkemedel
Vidare bedömer Riksrevisionen att Socialstyrelsens, Läkemedelsverkets och Statens beredning för medicinsk och social utvärderings (SBU) arbete med kunskapsstyrande underlag överlag är tillfredsställande, men att kunskapsstyrningen trots det har en begränsad effekt på förskrivningen av läkemedel. Myndigheternas kunskapsstöd är samordnade men uppföljningen av kunskapsstyrningen, och återförandet av dess resultat till regionerna, kan förbättras. Kunskapsstöden grundas på vetenskap och beprövad erfarenhet, har gedigna processer för kvalitetssäkring och utgör ett stöd för olika professioners behov. Myndigheterna genomför grundlig jävsbedömning av experterna som deltar i arbetet med att ta fram kunskapsstöd. I framtagandet av underlagen behöver Socialstyrelsen och Läkemedelsverket i högre grad beakta huvudmännens behov. Läkemedelsverket behöver i högre grad involvera patienter och brukare.
Riksrevisionen 5
Tillsynen av felaktiga förskrivningar är inte effektiv
Enligt Riksrevisionens bedömning uppfyller inte Inspektionen för vård och omsorgs (IVO) handläggningstider av ärenden som gäller felaktig läkemedelsförskrivning kravet i förvaltningslagen om skyndsam handläggning. Handläggningstiderna, mängden inkomna ärenden och ärendestocken hos IVO har ökat över tid. Även Hälso- och sjukvårdens ansvarsnämnds (HSAN) handläggningstider är årslånga, vilket tillsammans med IVO:s handläggningstider leder till orimligt långa handläggningstider. Under handläggningstiden hos IVO och HSAN kan förskrivare fortsätta med den felaktiga förskrivningen om inte HSAN har fattat ett interimistiskt beslut att begränsa eller dra in förskrivningsrätten eller återkalla legitimationen efter yrkande av IVO.
IVO har inte författningsmässiga förutsättningar att utföra tillsynen av läkemedelsförskrivningen effektivt eftersom IVO saknar möjlighet att använda registeruppgifter för att söka efter förskrivare som ägnar sig åt felaktig förskrivning. Det innebär att det finns en risk för att viktiga missförhållanden helt undgår upptäckt.
Riksrevisionens bedömning är att IVO:s sanktionsmöjligheter är effektiva. De flesta yrkesutövare som har fått ett beslut med kritik upphör med den felaktiga förskrivningen. Cirka tre fjärdedelar av yrkesutövarna som har fått ett beslut om prövotid fullföljer prövotiden.
Stora brister i regleringen av felaktig användning av läkemedelsförmånerna och smittskyddssubventioner
Det finns även omfattande brister i regleringen av hur förskrivningar som leder till felaktigt användande av läkemedelsförmånerna och subventioner enligt smittskyddslagen ska hanteras. Ett exempel på felaktigt användande är när läkemedel förskrivs som kostnadsfria för patienten enligt smittskyddslagen trots att de inte används mot en smittsam sjukdom. Ett annat är när läkemedel som endast ingår i läkemedelsförmånerna för vissa grupper eller vissa tillstånd förskrivs med läkemedelsförmån även utanför begränsningarna. Exempel är diabetesläkemedel för bantning och mjukgörande krämer. Även felaktig förskrivning av narkotikaklassade och andra begärliga läkemedel som botulinumtoxin mot rynkor, tillväxthormoner till kroppsbyggare och potenshöjande läkemedel har som sidoeffekt att de belastar läkemedelsförmånerna.
Tandvårds- och läkemedelsförmånsverket (TLV) och IVO har båda tillsynsansvar på området men ingen av myndigheterna har förutsättningar att utföra tillsynen effektivt. TLV har inte tillgång till journaler eller andra uppgifter över enskilda
6 Riksrevisionen
förskrivares förskrivningar och ingen möjlighet att tillsyna enskilda förskrivare. IVO inriktar sin tillsyn på patientsäkerheten och inte läkemedelsförmånerna eller smittskyddssubventioner. IVO har inte heller möjlighet att få uppgifter från
När regionerna upptäcker felaktigt utnyttjande av läkemedelsförmånerna eller smittskyddssubventioner har de små möjligheter att stoppa förskrivarna och att få tillbaka utbetalade medel. Ett sätt för regionerna att hindra utnyttjandet av förmånen är att dra in en vårdgivares arbetsplatskod. Arbetsplatskoden behövs för att läkemedel ska kunna förskrivas med läkemedelsförmån. I många fall överklagar klinikerna indragningen av arbetsplatskoden till Socialstyrelsen. I många fall gör Socialstyrelsen bedömningen att vårdgivare ska få tillbaka arbetsplatskoden, helt i linje med förordningen om läkemedelsförmåner m.m. Enligt förordningen har alla som har en arbetsplats och är behöriga att förskriva läkemedel rätt att få en arbetsplatskod. Regionerna har inte heller möjlighet att få ersättning för redan utbetalade felaktiga förmånskostnader. Några regioner har som målsägande yrkat skadestånd för kostnader för läkemedelsförmånerna i samband med att förskrivare har åtalats för brott. Men yrkandena har ogillats när de åtalade har frikänts av domstolarna.
Rekommendationer
Till regeringen
∙För över statsbidraget för läkemedelsförmånerna m.m. till det generella statsbidraget för regioner inom anslaget för kommunalekonomisk utjämning.
∙Förtydliga myndigheternas tillsynsansvar för felaktigt användande av läkemedelsförmånerna.
∙Utred hur felaktig användning av läkemedelssubventioner kan hindras och hur regionerna kan ersättas för felaktiga utbetalningar.
∙Förtydliga reglerna för tilldelning och indragning av arbetsplatskoder.
∙Ge IVO möjlighet att använda de uppgifter om förskrivningar av särskilda läkemedel och andra läkemedel som behövs för att få kännedom om avvikande förskrivningsmönster och riskindivider inför och under tillsynen av läkemedelsförskrivarna.
∙Utred möjligheterna för HSAN att korta ned handläggningstiderna alternativt att ge IVO möjlighet att dra in eller begränsa förskrivningsrätten interimistiskt under en pågående tillsyn.
Riksrevisionen 7
Till Läkemedelsverket och Socialstyrelsen
∙Följ upp kunskapsstyrningen kontinuerligt och återför resultaten till regionerna.
∙Ta in huvudmännens, det vill säga regionernas, perspektiv och behov inför arbetet med att ta fram behandlingsrekommendationer och nationella riktlinjer.
Till Läkemedelsverket
∙Utveckla patient- och brukardeltagandet under arbetet med behandlingsrekommendationerna.
Till IVO
∙Effektivisera handläggningen av ärenden som rör brister i läkemedelsförskrivningen för att korta handläggningstiderna.
Till TLV
∙Fortsätt att utveckla och systematisera uppföljningen av förskrivarnas följsamhet till förmånsbegränsningarna.
∙Ompröva förmånsbeslutet vid låg följsamhet till förmånsbegränsningarna eller om de antaganden om kostnadseffektivitet som låg till grund för beslutet har ändrats.
8 Riksrevisionen
1 Inledning
1.1Motiv till granskning
Statens styrning och tillsyn av läkemedelsförskrivningen är viktig för patientsäkerheten och för att säkerställa att statens läkemedelssubventioner används på rätt sätt. Rätt läkemedel till rätt pris ska förskrivas till rätt person i rätt dos. Därigenom blir även läkemedelsanvändningen kostnadseffektiv. Nästan
6,9 miljoner personer hämtade ut minst ett förskrivet läkemedel 2022.1 Den totala försäljningskostnaden för receptbelagda läkemedel var 40 miljarder kronor 2022.2 Statens bidrag till regionerna för läkemedel uppgick till knappt 34,4 miljarder kronor samma år.3
Socialstyrelsen bedömer att den totala kostnaden för läkemedelsförmånerna kommer att ha ökat från 29,4 miljarder kronor 2020 till 36,4 miljarder kronor 2025, en ökning med 24 procent på fem år. Kostnadsökningarna förklaras till stor del av en ökad andel äldre i befolkningen, men också av att nya läkemedel med bättre effekt är dyrare än äldre läkemedel.4 Snabbt stigande läkemedelskostnader riskerar att tränga undan annan vård eftersom hälso- och sjukvården är en budgetstyrd verksamhet. Kostnadsökningarna accentuerar därför kraven på en kostnadseffektiv läkemedelsanvändning, och på styrning och uppföljning för att åstadkomma detta.
Vi har indikationer på att staten och regionerna, vilka staten delvis delegerat ansvaret till, har svårt att styra och tillsyna läkemedelsförskrivningen bland annat på grund av att det:
∙är många aktörer inblandade
∙finns begränsningar i möjligheten att utbyta information
∙finns luckor i befintlig ansvarsfördelning.
I Riksrevisionens tidigare granskning ”Mesta möjliga hälsa för skattepengarna” konstaterade vi att det är önskvärt ur ett statligt perspektiv att regionerna tar ett större ansvar än i dag för att informera och styra förskrivarna mot att förskriva de mest prisvärda läkemedlen inom ett sjukdomsområde.5
1
2
3
4
5
Socialstyrelsen, ”Statistik om läkemedel”, hämtad
Socialstyrelsen, Statistik om läkemedel 2022. Bilaga – Tabeller – Statistik om läkemedel 2022, tabell 2, 2023.
Regeringsbeslut S2021/08207.
Socialstyrelsen, Läkemedelsförsäljning i Sverige – analys och prognos
Riksrevisionen 9
1.2Övergripande revisionsfråga och avgränsningar
Den övergripande revisionsfrågan är följande:
Är statens styrning och tillsyn av läkemedelsförskrivningen effektiv?
Den besvaras genom följande delfrågor:
1.Är regeringens styrning av läkemedelsförskrivningen genom överenskommelser med SKR om statsbidrag för läkemedelsförmånerna m.m. effektiv?
2.Är statens kunskapsstyrning av läkemedelsförskrivningen effektiv?
3.Är statens tillsyn av läkemedelsförskrivning som medför patientsäkerhetsrisker effektiv?
4.Är statens tillsyn av felaktigt användande av läkemedelssubventioner effektiv?
Granskningen omfattar Läkemedelsverkets, Socialstyrelsens och SBU:s uppdrag att styra läkemedelsförskrivning genom kunskap. Den omfattar också IVO:s tillsyn av förskrivare som riskerar patientsäkerheten samt TLV:s och IVO:s tillsyn av läkemedelssubventioner. HSAN är inte granskningsobjekt i den här granskningen. Men HSAN:s roll i tillsynen av förskrivare beskrivs och rekommendationer riktas till regeringen.
Vi avgränsar granskningen till läkemedelsförskrivning inom hälso- och sjukvård. Vi granskar inte arbetet med den nationella läkemedelsstrategin.
1.3Bedömningsgrunder
1.3.1 Delfråga 1
För att svara på delfråga 1 använder vi oss av följande bedömningsgrund:
Statsbidraget för läkemedelsförmånerna m.m. ska leda till en mer kostnadseffektiv läkemedelsförskrivning
Kostnadsansvaret för läkemedelsförmånerna överfördes till regionerna (landstingen) 1998. Enligt regeringen skulle en överföring av kostnadsansvaret ge sjukvårdshuvudmännen bättre möjligheter att styra resursanvändningen och
10 Riksrevisionen
genomföra prioriteringar som innebar en effektivare resursanvändning inom hela sjukvården och lägre läkemedelskostnader.6 Ett statsbidrag infördes för att finansiera överföringen av kostnadsansvaret till regionerna.7 Statsbidragets utformning förhandlades fram och befästes i en överenskommelse med Landstingsförbundet.8 Modellen för hur statsbidraget beräknas och fördelas mellan regionerna har justerats upprepade gånger genom nya överenskommelser mellan staten och Landstingsförbundet/SKR, men innebörden har varit densamma.9
Vi operationaliserar bedömningsgrunden:
∙Statsbidraget är ett effektivt styrmedel för att åstadkomma en mer kostnadseffektiv läkemedelsförskrivning.
Statsbidragets utformning bör ge sådana incitament att regionerna informerar och styr de förskrivande läkarna så att de förskriver de mest prisvärda läkemedlen inom varje sjukdomsområde, att överförskrivning av läkemedel minskar samt att utgifterna för läkemedel hålls nere.
1.3.2 Delfråga 2
För att svara på delfråga 2 använder vi oss av följande bedömningsgrund:
Myndigheternas styrning med kunskap ska bidra till en effektiv läkemedelsförskrivning
Bedömningsgrunden utgår från förordningen om statlig styrning med kunskap avseende hälso- och sjukvård och socialtjänst. Styrningen med kunskap ska bidra till att målen i hälso- och sjukvårdslagen uppfylls: en god hälsa och en vård på lika villkor för hela befolkningen.10 Den ska ske genom kunskapsstöd och föreskrifter som syftar till att bidra till att hälso- och sjukvård bedrivs i enlighet med vetenskap och beprövad erfarenhet. Styrningen med kunskap ska vara samordnad, effektiv och anpassad till de behov olika professioner inom hälso- och sjukvården samt huvudmännen har. Styrningen ska även bidra till en ökad jämställdhet.11 De myndigheter som har i uppdrag att styra med kunskap i hälso- och sjukvården ska
6Prop. 1996/97:27, s. 44 ff.
7Prop. 1996/97:27, s. 41.
8Prop. 1996/97:27, s. 180 f.
9Se budgetpropositionerna för åren
103 kap. 1 § hälso- och sjukvårdslag (2017:30).
111 och 2 §§ förordning (2015:155) om statlig styrning med kunskap avseende hälso- och sjukvård och socialtjänst.
Riksrevisionen 11
samverka i Rådet för statlig styrning med kunskap avseende hälso- och sjukvård och socialtjänst (förkortat Rådet för styrning med kunskap).12 Myndigheter med uppdrag att styra läkemedelsförskrivningen med kunskap är Läkemedelsverket, Socialstyrelsen och SBU.
Vi operationaliserar bedömningsgrunden enligt följande:
∙Kunskapsstöden ska
o grundas på vetenskap och beprövad erfarenhet o ha gedigna processer för kvalitetssäkring
o beakta patienters och brukares synpunkter och erfarenheter13
o vara anpassade till och utgöra ett stöd för olika professioners och huvudmännens behov.14, 15
∙Myndigheterna ska samverka så att rekommendationer och kunskapsstöd blir samordnade.16
∙Kunskapsstyrningen ska bidra till en jämlik och jämställd läkemedelsförskrivning.17 Resultaten av kunskapsstyrningen ska följas upp och återföras till regionerna som är huvudmän för sjukvården.
1.3.3 Delfråga 3
För att svara på delfråga 3 använder vi oss av följande bedömningsgrund:
Tillsynen av läkemedelsförskrivarna ska vara effektiv
IVO ska bedriva tillsyn över att befolkningen får vård och omsorg som är säker, har god kvalitet och bedrivs i enlighet med lagar och andra föreskrifter.18 Enligt patientsäkerhetslagen ska hälso- och sjukvårdspersonalen utföra sitt arbete
i överensstämmelse med vetenskap och beprövad erfarenhet.19 Hälso- och sjukvårdens personal står under tillsyn av IVO.20 Om IVO anser att det finns skäl
124 § förordningen om statlig styrning med kunskap avseende hälso- och sjukvård och socialtjänst.
138 § 2 förordningen om statlig styrning med kunskap avseende hälso- och sjukvård och socialtjänst.
148 §
151 § förordningen om statlig styrning med kunskap avseende hälso- och sjukvård och socialtjänst.
168 § 5 förordningen om statlig styrning med kunskap avseende hälso- och sjukvård och socialtjänst.
171 § förordningen om statlig styrning med kunskap avseende hälso- och sjukvård och socialtjänst.
18Förordning (2013:176) med instruktion för Inspektionen för vård och omsorg.
196 kap. 1 § patientsäkerhetslag (2010:659).
207 kap. 1 § PSL.
12 Riksrevisionen
för prövotid, indragning eller begränsning av förskrivningsrätten eller återkallelse av legitimation ska förskrivaren anmälas till HSAN.21 HSAN fattar beslut om prövotid, begränsningar och indragning av förskrivningsrätten och återkallelse av legitimation. HSAN:s beslut kan överklagas till förvaltningsdomstol.
Vi operationaliserar bedömningsgrunden enligt följande:
∙IVO:s arbete med att välja ut vilka förskrivare som ska tillsynas ska vara effektivt.
Enligt patientsäkerhetslagen ska IVO, efter anmälan, pröva vilka klagomål mot hälso- och sjukvården och dess personal som ska utredas.22 Utöver inkomna ärenden kan IVO starta egna initiativärenden.23 Enligt IVO:s instruktion ska den egeninitierade tillsynen vara riskbaserad. Tillsynen ska planeras och genomföras med utgångspunkt i egna riskanalyser, om inte annat följer av lag, förordning eller särskilt beslut från regeringen.24
∙IVO:s handläggning av inkomna tillsynsärenden som rör förskrivningar i strid med vetenskap och beprövad erfarenhet (så kallad felaktig förskrivning) ska vara effektiv och handläggningstiderna rimliga.
Enligt förvaltningslagen ska ett ärende handläggas så enkelt, snabbt och kostnadseffektivt som möjligt utan att rättssäkerheten eftersätts.25
∙IVO:s sanktionsmöjligheter ska vara effektiva så att berörda förskrivare upphör att förskriva läkemedel felaktigt.
Regeringen har i en skrivelse, som riksdagen ställt sig bakom, lämnat generella bedömningar av hur en tillsynsreglering bör vara utformad. Enligt regeringen bör tillsynen ha en framåtsyftande funktion och leda till att regler följs i framtiden.26
217 kap. 30 § PSL.
227 kap. 10 § PSL.
237 kap. 19 § PSL.
242 § förordningen med instruktion för Inspektionen för vård och omsorg.
259 § förvaltningslag (2017:900).
26Skr. 2009/10:79, s. 42, bet. 2009/10:FiU12, s. 18, rskr. 2009/10:210.
Riksrevisionen 13
1.3.4 Delfråga 4
För att svara på delfråga 4 använder vi oss av följande bedömningsgrund:
Tillsynen av förskrivningar som leder till felaktigt användande av läkemedelsförmånerna och smittskyddssubventioner ska vara effektiv
TLV beslutar om ett läkemedel ska ingå i läkemedelsförmånerna och därmed subventioneras av statliga medel.27 TLV har fattat beslut om vilka indikationer och patientgrupper som läkemedlet är kostnadseffektivt och ska subventioneras för. Även extemporeläkemedel28 ingår i läkemedelsförmånerna om apotekens inköpspris och försäljningspris beräknas i enlighet med TLV:s föreskrifter.29 TLV ska bedriva tillsyn över att lagen om läkemedelsförmåner m.m. efterlevs.30
I smittskyddslagen regleras att läkemedel som har förskrivits mot en allmänfarlig sjukdom och som förskrivaren bedömer minska risken för smittspridning är kostnadsfria för patienten.31 Smittskyddet står under tillsyn av IVO.32 TLV ska bedriva tillsyn över prissättningen av smittskyddsläkemedel.33 I statsbidraget för läkemedelsförmåner m.m. ingår bidrag för vissa läkemedel som förskrivs kostnadsfritt enligt smittskyddslagen.
IVO har möjlighet att tillsyna att förskrivare följer lagar och förordningar. IVO:s tillsyn ska dock främst inriktas på patientsäkerheten.34
Vi operationaliserar bedömningsgrunden enligt följande:
∙För att statens tillsyn av förskrivningar som leder till felaktigt användande av läkemedelsförmånerna och smittskyddssubventioner ska vara effektiv ska
o myndigheternas tillsynsansvar vara tydligt
o myndigheterna ha förutsättningar att utföra tillsynen
o sanktionsmöjligheterna leda till att det felaktiga användandet upphör.
27
28Extemporeläkemedel är läkemedel som tillverkas av ett apotek för viss patient, visst djur eller viss djurbesättning, 2 § Tandvårds- och läkemedelsförmånsverkets föreskrifter om licensläkemedel, extemporeläkemedel, lagerberedningar och tillfällig subvention
2913 § Tandvårds- och läkemedelsförmånsverkets föreskrifter om licensläkemedel, extemporeläkemedel, lagerberedningar och tillfällig subvention
3025 § lagen om läkemedelsförmåner m.m.
317 kap. 1 § smittskyddslag (2004:168). Det gäller även läkemedel som de förskrivna läkemedlen har bytts ut mot enligt 21 b § lagen om läkemedelsförmåner m.m.
329 kap. 1 § smittskyddslagen.
337 § andra stycket lagen om läkemedelsförmåner m.m.
347 kap. 3 § PSL.
14 Riksrevisionen
Regeringen har i en skrivelse, som riksdagen har behandlat, lämnat generella bedömningar av hur en tillsynsreglering bör vara utformad. Enligt regeringen bör tillsynen ha en framåtsyftande funktion och tillse att regler följs i framtiden.35
1.4Metod och genomförande
Granskningen har genomförts av en projektgrupp bestående av Gabriella Sjögren Lindquist (projektledare), Sofie Brandberg och Linn Hemmar Larsson. Företrädare för Regeringskansliet (Socialdepartementet), IVO, Läkemedelsverket, Socialstyrelsen, SBU och TLV har fått tillfälle att faktagranska och i övrigt lämna synpunkter på ett utkast till granskningsrapport.
För att granska om statsbidraget är ett effektivt styrmedel för att åstadkomma en mer kostnadseffektiv läkemedelsförskrivning har vi tagit del av samtliga överenskommelser om statsbidrag för läkemedelsförmånerna m.m. som slutits mellan staten och Landstingsförbundet/Sveriges Kommuner och Regioner (SKR) sedan 1998 då statsbidraget infördes. Vi har ställt frågor till ett urval regioner (åtta tillfrågades och fem valde att delta) om hur de arbetar med läkemedelsbudgeteringen. Vi har även gjort en kartläggning av hur regionerna styr vårdgivarna mot en mer kostnadseffektiv läkemedelsförskrivning. Vi har också genomfört en statistisk beräkning för att få en indikation på om regeringens styrning med statsbidrag når ända fram till förskrivarna.
För att granska statens kunskapsstyrning har vi genomfört intervjuer med Läkemedelsverket, Socialstyrelsen och SBU och en representant för regionernas läkemedelskommittéer. Vi har även ställt skriftliga frågor till professions- och patientföreträdare36 som varit med och tagit fram kunskapsstöd. Vi har även tagit del av myndigheternas processbeskrivningar och metodvägledningar, årsredovisningar och mötesprotokoll med mera. Vidare har vi gått igenom cirka 280 kunskapsstöd, i dessa ingår samtliga av Socialstyrelsens och Läkemedelsverkets kunskapsstöd och samtliga kunskapsstöd som SBU har publicerat under de senaste fem åren.
Vi har också gjort en jämförelse mellan Läkemedelsverkets och Socialstyrelsens kunskapsstöd i de fall de behandlar samma diagnoser. Vi har även gjort en jämförelse mellan en remissversion och en slutlig version av en av Socialstyrelsens nationella riktlinjer. Vidare har vi genomfört en statistisk undersökning för att se om expedieringen av ett antal läkemedel som rekommenderas i Socialstyrelsens nationella riktlinjer eller Läkemedelsverkets behandlingsrekommendationer skiljer sig åt innan och efter kunskapsstöden publicerats.
35Skr. 2009/10:79, s. 42, bet. 2009/10:FiU12, s. 18, rskr. 2009/10:210.
36Några har även utvecklat sitt resonemang över ett möte via telefon eller Teams.
Riksrevisionen 15
Vi har även jämfört samstämmigheten mellan de 21 läkemedelskommittéernas läkemedelsrekommendationer för ett urval av diagnoser med Socialstyrelsens och Läkemedelsverkets läkemedelsrekommendationer för samma diagnoser. Vi har också har begärt in och gått igenom jävsdeklarationer för ett urval experter som deltagit i framtagandet av olika kunskapsstöd. Jävsdeklarationerna har även jämförts med ett större antal läkemedelsföretags värdeöverföringsrapporter till hälso- och sjukvården, det vill säga utbetalningar till experter.
För att granska statens tillsyn av förskrivarna har vi begärt in statistik från IVO om handläggningstider och antal ärenden som rör tillsynen av hälso- och sjukvårdpersonal. Vi har även begärt in olika typer av ärenden från IVO för att skapa förståelse kring de olika ärendetyperna. Vi har också tagit del av myndighetsdokumentation om tillsynen, exempelvis rapporter, processbeskrivningar, verksamhetsplan, årsredovisningar och verksamhetsredogörelser.
För att granska statens tillsyn av felaktigt användande av läkemedelssubventioner har vi analyserat statistik över vissa begärliga läkemedel och extemporeläkemedel som belastar läkemedelsförmånerna samt läkemedel förskrivna med subvention enligt smittskyddslagen. Vi har även gått igenom befintlig lagstiftning på området, gått igenom TLV:s omprövningsbeslut, intervjuat representanter från TLV, ställt frågor till representanter från Region Stockholm och Region Skåne, gått igenom domar som berör läkemedelsförmånerna samt gått igenom ett antal beslut från Socialstyrelsen om arbetsplatskoder.
16 Riksrevisionen
2 Aktörerna och systemets funktionssätt
2.1Flera yrkeskategorier har rätt att förskriva läkemedel
De yrkeskategorier som har rätt att förskriva läkemedel är läkare, veterinärer, tandläkare, tandhygienister, barnmorskor och sjuksköterskor.37, 38 Det är Läkemedelsverket som tar fram föreskrifter om vilka yrkeskategorier som har rätt att förskriva läkemedel och vilka läkemedel som de olika yrkeskategorierna får förskriva.39 Socialstyrelsen utfärdar yrkeslegitimationer.
Förskrivarna har traditionellt ”stor makt över receptblocket”, men en läkemedelsordination ska grundas på vetenskap och beprövad erfarenhet.40 Förskrivarna styrs på olika sätt av vårdgivarna, sjukvårdshuvudmännen, läkemedelskommittéerna och av statliga myndigheter genom främst författningar, kunskapsstyrning och tillsyn samt av överenskommelser mellan staten och sjukvårdshuvudmännen. Förskrivarna kan också påverkas av läkemedelsföretag, professions- och patientföreningar. Staten vill på en övergripande nivå styra läkemedelsförskrivningen. Det beror på att staten har ett ansvar för patientsäkerheten, men också på att läkemedelssubventionerna innebär en stor och växande kostnad för det allmänna.
2.2Regeringens styrning med överenskommelser om statsbidrag
En viktig komponent i statens styrning av läkemedelsförskrivningen är det statsbidrag som infördes i samband med att kostnadsansvaret för läkemedel fördes över från staten till regionerna (landstingen) 1998.41 Statsbidraget ska bidra till att täcka regionernas kostnader för läkemedelsförmånerna, smittskyddssubventioner
m.m.samtidigt som det är konstruerat på ett sådant sätt att det ska ge regionerna starkare incitament för ökad kostnadseffektivitet och för att hålla utgifterna för läkemedel nere.
37Läkemedelsverkets föreskrifter om förordnande och utlämnande av läkemedel och teknisk sprit
38Vi avgränsar granskningen till förskrivningar inom hälso- och sjukvården.
399 kap. 9 § 2 läkemedelsförordning (2015:458).
406 kap. 1 § PSL.
41Prop. 1996/97:27, Läkemedelsförmåner och läkemedelsförsörjning m.m. Tidigare belastade läkemedelsförmånerna den allmänna sjukförsäkringen.
Riksrevisionen 17
När läkemedel och andra varor som ingår i läkemedelsförmånerna expedieras på apotek betalar patienten endast en del av kostnaden, så kallad egenavgift, upp till ett kostnadstak.42 Läkemedel som förskrivits enligt smittskyddslagen är helt kostnadsfria för patienten. Apoteket skickar sedan en fordran till
Statsbidragets storlek och fördelningen av statsbidraget mellan regionerna bestäms i etttill treåriga överenskommelser med SKR. År 2022 var statsbidraget
34,4 miljarder kronor.45 Storleken på bidraget bestäms utifrån Socialstyrelsens höstprognos över läkemedelskostnader.46
Överenskommelserna kan även innehålla andra komponenter än storleken på och fördelningen av bidraget. Exempel är att parterna kommit överens om att de läkemedel som TLV47 har bedömt som kostnadseffektiva ur ett samhällsperspektiv ska komma till användning48, att landstingens möjligheter att följa upp läkemedelsanvändningen ska stärkas49 och att regionerna ska införa en gemensam plattform för rekommenderade läkemedel50.
425 § lagen om läkemedelsförmåner m.m.
43Enligt 7 § lagen om läkemedelsförmåner m.m. fastställer TLV apotekens försäljningspris på varor som ingår i läkemedelsförmånerna och för läkemedel som förskrivs kostnadsfritt för patienten enligt smittskyddslagen.
44Om patienten inte är bosatt inom någon regions område regleras vilken region som ska bekosta läkemedelsförmånen i 22 § lagen om läkemedelsförmåner m.m.
45Regeringsbeslut S2021/08207.
46Socialstyrelsen ska enligt sin instruktion redovisa en bedömning av kostnadsutvecklingen av läkemedelsförmånerna, läkemedel som förskrivs enligt smittskyddslagen samt rekvisitionsläkemedel. Uppdraget redovisas senast den 30 april och en kortare uppdatering av prognosen i form av ett PM redovisas senast den 30 oktober varje år. Källa:
47Tidigare Läkemedelsförmånsnämnden.
48Infördes i överenskommelsen för 2016 och har sedan dess varit en del i överenskommelsen.
49Regeringsbeslut S2004/6213/HS.
50Regeringsbeslut S2009/2399/HS.
18 Riksrevisionen
Statsbidraget för läkemedelsförmåner m.m. utgör en viktig intäktskälla för regionerna. Under 2022 utgjorde statsbidraget för läkemedelsförmåner m.m.
7 procent av regionernas totala intäkter. Kostnaderna för läkemedel51, sjukvårdsartiklar och medicinskt material uppgår till totalt 56,1 miljarder kronor och utgjorde knappt 13 procent av regionernas totala verksamhetskostnader. Statsbidraget för läkemedelsförmåner m.m. täckte drygt 61 procent av regionernas totala kostnader för läkemedel, sjukvårdsartiklar och medicinskt material. Skatter stod för 64 procent av regionernas intäkter, ekonomiska utjämningssystemet för 9 procent och olika avgifter (t.ex. patient- eller trafikantavgifter) för 19 procent av intäkterna.52
2.3Kunskapsstyrning av läkemedelsförskrivningen
Regionerna ansvarar för att vården är av god kvalitet och att kvaliteten systematiskt och fortlöpande utvecklas och säkras.53 Förskrivarna arbetar utifrån krav på vetenskap och beprövad erfarenhet.54 Som stöd till regionerna och förskrivarna har regeringen gett flera myndigheter i uppdrag att styra hälso- och sjukvården med kunskap. Enligt Socialstyrelsens, Läkemedelsverkets och SBU:s instruktioner ska myndigheterna ta fram och sprida kunskap om bland annat läkemedelsanvändning. De ska också följa upp och bedriva utvecklingsarbete för att förbättra läkemedelsanvändningen och samverka om kunskapsstyrningen.55
2.3.1 Styrningen med kunskap ska ske genom kunskapsstöd
Socialstyrelsen, Läkemedelsverket och SBU tar fram olika typer av kunskapsstöd. Kunskapsstöden är inte juridiskt bindande men ger rekommendationer som har stor betydelse för hur hälso- och sjukvården bör bedrivas. Dokumenten kan vara allt från 6 till 1 000 sidor långa och tar, baserat på omfattning, mellan några månader och några år att arbeta fram. Vid tiden för vår genomgång hade Socialstyrelsen, Läkemedelsverket och SBU tillsammans drygt 280 olika kunskapsstöd publicerade på sina webbplatser. I vilken omfattning kunskapsstöden berör läkemedel varierar (tabell 1).56
51Här ingår både receptläkemedel och rekvisitionsläkemedel.
52Statistiska centralbyrån, ”Resultaträkning för kommuner efter region och resultaträkningsposter. År 1998 – 2022”, hämtad
535 kap. 1 och 4 §§ hälso- och sjukvårdslagen.
546 kap. 1 § PSL.
55Förordning (2015:284) med instruktion för Socialstyrelsen, förordning (2020:57) med instruktion för Läkemedelsverket och förordning (2007:1233) med instruktion för Statens beredning för medicinsk och social utvärdering.
56Socialstyrelsens kunskapsstöd som var aktuella under
Riksrevisionen 19
Tabell 1 Överblick över myndigheternas kunskapsstöd och i vilken omfattning de berör läkemedel
| Socialstyrelsen | Läkemedelsverket | SBU | |
| Antal | 19 nationella riktlinjer | 46 behandlings- | 176 kunskapsstöd |
| kunskapsstöd | 15 nationella kunskapsstöd | rekommendationer | riktade till hälso- |
| 31 läkemedels- | och sjukvården | ||
| monografier |
| Berör | Samtliga nationella | Samtliga |
| läkemedel | riktlinjer, ca. 577 av 1 825 | |
| (32 %) rekommendationer | ||
| 6 av 15 nationella | ||
| kunskapsstöd (40 %) |
ca. 50 av 176 (28 %)
Källa: Riksrevisionens genomgång av kunskapsstöden.
Granskningen av myndigheternas kunskapsstöd har avgränsats till att omfatta Socialstyrelsens nationella riktlinjer, Läkemedelsverkets behandlingsrekommendationer och SBU:s olika typer av kunskapsstöd. Socialstyrelsens nationella riktlinjer ger rekommendationer om behandlingar, inklusive läkemedelsförskrivning, till beslutsfattare för beslut om prioriteringar i styrnings- och ledningsfrågor.57 Läkemedelsverkets behandlingsrekommendationer riktar sig till förskrivare och relaterar oftast till en särskild diagnos. SBU:s kunskapsstöd innehåller utvärderingar av det vetenskapliga stödet för nya eller etablerade behandlingsmetoder inom hälso- och sjukvården, till exempel behandling med ett särskilt läkemedel. I kunskapsstöden ges en överblick över hur säker och effektiv en särskild behandlingsmetod är. Kunskapsstöden kan även belysa var det saknas tillräckligt med kunskap om effekten av en viss metod. SBU tar fram nio olika typer av publikationer, allt från kortare kommentarer till större systematiska översikter. SBU:s kunskapsstöd riktar sig både till beslutsfattare och förskrivare.58
Till skillnad från Socialstyrelsens och Läkemedelsverkets kunskapsstöd innehåller inte SBU:s kunskapsstöd rekommendationer. SBU:s kunskapsstöd innehåller
i stället en bedömning av det vetenskapliga underlagets tillförlitlighet som kunskapsstödet grundas på. Baserat på denna bedömning är det upp till mottagaren av kunskapsstödet att fatta beslut om en behandlingsmetod bör användas eller inte.59
57Möte med representanter för Socialstyrelsen,
58Statens beredning för medicinsk och social utvärdering, Oberoende utvärderingar för bättre vård och omsorg, 2016, s.
59Möte med representanter för SBU,
20 Riksrevisionen
2.3.2Styrningen med kunskap sker på både nationell och regional nivå
För att samordna, effektivisera och behovsanpassa kunskapsstyrningen inrättade regeringen Rådet för styrning med kunskap år 2015.60 I rådet ingår Socialstyrelsen, IVO, Läkemedelsverket, SBU och TLV, samt ytterligare fem myndigheter.61 Till Rådet för styrning med kunskap finns det knutet en så kallad huvudmannagrupp som har till uppgift att informera rådet om områden där sjukvårdshuvudmännen har behov av kunskapsstyrning och hur styrningen bör utformas och kommuniceras.62
Varje region ska ha minst en läkemedelskommitté som ska verka för att läkemedelsanvändningen inom regionen är tillförlitlig och rationell. Läkemedelskommittéerna har ett kunskapsstyrande uppdrag. Råd och rekommendationer ska nå ut till kliniker, specialistmottagningar och primärvårdsenheter och kommittéerna ska följa upp om det förekommer brister i läkemedelsanvändningen.63
Sedan 2017 har regionerna ett gemensamt system för kunskapsstyrning: Nationellt system för kunskapsstyrning hälso- och sjukvård. Syftet är att minska skillnaderna i vård, behandling och resultat beroende på var i landet man bor.64 Systemet är strukturerat i 26 nationella programområden (NPO) som leder kunskapsstyrningen och tar fram kunskapsstöd inom respektive område. Till NPO:erna finns nationella arbetsgrupper (NAG) kopplade.65 En arbetsgrupp (NAG LOK) ger vägledning
i läkemedelsfrågor när NPO:erna tar fram kunskapsstöd. NAG LOK ska se till att läkemedelsriktlinjerna i NPO:ernas kunskapsstöd överensstämmer med läkemedelskommittéernas rekommendationer.66
Rådet för styrning med kunskap inledde 2018 ett samarbete med regionernas system för kunskapsstyrning. Samarbetet kallas Partnerskapet för stöd till kunskapsstyrning inom hälso- och sjukvården.67 Syftet med partnerskapet är att bidra till ökad samverkan, bättre stöd för implementering och effektivare kunskapsstöd.68
60Förordningen om statlig styrning med kunskap avseende hälso- och sjukvård och socialtjänst.
616 § förordningen om statlig styrning med kunskap avseende hälso- och sjukvård och socialtjänst.
6212 § förordningen om statlig styrning med kunskap avseende hälso- och sjukvård och socialtjänst.
63Lag (1996:1157) om läkemedelskommittéer.
64Sveriges Kommuner och Regioner, ”Kunskapsbaserad och jämlik vård”, hämtad
65Sveriges Kommuner och Regioner, ”Programområden och samverkansgrupper”, hämtad
66Sveriges Kommuner och Regioner, ”Läkemedel i kunskapsstöd”, hämtad
67Sveriges Kommuner och Regioner, ”Läkemedel i kunskapsstöd”, hämtad
68Socialstyrelsen, Statlig styrning med kunskap för hälso- och sjukvård och socialtjänst. Redogörelse för arbetet inom Rådet för styrning med kunskap och Huvudmannagruppen under 2021, 2022, s. 13.
Riksrevisionen 21
2.4Tillsyn av läkemedelsförskrivningen
IVO tillsynar att förskrivare inte förskriver läkemedel felaktigt. IVO kan efter utredning rikta kritik mot förskrivare eller anmäla till HSAN och yrka på prövotid, indragning eller begränsning av förskrivningsrätten eller återkallelse av legitimationen. HSAN:s beslut kan överklagas till förvaltningsdomstol.
2.4.1 IVO tillsynar att läkemedel inte förskrivs felaktigt
IVO ska tillsyna att hälso- och sjukvårdspersonal inte förskriver läkemedel felaktigt utan i enlighet med vetenskap och beprövad erfarenhet för att inte riskera patientsäkerheten.69 Felaktig förskrivning kan till exempel handla om förskrivning av läkemedel på felaktiga grunder (indikationer) eller förskrivning av en större mängd läkemedel än den som behövs för den medicinska behandlingen.
Den vanligaste orsaken till att IVO antingen kritiserar eller anmäler en läkare till HSAN rör felaktiga förskrivningar av narkotikaklassade läkemedel.70
2.4.2IVO kan rikta kritik eller yrka på prövotid eller behörighetsinskränkningar av förskrivningsrätt hos HSAN
Beroende på vad IVO:s utredning visar kan IVO fatta tre olika beslut:
∙Beslut utan kritik lämnas om utredningen inte visar på brister hos förskrivaren.
∙Beslut med kritik lämnas om förskrivaren inte har utfört sitt arbete enligt vetenskap och beprövad erfarenhet eller visat sig olämplig på annat sätt. Ett beslut med kritik leder inte till någon ytterligare åtgärd.
∙Anmälan till HSAN görs med yrkande om att ställa förskrivaren under tillsyn (prövotid), dra in eller begränsa förskrivningsrätten eller återkalla legitimationen.
HSAN kan efter utredning besluta om prövotid på tre år, indragen eller begränsad förskrivningsrätt eller återkallelse av legitimation.71 Ett beslut om prövotid innebär inte någon inskränkning i möjligheten att utöva sitt yrke, men personen måste följa en prövotidsplan.72 Exempel på krav i prövotidsplanen kan vara att yrkesutövaren ska gå en specifik utbildning, få behandling för ett missbruk eller
69Se 1 § förordningen med instruktion för Inspektionen för vård och omsorg och 7 kap.
70Inspektionen för vård och omsorg, Vad har IVO sett 2021?, 2022, s. 46.
71Inspektionen för vård och omsorg, ”Tillsyn av hälso- och sjukvårdspersonal”, hämtad
72Ett förslag på prövotidsplan tas fram av IVO men beslutas av HSAN.
22 Riksrevisionen
förändra sitt förskrivningsmönster.73 Det är IVO som följer upp att prövoplanen följs. HSAN:s beslut kan överklagas till förvaltningsdomstol.
Om IVO under utredningen bedömer att en förskrivare utgör en direkt fara för patientsäkerheten ska IVO göra en anmälan till HSAN och yrka på att HSAN drar in eller begränsar förskrivningsrätten eller återkallar legitimationen interimistiskt. Den interimistiska åtgärden ska gälla fram tills att IVO:s utredning är genomförd. Den interimistiska åtgärden gäller i högst sex månader och kan förlängas en gång, med högst sex månader, om det finns särskilda skäl.74 IVO:s utredning ska genomföras skyndsamt under den interimistiska åtgärden så att IVO kan lämna ett slutligt yrkande till HSAN.75
Under 2022 fattade IVO beslut i 265 ärenden som rör läkemedelsförskrivning (tabell 2). I två tredjedelar av besluten lämnade inte IVO någon kritik. Andelen beslut där IVO inte lämnat kritik har ökat något över tid. Andelen beslut där IVO riktar kritik mot en förskrivare har minskat från vart tredje beslut 2017 till vart femte beslut 2022. IVO anmäler ungefär vart tionde ärende som gäller läkemedelsförskrivning till HSAN och andelen har varit konstant mellan 2017 och 2022. Det innebär att när IVO fattar beslut om brister har andelen yrkanden till HSAN ökat i relation till andelen beslut med kritik.
Tabell 2 Antal beslutade ärenden där ärendet rör läkemedelsförskrivning
| Beslut | 2017 | 2018 | 2019 | 2020 | 2021 | 2022 |
| Med kritik | 94 | 96 | 75 | 80 | 80 | 58 |
| Till HSAN | 27 | 29 | 23 | 34 | 36 | 25 |
| Utan kritik | 167 | 165 | 151 | 193 | 206 | 178 |
| Övrigt | 0 | 0 | – | 11 | – | 4 |
Källa: Uppgifter från IVO inhämtade
Anm.:
73Möte med representanter från IVO
748 kap. 6 och 11 §§ PSL.
75Inspektionen för vård och omsorg, Vägledning vid utredning av hälso- och sjukvårdspersonal med legitimation eller annan behörighet att utöva yrke inom hälso- och sjukvården - Delprocess 3.6.1, 2022, s
Riksrevisionen 23
2.5Statens tillsyn av felaktig användning av läkemedelsförmånerna och smittskyddssubventioner
Det är TLV som beslutar om ett läkemedel ska ingå i läkemedelsförmånerna och därmed subventioneras. Som beslutsunderlag använder sig TLV bland annat av en hälsoekonomisk kalkyl där kostnaden för läkemedlet jämförs med hälsovinsten för de indikationer som läkemedlet är godkänt för. Om relationen mellan pris och hälsovinst bedöms rimlig, det vill säga om läkemedlet anses kostnadseffektivt, kan läkemedlet subventioneras. Ibland visar TLV:s hälsoekonomiska kalkyler att ett läkemedel endast är kostnadseffektivt för vissa indikationer (sjukdomstillstånd) eller för vissa patientgrupper. Då kan TLV besluta att läkemedlet ska ingå i läkemedelsförmånerna med förmånsbegränsning och endast subventioneras för de utvalda patientgrupperna eller indikationerna.
För att patienten ska få ett läkemedel subventionerat med läkemedelsförmån på apoteket krävs att förskrivaren intygar att patienten är förmånsberättigad och anger det på receptet.76 För att ett läkemedel med förmånsbegränsning ska subventioneras krävs att förskrivaren intygar på receptet att förutsättningarna för förmån är uppfyllda, det vill säga att patienten har en viss sjukdom eller tillhör en viss patientgrupp. Om ett läkemedel med förmånsbegränsning förskrivs med subvention till en patient inom en patientgrupp eller för en indikation som inte omfattas av läkemedelsförmånerna innebär det att statliga medel används på ett sätt som inte är kostnadseffektivt. Läkemedelsförmånerna används då på ett felaktigt sätt. Informationen om läkemedlet ingår i förmånerna, samt för vilka indikationer och patientgrupper, finns tillgängliga i journalsystemet i de flesta regionerna. Informationen finns även tillgänglig i till exempel Fass.77
Förskrivaren måste fylla i sin arbetsplatskod på receptet för att patienten ska få läkemedlet med läkemedelsförmån.78 Ett recept på ett läkemedel som ingår
i läkemedelsförmånerna kan expedieras utan arbetsplatskod, men då
76Vilka uppgifter som ska anges på recept för att de ska expedieras med läkemedelsförmån regleras i 4 kap. 8 § 2 och 5 Läkemedelsverkets föreskrifter
77Namnet Fass kommer ursprungligen från en förkortning av Farmacevtiska specialiteter i Sverige. Fass produceras av Läkemedelsindustriföreningen (Lif). Lif företräder cirka
80 företag som tillsammans tillverkar 80 procent av alla läkemedel som säljs i Sverige. I Fasssamarbetet deltar även exempelvis generikaföretag, parallellimportörer och naturläkemedelsföretag, sammanlagt drygt 240 företag. Företagen som deltar i samarbetet ansvarar själva för sina produkttexter på Fass och uppdaterar dem kontinuerligt. Källa: Lif, ”Fass. Allmänhet”, hämtad
786 § lagen om läkemedelsförmåner m.m.
24 Riksrevisionen
subventioneras inte läkemedlet.79 Det är regionerna som utfärdar arbetsplatskoder till vårdgivarna. Kravet för att få tillgång till en arbetsplatskod är att förskrivaren har en arbetsplats samt är behörig att förskriva läkemedel som ingår i läkemedelsförmånerna. Om regionen anser att en sökande inte har rätt till en arbetsplatskod ska regionen vända sig till Socialstyrelsen för att få ärendet prövat.80 Det kan till exempel vara om vårdgivaren inte bedriver hälso- och sjukvård utan skönhetsvård.
Även smittskyddsläkemedel subventioneras och är kostnadsfria för patienten. Men det regleras i smittskyddslagen och inte i lagen om läkemedelsförmåner m.m.81 För att patienten ska få läkemedlet kostnadsfritt enligt smittskyddslagen krävs att förskrivaren anger det på receptet.82 Förskrivaren ska också ange sin arbetsplatskod på receptet83, men ett recept kan expedieras kostnadsfritt enligt smittskyddslagen utan arbetsplatskod84.
Motivet bakom att arbetsplatskoderna infördes 2002 var att koderna var en förutsättning för att verksamhetschefer och sjukvårdshuvudmän skulle ha möjlighet att arbeta med verksamhetsplanering, kvalitetsutveckling och budget samt följa upp den egna verksamheten.85
TLV har tillsyn över att lagen om läkemedelsförmåner m.m. efterlevs.86 TLV ska även följa upp och utvärdera sina subventionsbeslut.87 TLV kan pröva om ett läkemedel ska fortsätta att ingå i läkemedelsförmånerna om de antaganden som gjordes i den hälsoekonomiska kalkylen har ändrats. En omprövning kan till exempel initieras om indikationerna som läkemedlet är godkänt för har ändrats eller om gruppen som förskrivs läkemedlet är större än vad som antogs när beslutet fattades.
IVO har möjlighet att tillsyna att förskrivare följer de regler och lagar som finns och har därmed möjlighet att granska om förskrivarna följer lagen om läkemedelsförmåner m.m. och reglerna om kostnadsfria läkemedel enligt smittskyddslagen. Men enligt patientsäkerhetslagen ska IVO:s tillsyn främst inriktas på patientsäkerheten.88
794 § förordning (2002:687) om läkemedelsförmåner m.m.
804 § förordningen om läkemedelsförmåner m.m.
817 kap. 1 § smittskyddslagen.
824 kap. 8 § 6 Läkemedelsverkets föreskrifter
839 a § smittskyddsförordning (2004:255).
84
85Prop. 2001/02:63, s. 49.
8625 § lagen om läkemedelsförmåner m.m.
872 § förordning (2007:1206) med instruktion för Tandvårds- och läkemedelsförmånsverket.
887 kap. 3 § PSL.
Riksrevisionen 25
3Statsbidraget som styrmedel av förskrivningen
I detta kapitel granskar vi om statsbidraget för läkemedelsförmånerna m.m. är ett effektivt styrmedel för att åstadkomma en mer kostnadseffektiv läkemedelsförskrivning.
En förutsättning för att regeringen ska kunna styra läkemedelsförskrivningen med statsbidraget till att bli mer kostnadseffektiv är att hela styrkedjan håller ända ut till förskrivarna. Våra iakttagelser visar att så inte är fallet. Statsbidragets konstruktion ger teoretiskt regionerna incitament att hålla nere läkemedelskostnaderna. Men regionerna utgår i praktiken endast i liten utsträckning från statsbidragets storlek vid budgeteringen för förmånsläkemedel och styrkedjan bryts. Våra statistiska beräkningar bekräftar att regeringens försök till styrning genom statsbidraget inte påverkar de enskilda regionernas kostnader för läkemedelsförmånerna. Statsbidraget kan därmed inte ses som ett effektivt styrmedel av läkemedelsförskrivningen utan fungerar snarare som en budgetförstärkning för regionerna.
3.1Styrkedjan från statsbidrag till läkemedelsförskrivning
För att regeringen ska kunna styra läkemedelsförskrivningen och läkemedelsutgifterna genom statsbidraget krävs att hela styrkedjan fungerar ända ut till förskrivarna. Först krävs att statsbidragets storlek och konstruktion ger regionerna incitament att öka kostnadseffektiviteten i läkemedelsanvändningen och hålla utgifterna för läkemedel nere. En förutsättning är att regionerna planerar läkemedelsbudgeten utifrån statsbidraget. I nästa steg behöver regionens finansiella styrning av vårdgivarna ge verksamhetscheferna incitament att styra de enskilda förskrivarna att hålla nere läkemedelsutgifterna. Förskrivarna har i slutänden fri förskrivningsrätt och ska basera förskrivningen på vetenskap och beprövad erfarenhet.
3.2Statsbidragets konstruktion bör ge regionerna incitament att hålla nere läkemedelsutgifterna
Storleken på statsbidraget bestäms utifrån Socialstyrelsens höstprognos över läkemedelskostnader. Statsbidraget fördelas därefter mellan regionerna genom en behovsmodell. Regioner som har en mer vårdintensiv befolkning tilldelas mer resurser för förmånsläkemedel än andra. Sedan 2021 används samma behovsmodell
26 Riksrevisionen
som i det kommunalekonomiska utjämningssystemet för att fördela statsbidraget mellan regionerna.89 Fördelningen baseras på andelen i befolkningen i olika åldersgrupper med olika socioekonomisk bakgrund. Till exempel får regioner med en stor andel äldre och lågutbildade med inkomst under medianinkomsten ett större statsbidrag per person än regioner med en stor andel medelålders höginkomsttagare.
Statsbidraget är inte öronmärkt för läkemedel. Om regionen styr läkemedelsanvändningen mot att hålla nere utgifterna får regionen behålla mellanskillnaden mellan statsbidraget och regionens utgifter för förmånsläkemedel och andra läkemedel som ersätts genom statsbidraget. På aggregerad nivå finns dock en vinst- och förlustdelningsmodell. Om regionernas sammanlagda utgifter för förmånsläkemedel överstiger det totalt utbetalade statsbidraget med mer än 3 procent står staten för hälften av de överskjutande kostnaderna.90 Tekniskt sett ökas kommande års totala statsbidrag med statens del för regionernas ”förlust”. Det ökade totala statsbidraget fördelas sedan ut till regionerna utifrån behovsmodellen. Den enskilda regionens utgifter för läkemedelsförmånerna påverkar därför inte direkt det egna statsbidragets storlek nästa år. Konstruktionen gör det inte möjligt för en enskild region att påverka storleken på kommande statsbidrag.
Om regionernas sammanlagda utgifter för förmånsläkemedel i stället är lägre än 97 procent av utbetalat statsbidrag delar regionerna och staten lika på ”vinsten”. Det innebär att nästa års totala statsbidrag minskas med hälften av vinsten. Det minskade beloppet fördelas sedan till regionerna utifrån behovsmodellen.
Regionernas sammanlagda utgifter för läkemedel ett år påverkar storleken på kommande års statsbidrag eftersom Socialstyrelsens prognos baseras på historiska utgifter för läkemedel. Om regionernas sammanlagda utgifter är större än statsbidraget ett år innebär det att de kommande statsbidragen ökar. På samma sätt bidrar en mer återhållsam läkemedelsanvändning eller styrning mot billigare läkemedel till att kommande statsbidrag blir lägre.
Sedan 2014 finns det möjlighet för regionerna att teckna sidoöverenskommelser med återbäring med läkemedelsbolagen för att få ned kostnaderna för läkemedel. TLV samordnar arbetet. Återbäringen delas mellan regionerna och staten, där regionerna tilldelas 70 procent av återbäringen 2023. Fördelningen av återbäringen
89Fördelningen utifrån en behovsmodell infördes 2002. Innan dess ersattes regionerna för sina faktiska kostnader. Se bilaga 1.
90Det finns även en separat vinst- och förlustdelningsmodell för ersättningen för hepatit C i överenskommelsen.
Riksrevisionen 27
mellan regionerna och staten bestäms i överenskommelsen om statsbidraget för läkemedelsförmåner m.m. och har ändrats flera gånger sedan 2014 (se bilaga 1).
Under 2022 omfattades 63 läkemedel av sidoöverenskommelser.91 Den samlade återbäringen uppgick till cirka 2,5 miljarder kronor.92 TLV beräknar varje regions återbäring uppdelat på de enskilda läkemedelsbolagen utifrån invånarnas faktiska läkemedelskonsumtion (mätt som expedierade läkemedel). Regionen fakturerar sedan läkemedelsbolagen kvartalsvis. Många regioner upplever att avtalen har blivit en administrativ börda. Den interna kommunikationen ut till vårdgivarna om priser och val av läkemedel har försvårats i och med avtalen eftersom läkemedelspriserna efter återbäring är sekretessbelagda.93 Det har lett till att viljan från regionerna att ingå sidoöverenskommelser har minskat.94
3.3Statsbidraget mindre viktig komponent i regionernas arbete med läkemedelsbudgeten
Läkemedelsutredningen, som lämnade sitt slutbetänkande 2018, genomförde en enkätstudie till regionernas budgetchefer för att försöka förstå vilka effekter statsbidragets konstruktion fick för planeringen av läkemedelsbudgeten. Enkätundersökningen kompletterades med djupintervjuer. Slutsatsen som Läkemedelsutredningen drog var att statsbidraget inte påverkade regionernas läkemedelsbudget i särskilt stor utsträckning. En av orsakerna som angavs var att utfallet från överenskommelsen kom allt för sent för att kunna inkluderas i budgetarbetet kring läkemedel.95
Vår granskning visar att regionerna inte har getts tillräckliga förutsättningar att planera läkemedelsbudgeten utifrån statsbidraget. Storleken på statsbidraget annonseras för sent och de återkommande förändringarna av bidragskonstruktionen leder till svårigheter för regionerna att prognostisera statsbidragets storlek inför kommande budgetår. Intervjuer med några regioner bekräftar att regionerna i huvudsak utgår från andra faktorer i planeringen av läkemedelsbudgeten än statsbidraget.
91Tandvårds- och läkemedelsförmånsverket, Besparingar från sidoöverenskommelser 2022 – Slutavstämning mars 2023, 2023, s. 5.
92Tandvårds- och läkemedelsförmånsverket, Besparingar från sidoöverenskommelser 2022 – Slutavstämning mars 2023, 2023, s. 8.
93Riksrevisionen, Mesta möjliga hälsa för skattepengarna – statens subventionering av läkemedel, 2021, s. 66.
94Tandvårds- och läkemedelsförmånsverket, Kostnadsutveckling och långsiktig hållbar finansiering av läkemedel, 2023.
95SOU 2018:89, s. 138.
28 Riksrevisionen
3.3.1Utfallet kommer nästan alltid efter att fullmäktige beslutat om budgeten
Vi har gått igenom de 18 överenskommelser som har slutits mellan staten och regionerna om statsbidraget för läkemedelsförmånerna m.m. sedan överföringen av finansieringsansvaret 1998 (se bilaga 1). Majoriteten av överenskommelserna är ettåriga.96 Överenskommelserna annonseras i de allra flesta fall efter att regionernas läkemedelsbudget är bestämd för kommande år, oftast flera månader in på året som överenskommelsen ska gälla. Det innebär att regionen inte kan ta hänsyn till statsbidragets storlek när budgeten ska fastslås eftersom storleken på statsbidraget ännu inte är bestämd. Förslag till budget för kommande år ska upprättas av regionstyrelsen innan 31 oktober.97 Nämnderna som ansvarar för läkemedelsbudgeten ska ha lämnat in sina budgetförslag innan dess.98 Budgeten ska sedan fastställas av fullmäktige före november månads utgång.99
När överenskommelserna sluts under pågående budgetår har de månadsvisa utbetalningarna till regionerna dessutom redan påbörjats. Storleken på bidraget är då densamma som vid senast gällande överenskommelse. Bidraget justeras sedan under utbetalningsåret när en ny överenskommelse slutits.
3.3.2Förutsättningarna för regionerna att prognostisera statsbidragets storlek är bristfälliga
Förutsättningarna för regionerna att göra prognoser över den egna regionens tilldelning av statsbidrag har varit bristfälliga då beräkningsmodellen för hur statsbidraget ska fördelas ändrats upprepade gånger som ett resultat av förhandlingarna mellan SKR och staten (se bilaga 1). Sedan 2015 har överenskommelserna innehållit en skrivning om att parterna ska arbeta för att hitta en långsiktig och förutsägbar finansieringsmodell för att skapa ekonomisk
96Undantaget är de överenskommelser som slöts för perioderna
9711 kap. 8 § kommunallag (2017:725). Om det finns särskilda skäl för det, får budgetförslaget upprättas i november månad.
9811 kap. 9 § kommunallagen. Styrelsen bestämmer när övriga nämnder senast ska lämna in sina särskilda budgetförslag till styrelsen.
9911 kap. 10 § kommunallagen. Om budgeten av särskilda skäl inte kan fastställas före november månads utgång ska budgeten fastställas före december månads utgång.
Riksrevisionen 29
förutsägbarhet.100 Trots viljeinriktningen har beräkningsmodellerna ändrats 5 gånger sedan dess.101
Sedan 1998 har bidraget fördelats med ett enhetligt belopp per invånare i en överenskommelse, utifrån prognos för den faktiska förbrukningen i tre överenskommelser, utifrån faktiska kostnader för läkemedelsförmånen året innan uppräknat med KPI i en överenskommelse, utifrån faktiska kostnader som justerats i efterskott i en överenskommelse och utifrån behov i tretton överenskommelser. Behovsmodellen har dock ändrats tre gånger. Enligt fem överenskommelser fördelas bidraget utifrån den behovsmodell som fastslogs 2002, enligt ytterligare fem överenskommelser fördelas bidraget efter en justerad behovsmodell från 2015102 och i de tre senaste överenskommelserna efter den nya behovsmodell som gäller sedan 2021.
Även vinst- och förlustdelningsmodellen har ändrats flera gånger (se bilaga 1). I de avtalslösa perioderna har det av naturliga skäl inte funnits någon vinst- och förlustdelningsmodell eftersom staten stått för hela kostnaden. Men även i fyra av överenskommelserna har det inte funnits någon vinst- och förlustdelningsmodell. De flesta överenskommelserna (11 stycken) har en vinst- och förlustdelningsmodell där staten finansierar 50 procent av beloppet mellan den verkliga kostnaden och prognosen om avvikelsen är större än 3 procent. Om kostnaderna understiger prognosen med mer än 3 procent återbetalar regionerna hälften av beloppet. Ett annat exempel på vinst- och förlustdelningsmodell som har använts är en där regionerna behåller allt överskott samtidigt som staten står för hälften av kostnaderna om de överstiger utbetalt belopp upp till ett tak. Ytterligare en annan modell är att regionen betalar tillbaka 40 procent om de faktiska kostnaderna blir lägre än beloppet och att staten står för 80 procent om kostnaderna blir högre än beloppet upp till ett tak.
Sedan 2014 kan regioner, stat och läkemedelsbolag sluta sidoöverenskommelser om återbäring vid försäljning av läkemedel. I överenskommelsen från 2015 nämndes inte återbäringen (bilaga 1). Enligt överenskommelsen från 2016 fick
100Se överenskommelserna om statens bidrag till regionerna för kostnader för läkemedelsförmånerna mellan staten och SKR/SKL för åren
101Enligt överenskommelsen 2016 fick regionerna behålla återbäringen från trepartsavtalen. Sedan 2017 fördelas återbäringen mellan stat och regioner. Andelen som tillfaller staten ändrades sedan 2018 och 2023. Behovsmodellen ändrades 2021.
102Denna behovsmodell användes även för att fördela bidraget mellan regionerna under den avtalslösa perioden
30 Riksrevisionen
regionerna behålla hela återbäringen från sidoöverenskommelserna. Sedan överenskommelsen 2017 delas återbäringen mellan staten och regionerna. Fördelningen av återbäringen mellan stat och regioner har ändrats ytterligare två gånger sedan dess.
3.3.3Trots SKR:s utvecklingsarbete med prognoser baseras budgeten huvudsakligen på annat än statsbidraget
Vi har frågat ett urval regioner om hur deras budgetarbete ser ut 2023 för att fånga upp om arbetet med läkemedelsbudgeten har ändrats sedan 2018 när Läkemedelsutredningen skickade ut sin enkät.103 För att underlätta regionernas arbete med läkemedelsbudgeten gör SKR sedan 2021 prognoser över de enskilda regionernas kommande statsbidrag. Prognosen delas med nätverket för regionernas budgetchefer, redovisningschefer respektive läkemedelkontaktpersoner i maj så att prognosen ska kunna inkluderas i budgetarbetet.104
Vår undersökning visar att statsbidraget inte är en viktig ingående komponent
i regionernas bedömning av nästa års läkemedelskostnader. De tillfrågade regionerna baserar framför allt läkemedelsbudgeten på egna framskrivningar av läkemedelskonsumtion, vårdbehov, nytillkommande läkemedel, patentutgångar, myndighetsbeslut, Socialstyrelsens kostnadsprognoser och avstämningar med regionala arbetsgrupper för kunskapsstyrning.105
3.4Majoriteten av regionerna har decentraliserat kostnadsansvaret för läkemedel inom primärvården
Regionledningen använder i sin tur bland annat finansiell styrning av vårdenheterna för att styra vård- och läkemedelskonsumtionen. Genom olika ersättningsmodeller vill regionledningen ge vårdgivarna incitament att bedriva god och kostnadseffektiv vård. Forskningen om den finansiella styrningens effekt på läkemedelsförskrivningen är knapphändig, men en studie från 2010 slår fast att regioner som har decentraliserat kostnadsansvaret för läkemedel till vårdenheterna har lägre läkemedelskostnader än andra regioner.106
103Vi har frågat de regioner som djupintervjuades i Läkemedelsutredningen samt ytterligare 3 regioner hur de bestämmer storleken på läkemedelbudgeten inför kommande år. 5 av 8 tillfrågade regioner återkom med svar.
104
105
106Levin m.fl., Styrformer för effektiv läkemedelsanvändning, 2010.
Riksrevisionen 31
Förskrivningarna som görs inom primärvården står för 35 procent av kostnaderna för förmånsläkemedel.107 År 2021 var kostnadsansvaret för läkemedel inom förmånen helt decentraliserat till primärvårdsenheterna i 15 regioner. Primärvårdsenheterna finansieras helt eller delvis genom kapitationsersättning (ersättning för varje person som är listad på vårdenheten) från regionerna. Storleken på kapitationsersättningen baseras på de listade patienternas risk att drabbas av ohälsa. Vilka karaktäristikor som risken att drabbas av ohälsa beräknas utifrån och prislappen på dessa varierar mellan regionerna.108
Regionerna kombinerar ofta andra ersättningsformer med kapitationsersättning. Andra ersättningsformer som kan ingå i ersättningsmodellerna till primärvårdsenheterna är till exempel ersättning för geografiskt ogynnsamma lägen med litet patientunderlag, ersättning för ett av huvudmannen uppsatt önskat resultat eller ersättning för antal besök (se diagram 1).
Diagram 1. Antal regioner med olika ersättningsformer i primärvården 2021
Kapitationsersättning
var av med 100 % kapitation
Tillägg för geografiskt läge
Resultatbaserad ersättning
Besöksersättning för listade eller
patientavgift
Täckningsgrad primärvårdskonsumtion
| 0 | 5 | 10 | 15 | 20 | 25 |
Antal regioner
Källa: Sveriges Kommuner och Regioner, Ersättningsmodeller i primärvården. Delrapport 1 – en nulägesbeskrivning av ersättningsmodeller och andra ekonomiska villkor inom svensk primärvård 2021 (2022).
107Beräknat utifrån uppgifter om läkemedelskostnader i Kolada.
108Sveriges Kommuner och Regioner, Ersättningsmodeller i primärvården. Delrapport 1 – en nulägesbeskrivning av ersättningsmodeller och andra ekonomiska villkor inom svensk primärvård 2021, 2022.
32 Riksrevisionen
64 procent av regionernas kostnader för läkemedelsförmånerna kan härledas till förskrivningar inom specialistvården. Kostnadsansvaret för förmånsläkemedel som förskrivits inom specialistvården skiljer sig åt mellan regionerna, men majoriteten av regionerna decentraliserar hela eller delar av kostnaderna till vårdenheterna. I till exempel Region Stockholm är kostnadsansvaret i specialistvården decentraliserat till vårdenheter inom geriatriken och psykiatrin samt till de regionägda sjukhusen. Övriga läkemedelskostnader inom både primär- och specialistvård belastar Hälso- och sjukvårdsförvaltningen.109 Ett annat exempel är Region Östergötland där kostnadsansvaret för
Om vårdenheten inte har avtal med Region Östergötland ansvarar Hälso- och sjukvårdsnämnden för kostnaden för klinikläkemedel.110
Vårdgivarna inom specialistvården ersätts framför allt av regionerna genom anslagsfinansiering. Vårdgivaren får en summa pengar, en ram, som ska täcka verksamheten som bedrivs. Det finns ingen direkt koppling mellan behov och prestationer. Under 2021 fördelade alla regioner, utom Stockholm, Östergötland och Västra Götaland, resurserna inom specialistvården helt genom anslag. De sistnämnda regionerna kompletterade anslagsfinansieringen med besöksersättning, ersättning för diagnosrelaterade grupper och målersättning för mål uppsatta av huvudmannen.111
3.5En statistisk analys av statsbidragets styrförmåga
För att undersöka vilken följsamhet läkemedelsförskrivningen har till statsbidraget, det vill säga vilken ”styrförmåga” statsbidraget har, har vi studerat om den nya behovsmodellen som infördes 2021 påverkade regionernas läkemedelsanvändning. Vår analys visar att regeringens försök till styrning genom statsbidraget inte påverkade de enskilda regionernas utgifter för läkemedelsförmånerna.
Vi undersöker perioden
109Vårdgivarguiden, ”Kostnadsansvar för läkemedel i öppenvård, KÖL”, hämtad
110Region Östergötland, ”Läkemedel och ekonomi”, hämtad
111Sveriges Kommuner och Regioner, Ersättningsmodeller i specialiserad vård. Delrapport 2 i projektet Ändamålsenliga ersättningsmodeller, 2022.
Riksrevisionen 33
(region 1 respektive 23 i diagram 2). Enligt den nya behovsmodellen har Region Stockholm betydligt lägre behov av läkemedel, och bidraget ökade relativt lite mellan 2020 och 2021. Region Jämtland Härjedalen anses däremot ha betydligt högre behov enligt den nya modellen jämfört med den gamla, och fick den största ökningen av statsbidraget mellan 2020 och 2021 av alla regioner. Andra regioner som har högre behov enligt den nya modellen är bl.a. Gotland (9), Dalarna (20), Kronoberg (7) och Värmland (17). Några andra regioner som bedömdes ha något lägre behov i den nya jämfört med den gamla modellen är Västmanland (19) och Uppsala (3).
Diagram 2 Procentuell förändring av statsbidraget från behovsmodellen per region
Procent 10
8
6
4
2
0
| 2017/2018 | 2018/2019 | 2019/2020 | 2020/2021 | 2021/2022 | ||||
| 1 | 3 | 4 | 5 | |||||
| 6 | 7 | 8 | 9 | |||||
| 10 | 12 | 13 | 14 | |||||
| 17 | 18 | 19 | 20 | |||||
| 21 | 22 | 23 | 24 | |||||
| 25 | Genomsnitt | |||||||
Källa: Uppgifter sammanställda från Ekonomi Nytt, SKR nr 1/2018, 1/2019, 13/2019, 1/2021.
Om statsbidragets storlek påverkar regionernas budgetering och styrningen av läkemedelsförskrivningen borde utgifterna för läkemedelsförmånerna i de regioner som fått störst förändringar av läkemedelsbidraget påverkas i liknande riktning.
I och med att överenskommelsen slöts först i juni 2021 bör effekterna komma först till budgetåret 2022.
34 Riksrevisionen
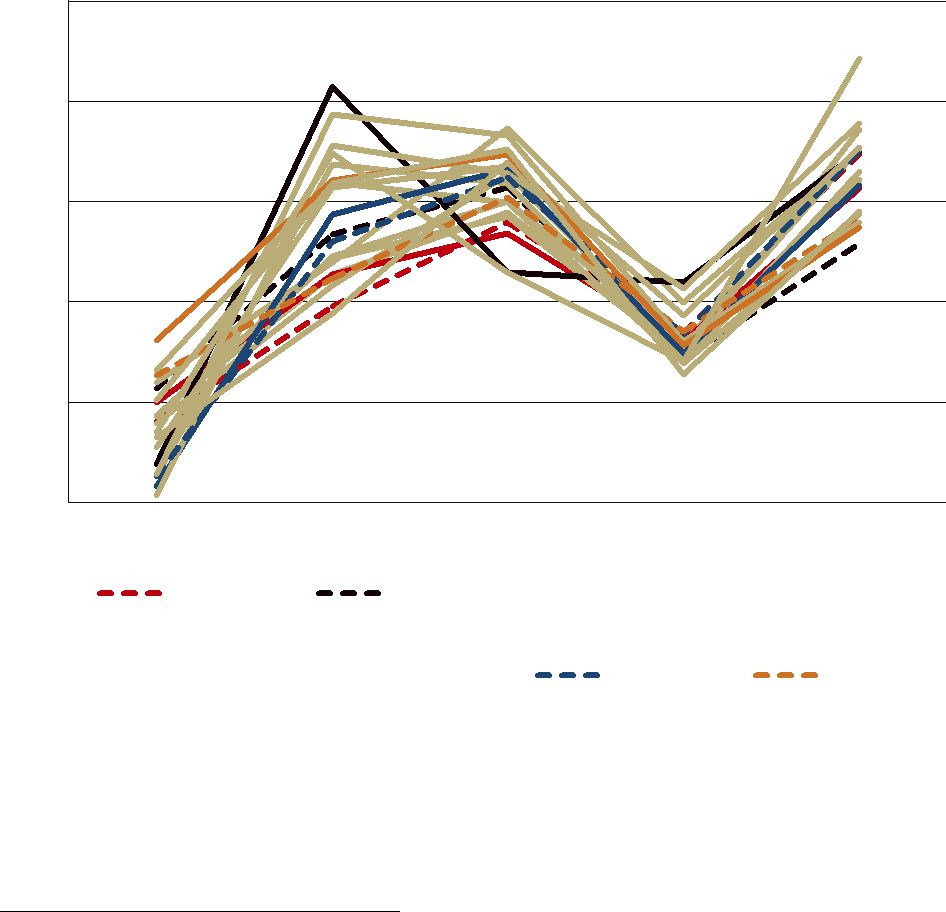
Vi ser inga indikationer på att ändringarna av statsbidraget påverkar regionernas utgifter för läkemedelsförmånerna (diagram 3). Utvecklingen av regionernas förmånskostnader mellan 2017 och 2021 följer inte alls samma stabila mönster som statsbidragets utveckling (jämför diagram 3 med diagram 2). Till exempel är kostnadsförändringen mellan 2017 och 2018 mycket lägre, eller till och med negativ med minskande kostnader för flera regioner. En av orsakerna till den låga kostnadsökningen var den stora återbäring som regionerna fick från läkemedelsbolagen genom trepartsavtalen. En annan orsak var att patenten på
Diagram 3 Förändringen av regionernas förmånskostnader efter avdrag för återbäring från trepartsavtal
Procent 20
15
10
5
0
| 2017/2018 | 2018/2019 | 2019/2020 | 2020/2021 | 2021/2022 | |||||
| 1 | 3 | 4 | 5 | ||||||
| 6 | 7 | 8 | 9 | ||||||
| 10 | 12 | 13 | 14 | ||||||
| 17 | 18 | 19 | 20 | ||||||
| 21 | 22 | 23 | 24 | ||||||
| 25 | |||||||||
Källa: Uppgifter hämtade från
112Socialstyrelsen, Läkemedelsförsäljningen i Sverige – analys och prognos
Riksrevisionen 35
Om läkemedelsförskrivningen, och därmed utgifterna, styrs utifrån statsbidragets storlek borde förmånskostnaderna i Region Jämtland Härjedalen (23), Gotland (9), Dalarna (20), Kronoberg (7) och Värmland (17) ha ökat markant mer än övriga regioners kostnader 2022 i och med budgetförstärkningen från den nya behovsmodellen. Från diagrammet ser vi att Region Jämtland Härjedalen som borde haft störst kostnadsökning för läkemedel mellan 2021 och 2022 har näst lägst kostnadsökning. Även Dalarna, Kronoberg och Värmland har lägre kostnadsökningar än genomsnittsregionen. Det är bara Gotland av de regioner som fått en större tilldelning av statsbidraget med den nya behovsmodellen som har ökat sina utgifter mer än genomsnittet.
Region Stockholm som fått en mycket mindre ökning av statsbidraget än övriga regioner till följd av den nya behovsmodellen hade en något högre kostnadsutveckling än genomsnittsregionen. Om läkemedelsförskrivningen och utgifterna styrdes av storleken på statsbidraget borde Region Stockholms kostnadsutveckling varit bland de lägsta. Våra beräkningar bekräftar att statsbidraget för läkemedel är att betrakta mer som ett allmänt budgetstöd än ett styrmedel.
36 Riksrevisionen
4 Myndigheternas styrning med kunskap
I detta kapitel granskar vi om Läkemedelsverkets, Socialstyrelsens och SBU:s styrning med kunskap bidrar till en effektiv läkemedelsförskrivning.
Våra iakttagelser visar att Socialstyrelsens, Läkemedelsverkets och SBU:s kunskapsstöd grundas på vetenskap och beprövad erfarenhet. Externa experter involveras i arbetet med kunskapsstöden och gedigna processer för kvalitetssäkring finns på plats. Socialstyrelsen och SBU beaktar patienters och brukares synpunkter och erfarenheter i framtagandet av kunskapsstöden, medan Läkemedelsverket endast gör det i liten utsträckning. Kunskapsstöden utgör ett stöd för olika professioners behov, men Socialstyrelsen, vars nationella riktlinjer främst riktar sig till beslutsfattare, involverar inte huvudmännen när de inventerar vilka områden de ska ta fram nya riktlinjer för. De olika myndigheternas kunskapsstöd är samordnade och ger i huvudsak samma rekommendationer i de fall områdena för kunskapsstöden överlappar varandra. Trots myndigheternas överlag tillfredsställande arbete med kunskapsstöden är det svårt att påvisa att kunskapsstyrningen bidrar till en mer jämlik och jämställd läkemedelsförskrivning.
4.1Kunskapsunderlagen grundas på vetenskap och beprövad erfarenhet
Alla tre myndigheter använder vedertagna metoder för att värdera och gradera evidens i de vetenskapliga studier som ligger till grund för kunskapsstöden. Myndigheterna anlitar också externa experter som bidrar till att säkerställa att kunskapsstöden grundas på vetenskap och beprövad erfarenhet. Innan Socialstyrelsen och Läkemedelsverket publicerar sina kunskapsstöd krävs det att experterna når konsensus om de rekommendationer som myndigheterna väljer att ge hälso- och sjukvården.
4.1.1Myndigheterna använder vedertagna metoder för att bedöma tillförlitligheten i det vetenskapliga underlaget
Socialstyrelsen, Läkemedelsverket och SBU använder internationellt vedertagna metoder för att bedöma evidens i det vetenskapliga underlag som ligger till grund för kunskapsstöden.
Under arbetet med att ta fram kunskapsstöden genomförs systematiska litteratursökningar av den forskning som finns publicerad inom det aktuella området. Syftet med litteratursökningarna är att granska och bedöma tillförlitligheten i den litteratur som kommer att ligga till grund för myndighetens kunskapsstöd.
Riksrevisionen 37
Myndigheterna granskar sedan kvalitén på de studier som sökningen resulterar i. Baserat på studiernas kvalitet formulerar myndigheterna tillsammans med experterna slutsatser om effekten av en viss behandling. Gruppen anger även med vilken tillförlitlighet den drar denna slutsats.113, 114, 115 För att bedöma tillförlitligheten i litteraturen använder sig Socialstyrelsen och SBU av metoden GRADE (The Grading of Recommodations Assessment Development and Evaluation) som bygger på en fyrgradig skala där det vetenskapliga underlaget bedöms ha stark, måttlig, låg eller mycket låg tillförlitlighet.116, 117 Läkemedelsverket använder i stället metoden ESC (The European Society of Cardiology).118 ESC bygger, precis som GRADE, på en fyrgradig skala där en behandling antingen rekommenderas, bör övervägas, kan övervägas eller inte rekommenderas baserat på vilken grad av tillförlitlighet forskningen som ligger bakom behandlingen har.119
Läkemedelsverket kan i vissa av sina behandlingsrekommendationer föreslå läkemedel utanför godkänd indikation, så kallad off
4.1.2Beprövad erfarenhet avgör när det vetenskapliga underlaget är otillräckligt
När det vetenskapliga underlaget bedöms vara otillräckligt kan myndigheterna överväga om det i stället är möjligt att samla in beprövad erfarenhet av en viss behandling. Myndigheterna arbetar med detta på olika sätt. Socialstyrelsen tillsätter en konsensuspanel som består av yrkesverksamma inom ett visst hälso- och sjukvårdsområde som, utifrån sin beprövade erfarenhet, får ta ställning till ett antal påståenden om behandlingens nytta via en webbenkät. Socialstyrelsen sammanställer därefter resultaten från enkäten och bedömer att konsensus är uppnådd när minst 30 personer har svarat och minst 75 procent av dessa personer är
113Socialstyrelsen, Nationella riktlinjer för vård och stöd vid adhd och autism. Metodbeskrivning, Bilaga, 2022, 2022, s. 9.
114Statens beredning för medicinsk och social utvärdering, SBU:s metodbok, 2020, s.
115Läkemedelsverket, Behandlingsrekommendationer, 2022, s. 5., Läkemedelsverket, Litteratursökning, 2022, s. 2.
116Socialstyrelsen, Nationella riktlinjer för vård och stöd vid adhd och autism. Metodbeskrivning, Bilaga, 2022, 2022, s. 10.
117Statens beredning för medicinsk och social utvärdering, SBU:s metodbok, 2020, s. 93.
118Möte med representanter för Läkemedelsverket,
119European Society of cardiology, Recommendations for Guidelines Production. A document for Task Force Members Responsible for the Production and Updating of ESC Guidelines, 2010, s. 10.
120Läkemedelsverket, ”Läkemedelsverkets syn på off
38 Riksrevisionen
samstämmiga i sina svar. I arbetet med de nationella riktlinjerna för adhd och autism samlade Socialstyrelsen till exempel in erfarenhetsbaserad kunskap för totalt 30 frågeställningar, med en konsensuspanel bestående av cirka 600 personer som arbetar med riktlinjens målgrupp.121
I Läkemedelsverkets arbete med behandlingsrekommendationer är det expertgruppen respektive Läkemedelsverkets interna kvalitetsgrupp som slår fast vad som är beprövad erfarenhet i de fall det saknas vetenskaplig evidens för en behandling. Expertgruppen består i normalfallet av
SBU ska utvärdera det vetenskapliga stödet för behandlingar och metoder som används i hälso- och sjukvården. SBU sammanställer inte beprövad erfarenhet av en behandling. SBU identifierar däremot vilka vetenskapliga kunskapsluckor som finns samt ger ut och prioriterar vilka kunskapsluckor som är mest angelägna att täppa till med klinisk forskning.127
4.2Myndigheterna har gedigna processer för kvalitetssäkring
Alla de tre granskade kunskapsstyrande myndigheterna har gedigna processer för att ta fram kunskapsstöd. Utöver de interna kvalitetssäkringsfunktionerna involverar myndigheterna externa experter i alla faser av arbetet vilket bidrar till god kvalitet och att kunskapsstöden kvalitetssäkras kontinuerligt. Myndigheterna genomför även grundlig jävsbedömning av experterna. Trots det har ett fåtal experter haft pågående arvoderade uppdrag åt läkemedelsföretag under tiden för arbetet med behandlingsrekommendationerna och de nationella riktlinjerna. Socialstyrelsen
121Socialstyrelsen, Nationella riktlinjer för vård och stöd vid adhd och autism. Metodbeskrivning, Bilaga, 2022, 2022, s.
122Möte med representanter för Läkemedelsverket
123Om en expert är oenig ska det framgå i deltagarlistan. Om en ledamot av kvalitetsgruppen är oense ska det framgå av minnesanteckningarna. Källa: Läkemedelsverket, Utarbeta behandlingsrekommendationer, 2023, s. 6.
124Läkemedelsverket, Utarbeta behandlingsrekommendationer, 2023, s. 8.
125Läkemedelsverket, Kvalitetssäkring vid
126Läkemedelsverket, Utarbeta behandlingsrekommendationer, 2023, s. 5.
127Statens beredning för medicinsk och social utvärdering, ”Vetenskapliga kunskapsluckor – otillräckligt utvärderade åtgärder och metoder”, hämtad
Riksrevisionen 39
kvalitetssäkrar och behovsanpassar stödet ytterligare genom de synpunkter som kommer in på kunskapsstödens remissversioner.128
4.2.1 Externa experter involveras löpande
Socialstyrelsen, SBU och Läkemedelsverket anlitar experter som är med och tar fram kunskapsunderlagen. Experterna är till exempel läkare, sjuksköterskor, forskare, representanter från andra myndigheter och patient- och brukarorganisationer med relevant klinisk och/eller vetenskaplig kompetens inom det område kunskapsstödet behandlar.
Socialstyrelsen och Läkemedelsverket involverar experter i projektledningsgruppen för att tillsammans landa i vilka frågeställningar som ska ligga till grund för det fortsatta arbetet med kunskapsstödet och vilka ytterligare experter som bör bjudas in. Ytterligare experter ingår i den grupp som tar fram kunskapsstödets vetenskapliga underlag och utreder hur evidensen ser ut för en viss fråga eller behandling.129, 130 Hos Socialstyrelsen får en tredje grupp experter med tydlig förankring i hälso- och sjukvården sedan i uppdrag att prioritera (rangordna) rekommendationerna. Regionerna har möjlighet att nominera personer till prioriteringsgruppen i syfte att nå en spridning av sakkunniga.131 Läkemedelsverket arbetar i stället efter ett konsensusupplägg som innebär att samtliga experter som deltagit i projektet samlas under så kallade expertmöten för att diskutera kunskapsstödets vetenskapliga underlag och tillsammans arbeta fram ett utkast till behandlingsrekommendation.132
Även SBU anlitar experter som tillsammans med myndigheten tar fram det vetenskapliga underlag som kunskapsstödet vilar på. Experter involveras i olika hög grad i SBU:s olika typer av publikationer.133 I exempelvis publikationstypen ”SBU Utvärderar” gör SBU på liknande sätt som Socialstyrelsen och Läkemedelsverket och involverar experter redan tidigt i projektet för att definiera frågeställningar och avgränsningar.134 Experterna är sedan med och tar fram och värderar relevanta vetenskapliga underlag samt granskar ett utkast av kunskapsstödet.
I publikationstypen ”SBU:s upplysningstjänst” genomför SBU en strukturerad
128Remissversion har bytt namn till första version för att tydliggöra att det är den versionen som är aktuell. Den slutgiltiga versionen kallas nu uppdaterad version.
129Möte med representanter för Socialstyrelsen,
130Läkemedelsverket, Anlita externa experter i arbetet med behandlingsrekommendationer, 2022, s. 4.
131Möte med representanter för Socialstyrelsen,
132Läkemedelsverket, Utarbeta behandlingsrekommendationer, 2023, s.
133Statens beredning för medicinsk och social utvärdering, ”Organisation”, hämtad
134Statens beredning för medicinsk och social utvärdering, Projektprocess – SBU Utvärderar, 2021.
40 Riksrevisionen
litteratursökning för att besvara frågor från vården om vilka relevanta översikter och studier som finns inom ett visst område. Ett sådant svar utformas främst av medarbetare på SBU, och externa experter involveras enbart vid behov.135
SBU har även ett vetenskapligt råd till sin hjälp. Det vetenskapliga rådets uppgift är att bistå SBU i beredningen inför beslut som bland annat rör projektplan och anlitandet av externa experter.136
4.2.2 Experterna jävsbedöms grundligt
Socialstyrelsen, Läkemedelsverket och SBU genomför även grundliga jävsbedömningar av experterna. Vid vår genomgång av läkemedelsföretags värdeöverföringsrapporter framkom det att ett fåtal experter har haft pågående arvoderade uppdrag åt läkemedelsföretag under tiden för arbetet med behandlingsrekommendationerna och de nationella riktlinjerna. Det är även några experter som inte har angett tidigare uppdrag, som de har arvoderats för, i jävsdeklarationerna.
Experterna bedöms gällande jäv och andra intressekonflikter innan de anlitas. Läkemedelsverket, Socialstyrelsen och SBU har tillsammans med sju andra myndigheter kommit överens om gemensamma regler för redovisning av eventuella intressekonflikter hos experter och sakkunniga.137 Vi har gjort en genomgång av de externa experternas jävsdeklarationer för de tre senaste nationella riktlinjerna, de fyra senaste behandlingsrekommendationerna som innehåller rekommendationer om läkemedel samt ett av SBU:s senast publicerade kunskapsstöd.138 Genomgången visar att myndigheterna gör ett gediget arbete med att jävsbedöma experterna. Socialstyrelsen saknade dock 5 av 161 jävsdeklarationer.
Vi har även gått igenom värdeöverföringsrapporter för ett antal läkemedelsföretag som säljer läkemedel på områdena för de tre senaste nationella riktlinjerna och de tre senaste behandlingsrekommendationerna som innehåller rekommendationer
135Statens beredning för medicinsk och social utvärdering, ”SBU:s publikationstyper”, hämtad
136Statens beredning för medicinsk och social utvärdering, Årsredovisning 2022, 2023, s. 51.
137Läkemedelsverket, ”Hantering av jäv”, hämtad
138Socialstyrelsens nationella riktlinjer för multipel skleros (MS) och Parkinsons sjukdom (2022), adhd och autism (2022) och obesitas (2023). Läkemedelverkets behandlingsrekommendationer för astma (2023) och kroniskt obstruktiv lungsjukdom (KOL) (2023), inflammatorisk tarmsjukdom (IBD) (2021) och influensa (2022). SBU:s kunskapsstöd lipödem (2023).
Riksrevisionen 41
om läkemedel.139 Värdeöverföringsrapporterna finns samlade hos De forskande läkemedelsföretagen (Lif) som arbetar med bland annat etik inom läkemedelsbranschen och verkar för öppenhet och transparens.140 I värdeöverföringsrapporterna kan man se överföringar av konsultarvoden från läkemedelsföretag till hälso- och sjukvårdspersonal.
Trots myndigheternas gedigna arbete, visar vår genomgång att ett fåtal experter haft pågående arvoderade uppdrag åt läkemedelsföretag under tiden för arbetet med behandlingsrekommendationerna och de nationella riktlinjerna. Några experter har inte heller angett tidigare uppdrag, som de har arvoderats för, i jävsdeklarationerna, trots att det står att experterna ska fylla i uppgifter för de senaste fem åren. Några experter har även fått arvoden samma år som den nationella riktlinjen och behandlingsrekommendationen publicerades. Då Lif inte skriver ut när på året arvodet har betalats ut är det svårt att veta om experten har fått arvodet under arbetets gång eller efter publiceringen.
Att läkemedelsföretag anlitar hälso- och sjukvårdspersonal är inget nytt fenomen; hundratals miljoner kronor förs över årligen från läkemedelsindustrin till sjukvårdspersonal.141 Riksrevisionen har i en tidigare granskningsrapport142 konstaterat att experter som myndigheterna anlitar har starka kopplingar till läkemedelsindustrin och att detta är en svårlöst intressekonflikt då de främsta experterna på läkemedelsområdet tenderar att ha eller har haft samarbete med läkemedelsföretag.
4.2.3 Framtagna utkast kvalitetssäkras ytterligare
Utöver den kvalitetsgranskning som de externt anlitade experterna bidrar med har de tre granskade myndigheterna ytterligare interna processer för kvalitetssäkring. Socialstyrelsen använder sig även av ytterligare extern kvalitetskontroll.
Läkemedelsverket kvalitetssäkrar de utkast av behandlingsrekommendationer som tagits fram under expertgruppsmötena på utredarmöten
139SBU:s kunskapsstöd är en sammanställning av prioriterade forskningsluckor och berör inte läkemedel på samma sätt som i Socialstyrelsens och Läkemedelsverkets kunskapsstöd. SBU är därför inte med i denna genomgång.
140Läkemedelsindustriföreningen (Lif), ”Sök öppen rapportering av värdeöverföring”, hämtad
141Blume, ”Miljonflöden från läkemedelsbolag till läkare”,
142Riksrevisionen, Säkra och effektiva läkemedel – hur hanterar staten läkemedelsindustrins inflytande?, 2016, s. 70, 68.
42 Riksrevisionen
ett
På SBU arbetar ett flertal olika funktioner med att kvalitetssäkra myndighetens publikationer. Under arbetet med att ta fram ett kunskapsstöd finns det till exempel olika metodstödsgrupper som projektledaren kan vända sig till vid behov. Metodstöden kan bland annat bistå projektledaren i frågor som rör specifika metodfrågor, formulering av slutsatser och terminologi. Utöver metodstöden har SBU en kvalitetssäkringsgrupp
Innan publicering av en nationell riktlinje kvalitetssäkrar den ansvariga utredaren riktlinjen tillsammans med enhetschefen. Därefter kan projektledningsgruppen behöva revidera utkastet innan riktlinjen presenteras för avdelningschefen. Efter eventuella ytterligare revideringar föredras kunskapsstödet för generaldirektören och ledningsgruppen för ytterligare kvalitetssäkring. En ny nationell riktlinje publiceras först som en remissversion147 som diskuteras på ett antal regionala seminarier där beslutsfattare runt om i landet analyserar hur riktlinjerna kan komma att påverka deras verksamhet. Remissversionen publiceras även på Socialstyrelsens webbplats så att även andra intressenter, exempelvis professionsföreningar, patient- och brukarorganisationer och allmänheten, ska ha möjlighet att lämna synpunkter. När Socialstyrelsen sammanställt resultatet av beslutsfattarnas
143Möte med representanter för Läkemedelsverket,
144Läkemedelsverket,
145Läkemedelsverket, Kvalitetssäkring vid
146Statens beredning för medicinsk och social utvärdering, Arbetsformer för kvalitetssäkring av SBU:s produkter och metoder, 2021, s.
147Remissversion har efter vår granskning bytt namn till första version.
Riksrevisionen 43
konsekvensanalyser och beaktat övriga intressenters synpunkter publiceras en slutlig version av riktlinjerna.148
4.3Patienters och brukares medverkande i kunskapsstöden skiljer sig mellan myndigheterna
Stärkt patient- och brukarinflytande är en fråga som myndigheterna samverkar kring i Rådet för styrning med kunskap. Socialstyrelsen och SBU involverar nästintill alltid patientföreträdare i arbetet med sina kunskapsstöd. Läkemedelsverket har samarbetat med patientföreträdare i ett fåtal behandlingsrekommendationer. De patientföreträdare vi har pratat med som deltagit i arbetet med Socialstyrelsens och SBU:s kunskapsstöd är överlag positiva till samarbetet. Patientrepresentanterna som deltagit i arbetet med Läkemedelsverkets kunskapsstöd ger en mer splittrad bild där några upplever att deras synpunkter och erfarenheter kunde ha tagits bättre om hand.
4.3.1Stärkt patient- och brukarinflytande är en prioriterad fråga i Rådet för styrning med kunskap
Socialstyrelsen, Läkemedelsverket och SBU samverkar kring frågor om stärkt patient- och brukarinflytande i Rådet för styrning med kunskap. År 2016 fick SBU ett uppdrag av Rådet för styrning med kunskap att tillsätta en myndighetsgemensam arbetsgrupp med fokus på att stärka patient- och brukarinflytandet. Syftet med samarbetet var att bättre ta vara på patienters och brukares erfarenheter samt ge dessa större möjligheter att bland annat påverka innehållet i de kunskapsstöd som tas fram. Patient- och brukarperspektivet är en hörnsten i den omställning som sker inom vården för att åstadkomma god och nära vård.
I arbetsgruppen fanns alla nio myndigheter som då ingick i Rådet för styrning med kunskap representerade, däribland Socialstyrelsen, Läkemedelsverket och SBU.149 Med hjälp av företrädare för fem stora patientorganisationer och intresseföreningar tog arbetsgruppen fram ett antal gemensamma rekommendationer till myndigheterna i Rådet för styrning med kunskap för att stärka patienters och brukares inflytande på framtida satsningar och forskning.150
148Möte med representanter för Socialstyrelsen,
149Statens beredning för medicinsk och social utvärdering, ”Nu stärks brukarnas inflytande i nio myndigheter”, hämtad
150Socialstyrelsen,
44 Riksrevisionen
I samband med att rekommendationerna togs fram skapades ett myndighetsgemensamt nätverk där SBU, Socialstyrelsen och Läkemedelsverket idag, tillsammans med de resterande sju myndigheter i Rådet för styrning med kunskap, arbetar med frågor som berör samverkan med patienter och brukare.151
4.3.2Formerna för samarbetet med patient- och brukarorganisationer skiljer sig mellan myndigheterna
Samarbetet med patientföreträdarna ser olika ut, beroende på vilken myndighet och vilken typ av kunskapsstöd det rör sig om. Socialstyrelsen eftersträvar en regelbunden dialog med patientföreträdare under hela projektets gång. Socialstyrelsen kan till exempel ha en hearing i början av ett projekt, där patientföreträdare finns representerade och har möjlighet att uttrycka sina åsikter i en viss fråga. Ibland har Socialstyrelsen även en hearing efter att projektgruppen har landat i frågeställningar och avgränsningar för att stämma av dem med patientföreträdare.152 Socialstyrelsen involverar även
Läkemedelsverket kan rekrytera en eller flera patientrepresentanter som deltar i de expertgruppsmöten där behandlingsrekommendationerna arbetas fram.153 Läkemedelsverket har även ett patient- och konsumentråd som myndigheten träffar två gånger per år.154 Syftet med rådet är bland annat att patient- och konsumentorganisationer ska ges möjlighet att ge inspel i olika frågor kopplat till Läkemedelsverkets verksamhet, däribland myndighetens kunskapsstöd.155
SBU:s behov av att involvera patientföreträdare i arbetet med sina kunskapsstöd varierar beroende på publikationstyp. Patientföreträdare involveras främst
i publikationstypen ”Prioritering av vetenskapliga kunskapsluckor” där SBU gör en prioritering av vilka kunskapsluckor som är mest angelägna att täppa till med klinisk forskning baserat på bland annat brukares och patienters perspektiv.156 Projektet består vanligtvis av en inledande inventeringsdel då kunskapsluckor identifieras, samt en efterföljande prioriteringsdel där de kunskapsluckor som har
151Socialstyrelsen, Statlig styrning med kunskap för hälso- och sjukvård och socialtjänst. Redogörelse för arbetet inom Rådet för styrning med kunskap och Huvudmannagruppen under 2021, 2021, s. 9.
152Möte med representanter för Socialstyrelsen,
153Läkemedelsverket, Anlita externa experter i arbetet med behandlingsrekommendationer, 2022.
154Läkemedelsverket, ”Patient- och konsumentråd”, hämtad
155Möte med representanter för Läkemedelsverket,
156Statens beredning för medicinsk och social utvärdering, ”SBU:s publikationstyper”, hämtad
Riksrevisionen 45
identifierats rangordnas. I båda delar engageras personer som har kunskap om och egen erfarenhet av det aktuella ämnesområdet, däribland patienter.157
4.3.3Patient- och brukarorganisationers involvering i arbetet med kunskapsstöden
Vi har undersökt i vilken utsträckning Socialstyrelsen, Läkemedelsverket och SBU involverar patient- och brukarrepresentanter i expertgrupperna som arbetar med att ta fram kunskapsstöden. Vår genomgång visar att:
∙Socialstyrelsen har samarbetat med patientföreträdare i 16 av 18 nationella riktlinjer
∙SBU har samarbetat med patientföreträdare i samtliga 6 kunskapsstöd av publikationstypen ”Prioritering av vetenskapliga kunskapsluckor”158
∙Läkemedelsverket har samarbetat med patientföreträdare i 9 av 46 behandlingsrekommendationer.
Läkemedelsverket strävar efter att anlita patientföreträdare till de behandlingsrekommendationer som berör kroniska diagnoser där det finns en lämplig patientorganisation att kontakta.159 Vår genomgång av Läkemedelsverkets
46 behandlingsrekommendationer visar dock att ett flertal av de rekommendationer där Läkemedelsverket inte har involverat patientföreträdare, berör diagnoser med koppling till stora patient- och brukarorganisationer. Några exempel är behandlingsrekommendationerna för astma, KOL, MS och schizofreni.160 Samtliga av dessa diagnoser behandlas även i Socialstyrelsens nationella riktlinjer. För alla fyra diagnoser har Socialstyrelsen samarbetat med patientföreträdare.
157
158Vi bedömer att ”Prioritering av vetenskapliga kunskapsluckor” är den enda av SBU:s publikationstyper där patientföreträdare ska involveras. Vi har därför valt att bortse från involveringen av patientföreträdare i övriga publikationstyper.
159Möte med representanter för Läkemedelsverket,
160Enligt Läkemedelsverket hade projektgruppen identifierat Astma- och allergiförbundet och Riksförbundet HjärtLung som lämpliga att bjuda in som patientrepresentanter till behandlingsrekommendationerna för både astma och KOL. Organisationerna bjöds dock aldrig in. Omständigheter som enligt Läkemedelsverket kan ha bidragit till detta var pandemin, en omfattande jävsprocess, svårigheter att rekrytera experter samt pensionsavgångar i projektgruppen som innebar ett byte av projektledare under pågående process.
46 Riksrevisionen
Vi har intervjuat ett antal patientföreträdare som deltagit i arbetet med några av de senaste kunskapsstöden som myndigheterna har tagit fram.161 Samtliga patientföreträdare som samarbetat med Socialstyrelsen och SBU är positivt inställda till samarbetet med myndigheterna och upplever att de haft samma möjligheter som resterande projektdeltagare att lyfta fram sina synpunkter och erfarenheter i arbetet med kunskapsstöden. Ett flertal patientföreträdare lyfter vidare att dialogen med myndigheterna har varit god, samt att kärnan i det de lyft fram har tagits väl om hand. Det har dock framkommit kritik från både patient- och professionsrepresentanter mot Socialstyrelsen att det fanns oklarheter kring möjligheterna att inkludera off labelförskrivna läkemedel och läkemedel utan läkemedelsförmån i de nationella riktlinjerna.162
De patientföreträdare som har samarbetat med Läkemedelsverket ger en mer splittrad bild där några upplever att myndigheten har varit mindre bra på att involvera dem i processen. Kritiken som förmedlats är att mer kunde ha gjorts för att involvera patientrepresentanterna i de diskussioner som fördes. Vidare upplevdes att nivån på språket som användes under diskussioner och skrivprocess inte var anpassat efter rollen som patientföreträdare. Det fanns även vissa brister i informationen om hur de olika stegen i arbetet skulle gå till.163
4.4Involverandet av professionsrepresentanter och huvudmän i kunskapsstöden
Socialstyrelsens, Läkemedelsverkets och SBU:s kunskapsstöd är väl anpassade till olika professioners behov. Intervjuade professionsrepresentanter upplever att kunskapsstöden utgör ett bra stöd för den egna professionen. Socialstyrelsen, vars nationella riktlinjer främst riktar sig till beslutsfattare, involverar däremot inte huvudmännen i valet av vilka riktlinjer som ska tas fram.
4.4.1 Kunskapsunderlagen utgör ett viktigt stöd för professionen
Vi konstaterar att de kunskapsstyrande myndigheterna tar fram kunskapsstöd som är anpassade efter och utgör ett viktigt stöd för olika professioners behov.
161Socialstyrelsens nationella riktlinjer: psoriasis (2019), adhd och autism (2022), multipel skleros (MS) och Parkinsons sjukdom (2022) och obesitas (2023). Läkemedelsverkets behandlingsrekommendationer: psoriasis och psoriasisartrit (2019), inflammatorisk tarmsjukdom (IBD) (2021) och atopisk dermatit (2023). SBU:s kunskapsstöd: lipödem (2023).
162
163Telefonsamtal med patientföreträdare under juni och oktober 2023.
Riksrevisionen 47
En central del i myndigheternas arbete med att ta fram kunskapsstöden består i att identifiera behovet av vägledning, det vill säga vilka frågeställningar som ska ingå i kunskapsstöden. Förslag på nya kunskapsstöd kan komma som ett önskemål från såväl patientorganisationer som huvudmän och yrkesverksamma inom hälso- och sjukvården. Olika yrkeskategorier finns, som tidigare nämnts, representerade i de expertgrupper som myndigheterna anlitar för att ta fram kunskapsstöden och har där möjlighet att lyfta olika professioners behov.
Vi har intervjuat ett antal professionsrepresentanter som deltagit i arbetet med myndigheternas kunskapsstöd.164 Samtliga representanter delar uppfattningen att kunskapsstöden utgör ett bra stöd för den egna professionen. De menar även att samarbetet med myndigheterna har fungerat bra samt att deras åsikter, kompetens och erfarenheter inom det aktuella området har tagits väl om hand och hjälpt såväl utformningen som utvecklingen av projektet.165
4.4.2Huvudmännen är inte delaktiga i valet av vilka nationella riktlinjer som ska tas fram
Dialogen med huvudmännen (beslutsfattare i regionerna som högre tjänstemän och politiker) om behovet av vägledning för de granskade myndigheterna sker främst genom regionernas nationella system för kunskapsstyrning och de nationella programområden (NPO) som ingår där. Huvudmannagruppen som finns kopplad till Rådet för styrning med kunskap informerar även myndigheterna i rådet om olika områden där huvudmännen är i behov av kunskap.
Socialstyrelsen lyfter själv att myndigheten behöver utveckla sitt arbete med att göra personer som arbetar med styrning och ledning mer delaktiga i analysen av vilka riktlinjeområden som behövs. Framför allt eftersom de nationella riktlinjerna främst är ett stöd för just beslutsfattare.166 I dagsläget förekommer det att personer med lednings- och styrningsansvar inom en region eller kommun medverkar i den expertgrupp som avgränsar vilka frågor som inkluderas inom ett riktlinjeområde eller den expertgrupp som prioriterar bland rekommendationerna i en riktlinje, men personen deltar då inte i egenskap av huvudman utan snarare som företrädare för sin sakkunskap. Huvudmännens synpunkter på riktlinjerna kommer i stället främst in på de regionala seminarier som hålls efter att en remissversion av
164Socialstyrelsens nationella riktlinjer: adhd och autism (2022), multipel skleros (MS) och Parkinsons sjukdom (2022) och obesitas (2023). Läkemedelsverkets behandlingsrekommendationer: influensa (2022), astma (2023) och kroniskt obstruktiv lungsjukdom (KOL) (2023). SBU:s kunskapsstöd: lipödem (2023).
165
166Möte med representanter för Socialstyrelsen,
48 Riksrevisionen
riktlinjerna publicerats. Med andra ord efter det att en riktlinje i princip är klar. Synpunkterna kan Socialstyrelsen sedan ta i beaktande inför att den slutgiltiga versionen av riktlinjen publiceras.167
I april i år publicerades en slutgiltig version av Socialstyrelsens nationella riktlinjer för vård vid obesitas. Vår jämförelse av denna version med riktlinjens remissversion och inkomna remissvar visar att Socialstyrelsen inte gjort några större förändringar i den slutgiltiga versionen av den nationella riktlinjen för vård vid obesitas. De förändringar som gjorts har framför allt baserats på synpunkter som regioner, kommuner och andra intressenter lyft fram. En förklaring till det kan vara att kommuner, regioner och patientföreningar ofta kommer med konkreta förslag på förändringar med referenser till specifika sidor eller stycken, medan privatpersoner i högre grad uttrycker ett generellt missnöje över riktlinjerna.
SBU har en upplysningstjänst där både professioner och huvudmän har möjlighet att ställa frågor om vilken forskning som finns publicerad om en viss behandlingsmetod. Upplysningstjänsten används även av SBU för att identifiera områden där huvudmän och professionerna kan tänkas behöva vägledning.168
Eftersom Läkemedelsverkets kunskapsstöd främst riktar sig till professionen involveras inte huvudmännen i myndighetens behandlingsrekommendationer i någon större grad. Läkemedelsverket har dock, utöver dialogen med regionernas NPO:er, kontinuerliga avstämningar med regionernas läkemedelskommittéer om huvudmännens behov.169
4.5Myndigheternas rekommendationer är i hög grad samordnade
Socialstyrelsen, Läkemedelsverket och SBU samverkar i syfte att samordna sina kunskapsstöd och rekommendationer. Samverkan sker dels genom avstämningar och samarbeten myndigheterna emellan, dels genom det arbete som myndigheterna gemensamt bedriver inom Rådet för styrning med kunskap. Socialstyrelsens och Läkemedelsverkets kunskapsstöd behandlar i flertalet fall samma diagnoser. Vår jämförelse av dessa överlappande kunskapsstöd visar att myndigheterna i hög grad rekommenderar samma läkemedel.
167
168Möte med representanter för SBU,
169Möte med representanter för Läkemedelsverket,
Riksrevisionen 49
4.5.1Socialstyrelsen och Läkemedelsverkets överlappande kunskapsstöd ger i hög grad liknande rekommendationer
Vår genomgång av Socialstyrelsens och Läkemedelsverkets kunskapsstöd visar att Läkemedelsverket har behandlingsrekommendationer för 12 av de 19 diagnoser eller sjukdomstillstånd som Socialstyrelsen behandlar i sina nationella riktlinjer.170 Med ett fåtal undantag tar Socialstyrelsen och Läkemedelsverket fram rekommendationer om läkemedelsförskrivning som i hög grad överensstämmer med varandra. I de fall myndigheterna ger motstridiga rekommendationer beror skillnaderna oftast på att:
∙Socialstyrelsen, till skillnad från Läkemedelsverket, tar hänsyn till hälsoekonomiska analyser i sina bedömningar
∙Socialstyrelsen och Läkemedelsverket använder olika skalor vid prioriteringen av sina rekommendationer
∙Läkemedelsverket avstår från att rekommendera vissa läkemedel som Socialstyrelsen rekommenderar, på grund av brist på forskningsstudier
∙Läkemedelsverket baserar oftast sina rekommendationer på olika åldersgrupper, till skillnad från Socialstyrelsen
∙Läkemedelsverket, men inte Socialstyrelsen171, rekommenderar off labelförskrivna läkemedel
∙Socialstyrelsen rekommenderar, till skillnad från Läkemedelsverket, endast läkemedel som TLV har beslutat ska ingå i läkemedelsförmånerna.172
Jämförelsen mellan myndigheternas överlappande kunskapsstöd visar även goda exempel på hur Socialstyrelsen och Läkemedelsverket samverkar, i syfte att undvika dubbelarbete. Ett exempel är kunskapsstöden för behandling av tillstånd i livets slutskede som kompletterar, snarare än överlappar, varandra. Detta eftersom Socialstyrelsen i sin nationella riktlinje för god palliativ vård valt att utesluta rekommendationer som berör smärtlindring med hjälp av läkemedel. För denna
170SBU:s kunskapsstöd ger inga rekommendationer och har därför avgränsats bort inom ramen för jämförelsen.
171Det har förekommit i enstaka fall att Socialstyrelsen rekommenderat off
172Det har förekommit läkemedelsrekommendationer i de nationella riktlinjerna som inte omfattas av läkemedelsförmånerna. Socialstyrelsen har då gjort en bedömning i det enskilda fallet utifrån bl.a. läkemedelspris.
50 Riksrevisionen
form av behandlingsmetod hänvisar Socialstyrelsen i stället till Läkemedelsverkets behandlingsrekommendation ”Smärtlindring i livets slutskede”.173
Socialstyrelsen uppger att myndigheternas samordnade kunskapsstyrning har utvecklats ordentligt sedan förordningen om statlig styrning med kunskap kom 2015. Att myndigheterna idag ger olika signaler är därför ovanligt. Utmaningen är i stället myndigheternas samordning med regionerna som främst sker genom Partnerskapet för kunskapsstyrning inom hälso- och sjukvården (partnerskapet), en gemensam kontaktyta mellan myndigheterna och regionernas nationella system för kunskapsstyrning. Enligt Socialstyrelsen utgör partnerskapet för tillfället ett utvecklingsområde där arbetet går ut på att förtydliga roller och ansvar, undvika dubbelarbete och motverka att staten och regionerna ger olika signaler.174
Socialstyrelsen och Läkemedelsverket samarbetar även med samma experter i flera av sina kunskapsstöd. Det bidrar troligtvis också till att myndigheterna når en samsyn i sina slutgiltiga rekommendationer. För de 12 sjukdomsområden där Socialstyrelsens nationella riktlinjer och Läkemedelsverkets behandlingsrekommendationer överlappar varandra har minst två experter per sjukdomsområde deltagit i arbetet med båda myndigheternas kunskapsstöd. För tre sjukdomsområden, astma och KOL, diabetes samt epilepsi, har så många som 12 experter deltagit i båda myndigheternas kunskapsstöd.
4.5.2Myndigheterna samverkar såväl i som utanför Rådet för styrning med kunskap
Socialstyrelsen, Läkemedelsverket och SBU har flera olika kanaler för att samverka och samordna sina kunskapsstöd. Myndigheterna samverkar bland annat inom Rådet för styrning med kunskap. Under 2021 tog myndigheterna i Rådet för styrning med kunskap fram en gemensam strategi för arbetet fram till år 2025. Ett av strategins mål är att myndigheterna genom ett ökat gemensamt kommunikationsarbete och en ökad kunskap om varandras arbetssätt ska förmedla ett mer sammanhållet budskap.175 Rådet för styrning med kunskap har till exempel tagit
173Socialstyrelsen, Nationellt kunskapsstöd för god palliativ vård i livets slutskede. Vägledning, rekommendationer och indikatorer. Stöd för styrning och ledning, 2013, s.
174Möte med representanter för Socialstyrelsen,
175Socialstyrelsen,
Riksrevisionen 51
fram Kunskapsguiden som är en nationell webbplats där kunskapsstöd från flera olika myndigheter finns samlat.176
Samverkan mellan myndigheterna sker även utanför Rådet för styrning med kunskap. Socialstyrelsen och Läkemedelsverket har regelbundna avstämningar om aktuella läkemedelsfrågor i arbetet med sina kunskapsstöd. Syftet är till exempel att nå en samsyn i förskrivningsbegränsning eller behandlingslängd vid ett visst tillstånd.177
Socialstyrelsen och SBU samverkar även i form av att SBU ibland granskar och sammanställer forskning till Socialstyrelsens kunskapsstöd. För detta ändamål har SBU tagit fram en specifik publikationstyp kallad ”SBU Bereder”, där SBU bereder frågor till andra myndigheters och uppdragsgivares verksamheter. I dagsläget ser SBU att de i högre grad skulle kunna bidra i arbetet med att ta fram kunskapsunderlag även till andra myndigheter, exempelvis Läkemedelsverket. Enligt SBU har ett antal pilotprojekt genomförts med Läkemedelsverket under åren, men samarbetet mellan myndigheterna har inte kommit längre än så.178 Vår genomgång av Läkemedelsverkets behandlingsrekommendationer visar dock att cirka
30 procent av kunskapsstöden refererar till SBU:s rapporter och att Läkemedelsverket drar nytta av SBU:s kunskapsunderlag.
4.6Myndigheternas kunskapsstyrning ger svaga resultat vad gäller jämlik och jämställd läkemedelsförskrivning
Regionerna och de kunskapsstyrande myndigheterna ger i stor utsträckning samma läkemedelsrekommendationer. Socialstyrelsen och Läkemedelsverket gör uppföljningar av kunskapsstöden, men återrapporterar inte resultatet till kommuner och regioner. SBU:s kunskapsstöd innehåller inga rekommendationer och är därför svårare att följa upp. Myndigheternas kunskapsstyrning har inte någon större påverkan på förskrivningen av läkemedel. Skillnaderna mellan regionerna minskar i regel inte efter att ett nytt kunskapsstöd har publicerats.
176Socialstyrelsen, Statlig styrning med kunskap för hälso- och sjukvård och socialtjänst. Redogörelse för arbetet inom Rådet för styrning med kunskap och Huvudmannagruppen under 2021, 2021, s. 9.
177Möte med representanter för Socialstyrelsen,
178Möte med representanter för SBU,
52 Riksrevisionen
4.6.1Regionernas och de kunskapsstyrande myndigheternas läkemedelsrekommendationer är i hög grad samstämmiga
För att den statliga kunskapsstyrningen ska få effekt på förskrivningen av läkemedel krävs att kunskapsstyrningen på regional nivå överensstämmer med statens kunskapsstyrning. Inom ramen för Partnerskapet för kunskapsstyrning inom hälso- och sjukvården samarbetar Socialstyrelsen, Läkemedelsverket och SBU med regionernas nationella system för kunskapsstyrning. I partnerskapet finns det en överenskommelse om att regionerna ska utgå från Socialstyrelsens nationella riktlinjer i sina egna kunskapsstöd i den mån det är möjligt.179
Vid en genomgång av läkemedelskommittéernas180 rekommenderade läkemedel181 framkom att det inte var någon större skillnad i rekommendationerna mellan regionerna. Vid en jämförelse mellan regionernas läkemedelsrekommendationer och Socialstyrelsens och Läkemedelsverkets läkemedelsrekommendationer framkom att regionerna i hög grad rekommenderar samma läkemedel som staten. Det är dock vanligt förekommande att staten rekommenderar fler substanser än vad regionerna gör vid behandling av en specifik diagnos. En diagnos där staten och regionernas läkemedelsrekommendationer överensstämmer något sämre är psoriasis, där ett flertal immunsuppressiva läkemedel som rekommenderas av staten endast rekommenderas av en region.
4.6.2Trots samordnad kunskapsstyrning finns betydande regionala skillnader i läkemedelsförskrivningen
Vår genomgång av Socialstyrelsens och Läkemedelsverkets182 uppföljningar av sina kunskapsstöd, tillsammans med vår statistiska undersökning, visar att myndigheternas kunskapsstyrning endast har en begränsad påverkan på förskrivningen av läkemedel. Könsskillnader och skillnader mellan regionerna kvarstår i regel efter att ett nytt kunskapsstöd har publicerats.
Socialstyrelsen har genomfört utvärderingar av nio nationella riktlinjer med rekommendationer om läkemedel sedan 2018.183 I utvärderingarna undersöker Socialstyrelsen dels utvecklingen av expedierade läkemedel i riket för män och
179Socialstyrelsen, Statlig styrning med kunskap för hälso- och sjukvård och socialtjänst. Redogörelse för arbetet inom Rådet för styrning med kunskap och Huvudmannagruppen under 2021, 2022, s.
180År
181Vår genomgång rörde de läkemedel som rekommenderas för följande diagnoser: demens/alzheimer, epilepsi, psoriasis, depression och ångest samt akne.
182SBU:s kunskapsstöd innehåller inte rekommendationer och kan därmed inte följas upp.
183Nationella riktlinjer om rörelseorganens sjukdomar (artros), epilepsi, endometrios, schizofreni, astma och KOL, demenssjukdom, depression och ångestsyndrom, psoriasis samt stroke.
Riksrevisionen 53
kvinnor under ett antal år, dels hur den regionala spridningen ser ut ett enskilt år. Fem av utvärderingarna visar att den genomsnittliga användningen av läkemedlen i riket utvecklas i samma riktning som rekommendationerna. Men i tre av utvärderingarna (endometrios, epilepsi och schizofreni) rekommenderar Socialstyrelsen att läkemedelsbehandlingen behöver öka kraftigt för att regionerna ska anses följa rekommendationerna. Vid artros är behandlingen med smärtstillande läkemedel för hög och här rekommenderar Socialstyrelsen hälso- och sjukvården att upplysa patienterna om att smärtstillande har liten effekt vid artros och att det finns risker vid långvarigt bruk. I samtliga utvärderingar visar Socialstyrelsen att det finns betydande regionala skillnader i läkemedelsförskrivningen.
I fem av Socialstyrelsens utvärderingar har frågor ställts till regionerna, och i de fall det är relevant även till kommunerna, om hur de har implementerat de nationella riktlinjerna.184 För att undersöka om de som beslutar om resursfördelningen också har fattat beslut om att använda kunskapsstöden fick region- och kommunledningarna svara på frågor om de nationella riktlinjerna har behandlats i nämnd eller styrelse, om de fattat några politiska beslut med anledning av riktlinjerna samt om de tagit fram någon handlingsplan för att införa riktlinjerna. En del i implementeringsarbetet är att skapa förutsättningar för professionen att arbeta enligt riktlinjernas rekommendationer genom att till exempel utbilda vårdpersonalen. Regionerna och kommunerna fick därför även svara på om de anordnat någon informationsaktivitet till personalen om riktlinjerna.
Generellt bedömer Socialstyrelsen att regioner, men särskilt kommuner, behöver stärka sitt arbete med att på högsta beslutande ledningsnivå behandla och införa de nationella riktlinjerna. Regionerna, men särskilt kommunerna, behöver också fortbilda och informera personalen i större utsträckning.185 Socialstyrelsen konstaterar också att det i och med införandet av det nationella systemet för kunskapsstyrning finns bättre förutsättningar för regionerna att ta emot och arbeta vidare med rekommendationerna i de nationella riktlinjerna än tidigare.186
Socialstyrelsen betonar att de nationella riktlinjerna är en
184Utvärderingarna rör implementeringen av nationella riktlinjer för rörelseorganens sjukdomar från 2021 (med fokus på artros i utvärderingen), schizofreni och schizofreniliknande tillstånd från 2018, astma och KOL från 2015, palliativ vård i livets slutskede från 2013 samt sjukdomsförebyggande metoder från 2011.
185Undantaget är informationsinsatserna som gjorts i samband med införandet av de nationella riktlinjerna för astma och KOL.
186Utvärderingen från 2023 av den nationella riktlinjen för rörelseorganens sjukdomar från 2021.
54 Riksrevisionen
riktlinjerna inte enbart syftar till att nå en jämlik vård, utan även en bättre vård med en bättre kvalitet i de insatser som ges. I vissa fall kan det därmed finnas skäl till regionala skillnader.187
Läkemedelsverket har hittills gjort fyra uppföljningar av behandlingsrekommendationer.188 I utvärderingarna kartlägger Läkemedelsverket expedieringsmönster i riket före och efter en behandlingsrekommendation publicerats. Två av utvärderingarna visar att den genomsnittliga användningen av läkemedel i riket utvecklats i samma riktning som rekommendationerna, men ökningen hade redan börjat innan behandlingsrekommendationen publicerades.189 En av utvärderingarna visar på en oönskad ökning av läkemedelsbehandling vilket tolkas som överförskrivning av Läkemedelsverket.190 I den sista utvärderingen visas dels att andelen med rekommenderade läkemedel ökar mer efter att behandlingsrekommendationerna publicerats än innan. Dels visas att andelen som expedierats läkemedel som inte rekommenderas av Läkemedelverket minskat. Båda resultaten indikerar att behandlingsrekommendationen fått effekt.191
Både Socialstyrelsen och Läkemedelsverket uppger att det finns regionala skillnader i läkemedelsförskrivningen på flera av de områden där de har gett ut kunskapsstöd. När uppföljningen av kunskapsstyrningen visar på större regionala skillnader i förskrivningsmönster gör varken Socialstyrelsen eller Läkemedelsverket några direkta utskick till de regioner som avviker mest för att påpeka avvikelsen. Alla regionerna uppmärksammas däremot på att det gjorts en utvärdering genom den rapport som publiceras på myndigheternas webbplatser.192, 193 Socialstyrelsen skickar även ut utvärderingarna till regionerna (oavsett resultat från utvärderingen), professionsföreträdare och patientföreningar. Socialstyrelsen erbjuder också presentationer för nationella programområden, regionerna och professionsföreningar av utvärderingarna.194
187Möte med representanter för Socialstyrelsen,
188Behandling av sömnstörning hos barn och ungdomar, läkemedel vid klimakteriesymptom, läkemedelsbehandling för glukoskontroll vid typ
189Läkemedel vid klimakteriesymptom och läkemedel vid adhd.
190Läkemedel vid behandling av sömnstörning hos barn och ungdomar.
191Läkemedelsbehandling för glukoskontroll vid typ
192Möte med representanter för Socialstyrelsen,
193Möte med representanter för Läkemedelsverket,
194
Riksrevisionen 55
Utöver myndigheternas egna utvärderingar har vi undersökt om expedieringen av ett antal läkemedel195 som rekommenderas i Socialstyrelsens nationella riktlinjer eller Läkemedelsverkets behandlingsrekommendationer skiljer sig åt före och efter kunskapsstöden publicerats. Resultaten sammanfattas i tabell 3. I bilaga 2 finns en metodbeskrivning och fullständiga resultat.
Vi har undersökt om
∙det finns en tydlig förändring av expedieringen av ett rekommenderat läkemedel efter att kunskapsstödet publicerats
∙det finns könsskillnader i expedieringen och om de har ändrats efter att kunskapsstödet publicerats
∙skillnaderna mellan regionerna har minskat efter att kunskapsstödet publicerats.
Resultaten visar att expedieringen av de läkemedel som rekommenderas i nationella riktlinjerna och behandlingsrekommendationerna ökar över tid, men i de flesta fall är det svårt att härleda ökningen till kunskapsstöden. Det finns könsskillnader i andelen som behandlas med olika läkemedel och könsskillnaderna är konstanta eller ökar över tid. Skillnaden mellan regionerna ökar också över tid för fler av de läkemedel som rekommenderas i kunskapsstöden. Vår bedömning är att kunskapsstöden har en begränsad effekt för att åstadkomma en jämlik och jämställd läkemedelsförskrivning.
Tabell 3 Kunskapsstöd och läkemedelsförskrivning
| Diagnos och | Har den genomsnittliga | Finns | Har skillnaderna | |
| population | expedieringen förändrats | könsskillnader? Har | mellan regionerna | |
| med kunskapsstödet? | dessa förändrats? | ändrats? | ||
| Alzheimer: 2010, | Kunskapsstödet 2017 | Större andel kvinnor | De regionala | |
| 2017 | innebar att läkemedel | behandlas men det | skillnaderna är större | |
| Andelen med | prioriteras högre. | kan bero på att | efter att | |
| demensläkemedel | Andelen med | alzheimer är | kunskapsstödet | |
| demensläkemedel ökar | vanligare hos | publicerades men har | ||
| över tid vilket är positivt. | kvinnor. | överlag minskat sedan | ||
| män/kvinnor | ||||
| Går ej att se direkt | Könsskillnaderna | 2019. | ||
| Mätperiod |
||||
| samband med | minskar inte över | |||
| kunskapsstödet. | tid. | |||
195Urvalet av läkemedel har baserats på att det är läkemedel som rekommenderas för diagnoser som borde vara relativt jämt spridda hos befolkningen över hela landet, och exempelvis inte är beroende av socioekonomisk status eller vart i landet patienten bor.
56 Riksrevisionen
| Diagnos och | Har den genomsnittliga | Finns | Har skillnaderna | |
| population | expedieringen förändrats | könsskillnader? Har | mellan regionerna | |
| med kunskapsstödet? | dessa förändrats? | ändrats? | ||
| Epilepsi och | Andelen som expedieras | Större andel kvinnor | De regionala | |
| depression: 2019 | SSRI är lika stor före som | behandlas. | skillnaderna är | |
| Andelen med | efter kunskapsstöden | Könsskillnaderna | oförändrade för | |
| antiepileptika och | publiceras. | ändras inte över tid | kvinnor men ökar | |
| SSRI | bland dem med | något för män. | ||
| epilepsi. | ||||
| män/kvinnor | ||||
| Mätperiod |
||||
| Epilepsi och adhd: | Andelen epileptiker som | Större andel kvinnor | De regionala | |
| 2019 | behandlas med adhd- | behandlas. | skillnaderna är | |
| Andelen med | läkemedel ökar mer än i | Könsskillnaderna | ungefär lika stora över | |
| antiepileptika och | befolkningen i övrigt | ökar efter att | tid. | |
| efter att kunskapsstöden | kunskapsstöden | |||
| publiceras. LV lyfter fram | publiceras. | |||
| män/kvinnor | metylfenidat, men | |||
| metylfenidat ökar ej. | ||||
| Mätperiod |
||||
| Psoriasis: 2011, 2019 | Behandling med TNF- | Större andel män | De regionala | |
| Andelen med | hämmarna ökar. Men det | behandlas men män | skillnaderna har ökat | |
| traditionella och | kan även bero på | har ofta svårare | över tid, särskilt vad | |
| biologiska läkemedel | prissänkning p.g.a. | symtom. | gäller behandling med | |
| 18 år +, män/kvinnor | biosimilarer. | Könsskillnaderna | adalimumab. | |
| Mätperiod |
har ökat något över | |||
| tid. | ||||
| Akne: 2014 | Andelen pojkar och | Större andel flickor | Regionala skillnader | |
| Andel med | flickor |
och kvinnor | oförändrade för | |
| rekommenderade | expedieras förstahands- | behandlas. | förstahands- | |
| läkemedel | rekommendationen ökar | Könsskillnaderna | rekommendationen | |
| efter att kunskapsstödet | ökar några år efter | förutom för män 20– | ||
| publicerades. För män | kunskapsstödet | 44 år där skillnaderna | ||
| män/kvinnor | ||||
| och kvinnor |
publicerades. | minskar. Regionala | ||
| Mätperiod |
||||
| kommer ökningen 4 år | skillnaderna minskar | |||
| efter kunskapsstödet. | för andrahands- | |||
| rekommendationen. | ||||
| För B- | ||||
| rekommendationen | ||||
| ökar de regionala | ||||
| skillnaderna. | ||||
| Depression och | Andelen som expedieras | Större andel flickor | De regionala | |
| ångest: | sertralin, fluoxetin och i | behandlas. | skillnaderna ökar för | |
| Andel med olika | viss mån escitalopram | Könsskillnaden ökar | både pojkar och | |
| ökar över tid, särskilt | efter att | flickor, särskilt för | ||
| efter att kunskapsstöden | kunskapsstöden | behandling med | ||
| publicerades. | publicerades. | fluoxetin. | ||
| pojkar/flickor | ||||
| Mätperiod |
||||
Riksrevisionen 57
5 Tillsyn av förskrivare
I det här kapitlet granskar vi om tillsynen av läkemedelsförskrivarna ur ett patientsäkerhetsperspektiv är effektiv.
Våra iakttagelser visar att IVO inte har möjlighet att använda registeruppgifter för att söka efter förskrivare som systematiskt ägnar sig åt felaktig förskrivning utan får förlita sig på inkomna anmälningar och tips i tillsynen. Det innebär att det finns en risk för att viktiga missförhållanden helt undgår att bli upptäckta. Tillsynen av felaktig läkemedelsförskrivning är framför allt ärendestyrd.
Våra iakttagelser visar även att IVO:s och HSAN:s handläggningstider av ärenden som rör felaktig läkemedelsförskrivning är årslånga. Trots att IVO sedan 2020 arbetat med att effektivisera handläggningsprocessen har handläggningstiderna och ärendestocken ökat över tid.
IVO ser att många förskrivare ändrar sitt förskrivningsbeteende när IVO inleder tillsyn. Våra iakttagelser visar även att den felaktiga förskrivningen upphör i majoriteten av fallen där förskrivaren har fått ett beslut med kritik och runt tre fjärdedelar av förskrivarna fullföljer de prövotidsplaner som finns i besluten om prövotid196.
5.1IVO riskerar att missa förskrivare som systematiskt ägnar sig åt felaktiga förskrivningar
IVO har inte möjlighet att göra en systematisk riskanalys över vilka förskrivare som bör tillsynas eftersom de saknar tillgång till registeruppgifter för detta syfte. Tillsynen baseras i stället på inkomna anmälningar och tips om felaktig förskrivning. Det leder till att det finns risk för att förskrivare som systematiskt ägnar sig åt felaktig förskrivning undgår upptäckt.
5.1.1IVO saknar tillgång till registeruppgifter för att välja ut förskrivare för tillsyn
IVO har under en längre tid haft ambitioner att effektivisera all tillsyn och göra den mer datadriven.197 IVO har dock inte tillgång till registeruppgifter för att söka efter förskrivare som har ett avvikande förskrivningsmönster och därför skulle kunna vara
196Uppgiften gäller samtliga orsaker till att prövotid har beslutats, inte enbart läkemedelsförskrivning, eftersom IVO inte har möjlighet att dela upp statistiken utifrån orsaker till prövotid.
197Inspektionen för vård och omsorg, Förebyggande tillsyn – slutrapport, 2022, s. 12, 15; Inspektionen för vård och omsorg, Mot en mer förebyggande tillsyn – delrapport, 2021, s.
58 Riksrevisionen
potentiella tillsynsobjekt.198 Alla förskrivare som har ett avvikande förskrivningsmönster bör inte tillsynas eftersom det kan finnas helt naturliga orsaker till avvikande förskrivningsmönster. Till exempel kan en specialist på tillväxtsjukdomar helt naturligt skriva ut ett stort antal recept på tillväxthormon och en geriatriker skriva ut ett stort antal recept starka ångestdämpande läkemedel till äldre i livets slutskede.
5.1.2IVO:s tillsyn av läkemedelsförskrivningen baseras främst på anmälningar och tips
Våra iakttagelser visar att IVO framför allt initierar tillsynen av förskrivare utifrån anmälningar och tips som kommer in från apotek, vårdgivare och allmänheten. Antalet initierade ärenden som rör läkemedelsförskrivning har legat mellan 260 och 350 om året sedan 2017 (tabell 4).
Apotekspersonal som expedierar läkemedel har anmälningsskyldighet till IVO om de misstänker att förskrivningar av narkotikaklassade och särskilda läkemedel står i strid med vetenskap och beprövad erfarenhet.199 Även vårdgivare har skyldighet att anmäla legitimerad personal inom hälso- och sjukvården till IVO, men utifrån att personalen kan utgöra en fara för patientsäkerheten.200 Det kan till exempel vara om förskrivare systematiskt förskriver läkemedel felaktigt vid en viss indikation, felaktiga doser eller olämpliga kombinationer av läkemedel.
Även personer och myndigheter som inte är anmälningsskyldiga kan anmäla läkemedelsförskrivare för brister i patientsäkerheten. Det kan till exempel vara privatpersoner eller tjänstemän på myndigheter så som Försäkringskassan, Polisen eller Läkemedelsverket som anmäler misstänkta brister i läkemedelsförskrivningen till IVO.
IVO kan även inleda ett ärende utifrån en lex
IVO kan även initiera ärenden utifrån klagomål från allmänheten som handlar om felaktiga förskrivningar. Innan klagomålet anmäls ska patienten ha framfört det till
198I 6 kap. 6 § lag (2018:1212) om nationell läkemedelslista bestäms
1996 kap. 11 § PSL.
2003 kap. 7 § PSL.
Riksrevisionen 59
den verksamhet hen har fått vård hos och vårdgivaren ska ha fått möjlighet att utreda klagomålet.201 IVO kan också initiera ärenden utifrån uppgifter från andra ärenden, domar i vissa brottmål, behörighetsinskränkningar från andra länder202, övrig extern information eller utifrån synpunkter om vård och omsorg som inkommit till IVO genom upplysningstjänsten
Störst andel av IVO:s ärenden om felaktig läkemedelsförskrivning initieras genom anmälningar från apotekspersonal (tabell 4). Under 2022 påbörjades tre fjärdedelar av ärendena som rörde läkemedelsförskrivning efter anmälningar från apotek.
Endast ett fåtal av de ärenden som rör läkemedelsförskrivning har initierats utifrån lex
IVO utreder alltid anmälningar från apotek och vårdgivare. För övriga anmälningar, tips och klagomål om läkemedelsförskrivning som kommer in till myndigheten gör IVO en bedömning av allvarlighetsgraden och trovärdigheten i uppgifterna. IVO tar därefter ställning till om en utredning ska inledas.203
Tabell 4 Initieringsgrund för tillsynen där ärendet rör läkemedelsförskrivning
| 2017 | 2018 | 2019 | 2020 | 2021 | 2022 | |
| Anmälan från apotekspersonal | 194 | 165 | 159 | 204 | 199 | 193 |
| Anmälan från vårdgivare | 17 | 23 | 20 | 32 | 15 | 11 |
| Anmälan till IVO | 24 | 43 | 34 | 57 | 55 | 24 |
| Klagomål från enskild | 0 | – | – | – | – | 0 |
| Lex Maria | – | – | 0 | – | 0 | – |
| Upplysningstjänsten | 4 | 8 | 21 | 34 | 29 | 16 |
| Övrigt | 55 | 52 | 46 | 22 | 27 | 15 |
Källa: Uppgifter från IVO, inhämtade
Anm.: Kategorin ”övrigt” innehåller ärenden som har initierats utifrån information från andra ärenden hos IVO, domar i vissa brottmål, information från annan myndighet eller annat land eller övrig extern information. Uppgifter om tre eller färre beslutade ärenden har ersatts med
201Inspektionen för vård och omsorg, ”Klaga på vården”, hämtad
202Det innebär att andra
203Möte med representanter från IVO
60 Riksrevisionen
5.2Långa handläggningstider vid felaktiga förskrivningar
Våra iakttagelser visar att IVO:s handläggningstider för ärenden som rör felaktig förskrivning ofta är årslånga. Även HSAN:s handläggningstider är årslånga trots att de baseras på IVO:s utredningar. Handläggningstiderna har ökat över tid trots att IVO sedan 2020 arbetat med att effektivisera handläggningsprocessen. Det beror dels på ett ökat inflöde av ärenden, dels på att IVO inte har tillfört resurser till området för att möta det ökade inflödet.
5.2.1 IVO har i många fall årslånga handläggningstider
Vi konstaterar att handläggningstiderna för läkemedelsärenden där IVO har fattat ett beslut med kritik och ärenden som anmäls till HSAN är långa, särskilt mot bakgrunden av att förskrivarna som utreds inte har utfört sitt arbete enligt vetenskap och beprövad erfarenhet och därmed riskerar patientsäkerheten.
År 2022 var medianen för handläggningstiden för ärenden som avslutas med ett beslut med kritik av läkemedelsförskrivningen nästan ett och ett halvt år (se tabell 5). Det ärende som avslutats med kritik som hade haft längst handläggningstid hade pågått i tre år. Ärenden som är extra allvarliga anmäls till HSAN. År 2022 var medianen för ärenden som anmäls till HSAN drygt ett och ett halvt år. Det ärende som pågått längst innan IVO anmälde det till HSAN hade pågått i drygt fyra och ett halvt år. Under handläggningstiden kan förskrivaren fortsätta att skriva ut läkemedel. Handläggningstiden för både ärenden som avslutas med kritik eller en anmälan till HSAN har ökat över tid.
Handläggningstiden för ärenden som avslutas utan kritik är inte lika lång, men det finns ärenden som pågått under flera år.
Riksrevisionen 61
Tabell 5 Handläggningstider för beslutade ärenden där läkemedelsförskrivning berörts, antal dagar
| Beslut | Parameter | 2017 | 2018 | 2019 | 2020 | 2021 | 2022 |
| Utan kritik | median | 77 | 60 | 27 | 32 | 27 | 43 |
| max | 590 | 1 054 | 1 575 | 731 | 910 | 601 | |
| min | 1 | 1 | 2 | 1 | 1 | 1 | |
| Med kritik | median | 165 | 227 | 232 | 326 | 422 | 497 |
| max | 845 | 1 105 | 960 | 959 | 1 295 | 1 099 | |
| min | 29 | 32 | 44 | 8 | 51 | 98 | |
| Till HSAN | median | 290 | 361 | 479 | 481 | 532 | 570 |
| max | 905 | 1 527 | 1 212 | 996 | 1 244 | 1 660 | |
| min | 78 | 19 | 151 | 21 | 21 | 18 | |
Källa: Uppgifter från IVO, inhämtade
5.2.2 Även HSAN:s handläggningstider är långa
I de fall IVO bedömer att den felaktiga förskrivningen är så pass allvarlig att det finns skäl att begränsa eller dra in förskrivningsrätten eller återkalla legitimationen anmäler IVO förskrivaren till HSAN. HSAN kan fatta beslut om att ge förskrivaren prövotid där en prövotidsplan måste följas, dra in eller begränsa förskrivningsrätten eller i särskilt allvarliga fall återkalla förskrivarens legitimation.
HSAN uppger att deras handläggningstider är ungefär ett år, oavsett om det rör sig om ett ärende om läkemedelsförskrivning eller något annat.204 Konsekvensen av de långa handläggningstiderna är främst att den anmälda förskrivaren kan fortsätta med de felaktiga förskrivningarna under tiden. Det kan leda till allvarliga konsekvenser för patienterna, men även för förskrivaren själv om den felaktiga förskrivningen berör egenförskrivning. Det är IVO som genomför utredningen av hälso- och sjukvårdspersonalen som anmälan berör. HSAN använder sedan IVO:s underlag vid sin bedömning vilket borde leda till att HSAN har kortare handläggningstider än IVO. HSAN får även göra egna utredningsåtgärder utöver att kommunicera beslutet till berörd person, med stöd av IVO:s underlag.
När IVO bedömer att patientsäkerhetsrisken till följd av felaktig förskrivning är särskilt hög kan myndigheten gå in med ett yrkande om en interimistisk åtgärd till HSAN om att dra in eller begränsa förskrivningsrätten eller återkalla legitimationen
204
62 Riksrevisionen
under pågående handläggning. Mellan 2017 och 2022 har IVO gått in med ett till två interimistiska yrkanden om året vad gäller ärenden som rör läkemedel.205
Det är av stor betydelse att de interimistiska yrkandena till HSAN behandlas skyndsamt eftersom ett interimistiskt yrkande innebär att IVO har gjort en bedömning att förskrivaren utgör en direkt fara för patientsäkerheten. Handläggningstiden för interimistiska ärenden borde vara kortare än för ärenden där det inte har yrkats på en interimistisk åtgärd. IVO anser att de interimistiska yrkandena inte hanteras så effektivt och skyndsamt av HSAN som de borde. IVO upplever att dessa ärenden ”hamnar i HSAN:s vanliga hög”.206 Enligt HSAN är inte interimistiska beslut utpekade som särskilda förtursärenden. Men alla yrkanden och ärenden bedöms utifrån omständigheterna i varje enskilt fall. Det innebär att interimistiska yrkanden troligtvis kommer hanteras snabbare eftersom interimistiska åtgärder bygger på en sannolikhetsbedömning av vad som skulle kunna bli det slutliga beslutet.207
5.2.3Många nya ärenden och bristande resurser påverkar handläggningstiden
IVO har flera förklaringar till varför handläggningstiden är lång. En ökad inströmning av ärenden, bristande resurser samt komplexa och tidskrävande ärenden lyfts fram som de främsta orsakerna.
En av anledningarna till att handläggningstiderna har ökat över tid är att IVO inte har svarat upp med att sätta in mer resurser i tid när antalet inkomna ärenden började öka (tabell 6).208 Egeninitierade ärenden har prioriterats och det har krävt mycket resurser. Detta har lett till att IVO inte har haft utrymme att på samma sätt som tidigare handlägga anmälningar till HSAN. IVO menar även att den långa handläggningstiden 2022 beror på att en stor andel av personalen som handlägger anmälningarna till HSAN är nyanställd.209
En annan orsak som IVO anger till de långa handläggningstiderna är att det är viktigt att deras utredningar är enhetliga och rättssäkra oavsett om de kommer att anmäla yrkesutövaren till HSAN eller om de kommer att fatta ett beslut med kritik. Utredningen av alla väsentliga omständigheter, inklusive kompletteringar och
205Totalt gick IVO in med nio interimistiska yrkande i ärenden som rörde läkemedelsförskrivning
206Möte med representanter från IVO,
207
208Möte med representanter från IVO,
209Inspektionen för vård och omsorg, Årsredovisning 2022, 2023, s. 28.
Riksrevisionen 63
kommunikation med yrkesutövaren, är tidskrävande och bidrar till långa handläggningstider. Komplexiteten i ärendena är hög och personer med olika expertis behöver involveras vilket också bidrar till längre handläggningstider.210
Tabell 6 Antal inkommande, pågående och beslutade ärenden som rör läkemedelsförskrivning
| Ärenden | 2017 | 2018 | 2019 | 2020 | 2021 | 2022 |
| Inkommande | 295 | 296 | 281 | 351 | 326 | 260 |
| Pågående | 449 | 455 | 443 | 593 | 534 | 461 |
| Beslutade | 288 | 290 | 251 | 318 | 325 | 265 |
Källa: Uppgifter från IVO, inhämtade
5.2.4 IVO arbetar med att effektivisera handläggningsprocessen
Vår granskning visar att IVO under flera år har arbetat med att effektivisera handläggningsprocessen och förkorta handläggningstiderna. Trots detta har handläggningstiderna ökat successivt varje år. Under 2023 har IVO gjort ett omtag för att korta handläggningstiderna.
Under 2020 genomförde IVO en genomlysning av ett flertal processer för att förkorta och effektivisera handläggningen. Det utmynnade bland annat i att de tog fram ett nytt bedömningsstöd som syftade till att öka effektiviteten211 och enhetligheten
i handläggningen.212 IVO har även reviderat processbeskrivningen för utredning av hälso- och sjukvårdspersonal. Bland annat har kravet på att handläggaren ska vara jurist ändrats till att handläggaren ska ha juridisk kompetens. Processen har också ändrats från att beslutet/domen ska överklagas om IVO:s primära yrkanden inte har vunnit gehör, till att IVO ska överväga att överklaga beslutet/domen.213 IVO beslutade också att ha som mål att handläggningen av ärendena skulle vara kontinuerlig och aktiv. Målet innebär att inaktiviteten i ett ärende endast får överstiga 60 dagar om det finns godtagbara skäl.214
210Inspektionen för vård och omsorg, Årsredovisning 2022, 2023, s. 28, 40.
211Inspektionen för vård och omsorg, Vad har IVO sett 2020?, 2021, s. 84.
212Inspektionen för vård och omsorg, Bedömningsstöd för ärenden som rör åtgärder mot legitimerad hälso- och sjukvårdspersonal, 2020, s. 8.
213Jämförelse av processbeskrivningarna IVO, Processbeskrivning - 3.6.1 Utredning av hälso- och sjukvårdspersonal med legitimation eller annan behörighet att utöva yrke inom hälso- och sjukvården, 2020 och IVO, Processbeskrivning - 3.6.1 Utredning av hälso- och sjukvårdspersonal med legitimation eller annan behörighet att utöva yrke inom hälso- och sjukvården, 2022.
214Inspektionen för vård och omsorg, Årsredovisning 2021, 2022, s. 33.
64 Riksrevisionen
Även regeringen har uppmärksammat IVO:s handläggningstider. IVO fick
i regeringsuppdrag både 2022 och 2023 att redovisa på vilket sätt de har arbetat för att få till en effektivare handläggning av anmälningarna till HSAN.215, 216 IVO har återrapporterat att de har reviderat bedömningsstödet, som nämns ovan. De nämner även att de har reviderat vägledningen som handläggarna använder som stöd vid utredning av hälso- och sjukvårdspersonal.217
IVO har gjort ett omtag för att korta handläggningstiderna i tillsynen av legitimerad hälso- och sjukvårdspersonal under hösten 2023. IVO har dedikerat och ökat de avsatta resurserna för att få ned ärendebalanserna. IVO har i ett inledande skede infört ett nytt arbetssätt på tre av sex avdelningar. Det nya arbetssättet innefattar bland annat specialisering genom att fler resurser avsätts till att enbart arbeta med ärendeslaget samt att det görs täta uppföljningar av produktionen på
5.3IVO:s sanktioner påverkar förskrivarna
I majoriteten av fallen där yrkesutövaren har fått ett beslut med kritik upphör den felaktiga förskrivningen. Det är ovanligt att yrkesutövare som fått ett beslut med kritik också har fått ett eller flera kritikbeslut tidigare. Runt tre fjärdedelar av yrkesutövarna som har fått ett beslut om prövotid fullföljer denna.219
5.3.1IVO:s beslut med kritik leder till att felaktig förskrivning upphör
IVO är av uppfattningen att de allra flesta förskrivare som får ett beslut med kritik tar det på största allvar och försöker förbättra sig. De allra flesta förskrivare som är under tillsyn har förskrivit felaktigt på grund av oaktsamhet och tillsynen brukar då leda till att läkarna tänker sig för innan de exempelvis förskriver stora mängder av narkotikaklassade läkemedel.220
215Regeringsbeslut S2022/04810 (delvis).
216Regeringsbeslut S2022/03171.
217Inspektionen för vård och omsorg, Årsredovisning 2022, 2023, s. 30.
218Möte med representanter för IVO
219Uppgiften om prövotid gäller dock alla typer av ärenden, inte enbart läkemedelsförskrivning. Statistiken finns inte att dela upp på ärendeslag.
220Möte med representanter från IVO
Riksrevisionen 65
Vår granskning visar att IVO:s beslut med kritik i de flesta fall leder till att förskrivning i strid mot beprövad erfarenhet upphör. 59 förskrivare som fick ett beslut med kritik eller anmäldes till HSAN 2022 hade aldrig fått kritik tidigare,
6 förskrivare som fick ett kritikbeslut 2022 hade tidigare fått kritik vid ett tillfälle och 5 organisationer hade år 2022 fått fyra eller fler beslut med kritik (tabell 7).
Tabell 7 Ärenden som rört läkemedelsförskrivning som avslutats med ett beslut med kritik 2022.221
| Antal tidigare beslut med kritik | 0 | 1 | 2 | 3 | ≥4 |
| Organisationsnummer (vårdgivare) | – | 0 | 0 | 0 | 5 |
| Personnummer | 59 | 6 | – | – | 0 |
Källa: Uppgifter från IVO, inhämtade
Anm.: Uppgifter om tre eller färre beslutade ärenden har ersatts med
5.3.2 Tre fjärdedelar fullföljer prövotiden
Mellan åren
IVO anser att prövotid är en bra och effektiv sanktionsmöjlighet. Prövotidsinstitutet verkar som en skyddsfaktor dels för den enskilda som kan komma till rätta med till exempel ett pågående missbruk, dels för patientsäkerheten.225
Tabell 8 Antal avslutade prövotider
| Avslutsår | 2017 | 2018 | 2019 | 2020 | 2021 | 2022 |
| Antal avslutade prövotider | 45 | 39 | 71 | 79 | 76 | 89 |
| Andel som fullföljt prövotiden | 87 % | 72 % | 73 % | 72 % | 66 % | 75 % |
Källa: Uppgifter från IVO, inhämtade
221Det finns en sannolik överestimering av personnummer, men underestimering av organisationsnummer.
222IVO har inte möjlighet att dela upp statistiken utifrån om prövotidsbeslutet berör felaktig läkemedelsförskrivning eller andra orsaker.
223Möte med representanter från IVO
224
225Möte med representanter från IVO
66 Riksrevisionen
6Statens tillsyn av användningen av läkemedelssubventioner
I det här kapitlet granskar vi om tillsynen av förskrivningar som leder till felaktigt användande av läkemedelsförmånerna och smittskyddssubventioner är effektiv.
Våra iakttagelser visar att det förekommer att läkemedel felaktigt belastar läkemedelsförmånerna. Det förekommer också att läkemedel oriktigt förskrivs som kostnadsfria smittskyddsläkemedel. Iakttagelserna visar även att felaktig förskrivning av narkotikaklassade läkemedel och andra begärliga läkemedel som botulinumtoxin mot rynkor och tillväxthormoner till kroppsbyggare får som bieffekt att läkemedelsförmånerna används felaktigt.
TLV har ansvar för att tillsyna att lagen om läkemedelsförmåner m.m. följs. IVO har möjlighet att tillsyna om förskrivare följer regler och lagar, men IVO:s tillsyn ska främst vara inriktad på brister i patientsäkerheten. Både TLV och IVO saknar viktiga förutsättningar för att utföra tillsynen. TLV har däremot möjlighet att följa upp hur vissa förmånsbegränsningar följs på aggregerad nivå för att därefter ompröva om användningen av ett läkemedel är kostnadseffektiv och ska fortsätta att ingå i läkemedelsförmånerna. Men antalet omprövningar är relativt litet varje år. TLV har till exempel inte omprövat om botulinumtoxin ska fortsätta ingå i förmånerna trots kraftigt ökat användande.
Rättsläget är oklart om TLV har möjlighet att besluta om föreläggande med och utan vite för att få förskrivare att sluta förskriva läkemedel felaktigt med förmån. IVO har möjlighet att fatta beslut med kritik om en förskrivare bryter mot lagen om läkemedelsförmåner m.m., om läkemedel förskrivs felaktigt som kostnadsfria enligt smittskyddslagen eller om ett läkemedel förskrivs för felaktig indikation och får som bieffekt att det belastar läkemedelsförmånerna.
Regionerna har små möjligheter att stoppa förskrivare som systematiskt förskriver läkemedel med läkemedelsförmån felaktigt, förskriver läkemedel felaktigt som smittskyddsläkemedel eller förskriver läkemedel för felaktig indikation som får som bieffekt att det belastar läkemedelsförmånerna. Regionerna har även små möjligheter att få ersättning för den felaktiga subventioneringen. Det drabbar även staten i förlängningen då samhällets sammanlagda kostnader för läkemedel inom förmånerna och för smittskydd ökar på grund av att subventioner betalas ut på felaktiga grunder.
Riksrevisionen 67
6.1Läkemedel för estetiska behandlingar, smittskydd och extemporeberedningar subventioneras felaktigt
Bland annat Läkemedelsverket, TLV och Region Stockholm har uppmärksammat att läkemedel som används för estetiska behandlingar belastar läkemedelsförmånerna.226 Det innebär att patienterna får skönhetsbehandlingar subventionerade av skattebetalarna. Exempel myndigheterna tar upp är behandlingar med botulinumtoxin mot rynkor, diabetesläkemedel som används som bantningspreparat till normalviktiga, tillväxthormoner som förskrivs till kroppsbyggare och mjukgörande salvor.
6.1.1 Förmånskostnaderna för botulinumtoxin har ökat kraftigt
Problematiken med att botulinumtoxin förskrivs för skönhetsvård och belastar läkemedelsförmånerna har varit känd länge. Redan 2007 förordade Landstingens läkemedelsförmånsgrupp, i samband med att en subventionsansökan från ett läkemedelsbolag kom in till TLV, att botulinumtoxin inte skulle ingå i läkemedelsförmånerna eftersom det förekom att läkare förskrev botulinumtoxin för skönhetsbehandling.227 Enligt Landstingens läkemedelsförmånsgrupp fanns det inget behov av att förskriva botulinumtoxin på recept eftersom det endast var subventionerat för indikationer där behandling ska ges på klinik.228 Exempel på indikationer där subvention ska lämnas är olika typer av spasmer och urinblåsstörningar.229 Sedan 2011 är botulinumtoxin även godkänt som läkemedel vid kronisk migrän.230
Förmånskostnaderna för botulinumtoxin har ökat kraftigt de senaste åren och kostade skattebetalarna över 72 miljoner kronor 2022 (diagram 4). Det motsvarade kostnaden för att behandla 140 118 ”argrynkor” mellan ögonbrynen (glabellaveck) med botulinumtoxin.231
226Läkemedelsverket, ”Information till apotek”,
227Tandvårds- och läkemedelförmånsverket, ”Subvention för Xeomin”, hämtad
228Tandvårds- och läkemedelförmånsverket, ”Subvention för Xeomin”, hämtad
229Fass, ”Botox”, hämtad
230Cision News, ”BOTOX godkänt för förebyggande behandling av kronisk migrän”,
231Beräkningen är ett exempel för att visa omfattningen på subventionen för botulinumtoxin. Vi kan inte avgöra om all botulinumtoxin som förskrivs inom förmånen används till att just behandla glabellaveck. I vår beräkning använder vi oss av AUP (apotekens utpris) för Botox
68 Riksrevisionen
Diagram 4 Förmånskostnader för botulinumtoxin
Miljoner kronor 80
70
60
50
40
30
20
10
0
2000 2002 2004 2006 2008 2010 2012 2014 2016 2018 2020 2022
Källa:
6.1.2Diabetesläkemedel för bantning subventioneras felaktigt för miljontals kronor
Sedan vintern 2022/2023 har användningen av diabetesläkemedel där semaglutid är aktiv substans ökat kraftigt. Medier har rapporterat om att det används av normalviktiga för viktnedgång.232 Det har lett till att det råder global brist på läkemedel med semaglutid och att patienter med diabetes typ 2 har behövt byta läkemedel till ett som är mindre effektivt. Läkemedelsverket och tillverkaren varnar för att bristen kommer att kvarstå under hela 2023.233
232Se t.ex. Hällsten, ”Bantningstrend på Tiktok leder till brist på diabetesmedicin”,
233Helander, ”Läkemedelsverket varnar: Brist på Ozempic under resten av året”,
Riksrevisionen 69
Diagram 5 Förmånskostnader för läkemedel med semaglutid januari
Miljoner kronor/månad 70
| 60 | ||||||
| 50 | ||||||
| 40 | ||||||
| 30 | ||||||
| 20 | ||||||
| 10 | ||||||
| 0 | ||||||
Källa:
Anm.: Nedgången i förmånskostnader under januari, mars och april 2023 kan förklaras av brist på semaglutid.
Förmånskostnaderna för läkemedel med semaglutid har ökat kraftigt över tid (diagram 5). Det finns indikationer på att läkemedel med semaglutid har subventionerats till personer som inte är berättigade att få läkemedlet subventionerat. I förmånsbeslutet anges att läkemedel med semaglutid endast ska ingå i läkemedelsförmånerna om patienten först har provat diabetesläkemedel med metformin, sulfonureider eller insulin.234 Vår granskning visar att 16 procent av de som hämtade ut läkemedel med semaglutid på apoteket under november och december 2022 inte hade hämtat ut metformin, sulfonureider eller insulin innan, eller i kombination med, semaglutid.235 En överslagsberäkning visar att det motsvarar ca 20 miljoner kronor i felaktigt användande av förmånen under enbart november och december 2022.236
234Tandvårds- och läkemedelsförmånsverket, ”Ozempic ingår i högkostnadsskyddet med begränsning”, hämtad
235Socialstyrelsens beräkningar utifrån Läkemedelsregistret. Andelen har beräknats som antal personer som hämtat ut semaglutid med subvention under
236Här gör vi antagandet att de som fått läkemedel med semaglutid felaktigt subventionerat har betalat lika stora egenavgifter per expediering som de som hämtat ut metformin, sulfonureider eller insulin under 2022.
70 Riksrevisionen
6.1.3 Förmånskostnaden för mjukgörande salvor ökar
Förskrivningen av mjukgörande salvor har ökat kraftigt sedan läkemedel på recept blev kostnadsfria för barn 2016. Salvorna förskrivs till barnet men används sedan troligen av hela familjen eller säljs vidare på köp- och säljsidor på internet.237 Region Stockholm har tagit krafttag mot överförskrivningen av mjukgörande krämer genom att skärpa riktlinjerna för när salva ska förskrivas och när patienten ska rekommenderas egenvård.238
Även Socialstyrelsen har uppmärksammat den ökade förskrivningen av mjukgörande salvor till barn sedan reformen med kostnadsfria läkemedel genomfördes. I en uppföljning av reformen visar Socialstyrelsen att andelen barn som gjort minst ett uttag av mjukgörande salva nästan fördubblades när kostnadsfriheten infördes.239
Diagram 6 Förmånskostnader för mjukgörande salva och kortisonpreparat till patienter
Miljoner kronor 120
100
80
60
40
20
0
2010 2011 2012 2013 2014 2015 2016 2017 2018 2019 2020 2021 2022
| Mjukgörande salvor | Kortisonsalvor | |
Källa:
237Möte med representanter för Region Stockholm
238Torkelsson, ”Nya regler ska stoppa överförskrivning av kostnadsfria krämer”,
239Socialstyrelsen, Uppföljning av reformen om kostnadsfria läkemedel – slutrapport, 2019, s. 30.
Riksrevisionen 71
Förmånskostnaderna för mjukgörande salvor blev fem gånger så hög när reformen genomfördes 2016 jämfört med året innan och förmånskostnaderna har fortsatt att öka (se diagram 6). Mellan 2016 och 2022 ökade kostnaderna med 77 procent.
Under samma period ökade förmånskostnaderna för kortisonsalvor med
22 procent. Om de ökade kostnaderna för mjukgörande salva beror på att barns hudbesvär generellt ökat under perioden borde även förmånskostnaderna för kortisonsalvor ha ökat i ungefär samma takt som kostnaderna för mjukgörande salvor, men så är inte fallet.240
6.1.4Felaktig förskrivning av begärliga läkemedel belastar läkemedelsförmånerna
En sidoeffekt av felaktig läkemedelsförskrivning är att den belastar läkemedelsförmånen. Felaktig förskrivning av till exempel narkotikaklassade läkemedel, botulinumtoxin och tillväxthormoner subventioneras till patienterna. IVO:s och HSAN:s långa handläggningstider (avsnitt 5.2.1) leder till att förskrivarna kan fortsätta med den felaktiga förskrivningen som belastar läkemedelsförmånerna under en lång tid.
Regionerna har uppmärksammat att den organiserade brottsligheten utnyttjar läkemedelsförmånerna genom att förmå läkare att förskriva narkotikaklassade läkemedel och andra begärliga läkemedel som botulinumtoxin och tillväxthormoner som ingår i läkemedelsförmånerna för att sedan sälja vidare till ett betydligt högre pris. Regionerna har på så sätt kommit att finansiera brottslig verksamhet.241
6.1.5 Läkemedel förskrivs som extempore för att subventioneras
Extemporeläkemedel ingår i läkemedelsförmånerna. Det finns förskrivare som utnyttjar detta genom att förskriva läkemedel som extempore i syfte att de ska subventioneras.
Extemporeläkemedel är läkemedel som tillverkas eller bereds på apotek för en viss patient. Extemporeläkemedel kan användas om godkända läkemedel saknas eller om patienten till exempel är överkänslig mot en beståndsdel. Det är förskrivaren som anger extemporeläkemedlets komposition till apoteket. Extemporeläkemedel ingår i läkemedelsförmånerna även om det godkända läkemedlet med samma
240I gruppen mjukgörande salvor ingår läkemedel med
241Se Region Stockholms och Region Uppsalas komplettering av regionernas överklagande till Högsta domstolen i mål nr B
72 Riksrevisionen
beståndsdelar inte gör det, om apotekens inköpspris och försäljningspris beräknas i enlighet med TLV:s föreskrifter.242 Genom att förskriva ett snarlikt läkemedel som inte är subventionerat som ett extemporeläkemedel blir det subventionerat.
Det finns förskrivare som förskriver läkemedel extempore för att patienten ska få läkemedlet subventionerat. Ett aktuellt exempel är en hälso- och sjukvårdsmottagning243 som skrivit ut stora mängder cannabinoider (cannabis) extempore. Genom att göra på det sättet har kostnaden för cannabinoiden omfattats av läkemedelsförmånen. Alla kostnader har i detta fall hamnat hos Region Stockholm.244
6.1.6Det förekommer att läkemedel subventioneras felaktigt enligt smittskyddslagen
Det förekommer att läkemedel felaktigt förskrivs som kostnadsfria enligt smittskyddslagen, men omfattningen är relativt liten i jämförelse med de totala kostnaderna för smittskyddsläkemedel.
Läkemedel som förskrivs mot en allmänfarlig sjukdom som förskrivaren bedömer minska risken för smittspridning är enligt smittskyddslagen kostnadsfria för patienten och finansieras av den region som patienten är bosatt i.245 Regionerna ersätts för kostnaderna för smittskyddsläkemedel genom statsbidraget för läkemedelsförmånerna m.m. I en bilaga till smittskyddslagen framgår vilka sjukdomar som är klassade som allmänfarliga. Men det är inte reglerat exakt vilka läkemedel eller
TLV fastställer inköpspris och försäljningspris för förmånsläkemedel som ska tillämpas av öppenvårdsapoteken. Det fastställda priset gäller också när samma läkemedel är kostnadsfritt för patienten enligt smittskyddslagen.246 Apoteken har rätt till ersättning från regionerna med ett belopp som motsvarar försäljningspriset. För de smittskyddsläkemedel som inte ingår i läkemedelsförmånerna råder fri prissättning för läkemedelsbolagen och apoteken.
242Tandvårds- och läkemedelsförmånsverkets föreskrifter om licensläkemedel, extemporeläkemedel, lagerberedningar och tillfällig subvention
243Region Stockholm, Temporär stängning av arbetsplatskod, dnr HSN
244
2457 kap. 1 och 4 §§ smittskyddslagen.
246Lagen om läkemedelsförmåner m.m.
Riksrevisionen 73
Tabell 9 Exempel på läkemedel som felaktigt förskrivits som smittskydd 2022
| Läkemedel | Förmåns- | Indikation | Ingår i läkemedels- |
| kostnad, kr | förmånerna | ||
| L04AA40 kladribin | 440 128 | MS | Ja |
| L01EL02 akalabrutinib | 263 021 | Metastaserat melanom | Ja |
| C02KX04 macitentan | 166 125 | Plumonell arteriell | Med förmåns- |
| hypertension (PAH) | begränsning | ||
| L01EX22 selperkatinib | 115 271 | Med förmåns- | |
| lungcancer | begränsning | ||
| B01AC27 selexipag | 107 768 | PAH | Med förmåns- |
| begränsning | |||
| L04AX07 | 87 087 | Psoriasis och MS | Ja, men några läkemedel |
| dimetylfumarat | har förmånsbegränsning | ||
| N07XX05 amifampridin | 77 272 | Nej | |
| myastena syndrom | |||
| L01EA05 ponatinib | 64 746 | Leukemi | Ja |
| C03XA01 tolvaptan | 63 563 | Kronisk njursjukdom | Nej |
| L01EC03 enkorafenib | 57 760 | Metastaserat melanom | Ja |
| L01EE03 binimetinib | 48 986 | Metastaserat melanom | Ja |
Källa:
Under 2022 förskrevs läkemedel enligt smittskyddslagen för knappt 1 130 miljoner kronor. Enligt vår genomgång av samtliga läkemedel som förskrivits som smittskyddsläkemedel 2022 är läkemedel för 2,5 miljoner felaktigt subventionerade. Det kan till exempel röra sig om att läkemedel mot cancer, MS eller njursjukdom förskrivits som smittskydd (tabell 9). Av dessa är det läkemedel för 634 000 kronor som inte ingick i läkemedelsförmånen och 666 000 kronor för läkemedel med förmånsbegränsningar (vilket ger läkaren incitament att förskriva läkemedlet som smittskydd så att patienten får subvention trots att kraven för förmån inte uppfylls). Även läkemedel som ingår i förmånen har förskrivits felaktigt som smittskydd för 1,2 miljoner kronor. Regionen får då även utgifter för den egenavgift patienten annars skulle ha betalat.
74 Riksrevisionen
6.2Myndigheterna saknar förutsättningar att tillsyna användningen av läkemedelssubventioner
TLV har tillsyn över läkemedelsförmånerna.247 IVO ska tillsyna att förskrivarna uppfyller krav i lagar och förordningar vilket innebär att IVO har lagstöd för att kunna tillsyna att förskrivare följer lagen om läkemedelsförmåner m.m. 248 Det är är IVO som har tillsyn över felaktig förskrivning av läkemedel som har som bieffekt belasta läkemedelsförmånerna. IVO har även ansvar för att tillsyna reglerna för kostnadsfria läkemedel enligt smittskyddslagen.249 Båda myndigheterna saknar dock förutsättningar att tillsyna användningen av läkemedelssubventioner.
TLV har inte möjlighet att tillsyna att enskilda förskrivare gör en korrekt bedömning när de intygar på receptet att förutsättningarna för att ett läkemedel ska subventioneras är uppfyllda. TLV har varken tillgång till patientjournaler eller registeruppgifter från
IVO ska tillsyna att förskrivarna uppfyller krav i lagar och förordningar.252 Det innebär att IVO har lagstöd för att kunna tillsyna att förskrivare följer lagen om läkemedelsförmåner m.m. I ett pågående tillsynsärende har IVO rätt att begära in och granska journaler. IVO skulle därför ha möjlighet att bedöma om ett läkemedel har förskrivits för andra indikationer och för andra grupper än de som TLV har bestämt att läkemedlet ska subventioneras för. Men IVO har i nästa steg inte
247Lagen om läkemedelsförmåner m.m.
2487 kap. 3 § PSL.
2497 kap. 1 § smittskyddslagen.
250Möte med representanter från TLV
251SOU 2022:72, s. 234 ff.
2527 kap. 3 § PSL.
Riksrevisionen 75
möjlighet att begära ut uppgifter om läkemedlet expedierades med läkemedelsförmån från
IVO har även tillsynsansvar över smittskyddslagen. Men IVO har inte förutsättningar att tillsyna felaktigt användande av smittskyddssubventioner. Det beror på att IVO inte kan begära ut personuppgifter från
Även om IVO får tillsyna att förskrivarna följer lagen om läkemedelsförmåner
m.m.och reglerna om kostnadsfria läkemedel i smittskyddslagen ska IVO:s tillsyn främst inriktas på granskning av att vårdgivaren fullgör sina skyldigheter att bedriva ett systematiskt patientsäkerhetsarbete.255
6.3Oklara sanktionsmöjligheter vid tillsyn av läkemedelssubventioner
TLV:s sanktionsmöjligheter regleras i lagen om läkemedelsförmåner m.m. TLV har möjlighet att besluta om förelägganden och förbud så att lagen om läkemedelsförmåner m.m., inklusive föreskrifter och villkor, efterlevs. Beslut om föreläggande och förbud får förenas med vite. 256 När det gäller om förelägganden och förbud kan riktas mot förskrivare som felaktigt förskriver läkemedel med förmån utanför de begränsningar som TLV beslutat om är rättsläget dock oklart enligt TLV. Det finns inte heller förutsättningar att få frågan prövad då TLV inte har tillgång till uppgifter om enskilda förskrivares förskrivningar.257
IVO:s sanktionsmöjligheter bestäms i patientsäkerhetslagen och utgår från att vårdgivaren ska upprätthålla patientsäkerheten.258 IVO har vid initiativärenden möjlighet att fatta ett beslut med kritik om en förskrivare bryter mot lagen om läkemedelsförmåner m.m. eller smittskyddslagen som innebär utredning mot en vårdgivare eller hälso- och sjukvårdspersonal.259
253I 6 kap. 6 § lagen om nationell läkemedelslista definieras vilken uppgiftsskyldighet
2546 kap. 6 § lagen om nationell läkemedelslista.
2557 kap. 3 § PSL.
25625 § lagen om läkemedelsförmåner m.m.
257
258
259Se 7 kap. 19 § PSL.
76 Riksrevisionen
6.4TLV:s arbete med att följa upp och ompröva förmånsbeslut kan förbättras
En åtgärd som TLV kan vidta om läkemedel i stor utsträckning subventioneras utanför begränsningen är att ompröva om läkemedlet fortfarande är kostnadseffektivt. Skäl till omprövning kan till exempel vara att läkemedlet systematiskt förskrivs för en annan indikation än den som låg till grund för beslutet eller till en annan grupp patienter. Om TLV finner att läkemedlet inte är kostnadseffektivt vid omprövningen kan TLV sänka priset på läkemedlet så att det blir kostnadseffektivt även för en större patientgrupp. Men det finns då risk för att företaget drar tillbaka läkemedlet från förmånerna. I några fall har TLV informerat företaget om dålig följsamhet i förskrivningen, vilket gjort att företaget självmant sänkt priset för att läkemedlet ska fortsätta ingå i förmånerna. Företaget råder inte över förskrivningen och kan inte lastas för felaktig förskrivning, förutsatt att villkoren om att upplysa om förmånsbegränsningar i marknadsföringen av läkemedlen följts.260
I vår granskning ”Mesta möjliga hälsa för skattepengarna” från 2021 framgick att TLV inte systematiskt följde upp om förskrivarna följer de begränsningar som TLV har bestämt ska gälla för att ett läkemedel ska ingå i läkemedelsförmånerna. Vår granskning visade även att det fanns en omfattande felaktig subventionering av läkemedel och att den varierade mellan regionerna.261 Det innebär att läkemedelsanvändningen inte blir kostnadseffektiv.
Sedan granskningen har TLV utvecklat en publik webbapplikation som kan användas av till exempel regionerna för att se hur väl förskrivarna följer förmånsbegränsningarna för två relativt nya, dyra läkemedel:
I den tidigare granskningen visade vi även att TLV omprövar få beslut. 2021 omprövades och fattades nya subventionsbeslut för 4 läkemedel och under 2022 avslutades 4 omprövningar som sammanlagt omfattade 11 läkemedel. TLV fick 2023 i regeringsuppdrag att öka antalet omprövningar.262 Under första halvåret av 2023 har
260Riksrevisionen, Mesta möjliga hälsa för skattepengarna – statens subventionering av läkemedel, 2021, s. 43.
261Riksrevisionen, Mesta möjliga hälsa för skattepengarna – statens subventionering av läkemedel, 2021, s. 40 ff.
262Regeringsbeslut S2022/04000, S2022/04810 (delvis).
Riksrevisionen 77
4 omprövningar som omfattade 56 läkemedel (däribland 33
2 omprövningar har inletts.263
TLV har exempelvis inte omprövat om botulinumtoxin är kostnadseffektivt trots att förskrivningen med subvention har ökat kraftigt över tid. Sedan botulinumtoxin började ingå i förmånen för indikationen migrän (2011) har kostnaderna för botulinumtoxin nästan tredubblats och var knappt 73 miljoner kronor år 2022
(se diagram 4).
TLV har dock omprövat och förtydligat villkoren för exempelvis semaglutid. Förskrivare och apotekspersonal har påtalat för TLV att förmånsbegränsningarna för läkemedel som innehåller semaglutid och andra
6.5TLV saknar förutsättningar att tillsyna extemporeläkemedel
Tillverkningen av extemporeläkemedel sker oftast på särskilda tillverkande apotek och säljs sedan till öppenvårdsapotek. Extemporeapotekens prissättning av extemporeläkemedel omfattas av TLV:s tillsyn. För att extemporeläkemedlet ska ingå i läkemedelsförmånerna krävs att öppenvårdsapotekens inköpspris från extemporeapoteken beräknas utifrån summan av läkemedlets tillverknings- och tilläggskostnader.264 Reglernas utformning leder till att det är svårt för TLV att bedöma om extemporeapoteken prissätter läkemedel korrekt. TLV har även begränsade sanktionsmöjligheter som är svåra att tillämpa om en överträdelse har skett.265
Öppenvårdsapotekens priser till kund på extemporeläkemedel tillsynas av TLV. Öppenvårdsapoteket ska använda sig av den handelsmarginal som TLV har beslutat
263Genomgång av TLV:s omprövningar som avslutats respektive år. Källa: Tandvårds- och läkemedelsförmånsverket ”Omprövning av läkemedel”, hämtad
264
265
78 Riksrevisionen
om för läkemedel och andra varor som ingår i läkemedelsförmånerna.266 TLV har ett antal pågående ärenden mot öppenvårdsapotek angående vilka försäljningspriser som tagits ut för extemporeläkemedel där TLV har identifierat expedieringar av extemporeläkemedel med mycket höga priser. TLV har begärt in följesedlar från öppenvårdsapoteken med den prisinformation som extemporeapoteken uppgett så att TLV kan jämföra extempore- och öppenvårdsapotekens försäljningspriser och bedöma om prissättningen är korrekt utifrån befintlig reglering. TLV har inte fattat beslut i ärendena än.267
TLV föreslog i avrapporteringen av ett regeringsuppdrag om prissättning av extemporeläkemedel och lagerberedningar att
6.6TLV har förutsättningar att tillsyna prissättningen på smittskyddsläkemedel
Det finns ingen tydlig reglering av vilka läkemedel eller
Däremot är apotekens prissättning på läkemedel som förskrivs enligt smittskyddslagen reglerad269 och TLV har tillsynsansvar över apotekens prissättning270. TLV har förutsättningar att tillsyna prissättningen av smittskyddsläkemedel. 2016 gjorde TLV en större tillsyn av apotekens prissättning av smittskyddsläkemedel och förbjöd 64 apoteksföretag att ta ut felaktiga priser. TLV valde ut tolv olika läkemedel som förskrivits enligt smittskyddslagen men ingick i läkemedelsförmånerna och granskade prissättningen. Felprissättningen medförde en merkostnad för skattebetalarna med nästan 3 miljoner kronor. TLV beslutade om förbud för
266Tandvårds- och läkemedelsförmånsverkets föreskrifter (TLVFS 2009:3) om handelsmarginal för läkemedel och andra varor som ingår i läkemedelsförmånerna.
267
268Tandvårds- och läkemedelsförmånsverket, Prissättning av extemporeläkemedel och lagerberedningar, 2020.
2697 § lagen om läkemedelsförmåner m.m.
27025 § lagen om läkemedelsförmåner m.m.
Riksrevisionen 79
berörda apotek att ta ut andra priser än de som TLV beslutat om.271 Sedan dess har TLV inte sett några större avvikelser i prissättningen och området har därför inte varit prioriterat i förhållande till TLV:s andra tillsynsområden.272
6.7Regionerna har små möjligheter att stoppa förskrivare och få ersättning för felaktiga subventioner
För att ett läkemedel ska kunna förskrivas med läkemedelsförmån behöver förskrivaren ange en arbetsplatskod på receptet. Det är regionerna som utfärdar arbetsplatskoder till vårdgivarna. Om regionen anser att en sökande inte har rätt till en arbetsplatskod ska regionen vända sig till Socialstyrelsen för att få ärendet prövat.273 Exempel på ärenden där regioner har vänt sig till Socialstyrelsen är när vårdgivaren inte bedöms bedriva hälso- och sjukvård274, inte har sin arbetsplats i regionen275 eller bedöms förskriva läkemedel på ett felaktigt sätt som inte är medicinskt motiverat och kan medföra patientsäkerhetsrisker276.
Socialstyrelsen uppger i sina beslut om att bevilja eller dra in arbetsplatskoder att det inte är Socialstyrelsens uppdrag att tillsyna vårdgivare eller pröva frågor om behörighet eller förskrivningsrätt. Om vårdgivaren bedriver sjukvård, har anmält sin verksamhet till IVO och förskrivarna har legitimation utan begränsad förskrivningsrätt har vårdgivaren rätt till en arbetsplatskod. I de fall regionerna har bedömt att vårdgivare inte bedriver hälso- och sjukvård har Socialstyrelsen begärt in kompletterande handlingar från vårdgivaren. När vårdgivaren inte inkommer med kompletterande underlag har Socialstyrelsen dragit in arbetsplatskoden. I andra fall har vårdgivaren kompletterat med handlingar som visar att de ska bedriva vård vid sidan av till exempel skönhetsbehandlingar. Då har Socialstyrelsen beslutat att vårdgivaren får behålla arbetsplatskoden.277
271Tandvårds- och läkemedelsförmånsverket, ”TLV förbjuder 64 apoteksföretag att ta ut felaktiga priser för smittskyddsläkemedel”, hämtad
272
2734 § förordningen om läkemedelsförmåner m.m.
274Socialstyrelsen, Fråga om rätt till arbetsplatskod med dnr
dnr
275Socialstyrelsen, Fråga om rätt till arbetsplatskod dnr
276Socialstyrelsen, Fråga om rätt till arbetsplatskod, dnr
277Socialstyrelsen, Fråga om rätt till arbetsplatskod, dnr
80 Riksrevisionen
Det finns inte någon reglering som gör att regionerna ersätts för de subventionskostnader som den felaktiga förskrivningen fört med sig. Även om en förskrivare får sin förskrivningsrätt indragen eller begränsad, eller legitimation återkallad, blir hen inte ersättningsskyldig för de förmånskostnader som den felaktiga förskrivningen fört med sig. Det kan röra sig om stora belopp.
Det har förekommit att regioner har yrkat skadestånd för sina kostnader för läkemedelsförmånerna i samband med att förskrivare har åtalats för brott genom att ha skrivit ut läkemedel utan medicinska skäl. Eftersom domstolarna i dessa fall har friat de åtalade har även regionernas yrkande om skadestånd ogillats.278 Ett skadeståndsyrkande har delvis också ogillats när en förskrivare dömts för brott men där domstolen inte har kunnat bedöma om regionen belastats av kostnader för läkemedelsförmånerna.279
278Se Hovrätten för Västra Sveriges dom den 2 juni 2022 i mål nr B
279Se Stockholms tingsrätts dom den 4 augusti i mål nr B
Riksrevisionen 81
7 Slutsatser och rekommendationer
Riksrevisionen har granskat statens styrning och tillsyn av läkemedelsförskrivningen. Den övergripande slutsatsen är att statens styrning och tillsyn av läkemedelsförskrivningen inte är effektiv. En effektiv styrning och tillsyn av läkemedelsförskrivningen är viktig för att hela befolkningen ska få tillgång till en god och jämlik vård oavsett var i landet man bor, för patientsäkerheten och för att säkerställa att statens subventionering av läkemedel är kostnadseffektiv.
7.1Tillgång till läkemedel är en förutsättning för en god vård för hela befolkningen
Målet med hälso- och sjukvården är en god hälsa och en vård på lika villkor för hela befolkningen.280 Staten försöker på olika sätt styra hälso- och sjukvården så att hela befolkningen får tillgång till en jämlik vård. Samtidigt råder det kommunalt självstyre där de 21 regionerna är huvudmän för hälso- och sjukvården. För att minska de regionala skillnader som finns i läkemedelsanvändningen281, vad gäller både äldre och nyintroducerade läkemedel, och arbeta för en mer likvärdig vård behöver regionerna samordna och effektivisera styrningen.
7.2Statsbidraget är inte ett effektivt styrmedel för en mer kostnadseffektiv läkemedelsförskrivning
Riksrevisionens bedömning är att regeringens styrning av läkemedelsförskrivningen genom statsbidraget för läkemedelsförmånerna inte är effektiv. Statsbidraget ska bidra till att täcka regionernas kostnader för läkemedelsförmånerna m.m. samtidigt som det är konstruerat på ett sådant sätt att det ska ge regionerna incitament till en kostnadseffektiv läkemedelsanvändning och att hålla nere läkemedelsutgifterna. Statsbidragets storlek och fördelningen av statsbidraget mellan regionerna bestäms i etttill treåriga överenskommelser med SKR.
7.2.1Teoretiskt ger statsbidraget regionerna vissa incitament att hålla nere utgifterna för läkemedel
Riksrevisionen bedömer att statsbidragets konstruktion teoretiskt ger regionerna vissa incitament att hålla nere utgifterna för läkemedel och verka för en mer kostnadseffektiv läkemedelsanvändning. Statsbidraget fördelas mellan regionerna
2803 kap. 1 § hälso- och sjukvårdslagen.
281SOU 2017:87, s. 224 f.
82 Riksrevisionen
utifrån en behovsmodell i stället för utifrån faktiska läkemedelskostnader. Regioner med en befolkning som antas vara mer vårdkrävande och ha större behov av läkemedel får ett större bidrag per invånare än andra regioner. Bidraget är inte öronmärkt för läkemedel. Genom att styra läkemedelsförskrivningen mot kostnadseffektiva läkemedel och minskad förskrivning kan regionens utgifter bli lägre än tilldelat bidrag. Regionen får då behålla överskottet.
I statsbidraget ingår även en vinst- och förlustmodell som innebär att staten och regionerna delar på risken att samhällets kostnader för läkemedel blir mycket högre än förväntat. På samma sätt delar staten och regionerna på överskottet om de sammanlagda kostnaderna för läkemedel blir mycket lägre än förväntat. Riksrevisionens bedömning är att vinst- och förlustmodellen inte ger de enskilda regionerna incitament att kostnadseffektivisera läkemedelsförskrivningen eftersom det inte finns ett direkt samband mellan de egna läkemedelskostnaderna och tillskottet eller avdraget genom vinst- och förlustmodellen.
Sedan 2014 finns det möjlighet för regionerna att sluta återbäringsavtal med läkemedelsbolagen för att pressa priserna på läkemedel. Staten och regionerna delar på återbäringen enligt den fördelning som slås fast i överenskommelsen om statsbidraget. Återbäringen beräknas utifrån varje enskild regions faktiska läkemedelsanvändning. Riksrevisionens bedömning är att återbäringsavtalen bidrar till en kostnadseffektiv läkemedelsanvändning eftersom återbäringen tillfaller den enskilda regionen. Det ger regionerna incitament att styra förskrivningen mot kostnadseffektiva läkemedel med återbäringsavtal.
7.2.2Statsbidraget används endast i liten utsträckning i regionernas budgetarbete
Statsbidraget påverkar inte regionernas budgetarbete i särskilt stor utsträckning vilket är en förutsättning för att statsbidraget ska kunna användas som ett effektivt styrmedel av läkemedelsförskrivningen. En av orsakerna som regionerna anger är att utfallet från överenskommelsen kommer allt för sent för att kunna inkluderas i budgetarbetet kring läkemedel. De återkommande förändringarna av bidragskonstruktionen leder till svårigheter för regionerna att prognostisera statsbidragets storlek inför kommande budgetår. Sedan 2021 bistår SKR regionerna med prognoser över kommande statsbidrag för att underlätta budgetplaneringen. Men regionerna baserar framför allt läkemedelsbudgeten på andra faktorer än statsbidraget, exempelvis egna framskrivningar av läkemedelskonsumtionen, förväntat vårdbehov, nytillkommande läkemedel, patentutgångar, myndighetsbeslut, Socialstyrelsens kostnadsprognoser och avstämningar med regionala
Riksrevisionen 83
arbetsgrupper för kunskapsstyrning. Det går därför att ifrågasätta de många ändringar som gjorts i statsbidragets konstruktion i syfte att påverka utgifterna för läkemedel.
7.2.3En sammanhållen finansiering av läkemedel och hälso- och sjukvård ökar förutsättningarna för tydligare styrning
Statsbidraget var tänkt att vara en tillfällig finansieringslösning när kostnadsansvaret för läkemedel fördes över från staten till regionerna 1998. Regeringen framhöll inför reformen att det starka beroendet mellan olika behandlingsformer talade för ett enhetligt finansieringssystem för hela hälso- och sjukvården282, det vill säga att det särskilda statsbidraget för läkemedel på sikt skulle inkorporeras i utjämningssystemet. Att samla resurserna för hälso- och sjukvård och läkemedel skulle göra det möjligt för hälso- och sjukvården att samordna och avväga olika former av terapier, att rikta kostnader för allt dyrare vård och behandlingsmetoder till dem som har de största behoven och att göra en bättre samordning mellan den öppna och den slutna vården.283 Någon överföring av statsbidraget för läkemedelsförmånerna till utjämningssystemet har hittills inte kommit till stånd. Men frågan har aktualiserats flera gånger under åren. En av knäckfrågorna är prognosen om att det framöver kommer fler nya och dyra läkemedel. Om kostnadsansvaret fullt ut förs över till regionerna kan de komma att få problem med att finansiera dessa. Att ha kvar nuvarande finansieringslösning garanterar att staten fortsatt finansierar ökade läkemedelskostnader.
Riksrevisionens bedömning är att en mer långsiktig finansieringslösning än den som råder i dag behövs. Ett generellt bidrag skapar bättre planeringsförutsättningar för både staten och regionerna. Det tydliggör regionernas kostnadsansvar och stärker incitamenten att hålla nere kostnader för läkemedel. En överföring till det generella statsbidraget innebär också att läkemedel finansieras på samma sätt som andra behandlingsmetoder i hälso- och sjukvården. Det har fördelar ur ett prioriteringsperspektiv. Sammantaget är det mycket som talar för att ett generellt bidrag innebär att roller och ansvar i finansieringen av läkemedel förtydligas.
Det kan finnas behov av att staten stödjer regionerna ekonomiskt vid plötsliga och väl motiverade kostnadsökningar. En sådan kostnadsökning kan uppstå vid introduktion av nya dyra läkemedel. Utan ekonomiskt stöd från staten finns det en risk att regionernas olika budgetmässiga förutsättningar bidrar till en ojämlik introduktion. Riksrevisionen bedömer att det med tanke på läkemedelskostnadernas
282Prop. 1996/97:27, s. 46.
283Prop. 1996/97:27, s. 40.
84 Riksrevisionen
beloppsmässiga storlek är rimligt att staten regelbundet följer kostnadsutvecklingen och har en ordning för att kunna justera det generella bidraget när så är motiverat.284
7.3Myndigheternas styrning med kunskap ger ett bra underlag men den har en begränsad effekt
Riksrevisionens övergripande bedömning är att Socialstyrelsens, Läkemedelsverkets och SBU:s arbete med kunskapsstyrande underlag överlag är tillfredsställande, men att kunskapsstyrningen av läkemedelsförskrivningen trots det har en begränsad effekt på förskrivningen av läkemedel. Kunskapsunderlagen är vägledande,
7.3.1 Myndigheternas kunskapsstöd är samordnade
Riksrevisionens bedömning är att Socialstyrelsens, Läkemedelsverkets och SBU:s rekommendationer och kunskapsunderlag är samordnade. I de fall de olika myndigheternas kunskapsunderlag täcker samma diagnoser och behandlingar rekommenderas i mycket hög grad samma läkemedel. Socialstyrelsens nationella riktlinjer bygger ofta på kunskapsunderlag som SBU har tagit fram och Läkemedelsverket hänvisar ofta till SBU:s kunskapsunderlag i sina behandlingsrekommendationer. Även de rekommendationer som de regionala läkemedelskommittéerna tar fram är i mycket hög grad samordnade med de statliga kunskapsunderlagen.
I de få fall där rekommendationerna skiljer sig åt beror det på att Socialstyrelsen varken rekommenderar off
284SOU 2018:89.
285Intervju med ordföranden för Läkemedelskommittéernas nationella nätverk (LOK),
Riksrevisionen 85
7.3.2Kunskapsstöden grundas på vetenskap och beprövad erfarenhet och håller hög kvalitet
Riksrevisionens bedömning är att Läkemedelsverkets och Socialstyrelsens kunskapsstöd grundas på vetenskap och beprövad erfarenhet. SBU:s kunskapsstöd grundas på vetenskap. Myndigheterna använder vedertagna metoder för att värdera och gradera evidens i de vetenskapliga studier som kunskapsstöden grundar sig på. För att säkerställa att kunskapsstöden grundas på vetenskap och beprövad erfarenhet anlitar myndigheterna även externa experter som bidrar till arbetet. Innan ett kunskapsstöd kan publiceras krävs det att experterna når konsensus gällande de rekommendationer som myndigheterna bestämmer sig för att ge hälso- och sjukvården.
Riksrevisionen bedömer att Läkemedelsverket, Socialstyrelsen och SBU har gedigna processer för att ta fram kunskapsstöd. Myndigheterna involverar externa experter i arbetets alla faser vilket bidrar till en god kvalitet och att kunskapsstöden kvalitetssäkras kontinuerligt. Myndigheterna genomför även grundliga jävsbedömningar av experterna.
Det går att ifrågasätta användandet av samma experter i de olika myndigheternas kunskapsstöd eftersom det gör att ett fåtal personer kan upplevas få stort inflytande över kunskapsstyrningen inom ett visst område. Socialstyrelsen ser dock inte detta som ett problem eftersom alla myndigheter ställer krav på att experterna genomgår jävsbedömningar. Vidare menar Socialstyrelsen att det är svårt för experterna att få inflytande över hela arbetsprocessen eftersom de delas in i olika grupper och inte deltar i projektets alla delar.286
Utöver arbetet med att involvera experter har Läkemedelsverket och SBU även interna kvalitetssäkringsfunktioner som granskar deras kunskapsstöd medan Socialstyrelsen kvalitetssäkrar genom de synpunkter som kommer in på kunskapsstödens remissversioner.
7.3.3 Kunskapsstöden utgör ett stöd för olika professioners behov
Riksrevisionens bedömning är att Socialstyrelsen, Läkemedelsverket och SBU tar fram kunskapsstöd som är anpassade efter och utgör ett viktigt stöd för olika professioners behov. De expertgrupper som involveras i arbetet med att ta fram kunskapsstöden består av representanter från olika professioner vilket bidrar till att flera olika perspektiv täcks av stöden. De professionsrepresentanter som
286Möte med representanter för Socialstyrelsen,
86 Riksrevisionen
Riksrevisionen har intervjuat upplever att deras synpunkter har tagits väl om hand och att slutprodukten utgör ett bra stöd för den egna professionen.
7.3.4 Huvudmännens behov behöver beaktas i högre grad
De kunskapsstyrande myndigheterna och huvudmännen för främst dialogen om huvudmännens behov av vägledning genom Rådet för styrning med kunskap och huvudmannagruppen. Enligt Riksrevisionens bedömning behöver Socialstyrelsen tydligare involvera huvudmännen i valet av vilka nationella riktlinjer som ska tas fram för att fånga upp huvudmännens kunskap om var det största behovet av vägledning finns. Socialstyrelsen lyfter själv att myndigheten behöver utveckla sitt arbete med att göra personer som arbetar med styrning och ledning mer delaktiga i analysen av vilka riktlinjeområden som behövs. Huvudmännen involveras först under remissförfarandet när ett utkast till nationella riktlinjer redan tagits fram.
Läkemedelsverket involverar inte heller huvudmännen i arbetet med behandlingsrekommendationerna. Det motiverar Läkemedelsverket med att behandlingsrekommendationernas främsta målgrupp är förskrivarna. Riksrevisionens bedömning är att även Läkemedelsverket bör involvera huvudmännen i arbetet med att ta fram behandlingsrekommendationer så att huvudmännen och förskrivarna nås av en sammanhållen statlig styrning.
Riksrevisionens bedömning är att SBU involverar huvudmännen för att tillgodose deras behov. SBU har en upplysningstjänst där både professioner och huvudmän kan ställa frågor om vilken forskning som finns publicerad om en viss behandlingsmetod. Utöver att besvara frågeställarnas frågor är syftet med upplysningstjänsten att identifiera behovet av vägledning.
7.3.5Läkemedelsverket behöver bättre beakta patienters och brukares synpunkter och erfarenheter
Riksrevisionens granskning visar att Socialstyrelsen och SBU nästan alltid involverar patientföreträdare när de tar fram kunskapsstöd. Att involvera patienter och brukare i processen är en förutsättning för att uppnå en personcentrerad hälso- och sjukvård. De patient- och brukarföreträdare som intervjuats anser att deras synpunkter och kunskaper har tagits väl om hand. Läkemedelsverket däremot har endast samarbetat med patientföreträdare i ett fåtal behandlingsrekommendationer. Riksrevisionens bedömning är att även Läkemedelsverket bör involvera patient- och brukarföreträdare i arbetet med behandlingsrekommendationer samt säkerställa att deras kunskaper tas väl om hand.
Riksrevisionen 87
7.3.6Uppföljningen av kunskapsstyrningen och återförandet av resultaten till regionerna behöver förbättras
Riksrevisionens granskning visar att Socialstyrelsen gör uppföljningar av de nationella riktlinjerna. Men uppföljningarna är inget som sker kontinuerligt utan i regel har bara en uppföljning per nationell riktlinje genomförts. I många fall är det flera år sedan uppföljningen gjordes. Läkemedelsverket påbörjade ett arbete med uppföljning av nya behandlingsrekommendationer 2020. Läkemedelsverket och Socialstyrelsen återkopplar inte resultaten av uppföljningen direkt till regionerna, även om de bedömer att regionens förskrivningar har dålig följsamhet till rekommendationerna.
Riksrevisionens bedömning är att Socialstyrelsen och Läkemedelsverket kontinuerligt bör följa upp läkemedelsförskrivningen av rekommenderade läkemedel och återkoppla resultaten till regionerna. Det kan till exempel ske till huvudmannagruppen i Rådet för styrning med kunskap.
7.3.7Kunskapsstyrningen bidrar i begränsad utsträckning till en jämlik och jämställd vård
Riksrevisionens bedömning är att myndigheternas kunskapsstöd får en relativt liten påverkan på läkemedelsförskrivningen än vad som är önskvärt för att uppnå en god och jämlik vård. Myndigheternas uppföljningar av de nationella riktlinjerna och behandlingsrekommendationerna visar att det finns stora skillnader mellan regionerna i hur väl de följer läkemedelsrekommendationerna. Riksrevisionens egna beräkningar indikerar samma sak: det finns könsskillnader och skillnader mellan regionerna i förskrivningsmönster. Ofta ökar, i stället för minskar, skillnaderna över tid efter att ett kunskapsstöd har publicerats. Kunskapsstöden ger
7.4Tillsynen av felaktiga förskrivningar är inte effektiv
Riksrevisionens bedömning är att tillsynen av förskrivare som inte följer vetenskap och beprövad erfarenhet inte är effektiv. IVO saknar förutsättningar att genomföra en riskbaserad egeninitierad tillsyn. Tillsynen är framför allt ärendestyrd.
Riksrevisionens bedömning är att IVO:s handläggningstider inte når upp till kravet om skyndsam behandling i förvaltningslagen och även HSAN:s handläggningstider är årslånga. Riksrevisionens bedömning är att IVO:s sanktionsmöjligheter är effektiva.
88 Riksrevisionen
7.4.1IVO saknar möjlighet att använda uppgifter om läkemedelsförskrivning inför tillsynen
Riksrevisionen bedömer att regeringen inte har gett IVO tillräckliga förutsättningar för att kunna genomföra en riskbaserad egeninitierad tillsyn av läkemedelsförskrivarna. Regeringen har vid upprepade tillfällen poängterat att IVO behöver utveckla den riskbaserade tillsynen i regleringsbrev och regeringsuppdrag. Men regeringen har inte gett IVO möjlighet att använda sig av registeruppgifter i eller inför sin tillsyn för att söka efter förskrivare som har systematiskt riskfyllda förskrivningsmönster. Det kan till exempel röra sig om att söka i register efter förskrivare som skriver ut ovanligt många recept med narkotikaklassade läkemedel, eller olämpligt stora doser långt över de som Läkemedelsverket rekommenderar, och utifrån uppgifterna göra en riskbedömning om en tillsyn ska inledas. IVO får i stället förlita sig på anmälningar och tips i sin tillsyn av läkemedelsförskrivarna. Det finns därför stora risker att tillsynen missar förskrivare som systematiskt avviker från vetenskap och beprövad erfarenhet i sin läkemedelsförskrivning.
7.4.2Kraven om skyndsam handläggning i förvaltningslagen uppfylls inte
Enligt Riksrevisionens bedömning uppfyller inte IVO:s handläggningstider av ärenden som gäller felaktig läkemedelsförskrivning kravet i förvaltningslagen om skyndsam handläggning. Även HSAN:s handläggningstider är i många fall årslånga och under handläggningstiden kan förskrivarna fortsätta att förskriva läkemedel felaktigt. Det kan få stora konsekvenser för patientsäkerheten.
I de fall där IVO ser en särskilt allvarlig problematik kring en förskrivares läkemedelsförskrivning kan IVO yrka på att HSAN drar in eller begränsar förskrivningsrätten eller återkallar legitimationen under tiden för IVO:s handläggning. Under HSAN:s handläggningstid kan förskrivningarna fortsätta vilket vi bedömer som särskilt allvarligt eftersom konsekvensen är att förskrivningar som allvarligt hotar patientsäkerheten då kan fortgå under flera år.
Förvaltningsrättsligt är systemet med att en myndighet (IVO) utreder ett ärende och en annan fattar beslut (HSAN) en ovanlig lösning. Det brukar vara så att den första instansen (myndigheten) både utreder och fattar beslut i ett ärende. Därefter kan ärendet överklagas till förvaltningsrätten. ”Tvåstegsraketen” påverkar troligtvis den sammanlagda handläggningstiden negativt. När IVO anmäler en förskrivare till HSAN yrkar IVO på prövotid, begränsad eller indragen förskrivningsrätt eller återkallelse av legitimation. IVO har gjort en grundlig utredning av ärendet inför sitt yrkande. Där efter handlägger HSAN ärendet i ungefär ytterligare ett år. Ett sätt
Riksrevisionen 89
att undvika att felaktig förskrivning får fortsätta kan vara att IVO ges rätt att dra in eller begränsa förskrivningsrätten under utredningstiden. Att begränsa förskrivningsrätten är en mindre ingripande åtgärd än att dra in en förskrivares legitimation.
7.4.3Sanktionsmöjligheterna leder till förändrade förskrivningsmönster
Riksrevisionens bedömning är att IVO:s sanktionsmöjligheter är effektiva. IVO upplever att de allra flesta förskrivare ändrar sitt förskrivningsmönster redan i inledningen av en utredning. Det är även få förskrivare som har fått beslut med kritik, som återkommer bland IVO:s ärenden. Ungefär tre fjärdedelar av de förskrivare som fått en andra chans genom ett beslut om prövotid följer prövotidsplanen287.
7.5Stora brister i tillsynen av förskrivningar som leder till felaktigt användande av läkemedelssubventioner
Riksrevisionens övergripande bedömning är att det finns omfattande brister i regleringen av hur förskrivningar som leder till felaktigt användande av läkemedelsförmånerna och smittskyddssubventioner ska tillsynas och hanteras. Ett exempel på felaktigt användande är när läkemedel felaktigt förskrivs som kostnadsfria enligt smittskyddslagen. Ett annat är när läkemedel som endast ingår i läkemedelsförmånerna för vissa grupper eller vissa tillstånd förskrivs med förmån även utanför begränsningarna. Exempel är diabetesläkemedel för bantning och mjukgörande krämer. Även felaktig förskrivning av narkotikaklassade och andra begärliga läkemedel som tillväxthormoner till kroppsbyggare, botulinumtoxin mot rynkor och potenshöjande läkemedel har som sidoeffekt att de belastar läkemedelsförmånerna.
Riksrevisionen bedömer även att regionerna har små möjligheter att stoppa förskrivare som använder läkemedelsförmånerna och smittskyddsubventioner felaktigt. Regionerna har även svårt att få tillbaka utbetalda medel i fall där subventionerna har använts felaktigt.
287Detta gäller dock alla typer av ärenden, inte enbart läkemedelsförskrivning. IVO har inte möjlighet att dela upp statistiken utifrån att ärendet rör läkemedelsförskrivning.
90 Riksrevisionen
7.5.1Tillsynsmyndigheterna saknar verktyg för att tillsyna läkemedelsförmånerna och smittskyddssubventioner
TLV och IVO har båda tillsynsansvar över läkemedelssubventionerna men ingen av myndigheterna har förutsättningar att utföra tillsynen effektivt. TLV har inte tillgång till journaler eller andra uppgifter om enskilda förskrivares förskrivningar och ingen möjlighet att tillsyna enskilda förskrivare. Även om IVO har möjlighet enligt patientsäkerhetslagen att tillsyna att förskrivarna följer reglerna för att ett läkemedel ska ingå i förmånerna eller subventioneras enligt smittskyddslagen så ska IVO:s tillsyn främst inriktas på granskning av att vårdgivaren fullgör sina skyldigheter att bedriva ett patientsäkerhetsarbete som leder till god vård.288 IVO har ett omfattande tillsynsområde och begränsade resurser.
IVO har möjlighet att granska journaler för att bedöma om ett läkemedel har förskrivits för de indikationer som TLV har bestämt att läkemedlet ska subventioneras för. IVO har dock inte möjlighet att begära ut uppgifter från
7.5.2Regionerna försöker stoppa felaktiga utbetalningar från läkemedelsförmånerna genom att dra in arbetsplatskoden
När regionerna upptäcker felaktigt utnyttjande av läkemedelsförmånerna har de små möjligheter att stoppa förskrivarna och att få tillbaka utbetalade medel från förmånen. Ett sätt för regionerna att hindra utnyttjandet av förmånen är att dra in en vårdgivares arbetsplatskod. Arbetsplatskoden behövs för att läkemedel ska kunna förskrivas med läkemedelsförmån. I många fall överklagar vårdgivarna indragningen av arbetsplatskoden till Socialstyrelsen. Socialstyrelsen gör ofta bedömningen att kliniken ska få tillbaka arbetsplatskoden, helt i linje med förordningen om läkemedelsförmåner m.m.
I de fall regionerna har ansökt om att dra in arbetsplatskoden för vårdgivare med en problematik kring felaktig förskrivning som kan påverka patientsäkerheten hänvisar Socialstyrelsen i stället regionen till IVO. Under IVO:s långa handläggningstider kan förskrivaren fortsätta att skriva ut läkemedel som dels riskerar patientsäkerheten, dels belastar läkemedelsförmånerna. Regionerna har inte möjlighet att få ersättning för redan utbetalade felaktiga förmånskostnader. Några regioner har
2887 kap. 3 § PSL.
289I 6 kap. 6 § lagen om nationell läkemedelslista definieras vilken uppgiftsskyldighet
Riksrevisionen 91
i egenskap av målsägande yrkat skadestånd för kostnader för läkemedelsförmånerna när förskrivare har åtalats för brott. Men dessa yrkanden har ogillats när de åtalade har frikänts av domstolarna.
7.6Rekommendationer
Till regeringen
∙För över statsbidraget för läkemedelsförmånerna m.m. till det generella statsbidraget för regioner inom anslaget för kommunalekonomisk utjämning.
∙Förtydliga myndigheternas tillsynsansvar för felaktigt användande av läkemedelsförmånerna.
∙Utred hur felaktig användning av läkemedelssubventioner kan hindras och hur regionerna kan ersättas för felaktiga utbetalningar.
∙Förtydliga reglerna för tilldelning och indragning av arbetsplatskoder.
∙Ge IVO möjlighet att använda de uppgifter om förskrivningar av särskilda läkemedel och andra läkemedel som behövs för att få kännedom om avvikande förskrivningsmönster och riskindivider inför och under tillsynen av läkemedelsförskrivarna.
∙Utred möjligheterna för HSAN att korta ned handläggningstiderna alternativt att ge IVO möjlighet att dra in eller begränsa förskrivningsrätten interimistiskt under en pågående tillsyn.
Till Läkemedelsverket och Socialstyrelsen
∙Följ upp kunskapsstyrningen kontinuerligt och återför resultaten till regionerna.
∙Ta in huvudmännens, det vill säga regionernas, perspektiv och behov inför arbetet med att ta fram behandlingsrekommendationer och nationella riktlinjer.
Till Läkemedelsverket
∙Utveckla patient- och brukardeltagandet under arbetet med behandlingsrekommendationerna.
92 Riksrevisionen
Till IVO
∙Effektivisera handläggningen av ärenden som rör brister i läkemedelsförskrivningen för att korta handläggningstiderna.
Till TLV
∙Fortsätt att utveckla och systematisera uppföljningen av förskrivarnas följsamhet till förmånsbegränsningarna.
∙Ompröva förmånsbeslutet vid låg följsamhet till förmånsbegränsningarna eller om de antaganden om kostnadseffektivitet som låg till grund för beslutet har ändrats.
Riksrevisionen 93
Referenslista
Författningar med mera
Förordning (2002:687) om läkemedelsförmåner m.m.
Förordning (2007:1206) med instruktion för Tandvårds- och läkemedelsförmånsverket.
Förordning (2007:1233) med instruktion för Statens beredning för medicinsk och social utvärdering.
Förordning (2013:176) med instruktion för Inspektionen för vård och omsorg.
Förordning (2015:155) om statlig styrning med kunskap avseende hälso- och sjukvård och socialtjänst.
Förordning (2015:284) med instruktion för Socialstyrelsen. Förordning (2020:57) med instruktion för Läkemedelsverket. Förvaltningslag (2017:900).
Hälso- och sjukvårdslag (2017:30). Kommunallag (2017:725).
Lag (1996:1157) om läkemedelskommittéer. Lag (2002:160) om läkemedelsförmåner m.m. Lag (2018:1212) om nationell läkemedelslista. Läkemedelsförordning (2015:458).
Läkemedelsverkets föreskrifter om förordnande och utlämnande av läkemedel och teknisk sprit
Patientsäkerhetslag (2010:659). Smittskyddsförordning (2004:255). Smittskyddslag (2004:168).
Tandvårds- och läkemedelsförmånsverkets föreskrifter (TLVFS 2009:3) om handelsmarginal för läkemedel och andra varor som ingår i läkemedelsförmånerna.
Tandvårds- och läkemedelsförmånsverkets föreskrifter om licensläkemedel, extemporeläkemedel, lagerberedningar och tillfällig subvention
94 Riksrevisionen
Utredningar med mera
European Society of cardiology, Recommendations for Guidelines Production. A document for Task Force Members Responsible for the Production and Updating of ESC Guidelines, European Society of cardiology, 2010.
Hälso- och sjukvårdens ansvarsnämnd, Verksamhetsredogörelse 2022, Hälso- och sjukvårdens ansvarsnämnd, 2023.
Inspektionen för vård och omsorg, Bedömningsstöd för ärenden som rör åtgärder mot legitimerad hälso- och sjukvårdspersonal, Inspektionen för vård och omsorg, 2020.
Inspektionen för vård och omsorg, Förebyggande tillsyn – slutrapport, artikelnr 2022- 09, Inspektionen för vård och omsorg, 2022.
Inspektionen för vård och omsorg, IVO:s verksamhetsplan, Inspektionen för vård och omsorg, 2022.
Inspektionen för vård och omsorg, Mot en mer förebyggande tillsyn - delrapport, artikelnr
Inspektionen för vård och omsorg, Processbeskrivning - 3.6.1 Utredning av hälso- och sjukvårdspersonal med legitimation eller annan behörighet att utöva yrke inom hälso- och sjukvården, IVO, 2020.
Inspektionen för vård och omsorg, Processbeskrivning - 3.6.1 Utredning av hälso- och sjukvårdspersonal med legitimation eller annan behörighet att utöva yrke inom hälso- och sjukvården, IVO, 2022.
Inspektionen för vård och omsorg, Vad har IVO sett 2020?, Inspektionen för vård och omsorg, 2021.
Inspektionen för vård och omsorg, Vad har IVO sett 2021?, Inspektionen för vård och omsorg, 2022.
Inspektionen för vård och omsorg, Vägledning vid utredning av hälso- och sjukvårdspersonal med legitimation eller annan behörighet att utöva yrke inom hälso- och sjukvården - Delprocess 3.6.1, Inspektionen för vård och omsorg, 2022.
Inspektionen för vård och omsorg, Årsredovisning 2021, artikelnr IVO
Inspektionen för vård och omsorg, Årsredovisning 2022, artikelnr IVO
Levin
Riksrevisionen 95
Läkemedelsverket, Anlita externa experter i arbetet med behandlingsrekommendationer,
Läkemedelsverket, Behandlingsrekommendationer,
Läkemedelsverket, Kvalitetssäkring vid
Läkemedelsverket, Litteratursökning,
Läkemedelsverket,
Läkemedelsverket, Utarbeta behandlingsrekommendationer,
Region Stockholm, Temporär stängning av arbetsplatskod, dnr HSN
Riksrevisionen, Mesta möjliga hälsa för skattepengarna – statens subventionering av läkemedel, RiR 2021:14, Riksrevisionen, 2021.
Riksrevisionen, Säkra och effektiva läkemedel – hur hanterar staten läkemedelsindustrins inflytande?, RiR 2016:9, Riksrevisionen, 2016.
Socialstyrelsen,
Socialstyrelsen,
Socialstyrelsen, Fråga om rätt till arbetsplatskod, dnr
Socialstyrelsen, Fråga om rätt till arbetsplatskod, dnr
96 Riksrevisionen
Socialstyrelsen, Fråga om rätt till arbetsplatskod, dnr
Socialstyrelsen, Läkemedelsförsäljningen i Sverige – analys och prognos
Socialstyrelsen, Läkemedelsförsäljning i Sverige – analys och prognos
Socialstyrelsen, Nationella riktlinjer för vård och stöd vid adhd och autism – Metodbeskrivning, Bilaga, 2022, Socialstyrelsen, 2022.
Socialstyrelsen, Nationellt kunskapsstöd för god palliativ vård i livets slutskede. Vägledning, rekommendationer och indikatorer. Stöd för styrning och ledning, artikelnr
Socialstyrelsen, Statistik om läkemedel 2022. Bilaga - Tabeller – Statistik om läkemedel 2022, tabell 2, Socialstyrelsen, 2023.
Socialstyrelsen, Statlig styrning med kunskap för hälso- och sjukvård och socialtjänst. Redogörelse för arbetet inom Rådet för styrning med kunskap och Huvudmannagruppen under 2021, Socialstyrelsen, 2021.
Socialstyrelsen, Uppföljning av reformen om kostnadsfria läkemedel – slutrapport, artikelnr
SOU 2017:87, Finansiering, subvention och prissättning av läkemedel – en balansakt. SOU 2018:89, Tydligare ansvar och regler för läkemedel.
SOU 2022:72, Tillgång till försäljningsuppgifter om humanläkemedel.
Statens beredning för medicinsk och social utvärdering, Arbetsformer för kvalitetssäkring av SBU:s produkter och metoder, Statens beredning för medicinsk och social utvärdering, 2021.
Statens beredning för medicinsk och social utvärdering, Oberoende utvärderingar för bättre vård och omsorg, Statens beredning för medicinsk och social utvärdering, 2016.
Statens beredning för medicinsk och social utvärdering, Projektprocess – SBU Utvärderar, Statens beredning för medicinsk och social utvärdering, 2021.
Statens beredning för medicinsk och social utvärdering, SBU:s metodbok, Statens beredning för medicinsk och social utvärdering, 2020.
Statens beredning för medicinsk och social utvärdering, Årsredovisning 2022, Statens beredning för medicinsk och social utvärdering, 2023.
Riksrevisionen 97
Sveriges Kommuner och Regioner, Ersättningsmodeller i primärvården. Delrapport 1
–en nulägesbeskrivning av ersättningsmodeller och andra ekonomiska villkor inom svensk primärvård 2021, Sveriges Kommuner och Regioner, 2022.
Sveriges Kommuner och Regioner, Ersättningsmodeller i specialiserad vård. Delrapport 2 i projektet Ändamålsenliga ersättningsmodeller, Sveriges Kommuner och Regioner, 2022.
Tandvårds- och läkemedelsförmånsverket, Besparingar från sidoöverenskommelser 2022 – Slutavstämning mars 2023, Tandvårds- och läkemedelsförmånsverket, 2023.
Tandvårds- och läkemedelsförmånsverket, Kostnadsutveckling och långsiktig hållbar finansiering av läkemedel, Tandvårds- och läkemedelsförmånsverket, 2023.
Tandvårds- och läkemedelsförmånsverket, Prissättning av extemporeläkemedel och lagerberedningar, Tandvårds- och läkemedelsförmånsverket, 2020.
Regeringsbeslut
Regeringsbeslut S2004/6213/HS, Överenskommelse mellan staten och Landstingsförbundet om statens ersättning till landstingen för kostnaderna för läkemedelsförmånerna åren 2005 t.o.m. 2007.
Regeringsbeslut S2009/2399/HS, Godkännande av en överenskommelse om statens ersättning till landstingen för kostnaderna för läkemedelsförmånerna
Regeringsbeslut S2015/1661/FS (delvis), Överenskommelse om statens bidrag till landstingen för kostnader för läkemedelsförmåner m.m. för år 2015.
Regeringsbeslut S2016/04184/FS (delvis), Överenskommelse om statens bidrag till landstingen för kostnader för läkemedelsförmåner m.m. för år 2016.
Regeringsbeslut S2017/02911/FS, Överenskommelse om statens bidrag till landstingen för kostnader för läkemedelsförmåner m.m. för år 2017.
Regeringsbeslut S2018/00564/FS (delvis), Bemyndigande att underteckna en överenskommelse om statens bidrag till landstingen för kostnader för läkemedelsförmånerna m.m. för år 2018.
Regeringsbeslut S2018/03688/FS, S2019/00307/FS (delvis), Bemyndigande att underteckna en överenskommelse om statens bidrag till landstingen för kostnader för läkemedelsförmånerna m.m. för år 2019.
Regeringsbeslut S2019/05190/FS (delvis), Statens bidrag till regionerna för kostnader för läkemedelsförmåner m.m. – Överenskommelse mellan staten och Sveriges Kommuner och Regioner 2020.
Regeringsbeslut S2021/00821 (delvis), Statens bidrag till regionerna för kostnader för läkemedelsförmånerna m.m. 2021.
98 Riksrevisionen
Regeringsbeslut S2021/08207, Statens bidrag till regionerna för kostnader för läkemedelsförmånerna m.m. 2022 – Överenskommelse mellan staten och Sveriges Kommuner och Regioner.
Regeringsbeslut S2022/03171, Regleringsbrev för budgetåret 2022 avseende Inspektionen för vård och omsorg.
Regeringsbeslut S2022/04000, S2022/04810 (delvis), Regleringsbrev för budgetåret 2023 avseende Tandvårds- och läkemedelsförmånsverket
Regeringsbeslut S2022/04810 (delvis) Regleringsbrev för budgetåret 2023 avseende Inspektionen för vård och omsorg.
Regeringsbeslut S2023/00375, Överenskommelse mellan Staten och Sveriges Kommuner och Regioner om Statens bidrag till regionerna för kostnader för läkemedelsförmånerna m.m. 2023.
Riksdagstryck
Bet. 2009/10:FiU12, En tydlig, rättssäker och effektiv tillsyn.
Prop. 1996/97:27, Läkemedelsförmåner och läkemedelsförsörjning m.m. Prop. 2000/01:1, Budgetpropositionen för 2001.
Prop. 2001/02:1, Budgetpropositionen för 2002. Prop. 2001/02:63 De nya läkemedelsförmånerna. Prop. 2002/03:1, Budgetpropositionen för 2003. Prop. 2003/04:1, Budgetpropositionen för 2004. Prop. 2004/05:1, Budgetpropositionen för 2005. Prop. 2005/06:1, Budgetpropositionen för 2006. Prop. 2006/07:1, Budgetpropositionen för 2007. Prop. 2007/08:1, Budgetpropositionen för 2008. Prop. 2008/09:1, Budgetpropositionen för 2009. Prop. 2009/10:1, Budgetpropositionen för 2010. Prop. 2010/11:1, Budgetpropositionen för 2011. Prop. 2011/12:1, Budgetpropositionen för 2012. Prop. 2012/13:1, Budgetpropositionen för 2013. Prop. 2013/14:1, Budgetpropositionen för 2014. Prop. 2014/15:1, Budgetpropositionen för 2015.
Riksrevisionen 99
Prop. 2015/16:1, Budgetpropositionen för 2016.
Prop. 2016/17:1, Budgetpropositionen för 2017.
Prop. 2017/18:1, Budgetpropositionen för 2018.
Prop. 2018/19:1, Budgetpropositionen för 2019.
Prop. 2019/20:1, Budgetpropositionen för 2020.
Prop. 2020/21:1, Budgetpropositionen för 2021.
Prop. 2021/22:1, Budgetpropositionen för 2022.
Prop. 2022/23:1, Budgetpropositionen för 2023.
Rskr. 2009/10:210.
Skr. 2009/10:79, En tydlig, rättssäker och effektiv tillsyn.
Webbsidor
Fass, ”Botox”,
https://www.fass.se/LIF/product?userType=0&nplId=20000616000030, hämtad
Inspektionen för vård och omsorg, ”Klaga på vården”, https://ivo.se/publicerat-
Inspektionen för vård och omsorg, ”Tillsyn av hälso- och sjukvårdspersonal”,
Läkemedelsindustriföreningen (Lif), ”Fass. Allmänhet”, https://www.fass.se/LIF/faq?userType=2&menyrubrikId=31, hämtad
Läkemedelsindustriföreningen (Lif), ”Sök öppen rapportering av värdeöverföring”, https://www.lif.se/etik/vardeoverforing/, hämtad
Läkemedelsverket, ”Hantering av jäv”, https://www.lakemedelsverket.se/sv/om-
Läkemedelsverket, ”Läkemedelsverkets syn på off
Läkemedelsverket, ”Patient- och konsumentråd”,
100 Riksrevisionen
Region Östergötland, ”Läkemedel och ekonomi”, https://vardgivare.regionostergotland.se/vgw/kunskapsstod/lakemedel/lakemedel-
Socialstyrelsen, ”Statistik om läkemedel” https://www.socialstyrelsen.se/statistik-
Statens beredning för medicinsk och social utvärdering, ”Nu stärks brukarnas inflytande i nio myndigheter”,
Statens beredning för medicinsk och social utvärdering, ”Organisation”,
Statens beredning för medicinsk och social utvärdering, ”SBU:s publikationstyper” https://www.sbu.se/sv/publikationer/publikationstyper/, hämtad
Statens beredning för medicinsk och social utvärdering, ”Vetenskapliga kunskapsluckor – otillräckligt utvärderade åtgärder och metoder”, https://www.sbu.se/sv/publikationer/kunskapsluckor/, hämtad
Statistiska centralbyrån, ”Resultaträkning för kommuner efter region och resultaträkningsposter. År
Sveriges Kommuner och Regioner, ”Kunskapsbaserad och jämlik vård (startsida)”, https://kunskapsstyrningvard.se, hämtad
Sveriges Kommuner och Regioner, ”Läkemedel i kunskapsstöd”, https://kunskapsstyrningvard.se/kunskapsstyrningvard/programomradenochsamv erkansgrupper/nationellasamverkansgrupper/nsglakemedelochmedicinteknik/lake medelikunskapsstod.58991.html, hämtad
Sveriges Kommuner och Regioner, ”Programområden och samverkansgrupper”, https://kunskapsstyrningvard.se/kunskapsstyrningvard/programomradenochsamv erkansgrupper.44275.html, hämtad
Tandvårds- och läkemedelsförmånsverket ”Omprövning av läkemedel”,
Tandvårds- och läkemedelsförmånsverket, ”Ozempic ingår i högkostnadsskyddet med begränsning”,
Riksrevisionen 101
Tandvårds- och läkemedelförmånsverket, ”Subvention för Xeomin”,
Tandvårds- och läkemedelsförmånsverket, ”TLV förbjuder 64 apoteksföretag att ta ut felaktiga priser för smittskyddsläkemedel”, https://www.tlv.se/beslut/beslut-
Tandvårds- och läkemedelsförmånsverket, ”Vi beslutar att subventionera Neurobloc mot cervikal dystoni”,
Vårdgivarguiden, ”Kostnadsansvar för läkemedel i öppenvård, KÖL” https://vardgivarguiden.se/administration/verksamhetsadministration/lakemedel/ kostnadsansvar_lakemedel/#:~:text=De%20region%C3%A4gda%20akutsjukhusen %20har%20fr%C3%A5n,g%C3%A4ller%20f%C3%B6r%20geriatriken%20och%20 psykiatrin, hämtad
Nyhetsartiklar
Blume, E., ”Miljonflöden från läkemedelsbolag till läkare”, Svenska Dagbladet,
Bratt, A., Ewald Hurinsky, H., ”Övervikt ny marknad för nätläkare”, Dagens Nyheter,
Cision News, ”BOTOX godkänt för förebyggande behandling av kronisk migrän”, Cision News,
Helander, I.,
Helander, I., ”Läkemedelsverket varnar: Brist på Ozempic under resten av året”, Läkartidningen,
102 Riksrevisionen
Hällsten, A., ”Bantningstrend på Tiktok leder till brist på diabetesmedicin”, Aftonbladet,
Läkemedelsverket, ”Information till apotek”, Nyhetsbrev från Läkemedelsverket,
Torkelsson,
Riksrevisionen 103